Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. vol.32 no.1 Caracas jun. 2012
Virus de la hepatitis E. Características biológicas y epidemiológicas
Doneyla Alejandra Sánchez Partidas, Cristina del Rosario Gutiérrez García*
Laboratorio de Programas Especiales Hepatitis y Sida. Departamento de Virología. Instituto Nacional de Higiene Rafael Rangel. Caracas. Venezuela.
* Correspondencia: E-mail: cristicharo@gmail.com
Resumen
El virus de la hepatitis E (VHE) es un virus ARN de transmisión entérica, asociado a zoonosis y a una alta tasa de hepatitis fulminante en mujeres embarazadas. En este trabajo se describen las principales características moleculares y epidemiológicas del VHE. Ha sido clasificado recientemente como el único miembro del género Hepevirus de la nueva familia Hepeviridae. Actualmente, todas las cepas que infectan al hombre se agrupan en 4 de los 5 genotipos identificados para el VHE. Se ha descrito una alta tasa de infección por VHE entre adultos jóvenes y en edad productiva. En el curso de la infección, los anticuerpos IgM anti-VHE evidencian infección aguda, mientras que los anticuerpos IgG anti-VHE constituyen el marcador epidemiológico de infección pasada por el virus. A pesar de su amplia distribución mundial y su predominio en países en desarrollo, el VHE ha sido uno de los virus de hepatitis menos estudiados a nivel global. Se desconoce el verdadero impacto de esta infección en Latinoamérica dada la escasez de estuches de inmunodiagnóstico comercialmente disponibles para su detección, limitando el uso de estas metodologías a investigaciones epidemiológicas aisladas. Se requieren estudios futuros para optimizar los inmunoensayos serológicos existentes, facilitando su incorporación a la rutina del laboratorio clínico.
Palabras clave: virus de la hepatitis E, zoonosis, embarazo, hepatitis fulminante.
Hepatitis E virus. Biological and epidemiological characteristics
Abstract
Hepatitis E virus (HEV) is an RNA virus enterically-transmitted, associated to zoonosis, and a high rate of fulminating hepatitis en pregnant women. This paper describes the main molecular and epidemiological characteristics of HEV. It has been recently classified as the only member of the Hepevirus genus of the new Hepeviridae family. At present, all strains which infect humans are grouped in 4 of the 5 genotypes identified for HEV. A high rate of HEV infection has been described among young adults in productive ages. During the course of the infection anti-HEV IgM antibodies signify an acute infection, while anti-HEV IgG antibodies constitute an epidemiological marker of the virus transmitted infection. In spite of its worldwide distribution and its predominance in developing countries, HEV has been one of the least studies hepatitis viruses at a global level. The true impact of this disease in Latin America is unknown due to the scarcity of immunodiagnostic diagnostic kits commercially available for its detection, limiting the use of these methodologies to isolated epidemiological investigations. Future studies are required for optimizing the existing serologic immunoassays, facilitating their incorporation to routine clinical laboratory tests.
Keywords: hepatitis E virus, zoonosis, pregnancy, fulminating hepatitis.
Recibido 10 de agosto de 2011; aceptado 14 de febrero de 2011
Introducción
Las hepatitis virales son enfermedades infectocontagiosas que causan inflamación del hígado y constituyen un problema de salud pública mundial. Dos de los agentes que causan hepatitis viral, por transmisión vía fecal-oral son: el virus de la hepatitis A (VHA) y el virus de la hepatitis E (VHE) [1,2]. Este último, conocido anteriormente como agente no A, no B, no C, es responsable de la hepatitis E, una infección de distribución mundial, encontrada principalmente en países en desarrollo.
El VHE es un virus ARN que produce una infección aguda autolimitada. Presenta una distribución geográfica mundial, predominante con formas epidémicas en regiones endémicas (Centro y Sudeste de Asia, Medio Oriente y parte de África) y formas no epidémicas en países no endémicos, siendo estas últimas las causantes de los casos esporádicos encontrados en países desarrollados [3]. La infección por el VHE, es particularmente fatal para mujeres embarazadas, con una tasa de mortalidad elevada (entre 10 y 20%) [2,3].
Diversos hallazgos experimentales y epidemiológicos sugieren que el VHE parece ser una zoonosis ya que infecta a humanos y a algunas especies animales domésticas y salvajes [4]. Aunque algunos genotipos del VHE se han identificado en huéspedes animales, tales como: los genotipos 3 y 4 en cerdos, para los genotipos 1 y 2 de importancia fundamental en brotes epidémicos, no se ha identificado hasta el momento ningún reservorio animal [5].
La presente revisión tiene como objetivo el estudio de las principales características moleculares del virus de la hepatitis E y su epidemiología en países latinoamericanos, dado los cambios que se están presentando en su distribución a nivel global y al problema de salud pública que representa esta infección en la población.
Clasificación taxonómica
La clasificación taxonómica del VHE, ha sido objeto de múltiples estudios, los cuales lo adjudicaron inicialmente como miembro de la familia Picornaviridae. Sin embargo, estudios de secuencia y organización genómica del VHE con el tipo salvaje del VHA (Poliovirus), indicaron que el VHE era muy diferente a los picornavirus [3]. Estudios de microscopia electrónica y propiedades físico-químicas del VHE, indicaron que éste podría ser un miembro de la Familia Caliciviridae, basándose en un análisis inicial del genoma viral [6]. Sin embargo, el orden de los genes del VHE no es idéntico al de los Calicivirus. Posteriormente, el Comité Internacional de Taxonomía Viral ubicó al VHE en una familia aparte denominada virus parecidos al de la hepatitis E [7]. Actualmente, se tiene una clasificación concluyente del VHE en el género Hepevirus de la familia Hepeviridae [8].
Características moleculares y propiedades físico-químicas
En un estudio retrospectivo realizado a principios de la década de los noventa, se identificaron los componentes moleculares del VHE (proteínas de la cápside y genoma viral) y se conoció como el agente responsable de la hepatitis E [9].
El VHE es una partícula esférica de 27 a 30 nm de diámetro, simetría icosaédrica, no envuelto. Este virus contiene un genoma de ARN de cadena simple y de sentido positivo, incluido en el interior de una cápside compuesta por la única proteína estructural (glicoproteína) y el péptido de la cápside [3,9].
La densidad de flotación del VHE es 1.29 q/cm3, en tartrato de potasio y glicerol y el coeficiente de sedimentación es de 183S. Es inestable a temperaturas de almacenamiento entre -70 °C y 8 oC pero estable en nitrógeno líquido y en condiciones alcalinas suaves [1,10]. La supervivencia del virus en el tracto intestinal sugiere que el virus es relativamente estable en condiciones ácidas o alcalinas suaves [6].
La ausencia de un sistema de propagación in vitro ha constituido un obstáculo para descifrar por completo la biología del VHE [1].
Estructura y organización del genoma
El VHE contiene un genoma de ARN de cadena simple positiva, de aproximadamente 7,2 Kb de largo con una cola Poli A en su extremo 3. Las secuencias de las regiones no codificantes 5 y 3 son de 27 y 68 nucleótidos, respectivamente. Los genes no estructurales se localizan hacia el extremo 5, abarcando las dos terceras partes del genoma y los estructurales hacia el extremo 3 del genoma viral (Figura 1) [1]
Figura 1. Organización genómica del VHE. Se señalan en los extremos 5 y 3 las regiones no traducidas (UTR) y el extremo 3 poliadenilado. Se muestran los marcos abiertos de lectura (MAL) 1, 2 y 3, su extensión (nT/aa, nucleótidos/aminoácidos) con las proteínas que codifican. Se indican los ARN genómico y subgenómicos y su extensión (kb).
El genoma tiene tres marcos de lectura abiertos (ORF, en inglés) que se solapan entre sí y se distinguen en (Figura 1) [3]:
- ORF1 (5Kb), de 1693 codones, se encuentra localizado hacia el extremo 5 del genoma y codifica a las proteínas no estructurales: metiltransferasa, proteasa, helicasa y replicasa, requeridas en la replicación del virus.
- ORF2, de 660 codones se encuentra localizado en el extremo 3 del genoma, codifica la única proteína estructural y el péptido de la cápside. Esta región se cree que está involucrada en la encapsidación del transcripto genómico. Contiene en el extremo 3 un epítope inmunogénico principal.
- El ORF3 empieza con los últimos nucleótidos del ORF1 y se solapa ampliamente con los ORF2, codifica una fosfoproteína inmunogénica de 123 aminoácidos que se asocia con el citoesqueleto. Esta pequeña proteína estructural se sugiere participa en el ensamblaje de las partículas virales [7].
Replicación del VHE
El virus de la hepatitis E entra al hospedador por vía oral. El sitio primario de replicación, es el tracto digestivo, alcanza al hígado por la vena porta y finalmente se replica en el citoplasma de los hepatocitos. El ARN genómico viral es traducido en el citosol para producir la poliproteína de 1693 aminoácidos no estructural a partir del ORF1. Esta poliproteína contiene la replicasa viral que copia una hebra de ARN intermediario de polaridad negativa, el cual actúa como templado para la síntesis de copias adicionales de ARN genómico y subgenómico de polaridad positiva.
Se ha propuesto que los ARN subgenómicos pueden ser luego traducidos en proteínas estructurales de la cápside, en las etapas tardías de la replicación. Posteriormente, la proteína estructural de la cápside empaqueta al genoma viral y los viriones ensamblados son liberados en la bilis y la sangre. Las partículas del virus están presentes en la bilis y las heces de la persona infectada, desde el final de la incubación hasta 2 ó 3 semanas luego del inicio de la enfermedad [11,12].
Heterogeneidad genética
Se han propuesto 4 genotipos para el VHE en los cuales se agrupan todas las cepas actualmente identificadas mediante el análisis filogenético de la secuencia nucleotídica de dos regiones ubicadas en el ORF1 [3]. El genotipo 1 se considera el más conservado y se clasifica en 5 subtipos. En base a análisis filogenéticos se ha propuesto que el genotipo 2 presenta 2 subtipos y los genotipos 3 y 4 son extremadamente diversos y pueden ser subdivididos en 10 y 7 subtipos, respectivamente. Geográficamente, el genotipo 1 ha sido aislado en diversos países subtropicales en Asia y África. Recientemente, cepas del VHE pertenecientes al genotipo 1 se han encontrado en Cuba [13,14] y en Venezuela (Gutiérrez y cols., datos no publicados). El genotipo 2 se ha descrito en México, Nigeria y Chad, en tanto que el genotipo 3 fue identificado ampliamente a nivel mundial, incluyendo en Asia, Europa, Oceanía, América del Norte y del Sur. En contraste, el genotipo 4 incluye cepas del VHE obtenidas de humanos y cerdos y se ha encontrado exclusivamente en Asia, particularmente en China, Taiwán y Japón [14]. Ambos genotipos fueron identificados en otros animales, tales como el jabalí y el venado [15]. El VHE aviario ha sido clasificado en un nuevo genotipo, el genotipo 5, pero aún no ha sido confirmado [14,16].
Se ha demostrado una variabilidad genética continua del VHE en el organismo de un individuo infectado, dando origen a múltiples variantes conocidas como cuasiespecies, cuya heterogeneidad varía de 0,11 a 3,4% durante las epidemias y pudiera explicar la capacidad de adaptación del virus en las interrelaciones patógeno-hospedero [17].
Los análisis filogenéticos en 32 genomas completos del VHE provenientes de pacientes y cerdos infectados evidenciaron recombinación intragenotipo entre cepas divergentes del VHE [18].
Modos de transmisión
El VHE se transmite básicamente por vía fecal-oral a través de alimentos y aguas contaminadas con heces de personas infectadas por el VHE semejante al VHA. La transmisión directa de persona a persona es baja y existen pocos indicios de transmisión por actividad sexual. Aún cuando se tienen hallazgos del VHE en leche materna, se desconocen casos documentados de transmisión del virus a lactantes por esta vía. Se ha demostrado frecuente transmisión vertical en mujeres que se infectan en el tercer trimestre del embarazo, produciendo hepatitis aguda grave en el recién nacido [1,10].
El ser humano constituye el hospedero natural, aunque cepas del VHE aisladas en humanos tienen una estrecha relación genética con cepas halladas en cerdos, ratas y pollos, sugiriendo que la hepatitis E es una enfermedad de posible transmisión zoonótica. Diversos estudios señalan al cerdo como el principal reservorio animal del VHE [5]. Se ha sugerido la posibilidad de transmisión zoonótica de humanos a cerdos y viceversa, así como entre humanos y otros primates, tales como: chimpancés, monos rhesus, tamarinos y monos verdes africanos, los cuales son susceptibles a la infección natural con cepas humanas del VHE [19]. Se ha descrito la transmisión de las cepas humanas US-2 del VHE a ganado porcino, pero esto no ha podido ser demostrado para las cepas Sar-55 y Mex-14 [20]. Así mismo se han reportado similitudes, desde el punto de vista genómico viral y reacción cruzada entre antígenos de superficies de cepas provenientes de humanos y animales, tales como cerdos [21].
Curso clínico de la infección por el VHE
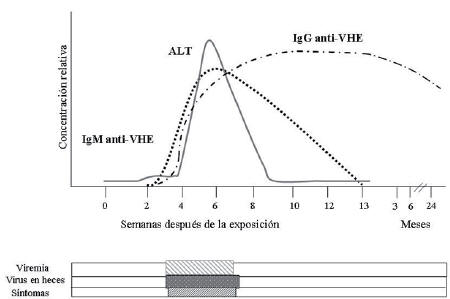
El periodo de incubación fluctúa entre 2 y 9 semanas (6 semanas en promedio). Poco antes de la aparición de los síntomas clínicos, el VHE puede detectarse en el torrente sanguíneo por 1 a 2 semanas y es excretado en las heces por 3 a 4 semanas (Figura 2) [22].
Figura 2. Curso natural de la infección por el virus de la hepatitis E. Se señalan los marcadores serológicos (IgG e IgM anti-VHE), los niveles de alaninaminotransferasa (ALT), el período de aparición de los síntomas, viremia y excreción del virus en heces.
La fase ictérica dura de 12 a 15 días, comienza abruptamente con la aparición de la ictericia, orina oscura y heces de color de arcilla. Cerca de la mitad de los pacientes desarrollan fiebre y 2/3 se quejan de artralgias. Las pruebas de función hepática son indicativas de necrosis hepática. En la mayoría de los casos, la disfunción hepática no es lo suficientemente importante como para desarrollar la ictericia, situación que se evidencia por un gran porcentaje de casos anictéricos. Se observa un aumento en los niveles de alanina aminotransferasa (ALT) aproximadamente 4 a 8 semanas luego de la exposición del individuo al VHE, alcanzando un pico único, que coincide con el comienzo de la ictericia (Figura 2). La hiperbilirrubinemia a expensas de la bilirrubina directa se observa en grados variables. El aumento en los niveles de ALT y la ictericia se correlaciona con detección del ARN del VHE por RT-PCR en sangre y la excreción de partículas virales en las heces. Al instaurarse los síntomas clínicos (ictericia, anorexia, hepatomegalia, dolor abdominal, nauseas, vomito y fiebre) las partículas virales desaparecen de la sangre pero continúan excretándose en heces. Los anticuerpos isotipos IgM e IgG contra el VHE, se detectan temprano durante el curso clínico de la infección. Los anticuerpos anti-VHE isotipo IgM alcanzan un pico durante la fase sintomática y declina a valores por debajo del límite de detección dentro de 3 a 6 meses de la enfermedad. Los anticuerpos anti-VHE isotipo IgG, permanecen detectables por un periodo variable que oscila entre 2-14 años, de acuerdo a lo establecido en diversos estudios [9]. No está claro si persiste durante períodos prolongados, tampoco si confiere inmunidad porque es posible que se presenten reinfecciones [23].
Hepatitis E y embarazo
Uno de los rasgos clínicos distintivos de la hepatitis E es la severidad del cuadro clínico en mujeres en estado de gestación, alcanzando hasta un 25% de letalidad. Así mismo, se han descrito abortos espontáneos o partos prematuros a consecuencia de la infección por el VHE [24].
El VHE causa infección intrauterina acompañada de una sustancial morbilidad y mortalidad perinatal. Los casos de hepatitis fulminante en mujeres embarazadas alcanzan una tasa de mortalidad del 20% en el primer trimestre, mientras que la tasa de mortalidad infantil alcanza el 33%. Las causas de estas altas tasas de mortalidad, aun no están claras. Algunas de las complicaciones en el embarazo son toxicidad, hipertensión, edemas y lesiones a nivel del riñón. La muerte se produce usualmente como consecuencia de encefalopatía, diátesis hemorrágica o insuficiencia renal [7].
Se ha propuesto una hipótesis para explicar la patogenia fulminante de la hepatitis E en gestantes, en la cual el virus ocasiona daño en las células sinusoidales (particularmente las células Küpffer), disminuyendo su capacidad de protección de los hepatocitos contra las endotoxinas originadas por las bacterias gramnegativas del tracto intestinal. El daño directo de los hepatocitos por las endotoxinas y trastornos secundarios mediados por la liberación de prostaglandinas, puede llevar a una atracción quimiotáctica de neutrófilos, produciendo inflamación del tejido por acumulación de agua (edema) y detención del flujo de bilis (colestasis) [7]. La validez de esta hipótesis y los mecanismos subyacentes celular y molecular exactos no se han confirmado [3]. Más recientemente, un estudio realizado en mujeres embarazadas asiáticas sugiere que el embarazo es un factor de riesgo potencial para la replicación viral del VHE, observándose en la población evaluada una disminución de la respuesta inmunitaria celular (evidenciada por un descenso de la proporción de células CD4/CD8) y un elevado nivel de hormonas esteroideas que influyen en la replicación y expresión viral durante la gestación, las cuales parecen ser las causas probables para la severidad de la enfermedad [25].
Epidemiología
Existen dos rasgos de la epidemiología de la hepatitis E únicos: la alta incidencia de la infección en adultos y la elevada incidencia de hepatitis fulminante con muerte subsecuente en las mujeres gestantes afectadas. La enfermedad puede variar de un rango de severidad subclínica a fulminante en el 0,5-3%. Estos antecedentes se emplearon como instrumento para el reconocimiento de la hepatitis E como una enfermedad nueva [26].
El virus es comúnmente detectado en personas entre 15 y 40 años de edad y en los niños, la infección por VHE es poco frecuente y a menudo no presenta síntomas [2,10].
La severidad de las infecciones por el VHE es moderada y se considera mayor que la de las infecciones por VHA. La mortalidad de la hepatitis E varia ampliamente, en una proporción de 0,4 a 4%, considerablemente alta en comparación con el 0,2% de la hepatitis A [27].
El virus de la hepatitis E causa grandes brotes de hepatitis viral [23,26], los cuales son más comunes en aquellas partes del mundo con climas calientes y escasos en regiones con climas templados [7], cómo en el caso de México [28], donde el agua contaminada es la vía de transmisión, infectando principalmente a adultos jóvenes.
Por lo general, las epidemias de hepatitis E ocurren cuando se espera que la contaminación sea máxima, es decir, durante los meses de invierno y los periodos de fuertes lluvias.
El VHE produce una infección de amplia distribución mundial, especialmente en países en vías de desarrollo, presentándose en cualquiera de sus tres formas: epidémica, brotes aislados ó infecciones esporádicas [4]. Aproximadamente, un 20% de la población mundial proveniente de áreas endémicas se ha infectado por el VHE [29]. Entre estas regiones se encuentran: el sudeste Asiático, Asia Central, África del Norte, Este y Occidental, América del Norte (México) y algunas regiones de Centroamérica. Las epidemias de la mayoría de estas regiones han sido confirmadas serológicamente como hepatitis E. La primera epidemia de esta infección, ocurrió en la India (Nueva Delhi) en 1955, cuando 29.000 casos de hepatitis se identificaron después de la contaminación fecal, ampliamente diseminada en el agua de consumo de la ciudad. Entre 1955 y 1956, se observaron presuntas epidemias de hepatitis E en la Unión Soviética y el sudeste Asiático incluyendo Birmania y Nepal [30,31].
Un análisis retrospectivo de las grandes epidemias de hepatitis en la década de los 50 y 60 en Bombay (Calcuta) señaló que el VHE fue el principal agente etiológico relacionado [32]. En la década de los 70 otras epidemias descritas en Túnez, Marruecos y Argelia, fueron igualmente relacionadas con este agente etiológico [33].
La hepatitis E esporádica se observa en países donde no se han producido epidemias y la enfermedad representa alrededor del 1% de los casos informados de hepatitis viral aguda asociados con viajes a zonas endémicas, aunque cada vez son más frecuentes aquellos casos que no tienen historia de viajes [34].
La seroprevalencia en Estados Unidos y Europa varía entre 1 al 5%, en pacientes de las áreas urbanas [31]. La enfermedad en estos países ha sido descrita principalmente como importada [35].
La infección por el virus de la hepatitis E ha sido implicada, en cerca del 50% de casos esporádicos de hepatitis viral aguda en países en desarrollo [36]. Estudios basados en el análisis del virus excretado en los desagües de zonas urbanas de España y otros países como Estados Unidos, Grecia, Francia y Suecia, sugieren que las cepas de hepatitis E están más difundidas de lo esperado en países industrializados [37].
En América Latina la hepatitis E fue detectada por primera vez en dos pueblos rurales ubicados en el sur de Ciudad de México en 1986 [38]. En América del Sur, se reportaron casos esporádicos, siendo los tres primeros encontrados en Brasil (en Salvador de Bahía), país de la región con el mayor registro de infección por VHE [33,39,40]. En otro estudio se sugiere que la hepatitis E es endémica en el sur de Chile, específicamente en grupos étnicos de bajo nivel sociocultural [41]. En Venezuela, se evidenciaron anticuerpos anti-VHE en 1,6% de mujeres embarazadas provenientes de Caracas, 3,9% en poblaciones rurales y 5,4% en amerindios. Los autores del estudio sugirieron que Venezuela no parece ser un país altamente endémico para hepatitis E [42]. De igual manera, en 3 comunidades de la población indígena Yukpa en el estado Zulia, se registró una prevalencia de 4,1 a 7,8 % de hepatitis E [43]. En otra investigación se encontraron anticuerpos anti-VHE isotipo IgM en 0,63% (2/317 sueros) de individuos sintomáticos de 15 y 16 años de edad, respectivamente y anticuerpos anti-VHE isotipo IgG en 6,3% (20/317 sueros) de los individuos evaluados, de los cuales 45% (9/20) eran pacientes con serología positiva para el VHA, evidenciando coinfección hepatitis A/E (Gutiérrez y cols., datos no publicados). En Uruguay, se detectó una prevalencia de anticuerpos anti-VHE de 1,2%, mientras que en Nicaragua ésta varía entre 4,6% y 8%. Hace algunos años, dos casos de hepatitis E fueron descritos en Argentina [2]. En Cuba se ha reportado una prevalencia de 5,3% de hepatitis E en la Habana [44] y Bolivia reporta prevalencias de anticuerpos anti-VHE más altas que en otros países latinoamericanos (2-15%) y más significativas en zonas urbanas (48,7% en Cochabamba) que en áreas rurales del altiplano y la Amazonía (19-20%) [45].
Diagnóstico de la hepatitis E
El diagnóstico de la infección se realiza mediante la determinación de anticuerpos específicos anti-VHE isotipos IgM e IgG en el suero del paciente. El inmunoensayo enzimático es el método más conveniente para la detección de estos anticuerpos específicos anti-VHE. Sin embargo, en la actualidad se disponen de escasos estuches de inmunodiagnóstico en el mercado para la detección de anticuerpos anti-VHE.
La presencia de anticuerpos anti-VHE isotipo IgM evidencia infección aguda por el VHE, mientras que los anticuerpos anti-VHE isotipo IgG son un marcador de infección presente o pasada por el VHE. No se dispone de estas pruebas para la práctica clínica, siendo utilizadas únicamente en estudios seroepidemiológicos. Se ha sugerido que debido a que la fase aguda de la hepatitis E es de corta duración, se investigue sólo los anticuerpos anti-VHE IgG a nivel diagnóstico por ser este marcador de aparición precoz y mantenido en el tiempo [46].
Los inmunoensayos anti-VHE confirmatorios como el Western blot se han empleado sólo a nivel de investigación de brotes y casos esporádicos de hepatitis E, utilizando proteínas recombinantes del VHE derivadas de aislamientos de diferentes regiones endémicas [47].
La detección del genoma viral mediante la técnica de trascripción reversa y reacción en cadena de la polimerasa (RT-PCR) ha contribuido al estudio del patrón de la enfermedad y de las características moleculares del VHE. Esta prueba es útil para confirmar la infección del VHE. No se trata de un procedimiento rutinario. Es un método muy sensible y específico que permite la detección de secuencias genómicas amplificadas del VHE en la bilis, sangre, hígado y heces, considerando que la liberación del virus es transitoria. Según informes de la OMS, el ARN del VHE puede ser detectado en las heces, en fase aguda mediante PCR en aproximadamente 50% de los casos [33].
El desarrollo y empleo de técnicas de biología molecular, han permitido esclarecer muchos aspectos de la epidemiología del VHE, pero dado su elevado costo, no pueden ser empleadas para el diagnostico de rutina, sino como una herramienta de investigación.
La inmunomicroscopía electrónica permite detectar partículas virales del VHE (de 27-34 nm), directamente de las heces de pacientes infectados. Es un método muy especifico y poco sensible, que requiere de un operador altamente entrenado, suficiente tiempo y cantidades considerables de antígeno y anticuerpo [3].
Conclusiones
La elevada variabilidad genética del VHE se evidencia en el número creciente de genotipos propuestos en los últimos años y su capacidad de zoonosis. A pesar de su amplia distribución mundial, ha sido uno de los virus de hepatitis menos estudiados a nivel global.
La escasez de estuches para inmunodiagnóstico comercialmente disponibles en Latinoamérica para la detección del VHE en estudios epidemiológicos, han limitado la posibilidad de definir la distribución geográfica de la hepatitis E, desconociéndose el verdadero impacto de esta infección viral en la región.
La prevalencia significativa de anticuerpos contra el VHE y la determinación ecológica de la enfermedad en diferentes países latinoamericanos constituye un problema de interés a nivel de salud pública, que requiere la investigación sobre diversos factores de riesgo y vías de transmisión alternas de este agente viral. Estos hallazgos, junto a los conocimientos actuales sobre la hepatitis E deberán ser difundidos mediante campañas de educación masiva, a las comunidades de mayor riesgo, con el fin de controlar la diseminación de la infección. Así mismo, se requieren de estudios futuros que permitan obtener mayor información acerca de la estructura del VHE, su replicación genómica y la respuesta inmunitaria frente a la infección, a fin de optimizar los diversos métodos diagnósticos existentes, especialmente los inmunoensayos serológicos para su incorporación de manera rutinaria en la práctica clínica.
Referencias
1. Panda S,Thakral D and Rehman S. Hepatitis E virus. Rev Med Virol. 2007;17: 151-80. [ Links ]
2. Moraes dos Santos DC, Dutra Souto FJ. Seroepidemiological markers of enterically transmitted viral hepatitis A and E in individuals living a community located in the north area of Rio de Janeiro, RJ, Brazil. Mem Inst Oswaldo Cruz. 2002; 97:37-40. [ Links ]
3. Quintana J, González A. Virus de la hepatitis E. Rev Biomed. 2003; 14:165-89. [ Links ]
4. Tanno H, Hay O. Hepatitis viral en América Latina. Acta Gastroenterol Latinoam. 2005; 35:169-82. [ Links ]
5. Meng XJ. Novel strains of hepatitis E virus identified from humans and other animal species: is hepatitis E a zoonosis?. J Hepatol. 2000; 33:842-5. [ Links ]
6. Tam AW, Smith MM, Guerra ME, Huang CC, Bradley DW, Fry KE et al. Hepatitis E virus (HEV): Molecular cloning and sequencing of the full-length viral genome. Virology. 1991; 185:120-31. [ Links ]
7. Berke T, Matson DO. Reclassification of the Caliciviridae into distinct genera and exclusión of hepatitis E virus from the family on the basis of comparative phylogenetic análisis. Arch Virol. 2000; 145:1421-36. [ Links ]
8. Emerson SU, Anderson D, Arankalle A, Meng XJ, Purdy M, Schlauder GG et al. Hepevirus. In: Fauquet M, Mayo MA, Maniloff J, Desselberger U, Ball A editors. Virus Taxonomy. Eight report of the International Committee on Taxonomy of Viruses. London UK: Elsevier/ Academic Press; 2005, p. 851-5. [ Links ]
9. Jameel S. Molecular biology and pathogenesis of hepatitis E virus. Exp Rev Mol Med. 1999; 6:1-16. [ Links ]
10. Acharya SK, Panda SK. Hepatitis E virus: epidemiology, diagnosis, pathology and prevention. Trop Gastroenterol. 2006; 27(2):63-8. [ Links ]
11. Ticehurst J, Popkin TJ, Bryan JP, Innis BL, Duncan JF, Ahmed A et al. Association of hepatitis E virus with an outbreak of hepatitis on Pakistan: Serologic responses and pattern of virus excretion. J Med Virol. 1992; 36:84-92. [ Links ]
12. Nanda SK, Ansari IH, Acharya SK, Jameel S, Panda SK. Protracted viremia during acute sporadic hepatitis E virus infections.Gastroenterol. 1995; 108: 225-30. [ Links ]
13. Montalvo MC, Rodriguez L, Chandra V, Bello M, Sariego S, Gutiérrez A et al. Hepatitis E virus genotype 1, Cuba. Emerg Infect Dis J. 2008; 14:1320-1. [ Links ]
14. Chandra V, Taneja S, Kalia M, Jameel S. Molecular biology and pathogenesis of hepatitis E virus. J Biosci Bioeng. 2008; 33:451-64. [ Links ]
15. Lu L, Li C, Hagedorn CH. Phylogenetic analysis of global hepatitis E virus sequences: genetic diversity, subtypes and zoonosis. Rev Med Virol. 2005; 21:2-20. [ Links ]
16. Huang F, Sun F, Emerson S, Purcell R, Shivaprasad H, Pierson F et al. Determination and analysis of the complete genomic sequence of avian hepatitis E virus (avian HEV) and attempts to infect rhesus monkeys with avian HEV. J Gen Virol. 2004; 85:1609-18. [ Links ]
17. Grandadam M, Tebbal S, Caron M, Siriwardana M, Larouze B, Koeck JL et al. Evidence for hepatitis E virus quasispecies. J Gen Virol. 2004; 85:3189-94. [ Links ]
18. Van Cuyck H, Fan J, Robertson DL, Roques P. Evidence of recombination between divergent hepatitis E viruses. J Virol. 2005; 79:9306 -14. [ Links ]
19. Meng X-J, Halbur PG, Shapiro MS, Jeremy SG, Mushahwar BI, et al. Genetic and experimental evidence for cross-species infection by swine hepatitis E virus. J Virol. 1998; 72:9714-21. [ Links ]
20. Meng XJ, Dea S, Engle RE, Lyon YS, Sininarumitri T, Urairong K, et al. Experimental infection of pigs with the newly identified swine hepatitis E virus (swine HEV), but not with strains of HEV. Arch.Virol. 1998; 143(7):1405-15. [ Links ]
21. Goens MD, Perdue ML. Hepatitis E viruses in humans and animals. Anim Health Res Rev. 2004; 5:145-56. [ Links ]
22. Bradley DW, Andjaparidze A, Cook EH, McCaustland KA, Balayan M, Steler H, et al. Etiological agent of enterically transmitted non-A non-B hepatitis. J Gen Virol. 1988; 69: 731-8. [ Links ]
23. Balayan MS. Epidemiology of hepatitis E virus infection. J Viral Hepat.1997; 4:155-65. [ Links ]
24. Khuroo MS, Teli MR, Skidmore SJ, Sofi MA, Khuroo MI. Incidence and severity of viral hepatitis in pregnancy. Am J Med. 1981; 70:252-5. [ Links ]
25. Jilani N, Das BC, Husain SA, Baweja UK, Chattopadhya D, Gupta RK, et al. Hepatitis E virus infection and fulminant hepatic failure during pregnancy. Gastroenterol Hepatol. 2007; 22:676-82. [ Links ]
26. Nanda SK, Yalcinkaya K, Panigrahi AK, Acharya SK, Jameel S, Panda SK. Etiological role of hepatitis E virus in sporadic fulminates hepatitis. J Med Virol. 1994; 42:133-137. [ Links ]
27. Yayli G, Kilic S, Ormeci R. Hepatitis agents with enteric transmission an epidemiological analysis. Infection. 2002; 30:334-7. [ Links ]
28. Tavera Hernández R, Richheimer WR. Hepatitis E anictérica en pediatría. Reporte de un caso y revisión de la literatura. Rev Enfer Infec Pediatr. 2008; 21:85-9. [ Links ]
29. National Centers for Disease Control and Prevention (CDC).Viral hepatitis. http://www.cdc.gov/hepatitis/. Acceso 25 de febrero 2011. [ Links ]
30. Myint H, Soe MM, Khin T, Myint TM, Tin KM. A clinical and epidemiological study of an epidemic of non-A, non-B hepatitis in Rangoon. Am J Trop Med Hyg. 1985; 34:1183-9. [ Links ]
31. Hillis A, Shrestha SM, Saha NK. An epidemic of infectious hepatitis in the Kathmandu Valley. J Nepal Med Assoc. 1973:11-51. [ Links ]
32. Reyes GR. Hepatitis E Virus. In: Progress in Liver Disease: Molecular Biology and Emerging Epidemiology. Philadelphia, WB Saunders. 1993; pp.203-11. [ Links ]
33. Paraná R, Cotrim H P, Cortey-Boennec D, Trépo C, Lyra L. Prevalence of hepatitis E virus IgG antibodies in patients from a referral unit of liver diseases in Salvador, Bahia, Brazil. Am J Trop Med Hyg. 1997; 57:60-1. [ Links ]
34. Rodríguez-Iglesias M., Pérez-Gracia MT. Nuevos conceptos sobre el virus de la hepatitis E y su importancia creciente en los países desarrollados. Enf Emerg. 2003; 5:105-12. [ Links ]
35. Tagle Martín. Hepatitis A y E. Simposio. Revista Diagnóstico. 2007;46(1):18-23. [ Links ]
36. Clemente-Casares P, Pina S, Buti M et al. Hepatitis E virus epidemiology in industrialized countries. Emerg Infect Dis. 2003; 9:448-9. [ Links ]
37. Buisson Y, Coursaget P, Bercion R, Anne D, Debord T, Roue R. Hepatitis E virus infection in soldiers sent to endemic regions. Lancet. 1994; 344:1165-6. [ Links ]
38. Velazquez O, Stetler HC, Avila C, Ornelas G, Alvarez C, Hadler SC, Bradley DW. Sepulveda J Epidemic transmission of enterically transmitted non-A, non-B hepatitis in Mexico, 1986-1987. JAMA. 1990; 263:3281-5. [ Links ]
39. Trinta KS, Liberto MIM, de Paula VS, Yoshida CFT. Hepatitis E virus infection in selected brazilian populations. Mem Inst.Oswaldo Cruz. 2001; 96:25-9. [ Links ]
40. Lyra AC, Pinho JRR, Silva LK, Sousa L, Saracen CP. HEV, TTV and GBV-C/HGV markers in patients with acute viral hepatitis. Braz J Med Biol Res. 2005; 38:767-75. [ Links ]
41. Hurtado C, Muñoz G, Brahm J. Anti-VHE IgM en casos de infección por el virus de hepatitis E. Rev Med Chile. 2005; 133:645-7. [ Links ]
42. Pujol F, Favorov MO, Marcano T, Esté JA, Magris M, Liprandi F et al. Prevalence of antibodies against hepatitis E virus among urban a rural populations in Venezuela. J Med Virol. 1994; 42:234-6. [ Links ]
43. Blitz-Dorfman L, Monsalve F, Atencio R, Porto L, Monzon M, Favorov MO et al. Serological survey of markers of infection with viral hepatitis among the Yukpa amerindians from western Venezuela. Ann Trop Med Parasitol. 1996; 9:655-7. [ Links ]
44. Quintana A, Sanchez L, Larralde O, Anderson D. Prevalence of antibodies to hepatitis E virus in residents of district in Havana, Cuba. J Med Virol. 2005; 76:69-70. [ Links ]
45. León P, Venegas E and Bengoechea L. Prevalencia de las Infecciones por virus de las hepatitis B, C, D y E en Bolivia. Rev Panam Salud Pública. 1999; 5:144-52. [ Links ]
46. Ke WM, Tan D, Li JG, Izumi S, Shinji Y, Hotta H et al. Consecutive evaluation of immunoglobulin M and G antibodies against hepatitis E virus. J Gastroenterol Hepatol. 1996; 31:818-22. [ Links ]
47. Mast EE, Alter MJ, Holland PV, Purc RH. Evaluation of assays for antibody to hepatitis E virus by a serum panel. Hepatol. 1998; 27: 857-61. [ Links ]












 uBio
uBio