Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. vol.33 no.1 Caracas jun. 2013
El estadio amastigota precede la evolución del epimastigota durante la epimastigogénesis in vitro de Trypanosoma cruzi
Diana Graterol, Rosa Yanet Arteaga, María Consuelo Navarro, María Isabel Domínguez, Ana Rita De Lima, Víctor Tulio Contreras*
Laboratorio de Protozoología. Instituto de Biología Molecular de Parásitos (InBioMolP). Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia. Estado Carabobo. Venezuela.
* Correspondencia: E-mail: convictu@cantv.net.ve
Resumen: La transformación de tripomastigotas sanguíneos de Trypanosoma cruzi en epimastigotas, ocurre naturalmente en el intestino del insecto y se identifica como epimastigogénesis. Aquí reportamos que durante la epimastigogénesis in vitro, los tripomastigotas se transforman en formas redondeadas, biológica y antigénicamente equivalentes al estadio amastigota; con un tiempo de persistencia dependiente de la altura del medio de cultivo. Formas tripomastigotas procedentes de cultivo de tejidos infectados se incubaron en envases con diferentes alturas de medio LITB (3 y 83 mm), y se compararon las cinéticas de transformación hacia epimastigotas. Para la obtención de antígenos se colectaron masas de parásitos a diferentes tiempos de diferenciación. Los cambios morfológicos, incremento del inóculo y resistencia a complemento, se estudiaron por microscopía de contraste de fases y extendidos coloreados con Giemsa. Los cambios antigénicos se analizaron mediante Western Blot usando anticuerpo IgY anti-amastigotas. Los resultados mostraron que las formas redondeadas resisten la lisis por complemento, expresan antígenos amastigota-específicos y la velocidad de transformación hacia epimastigotas depende de la altura del medio sobrenadante en el cultivo. Las evidencias sugieren que además de caída de la temperatura, una baja tensión de oxígeno disuelto y una alta densidad de parásitos por área, aceleran el proceso de diferenciación.
Palabras clave: Trypanosoma cruzi, epimastigogénesis in vitro, antígenos amastigota específicos.
The amastigote stadium precedes epimastigote evolution during in vitro Trypasnosoma cruzi epimastigogenesis
Abstract: Transformation of blood Trypanosoma cruzi tripomastigotes into epimastigotes occurs naturally at the insect gut and is identified as epimastigogenesis. Here we report that during in vitro epimastigogenesis, tripomastigotes transform into rounded forms, biologically and antigenically equivalent to the amastigote stadium, with a persistance time which depends on the height of the culture medium. Tripomastigote forms from cultures of infected tissues were incubated in flasks with different LITB medium heights (3 and 83 mm), and kinetics of transformation to epimastigotes were compared. Masses of parasites at different differentiation times were collected for antigen production. Morphological changes, inoculum increase and resistance to complement were studied by phase contrast microscopy and Giemsa stained smears. Antigenic changes were analyzed through Western Blot using an IgY anti-amastigote antibody. Results showed that rounded forms resist lysis by complement, express amastigote-specific antigens, and that the speed of transformation to epimastigotes depends on the height of the supernatant medium in the culture. Evidences suggest that apart from a temperature fall, a low dissolved oxygen tension and a high parasite per area density accelerate the differentiation process.
Keywords: Trypanosoma cruzi, in vitro epimastigogenesis, amastigote-specific antigens.
Recibido 12 de marzo de 2012; aceptado 12 de diciembre de 2012
Introducción
La diferenciación de los tripomastigotas sanguíneos de Trypanosoma cruzi en epimastigotas ocurre naturalmente en el tracto intestinal del invertebrado en respuesta a la diferencia de temperatura entre los hospedadores [1]. Se acepta que de los tripomastigotas ingeridos por el vector, algunos se transforman directamente en epimastigotas y otros en formas redondas con flagelo corto (esferomastigotas) y amastigotas, antes de diferenciarse en epimastigotas [2,3]. Un proceso de diferenciación similar ocurre in vitro cuando se cultiva sangre de animales infectados con T. cruzi; por extensión de la nomenclatura usada para otros procesos de diferenciación, algunos autores denominan este proceso como epimastigogénesis [4]. Es conocido el polimorfismo de los tripomastigotas sanguíneos de T. cruzi: en algunas cepas predominan las formas gruesas y en otras las formas intermedias y finas [5]. Los estudios de los eventos tempranos que ocurren en medio axénico mostraron que, cultivos con predominio de formas gruesas regularmente cambian a amastigotas y esferomastigotas, los cuales se dividen y originan grandes colonias de parásitos redondos; los cultivos con predominio de formas delgadas cambian a epimastigotas y las formas redondas son escasas [6]. Sin embargo, una vez establecidos los cultivos axénicos, los epimastigotas son las formas predominantes.
Las formas esferomastigotas que aparecen al inicio de la fase logarítmica y en la fase estacionaria tardía de la epimastigogénesis de T. cruzi en medios axénicos, no son iguales. Tyler y Engman [7] propusieron que las formas redondeadas al inicio son formas epimastigotas redondeadas con flagelo corto, producto de la presencia de glucosa en el medio y su depleción conduce a epimastigotas típicos. Estos planteamientos no están sustentados con criterios biológicos complementarios como la susceptibilidad al complemento, donde los epimastigotas se lisan cuando se incuban en suero fresco de cobayo [8], mientras que los metacíclicos, tripomastigotas sanguíneos y amastigotas, son resistentes [9-11], ni la demostración de antígenos estadio específicos (AES). Recientemente, nuestro grupo inmunizó gallinas con antígenos de amastigotas y obtuvo un anticuerpo (IgY) anti-AES que revela antígenos amastigota-específicos (Domínguez y col, en preparación).
Durante la epimastigogénesis de T. cruzi in vitro, usando un medio químicamente semi-definido, Barrios y col. [12], reportaron una morfología de transición asociada a cambios moleculares entre el tripomastigota y el epimastigota; antes de completar su diferenciación morfológica los parásitos expresaron proteínas, glicoproteínas y antígenos característicos del estadio epimastigota, sugiriendo que la expresión génica antecede la diferenciación morfológica. De Lima y col, [13], demostraron expresión diferencial de proteasas durante la epimastigogénesis, con aumento significativo de la actividad cisteín proteasa, mientras que la de metaloproteasas sólo se expresó una vez culminada la diferenciación, sugiriendo su papel en el proceso de diferenciación.
Nuestro propósito fue demostrar que durante la epimastigogénesis in vitro, los tripomastigotas de T. cruzi se transforman en formas redondas, biológica y antigénicamente equivalentes al estadio amastigota, y que su tiempo de persistencia es inverso a la altura del medio sobrenadante en el cultivo.
Materiales y métodos
Parásitos y estadios: Se trabajó con Trypanosoma cruzi MHOM/Ve/1967/EPm6 EPm6, tipificado genéticamente como perteneciente al linaje filogenético TcI. El parásito fue clonado y mantenido por pases sucesivos alternos triatomino/ratón [14], empleando parásitos recientemente aislados de ratón por hemocultivo. El estadio epimastigota usado como control se obtuvo de subcultivos semanales en medio LITB (Liver Infusión Triptose Broth) [15]. Las células Vero usadas para la producción de tripomastigotas y amastigotas intracelulares se cultivaron en medio MEM (Minimum Essential Medium) con 5% suero fetal bovino (SFB) a 35 ºC y atmósfera de CO2 (5%) [16]. El estadio amastigota intracelular usado como control se obtuvo de células Vero con 4 días de infección. Monocapas celulares infectadas se desprendieron con tripsina y se suspendieron en PBS (0,15 M NaCl, 0,02 M Na2HPO4, pH 7,2) suplementado con 1% SFB. Alícuotas de 10 mL de la suspensión se lisaron por pasaje en jeringa con aguja calibre 25 [17]. Los amastigotas se aislaron por centrifugación en un gradiente discontinuo de metrizamida (15-21%) [18]. Las formas tripomastigotas recientemente liberadas se obtuvieron del sobrenadante de monocapas celulares al 4to o 5to día de infección [17]. Los tripomastigotas se concentraron (1.500 xg 15 min a 4 ºC) y se usaron en los ensayos de inducción de epimastigogénesis in vitro como se describe más adelante. Las formas epimastigotas, amastigotas, tripomastigotas y parásitos de tiempos diferentes durante la cinética de diferenciación en cultivo vertical y horizontal, se sedimentaron (12.000 xg 3 min 4 °C) y se lavaron dos veces con PBS. Las masas húmedas de parásitos (20-25 mg) se criopreservaron a -70 °C hasta su uso.
Epimastigogénesis de Trypanosoma cruzi en cultivo vertical y horizontal: Se siguió el protocolo de Barrios y col. [12]. La cinética de transformación de los tripomastigotas en epimastigotas se hizo por triplicado incubando los parásitos en 35 mL de medio LITB a 27 ºC por tiempos variables entre 0 y 8 días. La condición vertical correspondiente a bajo tenor de oxígeno, se realizó en tubos cónicos de polipropileno (50 mL) para una altura de 83 mm, y la condición horizontal correspondiente a alto tenor de oxígeno, en frascos de cultivo de poliestireno (T-160 cm2) para una altura de 3 mm. Los inóculos de tripomastigotas empleados se describen en el pie de tablas 1 y 2. Se hizo recuento diferencial bajo microscopía de contraste de fases para estimar: (a) incremento del inóculo (Nt/N0); (b) porcentaje de tripomastigotas; (c) porcentaje de formas redondas y amastigotas; (d) porcentaje de formas en diferenciación; (e) porcentaje de epimastigotas, y (f) porcentaje de metacíclicos. La morfología de los parásitos se estudió en láminas coloreadas con Giemsa–ácido [19], con un aumento final de 1000X en microscopio óptico (Nikon, Eclipse 400), contando al menos 300 formas para determinar los porcentajes morfológicos presentes. Las morfologías más representativas se fotografiaron con cámara digital (Nikon, Coolpix, 4500).
Resistencia a la lisis por complemento: Parásitos de diferentes tiempos de incubación provenientes de las condiciones cultivo vertical y horizontal se lavaron con PBS (1 mL) en tubos Eppendorf y posteriormente se concentraron por centrifugación (7.000 xg 3 min a 4 °C). Los sedimentos se resuspendieron en 1 mL de solución de Hanks/Hepes/CO3 y se ajustaron a 3-5 x 107 parásitos/mL. Se mezclaron 250 µL de cada suspensión de parásitos con 250 µL de suero de cobayo (dilución 1:2) y se hizo recuento diferencial en microscopio de contraste de fases a tiempo 0 para estimar la población inicial (Ni). Se incubaron por 45 minutos a 35 °C y se hizo recuento para estimar la población post-incubación (Nf). El porcentaje de lisis (% lisis) se calculó restando al número de parásitos inicial (Ni) las formas que no se lisaron (Nf), dividiendo entre el número inicial (Ni) y multiplicando por 100 (% de lisis = (Ni-Nf)/Ni x 100). La resistencia (%) corresponde al total de formas que no se lisaron por la acción del complemento y se calculó restando a 100 el porcentaje de lisados (% de Resistencia = 100 - % lisis). Los recuentos se hicieron por triplicado de al menos tres experimentos. Como control de la acción del complemento se emplearon tripomastigotas sobrenadantes de células Vero y epimastigotas cultivados por 6 días, procesados en las mismas condiciones. La fuente de complemento fue suero fresco de cobayo sin inactivar (+C) e inactivado por 30 min a 56 °C (-C) usado como control de actividad lítica.
Obtención de extractos proteicos totales: Masas húmedas de peso conocido se lisaron en agua suplementada con una mezcla de inhibidores de proteasas [trans-epoxy succinil-L-leucilamido-4-guanidino-butano (E-64) 0,1 mM, Nα-ptosil-Lcloro lisina-metil cetona (TLCK) 0,5 mM, N-tosil-L-fenilalanina clorometil cetona (TPCK) 0,5 mM, fenantrolina 1 mM] en relación de 300 mg parásitos/mL en solución de lisis. Se sometieron a tres ciclos de congelación/descongelación (-20 ºC / 37 ºC), alternando con agitación en vórtex (3 min a temperatura ambiente). Los lisados se sedimentaron a 14.000 xg 10 min a 4 ºC y los sobrenadantes se suplementaron con 150 mM NaCl [20]. La concentración proteica se determinó mediante ensayo con Coomassie Plus-200 (Pierce, Rockford U.S.A.) respecto a patrones de seroalbúmina bovina, según protocolo del fabricante.
Análisis antigénico durante la epimastigogénesis: Los cambios antigénicos se revelaron mediante Western Blot [21] realizando la separación de las proteínas mediante electroforesis en gel de poliacrilamida 10% en condiciones desnaturalizantes [22], colocando 4 µg de proteína total por canal, seguida de electro-transferencia a membranas de nitrocelulosa (MNC, Pierce 0,45 µm) usando un equipo Trans-Blot (BIORAD) a voltaje constante (100 voltios) por 1 hora. Las membranas de nitrocelulosa (MNC) se incubaron en solución de bloqueo (leche descremada al 5% en PBS + 0,1% Tween 20) durante 90 minutos a temperatura ambiente. Se incubaron toda la noche con el anticuerpo primario IgY anti-AES con agitación delicada a 4 ºC, diluido 1/1000 a partir de una concentración inicial de 0,5 mg/mL (Domínguez y col, en preparación). Como anticuerpo secundario se usó anti-IgY peroxidasa preparado en suero de conejo diluido 1/10.000. Los inmunocomplejos se revelaron mediante quimioluminiscencia, empleando luminol como sustrato (Super Signal, Pierce Rockford U.S.A.) según protocolo del fabricante. Para obtener los luminogramas, las MNC se cubrieron con lámina de vinilo transparente y se expusieron a películas de Rayos X (AGFA curix. Mortsel, Bélgica).
Digitalización, registro fotográfico y análisis: Los luminogramas se digitalizaron en densitómetro (Bio-Rad, Imaging Densitometer, Modelo GS-690) y analizaron con el Software (Bio-Rad Molecular Analyst®/PC 1,2 Software package). Las figuras y fotografías se procesaron por Microsoft Power Point 2007.
Resultados
La tabla 1 muestra los cambios morfológicos y poblacionales que ocurrieron durante la epimastigogénesis de T. cruzi en medio LITB a 27 ºC en condición vertical, expresados como porcentaje de formas (tripomastigota, redondas, en diferenciación y epimastigota) e incremento del inóculo (Nt/N0). Se aprecia que el porcentaje de tripomastigotas decreció entre el día 0 a 6 (84,6 a 0%), mientras que el porcentaje de formas redondas aumentó entre 0 y 1 día (12,8 a 75,6%) y luego disminuyó progresivamente hasta el 6° día (13,4%). Los epimastigotas se incrementaron gradualmente desde 1/3 de día (8 horas) al 8° día (2,1 a 81,3%). Los mayores cambios morfológicos ocurrieron en los primeros 2 días sin incremento del inóculo, manteniéndose la relación Nt/N0 alrededor de 1. A partir del día 2 se apreció un incremento creciente del inóculo hasta 12,5 veces al 8° día, concomitante con el incremento acelerado del porcentaje de epimastigotas.
Tabla 1. Variaciones morfológicas y poblacionales durante la epimastigogénesis de Trypanosoma cruzi en medio LITB a 27 ºC (Condición vertical, 83 mm de altura del medio).
| Tiempo (días) | Porcentaje de formas (X ± DE) | Nt /N0 | |||
| Tripomastigotas | Redondeadas y amastigotas | En diferenciación | Epimastigotas | ||
| 0 | 84,6 ± 4,2 | 12,8 ± 0,6 | 0 | 2,6 ± 0,1 | 1,0 |
| 1/3 | 21,8 ± 1,1 | 33,1 ± 1,7 | 43,0 ± 2,2 | 2,1 ± 0,1 | 1,0 |
| 1 | 8,4 ± 0,4 | 75,6 ± 3,8 | 11,9 ± 0,6 | 4,1 ± 0,2 | 1,0 |
| 2 | 11,3 ± 0,6 | 63,8 ± 3,2 | 19,0 ± 1,0 | 5,9 ± 0,3 | 1,2 |
| 4 | 1,2 ± 0,1 | 56,4 ± 2,8 | 18,2 ± 0,9 | 24,2 ± 1,2 | 2,2 |
| 6 | 0 | 35,4 ± 1,8 | 8,5 ± 0,4 | 56,1 ± 2,8 | 4,3 |
| 8 | 0 | 13,4 ± 0,7 | 5,3 ± 0,3 | 81,3 ± 4,0 | 12,5 |
Inóculo = 9,6 x 106 parásitos/mL; Nt/N0 = cociente entre el número de parásitos total a tiempo t (Nt) y el número de parásitos a tiempo cero N0 (inóculo).
La tabla 2 muestra los cambios morfológicos y poblacionales que ocurren durante la epimastigogénesis de T. cruzi en medio LITB a 27 ºC en condición horizontal, expresados como porcentaje de formas (tripomastigota, redondas, en diferenciación y epimastigota) e incremento del inóculo (Nt/N0). Se apreció una caída abrupta del porcentaje de tripomastigotas en los primeros 4 días (94,9 a 0%) simultáneamente con un incremento de las formas redondas (0 a 90,4%). El porcentaje de epimastigotas varió erráticamente en los primeros 2 días y se incrementó lentamente entre el 4° y 8° día (9,6 a 19,4%). No hubo incremento estadísticamente significativo del inóculo en los primeros 4 días con una relación Nt/N0 alrededor de 1, e inclusive hubo lisis de los parásitos (Nt/N0<1,0). A mayor tiempo (6 y 8 días), el incremento del inóculo fue irregular (4,8 y 3,6 veces).
Tabla 2. Variaciones morfológicas y poblacionales durante la epimastigogénesis de Trypanosoma cruzi en medio LITB a 27 ºC (Condición horizontal, 3 mm de altura del medio).
| Tiempo (días) | Porcentaje de formas (X ± DE) | Nt /N0 | |||
| Tripomastigotas | Redondeadas y amastigotas | En diferenciación | Epimastigotas | ||
| 0 | 94,9 ± 4,3 | 0 | 0 | 5,1 ± 1,0 | 1,0 |
| ½ | 14,6 ± 0,9 | 47,3 ± 2,4 | 36,5 ± 1,8 | 1,6 ± 0,8 | 0,6 |
| 1 | 2,8 ± 0,1 | 89,4 ± 4,7 | 3,0 ± 1,2 | 4,8 ± 0,2 | 1,0 |
| 2 | 3,4 ± 0,2 | 86,3 ± 4,3 | 0 | 10,3 ± 0,5 | 0,8 |
| 4 | 0 | 90,4 ± 4,9 | 0 | 9,6 ± 0,5 | 1,4 |
| 6 | 0 | 84,5 ± 4,2 | 1,0 ± 0,9 | 14,5 ± 0,9 | 4,8 |
| 8 | 0 | 69,4 ± 3,5 | 0 | 19,4 ± 1,2 | 3,6 |
Inóculo = 2,0 x 107 parásitos/mL; Nt/N0 = cociente entre el número de parásitos totales a tiempo t (Nt) y el número de parásitos a tiempo cero N0 (inóculo). La diferencia hasta 100% del día 8 corresponde a metacíclicos.
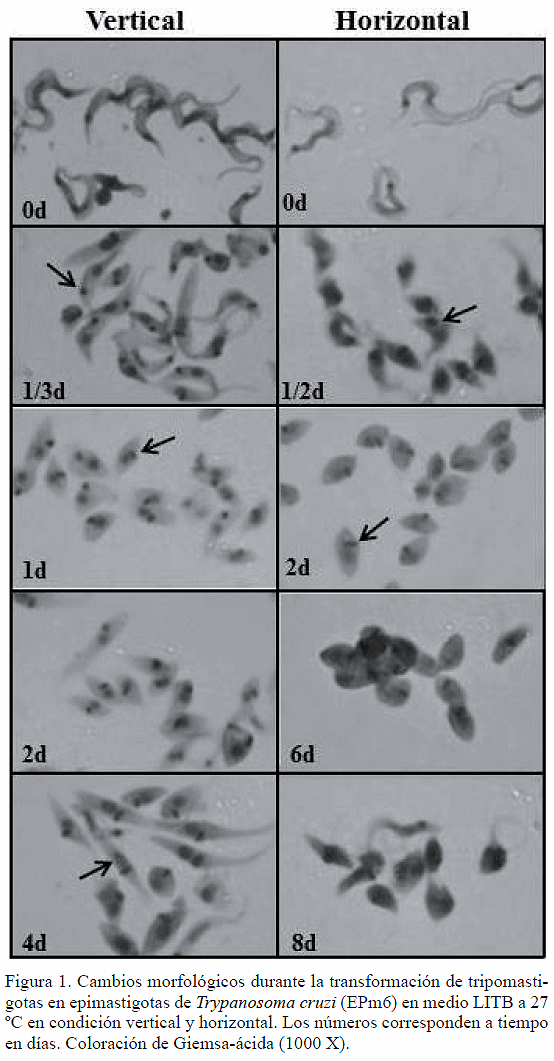
La figura 1 muestra los cambios morfológicos de tripomastigotas de T. cruzi incubados en medio LITB a 27 ºC en condición vertical y horizontal. En las primeras 8 a 12 horas ocurrió un acortamiento del cuerpo del tripomastigota en ambas condiciones, manteniendo el kinetoplasto redondo (flechas en 1/3 d y 1/2 d, vertical y horizontal, respectivamente). En ambas condiciones, en los días 1 y 2 se apreciaron amastigotas típicos de formas ovaladas y redondas con kinetoplasto en barra (flechas en 1 d y 2 d). Los amastigotas se mantuvieron como morfología predominante hasta el 8° día en la condición horizontal (8 d, horizontal) y los epimastigotas típicos aparecieron desde el 4° día de incubación (flecha en 4 d, vertical).
La tabla 3 muestra la resistencia al complemento durante la epimastigogénesis de T. cruzi incubados en medio LITB a 27 ºC en condición vertical y horizontal. En condición vertical, el porcentaje de parásitos que resistió la acción de complemento decreció de 94,1% (día 2) a 43,9% (día 4) hasta ser menor que 1% (día 12), simultáneo con el incremento porcentual de formas epimastigotas sensibles a complemento (Tabla 1). Los parásitos que no se lisaron presentaron aspecto redondeado típico de los amastigotas resistentes al complemento. En la condición horizontal, el porcentaje de resistencia a los 2 y 4 días fue alto (89,7 y 84,5%, respectivamente) y compatible con el predominio de formas redondas resistentes a complemento (Tabla 2). A los 12 días disminuyó la resistencia (66,9%) con presencia de formas redondas (73,8%) y metacíclicas (26,2%). Los parásitos que no se lisaron presentaron aspecto redondeado típico de amastigotas y de metacíclicos, resistentes al complemento. Esos porcentajes concordaron con la presencia de 44,2% de formas redondas, 33,1% de epimastigotas y 22,7% de metacíclicos, observados en la condición control incubados con complemento inactivo (resultados no tabulados).
Tabla 3. Porcentaje de resistencia a lisis por complemento durante la epimastigogénesis de Trypanosoma cruzi en medio LITB a 27 ºC en condición vertical y horizontal.
| Condición de Incubación | Tiempo (días) | Resistencia (%) | Porcentaje de formas | |||
| T | R | E | M | |||
| + C | + C | + C | + C | |||
| Vertical | 2 | 94,1 | 12,0 | 88,0 | 0 | 0 |
| 4 | 43,9 | 0 | 100 | 0 | 0 | |
| 12 | < 1 | 0 | 100 | 0 | 0 | |
| Horizontal | 2 | 89,7 | 3,1 | 96,9 | 0 | 0 |
| 4 | 84,5 | 0 | 100 | 0 | 0 | |
| 12 | 66,9 | 0 | 73,8 | 0 | 26,2 | |
T=tripomastigotas; R=formas redondeadas y amastigotas; E=epimastigotas y M=metacíclicos. Resistencia indica el porcentaje de las formas que no se lisaron en presencia de complemento (+C). Los estadios tripomastigotas sobrenadantes de células Vero, usados como control positivo de resistencia a la acción del complemento activo, no se lisaron y los epimastigotas de cultivo usados como control positivo de sensibilidad a la acción del complemento, se lisaron en un 100%.
Las figuras 2 y 3 muestran los análisis por Western Blot de los perfiles antigénicos revelados por el anticuerpo IgY anti-AES durante la epimastigogénesis de T. cruzi, incubados en medio LITB a 27 ºC en condición vertical y horizontal respectivamente. El perfil revelado por anti-AES en los amastigotas (canales A, Figuras 2 y 3) y en los tripomastigotas y epimastigotas (canales T y E, Figuras 2 y 3) mostró que los amastigotas están caracterizados por una región de antígenos no resueltos por encima del marcador de 150 kDa común con los tripomastigotas (asterisco a la derecha del canal A e izquierda canal T), una banda común con los tripomastigotas (47 kDa, trazo a la derecha de los canales A, Figuras 2 y 3), dos bandas comunes con los epimastigotas y tripomastigotas (dupleta 70/65 y 42/40 kDa, triángulos a la derecha de los canales A, Figuras 2 y 3) y cinco bandas específicas de amastigotas (130, 110, 95, 80, y 52 kDa, puntas de flecha a la derecha de los canales A, Figuras 2 y 3), ausentes en los tripomastigotas y epimastigotas. El análisis de los antígenos revelados por anti-AES en parásitos procedentes del cultivo vertical mostró que con el aumento del tiempo de incubación, la banda de 70/65 kDa se mantuvo con alta intensidad mientras la de 42/40 kDa perdió intensidad (triángulos a la izquierda del canal 1, Figura 2). Tres de los antígenos amastigota-específicos se revelaron en parásitos incubados por 1 día (130, 110 y 80 kDa, trazos a la derecha del canal 1, Figura 2) y no se revelaron a partir del día 2 de la incubación. En parásitos procedentes del cultivo horizontal, el mismo análisis mostró que las bandas antigénicas comunes a los tres estadios (70/65 y 42/40 kDa, canales 1 a 10, Figura 3) tuvieron un comportamiento similar al observado en parásitos derivados del cultivo vertical (Figura 2), en contraste con lo observado para las bandas específicas de los amastigotas ubicadas por encima del marcador de 75 kDa. En parásitos del día 1, anti-AES reveló cinco bandas antigénicas transitorias (140, 120, 105, 85 y 78 kDa, trazos a la izquierda del canal 1, Figura 3) cuyas masas moleculares no coincidieron con las observadas en tripomastigotas, epimastigotas ni amastigotas. A partir del día 2 de incubación, anti-AES reveló tenuemente dos antígenos específicos de amastigotas que incrementaron su intensidad progresivamente con el tiempo de incubación (130 y 110 kDa trazos a la izquierda de los canales 2 a 10, Figura 3), y a partir del 4° día de incubación se expresó un tercer antígeno especifico de amastigota (80 kDa trazos a la izquierda de los canales 4 a 10, Figura 3), que mantuvo su expresión hasta el día 10 de la incubación.
Discusión
Se demostró que durante la epimastigogénesis in vitro, los tripomastigotas de T. cruzi se transforman en formas redondas, biológicas y antigénicamente equivalentes al estadio amastigota, antes de transformarse en epimastigotas, y que su tiempo de persistencia es inverso a la altura del medio sobrenadante en el cultivo.
La epimastigogénesis de T. cruzi ocurre en el tracto intestinal del vector al ingerir sangre infectada con T. cruzi y se ha simulado in vitro en sangre heparinizada y hemocultivos incubados a temperatura ambiente. Factores como estrés nutricional, temperatura y pH son inductores de la morfogénesis de T. cruzi in vitro y actúan sobre estadios competentes del parásito [23]. Nuestros resultados confirmaron que la epimastigogénesis se dispara por la caída de temperatura, con la presencia de eventos tempranos y tardíos. Los eventos tempranos se caracterizan por la aparición de formas redondas que no se multiplican precediendo la transformación hacia epimastigota [12], mientras que los eventos tardíos corresponden a la presencia de epimastigotas que se multiplicaron siguiendo una curva de crecimiento igual a los cultivos axénicos [1,12].
Para excluir el papel del polimorfismo de los tripomastigotas sanguíneos, se trabajó con tripomastigotas tipo-hemático derivados de cultivos de células Vero y se ensayaron dos condiciones de incubación, colocando igual volumen de medio y similar inóculo en tubos cónicos con una altura del medio de 83 mm (condición vertical) y en placas de poliestireno con 3 mm de altura del medio sobrenadante (condición horizontal). El cultivo vertical representa condiciones de menor tensión de oxígeno disuelto (TOD) y mayor densidad de población (número de parásitos/área) y el cultivo horizontal la condición de mayor tensión de oxígeno disuelto y menor densidad de población. En la condición vertical, los eventos tempranos fueron de corta duración (2 días) y los tardíos se iniciaron al cuarto día con un incremento de 12,5 veces el inóculo al final del octavo día de incubación (Tabla 1). En contraste, en la condición horizontal los eventos tempranos fueron de larga duración incrementándose la transformación a formas redondas hasta el 4° día, sin incremento del inóculo, el cual aumentó apenas 4,0 veces al final del 8° día de incubación (Tabla 2). La comparación morfológica de los parásitos confirmó las evidencias de las tablas 1 y 2, mostrando que la transformación hacia la morfología típica del epimastigota ocurre más rápidamente en el cultivo vertical (4° día) que en el horizontal (8° día) y que la morfología de las formas redondas son típicas de los amastigotas con kinetoplasto en barra y ausencia de flagelo (Figura 1).
En contraste con la abundancia de trabajos de T. cruzi cultivados en tubos o fiolas (condición vertical), donde el parásito crece según una curva sigmoidea [24], mostrando que los grandes inóculos rápidamente agotan el medio y entran en fase estacionaria [15], no se encontraron trabajos de T. cruzi creciendo en placas con área grande y poca altura del medio sobrenadante (condición horizontal), que reporten el efecto de la relación volumen/área, papel de la tensión de oxígeno pericelular, ni efecto de densidad de población. Una aproximación metodológica a la condición horizontal es el cultivo de células in vitro, las cuales no crecen en la condición vertical por cuanto la TOD es fundamental para su crecimiento y sobrevivencia. Concentraciones de oxígeno en el medio más bajas que 2% de la tensión de oxígeno atmosférica, llevan al cese del crecimiento celular, mientras que exceso de oxígeno disuelto en el medio (95%) es tóxico para células en cultivo [25]. Metzen et al. [26], reportaron que, en células incubadas en placas de poliestireno, con una altura del medio sobrenadante de 5,2 mm y mantenidas en una atmosfera de aire 5% CO2 (similar al cultivo horizontal en nuestros ensayos), el oxígeno pericelular varía en un amplio rango (110 y 0,2 mm de Hg) según la tasa de consumo de oxígeno de cada línea celular, proponiendo que en esas condiciones las monocapas celulares están frecuentemente en hipoxia. En nuestros protocolos de trabajo, la condición vertical debe tener menor TOD que en la condición horizontal, donde la difusión de oxígeno permite mayor cantidad de oxígeno disuelto. Por otra parte, una aproximación al estudio de densidad de población lo representan los protocolos de trabajo para el cultivo de células adherentes Hela en envases de cultivo grandes (160 cm2) donde se establece que el inóculo no debe ser mayor a 288 células/mm2 y que en la condición de confluencia (contacto célula-célula) se incrementa cuatro veces el inóculo (1150 células/mm2) [27]. En nuestros ensayos, se colocaron 1250 parásitos/mm2 no adherentes con tamaños celulares 10 veces menores que las células Hela, y en fase temprana de la epimastigogénesis no se incrementó el inóculo, lo que indica que las monocapas de formas redondeadas no estaban en la condición de confluencia celular, y en consecuencia, no hubo contacto amastigota-amastigota, contrario con el cultivo vertical donde los parásitos sin flagelo sedimentan.
Nuestro diseño experimental no permitió concluir si el factor disparador de la transformación de los amastigotas en epimastigotas es la TOD, el índice de densidad o ambos factores. Sin embargo, sugiere que el incremento en la duración de los eventos tempranos no depende de la interacción célula-célula y podría estar determinado por una mayor TOD en el medio. En ensayos pilotos incubando bajo inóculo de epimastigotas en condición horizontal, se observó la aparición de formas redondeadas a partir del 2to día de cultivo y alcanzaron un pico máximo de 63,9% al 8vo día. De ellas, más del 80% fueron resistentes al complemento. En la condición vertical, solo se apreciaron epimastigotas típicos 100% sensibles al complemento durante toda la curva de crecimiento (resultados no mostrados). Estas evidencias apoyan la hipótesis de que una mayor TOD alarga la duración de las formas tipo-amastigotas en la condición horizontal, mientras que en la condición vertical, la mayor densidad de parásitos por área consume el oxígeno y acidifica el microambiente incrementando la hipoxia, y para sobrevivir el parásito se transforma rápidamente en epimastigota, con una mitocondria grande y metabolismo fermentativo alternativo.
El análisis de las propiedades biológicas de las diferentes morfologías que aparecen durante la epimastigogénesis en cultivo vertical y horizontal indica que las formas redondas resistentes al complemento corresponden a amastigotas y que en la condición horizontal aparecen formas metacíclicas características por su morfología y capacidad de resistir la acción del complemento.
Los análisis de los eventos de diferenciación molecular confirmaron evidencias previas [12,23] mostrando que los cambios morfológicos durante la epimastigogénesis están asociados a cambios en los perfiles proteicos y glicoproteicos, diferentes en la condiciones vertical y horizontal (resultados no mostrados). Los análisis por Western Blot, usando anticuerpo anti-AES, confirmaron que las formas redondeadas que anteceden la aparición de los epimastigotas, en términos antigénicos, son verdaderos amastigotas. En la condición vertical, los antígenos amastigota-específicos se expresaron transitoriamente (aparecieron el día 1 y dejaron de expresarse posteriormente) ver figura 2, mientras que en la condición horizontal se expresaron más lentamente y se mantuvieron por mayor tiempo, coincidiendo con los altos porcentajes de formas redondas de esta condición (Tabla 2). La detección de antígenos de masa molecular diferente a los revelados en los amastigotas, tripomastigotas y epimastigotas el primer día de incubación en la condición horizontal, pudiera ser debida a un re-arreglo antigénico, previo a la expresión de los antígenos específicos de amastigotas (Figura 3), que podría haber ocurrido en la condición vertical y ser visualizados analizando los cambios antigénicos antes de las primeras 24 horas de la diferenciación.
Aunque es prematuro proponer la existencia del estadio amastigota en el ciclo natural de T. cruzi en el invertebrado, el estudio de la epimastigogénesis in vivo de varias cepas de T. cruzi evidenció que la transformación de los tripomastigotas sanguíneos hacia epimastigotas es precedida por formas tipo amastigotas [28]. Es indudable la utilidad de la simulación in vitro para estudiar por qué los tripomastigotas se transforman en formas tipo-amastigotas antes de transformarse en epimastigotas.
En conclusión, los resultados de este trabajo demostraron que las formas redondeadas resisten la lisis por complemento; que los amastigotas preceden a los epimastigotas durante la epimastigogénesis in vitro, y que la velocidad de transformación hacia epimastigotas depende de la altura del medio sobrenadante en el cultivo con un tiempo de permanencia inverso.
Las evidencias sugieren que además de la caída de la temperatura, como disparador de la epimastigogénesis, una baja tensión de oxígeno disuelto y una alta densidad de parásitos por área, aceleran el proceso de diferenciación.
Agradecimientos
Al Sr. Jhonny Albanese por la asistencia infraestructural. Organismos Financiadores: FONACIT S1-2001000683; CDCH-UC FCS: 2003-005; 2006-006; 00212-07; 2010-001; 0394-2010; 011-2011; 180-2011; 0461-2010; 2005-012.
Referencias
1. De Souza, W. Basic cell biology of Trypanosoma cruzi. Curr Pharm Design. 2002; 8:269-85. [ Links ]
2. García ES, Azambuja P. Development and interactions of Trypanosoma cruzi within the insect vector. Parasitol Today. 1991; 7:240- 4. [ Links ]
3. Kollien AH, Schaub GA. The developmental of Trypanosoma cruzi in Triatominae. Parasitol Today. 2000; 16:381- 7. [ Links ]
4. Rondinelli E, Silva R, Carvalho JF, de Almeida Soares CM, de Carvalho EF, de Castro FT. Trypanosoma cruzi: an in vitro cycle of cell differentiation in axenic culture. Exp Parasitol. 1988; 66:197-204. [ Links ]
5. Brener Z. Life cycle of Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo. 1971; 13:171-8. [ Links ]
6. Brener Z, Chiari E. Aspect of early growth of different Trypanosoma cruzi strains in culture medium. J Parasitol. 1965; 51:922- 6. [ Links ]
7. Tyler KM, Engman DM. The life cycle of Trypanosoma cruzi revisited. Int J Parasitol. 2001; 31:472- 81. [ Links ]
8. Muniz J, Borriello A. Estudo sobre a açao litica de diferentes soros sobre as formas de cultura e sanguicolas do Schizotrypanum cruzi. Rev Brasil Biol. 1945; 5:563-76. [ Links ]
9. Kierszenbaum F, Lima M. Susceptibility of insect-borne, metacyclic forms of Trypanosoma cruzi to antibody-mediated mechanisms of destruction. Am J Trop Med Hyg. 1983; 32:1236- 41. [ Links ]
10. Kipnis TL, David JR, Alper CA, Sher A, Dias da Silva W. Enzymatic treatment transforms trypomastigotes of Trypanosoma cruzi into activators of alternative complement pathway and potentiates their uptake by macrophages. Proc Natl Acad Sci USA. 1981; 78:602-5. [ Links ]
11. Iida K, Whitlow MB, Nussenzweig V. Amastigotes of Trypanosoma cruzi escape destruction by the terminal complement components. J Exp Med. 1989; 169:881-91. [ Links ]
12. Barrios JG, Contreras O, Graterol D, Navarro MC, Contreras, VT, De Lima AR. Trypanosoma cruzi: Epimastigogénesis en condiciones axénicas, cambios morfológicos, peptídicos, glicopeptídicos y antigénicos. Act Cientif Venez. 2008; 59:29-38. [ Links ]
13. De Lima AR, Aparicio A, Berrocal A, Navarro MC, Graterol D, Contreras VT. Epimastigogénesis de Trypanosoma cruzi en medio axénico: cambios peptídicos, glicopeptídicos y enzimáticos. Salus. 2007; 11:39-47. [ Links ]
14. Contreras V. Elementos de apoyo para trabajar en Enfermedad de Chagas. Valencia: Clemente Editores, Vicerrectorado Académico Universidad de Carabobo; 1994. [ Links ]
15. Goitia-Aular M, Boisso JF. Cultivo de Trypanosoma cruzi (cepa Elpidio Padrón) en medio semidefinido. Efecto de algunas variaciones en la composición y condiciones del mismo. Act Cientif Venez. 1982; 33:488-96. [ Links ]
16. Andrews NW, Hong K, Robbins ES, Nussenzweig V. Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Exp Parasitol. 1987; 64:474-84. [ Links ]
17. Piras MM, Piras R, Henriquez D. Changes in morphology and infectivity of cell culture-derived trypomastigotes of Trypanosoma cruzi. Mol Biochem Parasitol. 1982; 6:67-81. [ Links ]
18. Carvalho TU, De Souza W. Separation of amastigotes and trypomastigotes of Trypanosoma cruzi from cultured cells. Parasitol Res. 1983; 69:571-5. [ Links ]
19. Carvalho ALM. Estudos sobre a posição sistemática, a biologia e a transmissão de tripanosomatídeos encontrados em Zelus leucogrammus (Perty, 1834) (Hemiptera, Reduviidae). Rev Pat Trop. 1973; 2:223-74. [ Links ]
20. De Lima AR, Navarro MC, Arteaga R, Contreras VT. Cultivation of Trypanosoma cruzi epimastigotes in low glucose axenic media shifts its competence to differentiate at metacyclic trypomastigotes. Exp Parasitol. 2008; 119:336-42. [ Links ]
21. Towbin H, Stachelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: Procedure and some applications. Proc Natl Acad Sci USA. 1979; 79:4350-4. [ Links ]
22. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophago T4. Nature. 1970; 227:680-5. [ Links ]
23. Contreras VT, De Lima AR, Navarro MC. Revisión: Morfogénesis de Trypanosoma cruzi: Factores relevantes para la diferenciación in vitro. Act Biol Venez. 2006; 26:49-60. [ Links ]
24. Chang SL, Negherbon WO. Studies on hemoflagellates. II.-A study of the growth rates of Leishmania donovani, Leishmania brasiliensis, Leishmania tropica and Trypanosoma cruzi in culture. J Inf Dis. 1946; 80:172-84. [ Links ]
25. Nahapetian AT, Thomas JN, William G. Thilly WG. Optimization of environment for high density Vero cell culture: Effect of dissolved oxygen and nutrient supply on cell growth and changes in metabolites. J Cell Sci. 1986; 81:65-103. [ Links ]
26. Metzen E, Wolff M, Fandrey J, Jelkmann W. Pericellular PO2 and O2 consumption in monolayer cell cultures. Resp Physiol. 1995; 100:101-6. [ Links ]
27. GIBCO® Cell Culture Basics Handbook. Disponible en: http://www.invitrogen.com/site/us/en/home/References/gibco-cell-culture-basics.html. Acceso 23 de febrero 2012. [ Links ]
28. Navarro MC, Córdova AS, Fernández KN, Arteaga RY, Graterol DI, Domínguez MI y col. Epimastigogénesis de Trypanosoma cruzi: método para estudiar in vivo la transformación de tripomastigota en epimastigota. Kasmera. 2012; 40:122-33. [ Links ]












 uBio
uBio