Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro v.23 n.1 Barquisimeto abr. 2011
Técnica de tinción de estructuras fúngicas con colorantes vegetales como una alternativa no contaminante
María S. González1, Diego Diamont P1. y Bárbara Gutiérrez1
1 Instituto Nacional de Investigaciones Agrícolas (INIA), Centro Nacional de Investigaciones Agropecuarias (CENIAP). Apdo. 4653. Maracay. Venezuela. e-mail: mgonzalez@inia.gob.ve
RESUMEN
Diversos productos químicos son usados para la tinción de estructuras fúngicas. Muchos son nocivos para la salud y altamente contaminantes para el ambiente como es el caso del fenol. Con el fin de evitar el uso de estos productos, se desarrolló una técnica de tinción para estructuras fúngicas con colorantes vegetales solubles en agua usados en la industria de alimentos tales como el rojo allura Nº 40 (16035) y azul brillante Nº 1 (42090). Para la mezcla de cada colorante se utilizó 1 mL de rojo de allura Nº 40 o azul brillante Nº 1 más ácido acético (10 mL) y glicerina (15 mL) en 75 mL de agua destilada esterilizada. Para la preparación de láminas se utilizaron colonias de varios tipos de hongos y Chromistas que crecían en sustrato natural o en medios agarificados. Los montajes preparados con rojo allura y azul brillante fueron comparados con láminas preparadas con colorantes usados en el diagnóstico rutinario de hongos como son azul de anilina y fucsina ácida en lactofenol. La técnica de tinción desarrollada con los colorantes rojo allura Nº 40 y azul brillante Nº 1 permitió evidenciar, con alto contraste, diversas estructuras de hongos y Chromistas. Además, resultó confiable, no costosa, no tóxica, con alta capacidad de tinción y con larga durabilidad. La técnica constituye una buena alternativa para fines didácticos, además que no es contaminante, ya que los reactivos son inocuos al humano y al ambiente.
Palabras clave adicionales: Hongos, Chromista, Rojo Allura Nº 40, Azul Brillante Nº 1
Staining technique for fungal structures using non contaminant vegetable stains
ABSTRACT
A number of chemical products are used to stain fungal structures. Many of them are harmful to the health and highly contaminant to the environment, such as phenol. In order to avoid the use of these products, a staining technique was developed to stain fungal structures by using vegetable soluble stains which are used in food industry such as allura red Nº40 (16035) and bright blue Nº 1 (42090). To prepare the mixture of each stain, 1 mL of allura red or bright blue was used mixed with acetic acid (10 mL), glycerin (15 mL) in 75 mL of sterile distilled water. To slide preparation, several types of fungi and Chromista that grew on natural substrate or agar media were used. The mounting prepared with allura red and bright blue were compared to stain used in the routine fungal diagnostic such as blue aniline and acid fucsin in lactophenol. The staining technique developed with allura red and bright blue allowed to observe, with high contrast, several fungal and Chromista structures. Besides, the technique is confident, cheap and non toxic, with high capacity of staining and durability. The technique constitutes a good alternative to didactical purpose and it is not contaminant because the reagents are innocuous to the human and environment.
Aditional key words: Fungi, Chromista, Allura red Nº 40, Bright blue Nº 1
Recibido: Abril 29, 2010 Aceptado: Diciembre 6, 2010
INTRODUCCIÓN
Para la identificación o determinación de hongos con fines de diagnóstico o estudios taxonómicos es necesario observar estructuras fúngicas con alta nitidez y contraste, y se utilizan diversos compuestos químicos que permitan tinción diferencial entre las paredes y citoplasma de las células fúngicas. Entre los compuestos más usados en pruebas rutinarias se incluyen: fenol, ácido láctico en combinación con azul de algodón o fucsina ácida, entre otros (CMI, 1985; Dhingra y Sinclair, 1986). El fenol desactiva las enzimas líticas en la célula e impide que ésta se rompa.
Además, actúa como mordiente cuando se usa en combinación con colorantes. El ácido láctico preserva las estructura fúngicas. El azul de algodón es un colorante ácido, que tiñe el citoplasma y la quitina presente en las células fúngicas. La fucsina ácida tiñe el citoplasma de las células (Carmichael, 1955). Sin embargo, el constante uso y exposición a estos productos podría producir deterioro de la salud. El fenol es un compuesto que es absorbido rápidamente a través de la piel y se ha señalado que produce una variedad de efectos adversos a la salud como náuseas, vómito, daños renales y hepáticos (Sigma-Aldrich. 2000). En el caso del azul de anilina y la fucsina ácida aunque son considerados levemente peligrosos son irritantes al contacto con la piel, ojos o cuando son inhalados (MSDS, 2007). El ácido láctico es usado extensivamente en la industria de alimentos como un agente de sabor, preservativo y ajustador de acidez de los alimentos (Sema-Cock y Rodríguez, 2005). Sin embargo, se ha señalado que la inhalación causa tos, problemas respiratorios, en contacto con la piel y ojos produce irritación y enrojecimiento del área afectada, la ingestión provoca problemas gástricos como quemado, náuseas y cólicos (Kegley et al., 2009). Además, el desecho de alguno de estos productos contamina el medio ambiente. No se encontraron antecedentes sobre el uso de colorantes vegetales para la tinción de hongos u otros organismos. En tal sentido, en la búsqueda de sustitutos químicos menos contaminantes este trabajo tuvo como objetivo desarrollar una técnica de tinción de estructuras fúngicas con colorantes vegetales solubles en agua usados en la industria de alimentos tales como rojo allura Nº 40 (16035) y azul brillante Nº 1 (42090) en combinación con ácido acético y glicerina.
MATERIALES Y MÉTODOS
Se utilizaron los colorantes vegetales rojo allura Nº 40 (16035) y azul brillante Nº 1 (42090). Para cada colorante se preparó una solución compuesta de: colorante vegetal (1 mL), ácido acético (10 mL) el cual se usó como mordiente y glicerina (15 mL) usada como humectante, mezclados en 75 mL de agua destilada esterilizada.
Se utilizaron colonias de varios tipos de hongos que incluyeron Bipolaris, Pseudocercospora y Rhizoctonia y Chromista como Phytophthora creciendo en sustrato natural o en medios agarificados. Para cada solución de colorantes se prepararon láminas semipermanentes, con impresiones con cinta engomada y con Necol. Esta última es una solución preparada con cuatro partes de acetona, una parte de alcohol diacetona y se le añadió celulosa acetato hasta obtener una consistencia como un esmalte transparente. Una vez preparada, se colocó una gota sobre las colonias de hongos que crecen superficialmente en hojas tales como Bipolaris y Pseudocercospora. Transcurridos 30 min, se formó una película transparente en la cual se encontraban adheridas las estructuras de los hongos. La película se removió cuidadosamente y se colocó en una lámina portaobjeto. Luego, sobre la película transparente, se colocaron gotas de acetona con el fin de remover la celulosa acetato, la cual forma un anillo blanco en la periferia donde se encuentran las estructuras del hongo (CMI, 1985). Una vez que se removió la celulosa acetato se colocó una gota de los colorantes vegetales rojo allura Nº 40 y azul brillante Nº 1.
Para la comparación de los resultados se prepararon láminas con los colorantes lactofenol con 0,1 % de azul de anilina o 0,1 % de fucsina ácida, los cuales son usados en el diagnóstico rutinario de enfermedades causadas por hongos en plantas.
RESULTADOS Y DISCUSIÓN
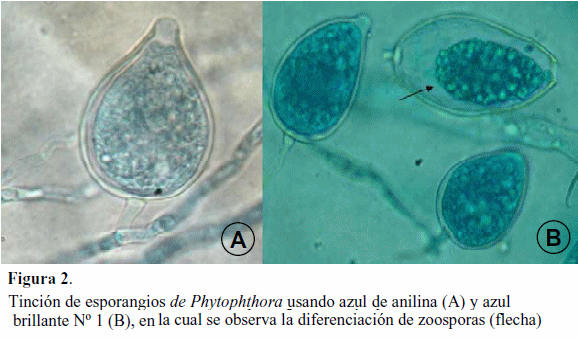
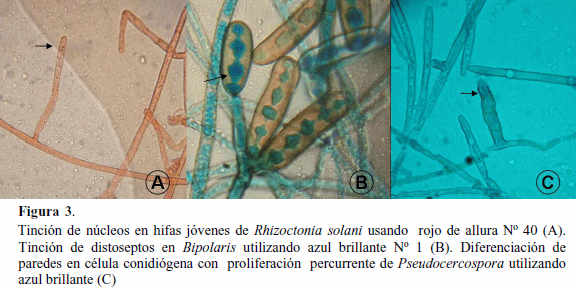
La técnica de tinción desarrollada permitió evidenciar, con alto contraste, diversas estructuras de cromistas y hongos. Los colorantes rojo allura Nº 40 y azul brillante Nº 1, tiñeron el citoplasma de las células y permitió un buen contraste con las paredes de las mismas, cuando se comparó con los colorantes usados convencionalmente como son el azul de anilina o fucsina ácida en lactofenol. Se observó tinción diferencial del contendido citoplasmático y paredes de los esporangios de Phytophthora usando lactofucsina (Figura 1A) y rojo de allura Nº 40 (Figura 1B). Igualmente, se evidenció la tinción de esporangios de Phytophthora usando azul de anilina (Figura 2A) y azul brillante Nº 1 (Figura 2B). Con el azul brillante se observó la diferenciación de zoosporas (flecha). El rojo allura resultó adecuado para teñir núcleos en hifas jóvenes de Rhizoctonia (Figura 3A). Esto permite de una manera rápida y sencilla determinar aislamientos bi o multinucleados de Rhizoctonia el cual es un criterio importante para la identificación de especies. Para fines didácticos el uso de azul brillante permite caracterizar conidios con presencia de distoseptos en géneros como Bipolaris (Figura 3B); así como evidenciar las proliferaciones percurrentes en células conidiógenas, por el contraste de tinción de paredes celulares en Pseudocercospora (Figura 3C).
Láminas preparadas con impresiones con cinta engomada usando rojo allura Nº 40 y azul brillante Nº 1, se preservaron hasta por más de seis semanas. Esto es importante cuando se necesitan conservar estructuras fúngicas con fines didácticos, ya que láminas preparadas con cinta engomada usando lactofucsina o azul de anilina, tienen una duración no mayor de 24 horas una vez preparadas. La técnica de tinción no resultó adecuada con láminas preparadas con Necol, ya que no se observó buen contraste.
CONCLUSIONES
La técnica desarrollada es simple, segura, con productos de fácil obtención y también puede ser aplicable a otros organismos como Chromistas. Además, resultó confiable, no costosa, no tóxica, con alta capacidad de tinción y con larga durabilidad. La técnica constituye una buena alternativa para fines didácticos, de investigación y lo más importante es que no es contaminante, ya que los reactivos son inocuos al humano y al ambiente. Actualmente se están realizando pruebas para determinar su aplicabilidad en estudios histopatológicos en plantas.
LITERATURA CITADA
1. Carmichael, J.W. 1955. Lacto-fucsin; a new medium for mounting fungi. Mycologia 47: 611. [ Links ]
2. CMI (Commonwealth Mycological Institute) 1985. Manual para patólogos vegetales. Commonwealth Agricultural Bureaux. London. 438 p. [ Links ]
3. Dhingra, O.D. y J.B. Sinclair. 1986. Basic Plant Pathology Methods. C.R.C. Press. Boca Ratón. Florida. 355 p. [ Links ]
4. Kegley, S.E., B.R. Hill, S. Orme y A.H. Choi. 2009. PAN Pesticide Database, Pesticide Action Network, North America, San Francisco, CA. Disponible en: http://www.pesticideinfo.org. [ Links ]
5. MSDS (Material Safety Data Sheet). 2007. Safety data for acid fucsia. http://msds.chem.ox.ac.uk/ac/acid_fuchsin.html. (consulta del 20/12/2010). [ Links ]
6. Sema-Cock, L y A. Rodriguez-de Stouvenel, 2005. Producción biotecnológica de ácido láctico: Estado del Arte. Cienc. Tecnol. Aliment. 5(1): 54-65. [ Links ]
7. Sigma-Aldrich. 2000. Material Safety Data Sheet P4161 Phenol ACS reagent. Sigma Chemical Co. St. Louis, Missouri. 6 p. [ Links ]