Universidad, Ciencia y Tecnología
versión impresa ISSN 1316-4821
uct vol.17 no.66 Puerto Ordaz mar. 2013
Modelado del control de la regulación de Glucosa
Sergio Velásquez1, Ronny Velásquez2, Miguel Leyton1, José Borjas1, Ángel Custodio1
1 Dpto. de Ingeniería Electrónica, UNEXPO Vicerrectorado Puerto Ordaz, Venezuela
2 Dpto. de Ingeniería Metalúrgica, UNEXPO Vicerrectorado Puerto Ordaz, Venezuela
Email: sergiovelasquezg@gmail.com
Resumen:
En este artículo se introduce el problema de regulación de glucosa en pacientes diabéticos. El problema pretende atacarse desde una perspectiva de sistemas de control, donde la variable medida es la glucosa en el paciente y la variable controlada son la infusiones subcutáneas de insulina. Diferentes formulaciones de insulina son analizadas, las cuales dan lugar a diferentes estrategias de control. Sin embargo, el objetivo general de todas ellas es mantener la concentración de glucosa dentro de condiciones normales (70 120 mg/dl) durante las 24 hrs., y además evitar casos extremos tanto hipoglicemia o de hiperglicemia. Con el objeto de mostrar las ventajas de un sistema automático de ajuste de dosificaciones, simulaciones a lazo cerrado utilizando un modelo para un diabético tipo 1.Palabras clave
: Diabetes/ Biomedicina/ Regulación de Glucosa/ Modelos fisiológicos/ Control en lazo cerrado/ Control PIDModeling the control of the regulation of Glucose
Abstract:
This paper introduces the problem of glucose regulation in diabetic patients. The problem aims attacked from the perspective of control systems, where the measured variable is glucose in the patient and the controlled variable is the subcutaneous infusion of insulin. Different formulations of insulin are analyzed, which lead to different control strategies. However, the overall objective of all is to keep glucose levels within normal (70 120 mg / dl) for 24 hrs., And also avoid extreme cases of both hypoglycemia and hyperglycemia. In order to show the advantages of an automatic adjustment of dosages, closed-loop simulations using a model for type 1 diabetes.Keywords:
Diabetes/ Biomedicine/ Regulation of Glucose/ Physiological models/ Closed loop control/ PID control.(Recibido Octubre 2012 Aceptado Marzo 2013)
I. INTRODUCCIÓN
La insulina secretada por las células del páncreas es la encargada de promover la asimilación de glucosa por las células del organismo. De esta manera, el páncreas provee una tasa basal de 22 mU/dl, la cual puede aumentar para compensar la glucosa absorbida durante una ingesta de alimentos [1]. Ahora, en la ausencia de insulina (Diabetes Tipo 1), las concentraciones de glucosa en el organismo pueden elevarse (hiperglicemia) o reducirse (hipoglicemia) de las condiciones normales (euglicemia). Este padecimiento al no ser tratado de manera adecuada puede ocasionar diferentes complicaciones a largo plazo como: retinopatía, neuropatía, nefropatía, y daño de tejido.
Por otro lado, la insulina en el organismo puede no ser procesada de manera adecuada (resistencia a la insulina) o no ser suficiente en cantidad, o en ocasiones la glucosa producida por el hígado puede no estar completamente regulada[2], lo cual también provoca concentraciones altas de glucosa (Diabetes Tipo 2).
Esta última enfermedad, en ciertos pacientes se atiende solamente siguiendo un estricto régimen de ejercicio y dieta. Sin embargo, en ocasiones puede también necesitarse infusiones externas de insulina, pero en menor cantidad que para diabéticos tipo 1.
La diabetes mellitus tipo 2 es una de la enfermedades de más rápido desarrollo en la sociedad moderna. La falta de un régimen de ejercicio físico y los cambios en costumbres alimenticias han sido algunos de los tantos factores que han favorecido el crecimiento de esta enfermedad [3]. En la comunidad de control ha buscado atacar el problema de regulación de glucosa desde su perspectiva. Dos estrategias se vislumbran: (a) control basado en una bomba de infusión que provea en tiempo real una taza de insulina variable, la cual pueda ser ajustada por medio de un controlador que reciba las lecturas de un sensor continuo, (b) control por medio de un esquema de múltiples infusiones diarias de insulina.
Dentro de la primera categoría, se tienen aportaciones de estrategias de control basadas en modelos de la dinámica glucosa-insulina, buscando diseñar algoritmos robustos que puedan tolerar la posible incertidumbre al tratar diferentes pacientes [4- 10].
Ahora, en los esquemas multidosis, diferentes estrategias también se han sugerido buscando combinar diferentes clases de insulina para recrear el comportamiento del páncreas, y optimizar la misma de manera que se mantenga regulada la glucosa [11 - 13].
No es objetivo del artículo presentar estrategias nuevas de control, sino inducir al lector a los posibles problemas desde un punto de vista de control automático, teniendo en mente una futura implementación experimental de estos algoritmos.
II. DESARROLLO
1. Características Dinámicas De Los Diferentes Tipos De Insulina
El páncreas en condiciones normales provee una tasa constante de insulina (22 mU/dl), la cual se ve incrementada durante la ingesta de alimentos [4]. Por lo tanto, idealmente se debe buscar imitar este comportamiento en pacientes diabéticos a través de infusiones de insulina. Ahora, asumiendo que la insulina es inyectada de manera subcutánea, el proceso de absorción al torrente sanguíneo produce un retraso inherente, es decir el efecto de la infusión nunca podrá ser inmediato.
A. El ciclo metabólico glucosa-insulina
Los tres constituyentes más importantes en la alimentación de una persona son los carbohidratos, las grasas y las proteínas. Cuando se realiza una ingesta, de los nutrientes se obtiene la glucosa y esta depende de la insulina para poder ser aprovechada por las células.
La glucosa es el último eslabón de los carbohidratos ingeridos y tiene tres destinos principales: almacenarse en forma de glucógeno en hígado y músculos, convertirse en grasa o ser utilizada directamente [11]. En este sentido, el hígado es el único órgano productor de glucosa ya que el glucógeno muscular se utiliza como fuente de energía en el mismo músculo.
Por otra parte, la regulación glucémica natural tiene por objetivo asegurar un perfecto equilibrio entre la producción de glucosa y su consumo, donde las principales hormonas implicadas en el control son la insulina, el glucagón, la hormona del crecimiento, los glucocorticoides, la adrenalina y la tiroxina [10].
El principal órgano encargado de que se realice la regulación glucémica es el páncreas, es el responsable de la digestión de las grasas, las proteínas y los carbohidratos de cadena larga, mediante enzimas (función exocrina) y la regulación del nivel de glucosa sanguínea, mediante el glucagón (hormona hiperglucemiante) y la insulina (hormona hipoglucemiante), un esquema se muestra en la Figura 1 [7].
En sujetos sanos tiene lugar un incremento de la insulina plasmática y de la glucemia después de una ingesta, esto es lo que se conoce como estado postprandial.
La concentración de insulina en la vena porta es muy superior a la de la circulación periférica. Estos cambios en las concentraciones de glucosa y de insulina a nivel portal producen en el hígado la supresión de la producción de glucosa y la estimulación en la síntesis de glucógeno.
Tal es la capacidad metabólica del hígado que entre un 60% y un 70% de los carbohidratos ingeridos se almacena en los tejidos hepático y extrahepático, probablemente en forma de grasa y glucógeno, mientras que el 30% o 40% restante es oxidado (consumido), ver Figura 1.En algunos casos se desea que esta liberación sea más lenta de lo normal. Por lo que se añade protamina o zinc, lo cual retrasa la absorción y la actividad biológica de la insulina (American Diabetes Association 2002), (Dickerson 1999), con el objetivo de reproducir la taza basal de insulina por el páncreas.
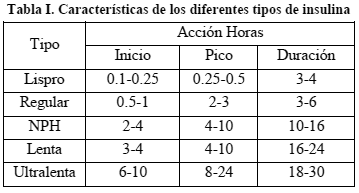
En general, la insulina se divide en tres clases de acuerdo a su origen: bovina, porcina y humana, y por la duración de su acción: ultrarrápida (Lispro), rápida (Regular), intermedia (NPH), lenta y ultralenta. (Dickerson 1999), (Flores et al. 1984).
La Tabla I presenta las propiedades de liberación de diferentes tipos de insulina humana.
Al respecto, Berger y Rodbard (1989) propusieron un modelo para reproducir la dinámica de absorción de insulina para las diferentes clases comerciales, donde se plantea modificar 3 parámetros del modelo de acuerdo a la clase de insulina. La Figura 1 muestra la evolución de la concentración de insulina en plasma después de una infusión de 10
U de insulina Lispro, Regular, NPH, Lenta y Ultralenta, utilizando el modelo de Berger y Rodbard (1989). 
2. Tratamiento en Base a Formulaciones de Insulina
Estudiando las propiedades de absorción de cada insulina (Tabla 1), se pueden sugerir varios regímenes terapéuticos.
Analizando las costumbres comunes deben entonces considerase tres alimentos por día, donde la comida (12:00-14:00 hrs.) es la ingesta fuerte del día. Como resultado se sugieren estrategias de tres o dos dosis diarias programadas antes de cada ingesta [5]. Debido los tiempos de absorción, se sugiere programar las dosificaciones de insulina Lispro 15 minutos antes de la ingesta, y la insulina Regular de 30 a 45 minutos antes. En todos los esquemas propuestos, el objetivo es proveer una alta concentración de insulina durante la absorción post-prandial por medio de una insulina de acción rápida (Lispro o Regular), en conjunto con una concentración constante a través de una insulina de lenta liberación (NPH, Lenta o Ultralenta).
La dosificaciones pueden cuantificarse de manera inicial siguiendo una proporción de 0.5 U/kg/dia por paciente (APhA Special Report 2001), (Dickerson 1999), (Flores et al. 1984). Sin embargo, esta proporción debe ajustarse a las necesidades de cada paciente, y en ocasiones debe incrementarse debido a stress o alguna enfermedad. Por lo que se propone un sistema de ajuste automático de dosificaciones utilizando objetivos de control.
3. Objetivos De Control
El objetivo de control puede definirse a partir del rango de variación para la concentración normal de glucosa (CNG) en un paciente diabético
El método de control en lazo cerrado debería de mantener la glucosa en sangre dentro de unos niveles de seguridad para evitar así las complicaciones de la diabetes, pero además se ha de mantener con la menor variabilidad posible, con el mayor rechazo posible a las perturbaciones (ingestas de carbohidratos) y sin influencia de las incertidumbres del sistema metabólico sobre el diseño del controlador (efectos no modelados). Pero existe una principal limitación de la propuesta del controlador y es el uso exclusivo de la insulina para mantener la normoglucemia, que causa descensos "controlados" de la glucosa en sangre, no existiendo una entrada al sistema que realice una subida controlada de glucosa (como podría ser la hormona glucagón).
El objetivo principal de un método de control metabólico en lazo cerrado que analice continuamente el nivel de glucosa (variable controlada) y en función del mismo determine las dosis de insulina que ha de administrar una bomba de infusión continua (acciones de control) para conseguir la normoglucemia en un paciente con diabetes Tipo 1, utilizando para ello algoritmos utilizados en la Ingeniería de Control de Sistemas y serán evaluados con algunos parámetros que puedan cuantificar la calidad metabólica del control y demostrando en simulación la viabilidad de un algoritmo de control metabólico en lazo cerrado aplicable en escenarios ambulatorios, es decir, que utilice la ruta subcutánea tanto para la medida de glucosa como para la administración de insulina.

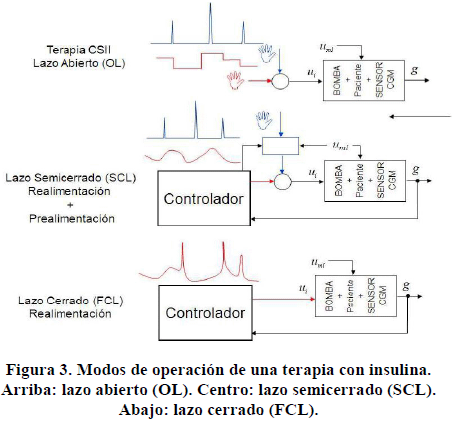
4. Sistema en Lazo Cerrado
Por medio de la realización de esta investigación se ha planteado el estudio de las consideraciones y diversas alternativas para lograr un sistema que permita monitorear constantemente el nivel de glucosa en plasma en pacientes en condiciones críticas, y posteriormente calcular una dosis adecuada de insulina a suministrar al mismo vía intravenosa manteniendo el nivel de glucosa en un rango entre 80 y 110 mg/dl [1]
El sistema diseñado, no contempla perturbaciones distintas a la alimentación del paciente como los medicamentos ingeridos. En la Figura 5 se ilustra un diagrama de bloques con los elementos que conforman el sistema de monitoreo continuo y control en lazo cerrado.
A. La regulación reactiva PID
El PID es un regulador ampliamente utilizado en la industria por simplicidad, flexibilidad y fácil sintonizado, que no siempre necesita la explicitación de un modelo ya que generalmente se utilizan reglas empíricas. Un regulador PID puede modelar el sistema metabólico no patológico, ya que describe la respuesta multifásica de la producción de insulina por el páncreas a un cambio instantáneo de glucosa en sangre, situación que no identifica la absorción de glucosa mediante una ingesta. La respuesta del controlador PID se compone de la suma de tres componentes que reaccionan lentamente a la glucosa, inmediatamente a la glucosa y/o a la velocidad de cambio de la glucosa (Steil, Panteleon & Rebrin 2004, Steil et al. 2006, Steil, Rebrin & Mastrototaro 2006), en la Figura 6 se muestra de forma gráfica la analogía.
B. Modelo de estimador de ingestas.
El modo más efectivo de minimizar el error producido por el retardo de la acción de la insulina es administrarla cierto tiempo antes de que se produzca la ingesta. Esto es imposible cuando se diseña un algoritmo de control que basa sus acciones exclusivamente en la medida de glucemia observada en un momento dado, ya que la administración de insulina siempre será posterior a la ingesta pues el controlador no actuará hasta que los efectos de la absorción de carbohidratos empiecen a reflejarse en las medidas de glucemia.
El objetivo cuando el controlador trabaja en el modo de funcionamiento FCL (Full Closed Loop),es reducir el tiempo que transcurre desde que se realiza la ingesta hasta que el algoritmo empieza a administrar insulina. En este trabajo se propone reducir ese tiempo de respuesta mediante un estimador de ingestas que permita detectar en una fase más temprana las elevaciones de las concentraciones de glucemia en sangre.

En cualquier caso, siempre se estimará la ingesta con un momento posterior a la ingesta real con lo que sigue sin ser posible anticipar la insulina a la ingesta, pero se minimiza el desfase. El concepto de estimador de ingestas mediante funciones inversas ya ha sido utilizado, aunque con modelos más simples (Neatpisarnvanit, Boston 1999), también ha sido utilizados algoritmos que intentan detectar la ingesta en su fase inicial (Dassau et al. 2008, Hyunjin et al. 2009).
III. RESULTADOS Y DISCUSIÓN
1. Simulaciones a Lazo Cerrado
Para efecto de ilustrar al lector las posibles ventajas de un sistema con ajuste de dosificaciones, se realizan simulaciones a lazo cerrado utilizando una estrategia de ajuste presentada por Campos-Delgado et al. (2004), bajo los diferentes esquemas multidosis. Para este propósito, se utilizó un modelo no-lineal de un paciente diabético tipo 1, el cual consta de los siguientes sub-sistemas:
●
Modelo por compartimentos insulina-glucosa propuesto por Sorensen (1985)● Modelo de absorción de glucosa gástrica a partir de ingestas, medidas a través de su contenido de carbohidratos (Lehmann y Deutsch 1992)
● Modelo de absorción de insulina subcutánea desarrollado por Berger y Rodbard (1989)
La Figura 9 muestra el diagrama de bloques del modelo total usado en las simulaciones a lazo cerrado. El lector interesado en una referencia detallada del modelo por compartimentos del diabético tipo 1, y su utilización con propósitos de control se le sugiere (Parker et al. 1999), (Parker et al. 2000), (Ruiz-Velazquez et al. 2004). Las simulaciones numéricas fueron realizadas en MATLAB/Simulink ©
Considerando las mediciones de glucosa, la desviación diaria (J) de la zona considerada como NNG (niveles normales la glucosa) es implementada como:
![]()
donde n es el numero de mediciones por día Φ(k) es la cantidad desviada de la zona NNG, y se define como:

donde
G es una constante positiva que asigna un peso extra a los casos de hipoglucemia. El límite superior de Φ(k) fue extendido a 140 mg/dl para reducir la sensibilidad del controlador.El ajuste de los escalamientos se realiza al inicio de cada día usando:
![]()
donde
ΔIr and ΔIuitra son los decrementos / incrementos dados por el controlador difuso externo. La expresión i 1 se refiere al factor de escalamiento anterior, e i al ajuste actual.El algoritmo PID es en esencia un algoritmo de control proporcional-integral-derivativo (PID). La ecuación general del algoritmo, utilizando la notación usual, es:

En (4) uc(t) es la señal de comando que envía el controlador hacia el elemento final de control,
ūc(t) es el valor base del controlador, e(t) es la señal de error que entra al controlador, Kp es el termino proporcional del algoritmo de control, Ki es el termino integral del algoritmo de control y Kd es el termino derivativo del algoritmo de control.De acuerdo con (3) la función de transferencia del controlador es:
![]()
Este algoritmo básico puede tener, dependiendo de las necesidades propias del proceso, alguna de las siguientes configuraciones: Proporcional (P), Proporcional + Integral (PI) o Proporcional + Integral + Derivativo (PID). A (4) se le conoce como PID ideal. Comparando (4) se tiene que: Kp = K, Kd = KTd, ![]() . Una expresión muy usada, similar a (4) que ayuda a mejorar el modo derivativo en los controladores PID es:
. Una expresión muy usada, similar a (4) que ayuda a mejorar el modo derivativo en los controladores PID es:
![]()
El valor de a (0.05< a < 0.2) es un valor práctico y se elige el mejor por ensayo y error.
La información usada por este controlador es la desviación diaria (J) de 24 hrs. antes y de 48 hrs. antes
(Jp), además los ajustes Δlrp and Δluitrap de 24 hrs. previas. La estrategia anterior es seleccionada para detectar tendencias en el comportamiento de los niveles de glucosa Nótese en la simulación de la Figura 10, el incremento en los niveles de glucosa estimados para pacientes de Diabetes tipo I, para cada incrementos existe una dosificación de insulina, mostrada en la Figura 11, es necesario acotar que en las figuras se muestran tiempos de establecimiento acorde con tiempo de simulación; aun así; se nota la ventaja en el establecimiento de la dosis ultralenta.En la Figura 11 observamos las curvas de respuesta según cada tipo de infusión o dosis del insulina, Lispro (azul oscuro), Regular (verde), Lenta (roja), Ultra Lenta (Aguamarina), llevando al paciente a set point que esta en 0.056/0.057.
Esto considerando una tasa de reabsorción de Glucosa de 2.5, una umbral de concentración de glucosa de 0.51 y una tasa de flujo de Glucosa de 8400.
El controlador fue implementados bajo la estructura de MATLAB®
En la Figura 12 se muestra la densidad de insulina usada en las dosis usando el promedio de Welch, nótese que el método usado permite que el termino más adecuado para referirnos a él sea el de multidosis, debido a las dosis multiples que se suministran al paciente para logar el establecimiento de los niveles de Glucosa, y la correcta proporción Insulina/Glucosa.
La relación de la proporción Glucosa/Insulina en tiempo de simulación no real se muestra en la Figura 13, note como la proporción de la relación máxima entre ambos es vista como aproximadamente cero en la simulación.
La Figura 14 muestra la relación logarítmica de las muestra (Azul), en cuadro comparativo con la Ganancia proporcional de la Glucosa (Roja), Glucosa Insulina (verde) e insulina (aguamarina).
III. CONCLUSIONES
1. El problema de control de glucosa en pacientes con Diabetes es un problema complejo, que requiere la compensación de grandes perturbaciones como la ingesta, ejercicio y estrés, con el peligro de inducir hipoglucemias en caso de sobre-actuación del controlador; una gran variabilidad intra-paciente, debida en parte a variaciones de la sensibilidad insulínica producidas por los ritmos circadianos; grandes retardos tanto en la actuación (de aproximadamente 2 horas) como en la medición (5-15 minutos); errores de medición medios del orden del 15 %, con una gran dispersión, y más significativos para glucemias bajas; y problemas frecuentes de infusión irregular de insulina por fallos en la bomba. Así pues, los desafíos son múltiples y de gran calado.
2. El modelo permite hacer un buen control de las variaciones de la glucosa en pacientes, se tiene en cuenta que la información presenta incertidumbres (debido a lo particular de cada paciente). Se deben considerar incertidumbres (ruidos y/o perturbaciones para efectos electrónicos de simulación) en los parámetros tales como las sensibilidades hepáticas y periféricas de la insulina, así como en los gramos de carbohidratos de una comida, con el fin de controlar los efectos que produce una terapia dada de insulina sobre la glucemia.
3. Si suponemos variabilidad en cada paciente e incertidumbre en la comida, puede conseguirse un control más seguro de los posibles episodios de hiperglucemia y de hipoglucemia inducidos por la terapia de insulina, consiguiendo una reducción del número de episodios debido a esta afección.
4. Actualmente, los métodos desarrollados se integran en un modelo de avanzada basado en la ayuda a la decisión con la finalidad de obtener la dosis de insulina modelo y el tiempo de la inyección, que permitan reducir al mínimo el riesgo de hiperglucemias e hipoglucemias en pacientes con diabetes del tipo 1.
IV. REFERENCIAS
1. R. Belazzi, G. Nucci y G. Cobelli, "The Subcutaneous Route to Insulin-Dependent Diabetes Therapy",
IEEE Engineering in Medicine and Biology, 20(2001), 54 64. [ Links ]2. E.F. Camacho y C. Bordona,
Model Predictive Control, Springer Verlag London Limited (1999). [ Links ]3. D.U. Campos-Delgado, R. Femat, E. Ruiz-Velázquez y A. Gordillo-Moscoso, "Knowledge-Based Controllers for Blood Glucose Regulation in Type I Diabetic Patients by Subcutaneous Route",
Proceedings of the International Symposium on Intelligent Control, Houston, 3-5 October (2003). [ Links ]4. L.M. Dickerson, "Insulin Therapy in the Treatment of Diabetes Mellitus",
http://www.musc.edu/dfm/pharmdMed%20Resident/insulin.pdf, (1999). [ Links ]5. F.J. Doyle III, B. Srinivasan y D. Bonvin, "Run-to-Run Control Strategy for Diabetes Management",
Proceedings of the SSrd Annual EMBS InternaUonal Conference, Istanbul, Turkey, October 25-28 (2001). [ Links ]6. E.D. Lehmann y T. Deutsch, "Compartmental models for glycaemic prediction and decision-support in clinical diabetes care: promise and reality",
Computer Met-hods and Programs in Biomedicine, 56(1998), 193 204. [ Links ]7. E.D. Lehmann, "The freeware AÍDA Lnteractive educational diabetes simulator - http://www.2aida.org - (1) A download survey for AÍDA v4.0",
Diagnostica and Medical Technology, 7(2001), 504-515. [ Links ]8. S.M. Lynch y B.W. Bequette, "Model Predictive Control of Blood Glucose in Type I Diabetics Using Subcutaneous Glucose Measurements",
Proceedings of the American Control Conference, Anchorage, AK, May 8-10 (2002). [ Links ]9. R.S. Parker, F.J. Doyle III y N.A. Peppas, "A Model-Based Algorithm for Blood Glucose Control in Type I Diabetes Patients",
IEEE Transactions on Biomedical Engineering, 46(1999), 148-156. [ Links ]10. J. Radziuky S. Pie, "Hepatic Glucose Uptake, Gluconeoge-nesis and the Regulation of Glycogen Synthesis",
Diabetes Metabolism, Research and Reviews, 17(2001), 250-272. [ Links ]11. T. Shimauchi, N. Kugai, N. Nagata, and O. Takatani, "Microcomputer-Aided Insulin Dose Determúiation in Intesifíed Conventional Insulin Therapy",
IEEE Transactions on Biomedical Engineering, 35(1988), 167-171. [ Links ]12. J.T. Sorensen, "A Physiologic Model of Glucose Metabolism in Man and its Use to Design and Assess Improved Insulin Therapies for Diabetes", Ph.D. Dissertation, Chemical Engineering Department, MIT, Cambridge (1985). [ Links ]
13. L.X. Wang,
A Course in Fuzzy Systems and Control, Prentice-Hall, Upper Saddle River (1997). [ Links ]14. Prados-Vilchez, A., Rodríguez-Herrero, A., Pérez-Gandía, C., Gómez, E.J. & Hernando, M.E. 2009, "Predictor Dinámico Paramétrico de la Glucosa Subcutánea en Diabetes Tipo 1: Muestreo y Filtrado", XXVII Congreso Anual de la Sociedad Española de Ingeniería Biomédica, pp. 640. [ Links ]












 uBio
uBio