Universidad, Ciencia y Tecnología
versión impresa ISSN 1316-4821
uct vol.20 no.80 Puerto Ordaz set. 2016
Deshidratación de etanol empleando líquidos iónicos
Lidersi Acosta Cordero, Osney Pérez Ones y Lourdes Zumalacárregui de Cárdenas
Facultad de Ingeniería Química, Universidad Tecnológica de la Habana José Antonio Echeverría (Cujae), Cuba
Resumen: El interés de los científicos por los líquidos iónicos ha ido creciendo en los últimos años, demostrado con el gran número de publicaciones y patentes sobre líquidos iónicos. Dadas las ventajas que presentan como disolventes alternativos a los disolventes moleculares, en la separación de las mezclas etanol-agua, en este trabajo se presentan las principales características, propiedades y aplicaciones de estos compuestos. Además se muestran los resultados obtenidos en la separación de las mezclas etanol-agua, con varios líquidos iónicos que han sido empleados. Finalmente se resaltan las principales ventajas que presentan los líquidos iónicos frente a los solventes convencionales, en la separación de la mezcla etanol-agua.
Palabras Clave: etanol, azeótropo, deshidratación de etanol, destilación extractiva, líquidos iónicos.
Ethanol dehydration employing ionic liquids
Abstract: The interest of scientists for ionic liquids has been growing up in recent years, which has been demonstrated by the large number of publications and patents on ionic liquids. Due to the advantages presented by them as an alternative to molecular solvents in the separation of ethanol-water mixtures, in this paper we present the main characteristics, properties and applications of these compounds. Furthermore, the results of the separation of the ethanol-water mixtures, with various ionic liquids used are displayed. Finally, the main advantages of ionic liquids compared to conventional solvents in the separation of the ethanol-water mixture are highlighted.
Key words: Ethanol, azeotropic point, ethanol dehydration, extractive distillation, ionic liquids.
Recibido (27/06/2016), aceptado (24/08/2016).
I. INTRODUCCIÓN
A nivel mundial el etanol ha adquirido un gran valor por la posibilidad de su uso como combustible, ya sea mezclado con gasolina o con petróleo y sobre todo porque es una fuente renovable de energía [1]. Las perspectivas mundiales para el etanol, usado como combustible, crecen con los niveles sin precedentes que están alcanzando los precios del petróleo crudo. Por lo anterior, hay un interés creciente en muchos países en usar el etanol, ya que es considerado un producto renovable [2].
Aproximadamente en el 95% de las industrias en el mundo, el etanol se obtiene por la vía fermentativa de azúcares, dando esto una mezcla de etanol-agua, la cual se deberá separar con la mayor eficiencia posible. La separación de esta mezcla es difícil debido a sus afinidades químicas [1]. La separación de esta mezcla azeotrópica no puede ser por destilación simple por lo que requiere de métodos especiales tales como destilación azeotrópica, destilación extractiva, adsorción con tamices moleculares, entre otros [3-5].
La destilación extractiva se aplica comúnmente en la industria y se ha convertido en un método de separación importante en ingeniería química. A una mezcla binaria que es difícil o imposible de separar por los métodos ordinarios, se le agrega un tercer componente, denominado agente extractivo o disolvente, el cual altera la volatilidad relativa de los componentes originales sin formar nuevos azeótropos, y permite, de esa forma, la separación. Este disolvente agregado es de baja volatilidad y de alta selectividad, no evaporándose de modo apreciable durante todo el proceso [1, 3-7]. Como agentes de separación se pueden emplear glicoles, sales disueltas, polímeros y líquidos iónicos.
El interés de los científicos por los líquidos iónicos ha ido creciendo en los últimos años, demostrado con el gran número de publicaciones y patentes sobre líquidos iónicos. Las posibilidades que tienen los líquidos iónicos como disolventes alternativos a los disolventes moleculares dependen de las ventajas que aporten para esta finalidad. Una de las propiedades más importantes y singulares de los líquidos iónicos es su baja presión de vapor a presiones y temperaturas moderadas. Como su volatilidad es tan pequeña, se les considera disolventes no volátiles. Por esta razón, este tipo de material ha ido ganando importancia y un particular interés como un nuevo tipo de disolvente no convencional (disolvente verde).
II. LÍQUIDOS IÓNICOS
Las sales fundidas son líquidos que están constituidos por iones pero, debido a su elevada temperatura de fusión, gran poder corrosivo y alta viscosidad, no pueden utilizarse como fase líquida para efectuar reacciones químicas. Por esta razón, el término de líquido iónico no se utiliza para designar a las sales fundidas, a pesar de que lo son [8]. Con este término, líquidos iónicos, se designa a otros compuestos que también son líquidos formados exclusivamente por iones pero sus propiedades son muy diferentes a las que tienen los líquidos procedentes de sales fundidas [8-11]. La singularidad de sus propiedades ha atraído la atención de científicos y técnicos y ha impulsado su estudio con el objetivo de explorar las posibilidades de este tipo de compuestos como un nuevo medio líquido en el que efectuar reacciones químicas [8].
Con el descubrimiento de compuestos iónicos cuya temperatura de fusión es inferior a 373 K se dispone de una nueva familia de disolventes cuyas propiedades ofrecen muchas ventajas potenciales, frente a los disolventes orgánicos convencionales, para la síntesis de compuestos orgánicos y para la extracción de determinados componentes de una mezcla [8, 12]. Los disolventes iónicos a temperatura ambiente aportan un nuevo medio líquido para estudiar las reacciones químicas y para utilizarlo en la fabricación de productos en las instalaciones químicas. Esta adaptación implica que debe ser líquido a la temperatura de operación y que no debe reaccionar, alterar o alterarse, en presencia de los reactivos, productos o catalizadores, necesarios para que tenga lugar la reacción [8].
Aunque el esfuerzo investigador es considerable y creciente en los últimos años en el ámbito de líquidos iónicos, su aplicación efectiva en procesos industriales en uso, se ve restringida básicamente por tres factores [13]: costo de los líquidos iónicos y complejidad en su tecnología de fabricación, dificultad de recuperación y reutilización de dichas sustancias para procesos industriales continuos, información limitada de propiedades físico-químicas y toxicidad potencial (humana y ambiental).
Composición
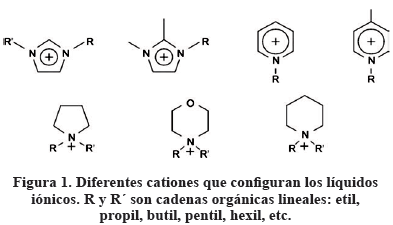
Los líquidos iónicos (llamados también disolventes de diseño) son sustancias iónicas formadas por cationes (figura 1) orgánicos asimétricos y voluminosos y aniones (figura 2) orgánicos e inorgánicos [3, 8, 9, 11, 14-18]. Los cationes por lo general tienen naturaleza aromática con átomos de nitrógeno en el anillo, heterociclos nitrogenados, mientras que los aniones suelen estar constituidos por diferentes elementos químicos [8].
Entre los cationes más comunes se destacan: [BMIN]+ (1-butil-3-metil imidazolio), [HMIM]+ (1-hexil-3-metil-imidazolio), [OMIM]+ (1-octil-3-metil-imidazolio), [BMIM]+ (1-butil-3-etil-imidazolio), [EMIM]+ (1-etil-3-metil-imidazolio), entre otros. Mientras, los aniones más usuales son: PF6- (hexafluorofosfato), BF4- (tetrafluoroborato), CF3-COO- (trifluoroacetato), CF3- SO3- (trifluorosulfonato o triflato), SbF6- (hexafluoro antimoniato), entre otros [3, 6].
Los líquidos iónicos son sales formadas por iones muy asimétricos y de gran tamaño por lo que las fuerzas de atracción catión-anión son más débiles que las fuerzas que intervienen en las sales iónicas convencionales (sales fundidas) [8].
Clasificación
Los líquidos iónicos pueden clasificarse en dos grandes categorías de compuestos, los líquidos iónicos apróticos (AIL, por sus siglas en inglés) y los líquidos iónicos próticos (PIL, por sus siglas en inglés), estos últimos también denominados líquidos iónicos de Brønsted. La diferencia entre ambas familias es su forma de obtención y la estructura química. Históricamente, el esfuerzo investigador se ha orientado de forma muy importante hacia los primeros, apareciendo desde hace apenas dos años un creciente interés en los PIL en aplicaciones industriales [19-21], y su previsible menor toxicidad.
Los líquidos iónicos de naturaleza prótica son más baratos que los apróticos, la síntesis química es más simple, además, tienen bajo perfil toxicológico y presentan mejor biodegradabilidad [22].
La síntesis de los líquidos iónicos apróticos se inicia con la formación de un catión precursor mediante una reacción de cuaternización, después se lleva a cabo una reacción de intercambio aniónico, que normalmente ocurre por metátesis, o una reacción con ácido de Lewis para obtener el líquido iónico deseado. En algunos casos, el catión precursor se encuentra disponible comercialmente, por lo tanto solo se requiere el intercambio aniónico o la reacción con el ácido de Lewis. La reacción de metátesis consiste en el intercambio de iones en una disolución que contiene dos pares iónicos, para dar como resultado el par de iones termodinámicamente más estable. Las resinas de intercambio iónico son polímeros capaces de intercambiar iones particulares que se encuentran dentro de él, con iones provenientes de una disolución que se pasa a través de esta. La columna de intercambio opera bajo un proceso cíclico: regeneración, lavado, carga/recarga [23-25].
Sin embargo, la síntesis de los líquidos iónicos próticos es más simple, consiste en la transferencia de un protón desde un ácido de Brönsted hasta una base del mismo tipo, ocasionando la presencia de al menos un protón, el cual es capaz de promover puentes de hidrógeno. Estos líquidos iónicos se sintetizan por reacción directa, en proporción estequiométrica, de compuestos de amina (etanolamina) con ácidos orgánicos (ácido fórmico, láctico, propanoico, etc.) [24, 26].
Los principales estudios de los líquidos iónicos próticos se han enfocado fundamentalmente a su caracterización, logrando probar su baja toxicidad, bajos costos de producción y la facilidad de su síntesis [26].
En fecha reciente, ha sido desarrollada una nueva familia de líquidos iónicos por el equipo de trabajo de Miguel Iglesias (Universidad Federal de Bahía, UFBa) [27, 28], que a la vista de los primeros resultados presenta ventajas adicionales a los ya existentes, tanto funcionales como de carácter ambiental, dado que están desprovistos en su estructura molecular de componentes aromáticos (anillos bencénicos o heterocíclicos) o átomos halogenados. Estas estructuras son comunes en los líquidos iónicos hasta ahora estudiados y en gran medida la toxicidad viene condicionada por ellas.
Propiedades
Las propiedades de los líquidos iónicos están determinadas por la combinación catión-anión. Al disponer de un gran número de aniones y de cationes para diseñar los líquidos iónicos se puede seleccionar la combinación más apropiada para aplicaciones específicas [3, 6, 8, 17]. El diseñador del líquido iónico dispone de un componente, el catión, principal responsable del comportamiento químico y de otro, el anión, que aporta la mayor parte de las propiedades físicas [3, 6, 8].
Una de las propiedades que hace que los líquidos iónicos sean especialmente atractivos como sustitutos de los tradicionales disolventes orgánicos volátiles es su baja presión de vapor. Esto es debido a que a diferencia de las sales fundidas, los líquidos iónicos presentan una débil interacción coulómbica entre iones, que limita la formación de pares iónicos necesarios para que se produzca la volatilización de las sales. Esta característica los hace fácilmente manejables al no evaporarse. Además presentan una alta estabilidad térmica y química, lo que permite que se puedan utilizar a altas temperaturas [29].
Las posibilidades que tienen los líquidos iónicos como disolventes alternativos a los disolventes moleculares dependen de las ventajas que aporten para esta finalidad [8]. Los líquidos iónicos tienen bajo punto de fusión (< 373 K), alta estabilidad térmica y química, no son inflamables ni corrosivos y como su volatilidad es tan pequeña, se les considera disolventes no volátiles [3, 6, 9, 14-16, 30].
En general los líquidos iónicos tienen mayor densidad que el agua. Como regla general la densidad del líquido iónico disminuye con el aumento en el volumen del catión orgánico [8, 9]. Además también depende de la naturaleza del anión. Normalmente la densidad de los líquidos iónicos varía entre 1,05 y 1,36 g/cm3. Reina [18] determinó experimentalmente las densidades e índices de refracción para mezclas binarias de agua, metanol y etanol con etilsulfato de 1-etil-3-metilimidazolio (EMIMEtSO4) y de etanol con metilsulfato de 1-metil-3-metilimidazolio (MMIM-MeSO4) a 298,15 K, 308,15 K y 318,15 K para ser utilizados en el cálculo del volumen de exceso molar (VME) y la desviación del índice de refracción, ajustados a una ecuación polinomial de Redlich-Kister.
Los líquidos iónicos son, por su propia naturaleza iónica, mucho más viscosos que los medios de reacción convencionales. El efecto de la temperatura en la viscosidad es mucho más complicado en los líquidos iónicos y no puede describirse con la ecuación de Arrhenius como en los disolventes moleculares [8, 9]. Sus coeficientes de viscosidad a temperatura ambiente se encuentran entre 10 y 1 000 mPa·s. Por ejemplo, la viscosidad dinámica de hexafluorofosfato de 1-butil-3- metil-imidazolio (BMIM)(PF6) es 330 mPa·s a 20ºC. También esta propiedad se modifica con el número de carbonos del radical del anillo aromático. La viscosidad aumenta al aumentar la longitud de la cadena del sustituyente del imidazolio [8]. Para el mismo catión, el cambio del anión afecta de manera muy importante a la viscosidad, disminuyendo su valor en la serie [Cl- ] > [PF6-] > [BF4]. En estos casos, los parámetros determinantes de la viscosidad son el tamaño del anión y la basicidad del mismo [29].
Muchos de los líquidos iónicos son higroscópicos y se ha observado que la presencia de agua, aún en trazas, modifica considerablemente la magnitud de la densidad, viscosidad, difusividad y conductividad eléctrica del compuesto [26].
El punto de fusión establece el límite inferior del intervalo de temperatura en el que puede utilizarse el líquido iónico como disolvente [8]. El punto de fusión depende del tamaño de líquido iónico, de su carga y de la distribución de la misma. La selección del catión y del anión puede determinar el punto de fusión de un líquido iónico. Así, al aumentar el tamaño del catión y del anión disminuye el punto de fusión [29]. Además, un líquido iónico con un catión de baja simetría posee un punto de fusión más bajo que el que tiene una alta simetría. Además interacciones intermoleculares débiles y una buena distribución de la carga en el catión puede favorecer el punto de fusión de un líquido iónico [9]. La baja presión de vapor junto al amplio intervalo de temperatura de los líquidos iónicos constituye un gran atractivo para que sustituyan a los compuestos orgánicos volátiles como disolventes y permitan desarrollar una química más limpia y sostenible [8].
La descomposición térmica define el límite superior del intervalo de temperatura en el que pueden utilizarse [8]. La mayoría de los líquidos iónicos son estables por encima de 400ºC. La descomposición térmica depende de la naturaleza de los aniones más que la de los cationes [9]. Muchos líquidos iónicos usados como disolventes son tan estables que el límite superior de temperatura no constituye ningún obstáculo para su empleo como medio para efectuar reacciones químicas. En general, la temperatura a la tiene lugar la reacción química para optimizar sus resultados es más pequeña que la temperatura a la que se inicia el proceso de descomposición del líquido iónico [8].
Las entalpías de solución se han determinado para algunos líquidos iónicos basados en cationes imidazolio en diferentes disolventes a 25ºC mediante un calorímetro de titulación isotérmica [9].
La forma de abordar la polaridad en disolventes moleculares no puede extrapolarse a los líquidos iónicos por lo que es preciso tener en cuenta las complejas interacciones entre soluto y disolvente mediante parámetros (dipolaridad (π*), acidez del enlace de H (α) y basicidad del enlace de H (β)) que expresen la contribución de cada una de ellas [8, 9]. Aunque las mediciones no se han realizado para un gran número de líquidos iónicos y no existe conocimiento de cómo estos parámetros se modifican en condiciones mixtas, la tendencia general sugiere que los valores de la dipolaridad (π*) para los líquidos iónicos son más altos que para los alcoholes de cadena alquilo y los valores de α para los líquidos iónicos son inferiores a los del agua y a los de los alcoholes de cadena alquilo. El anión de un líquido iónico determina la magnitud del parámetro β [9].
Valderrama determinó propiedades críticas de 50 líquidos iónicos apróticos [31] y de otros 200 líquidos iónicos [32] empleando métodos de contribución de grupos, demostrando que estos métodos (técnicas de contribución de grupos, correlaciones generalizadas, correlaciones empíricas, y redes neuronales) desarrollados para los fluidos moleculares se pueden extender para correlacionar y predecir las propiedades de los líquidos iónicos. De esta forma se han correlacionado y predicho hasta la fecha las propiedades críticas, la presión de vapor, la densidad y la viscosidad de líquidos iónicos [12]. La densidad de los líquidos iónicos ha sido correlacionada mediante la utilización simultánea de métodos de contribución de grupos y redes neuronales [33].
Con el fin de describir las propiedades termodinámicas y el comportamiento de los líquidos iónicos el modelo COSMO (Conductor-like Screening Models) gana cada vez más influencia [34]. Ejemplos de modelos de este tipo son: COSMO-RS (Conductor-like Screening Models-Realistic Solvents) y COSMO-SAC (Conductor-like Screening Models-Segment Activity Coefficient), ambos basados solamente en la estructura molecular [35].
El modelo COSMO-RS requiere solamente parámetros específicos de los átomos, mientras que en el modelo UNIFAC se correlacionan los parámetros de interacción con datos experimentales [34]. Por lo tanto, este método es, al menos cualitativamente, capaz de describir correctamente variaciones estructurales. Varias publicaciones demuestran la idoneidad general de COSMO-RS en el cálculo de los coeficientes de actividad y el equilibrio de fases de sistemas compuestos por solventes no volátiles (líquidos iónicos) [34]. Almeida [3] utilizó el modelo COSMO-RS para estudiar la influencia de la temperatura, del catión y del anión para diferentes sistemas de líquidos iónicos. Silva [35] aplicó el modelo COSMO-SAC para los cálculos de predicción del equilibrio líquido-vapor del sistema etanol-agua-líquido iónico a la presión atmosférica. Los resultados obtenidos se compararon con la literatura para el mismo modelo del coeficiente de actividad, obteniendo buenos resultados.
Aunque la toxicidad y la biodegradabilidad no han sido determinadas para muchos líquidos iónicos, la volatilidad prácticamente nula de ellos reduce las potenciales vías de exposición, siendo el contacto directo con la piel y la ingestión las únicas vías posibles. Algunos estudios han mostrado que es posible el diseño de líquidos iónicos no tóxicos mediante la adecuada selección del catión y el anión constituyentes. Por los ensayos biológicos que se han realizado a algunos líquidos iónicos parece ser que la toxicidad viene determinada fundamentalmente por el tipo de catión. Así se ha observado que los líquidos iónicos con sustituyentes alquílicos más cortos en el catión normalmente presentan menores toxicidades. También se ha observado que algunos líquidos iónicos son biodegradables, especialmente cuando presentan un grupo éster en la cadena alquílica lateral del catión [29].
Aplicaciones
Estas sustancias se caracterizan por ser sales orgánicas no volátiles, lo que evita su dispersión por evaporación, apareciendo en fechas recientes estudios que ponen de manifiesto multitud de aplicaciones de interés industrial como el uso como agentes selectivos de separación [35, 36], catalizadores en síntesis orgánica y organometálica y para polimerización de radicales, y algunos líquidos iónicos pueden ser usados como biocatalizadores con grandes ventajas comparados con los solventes orgánicos convencionales [12]. Los líquidos iónicos basados en cloroaluminatos son ácidos de Lewis fuertes. Esto, asociado con el hecho de que son relativamente fáciles de manejar, hace que los líquidos iónicos se presenten como alternativas no volátiles a los catalizadores ácidos de Lewis convencionales.
Los líquidos iónicos se han empleado además como solventes en gran variedad de reacciones que incluyen catálisis orgánica [38, 39], síntesis inorgánica, biocatálisis y polimerización. Entre las crecientes aplicaciones de los líquidos iónicos como fluidos de ingeniería, se ha descrito recientemente su capacidad para funcionalizar o modificar superficialmente materiales en forma de nanopartículas. En el caso del óxido de cinc, se han utilizado líquidos iónicos como disolventes para su síntesis con una amplia variedad de tamaños y morfologías [40]. Se pueden emplear como electrólitos en baterías [41], paneles solares [12, 29, 42] y disolventes en la electrodeposición de metales [12, 42]. Se emplean además como fase estacionaria en cromatografía de gases [12, 42], como aditivo en la fabricación de plásticos, en combustibles y lubricantes [12], así como técnicas de uso analítico, aplicaciones farmacéuticas y química fina [43-45]. Además han sido utilizados como solventes efectivos en procesos de extracción tradicionales [36, 37]. La aplicación más importante de los líquidos iónicos es probablemente su utilización como disolventes [4].
III. DESTILACIÓN EXTRACTIVA
La destilación extractiva se aplica comúnmente en la industria y se ha convertido en un método de separación importante en ingeniería química. Esta técnica se ha utilizado para separar mezclas binarias azeotrópicas, en la que se adiciona un agente de separación o solvente, cuya característica principal es que no presenta la formación de azeótropos con ninguno de los componentes de la mezcla a separar.
El solvente altera de manera conveniente las volatilidades relativas de los componentes de la mezcla, por tal razón debe tener baja volatilidad para asegurar su permanencia en la fase líquida. Además, para garantizar el contacto con la mezcla a lo largo de toda la columna debe tener un punto de ebullición superior al de los componentes a separar y se debe adicionar en una de las etapas cercanas al condensador, por encima de la etapa de mezcla azeotrópica.
La ausencia de azeótropos, más el hecho de que el disolvente se puede recuperar por destilación simple y de los bajos consumos energéticos, hacen que este tipo de destilación sea un proceso más simple y mucho más utilizado que la destilación azeotrópica [5, 46]. Como agentes de separación o de arrastre (arrastrador) se pueden emplear glicoles, sales disueltas, polímeros y líquidos iónicos. Para la selección de estos disolventes se deben tener en cuenta una alta estabilidad térmica y química, alta selectividad, [47] bajo punto de fusión, baja viscosidad, baja toxicidad, entre las propiedades principales [48].
Destilación extractiva con líquidos iónicos
Un análisis de artículos relacionados con el uso de agentes de arrastre para el sistema binario etanol-agua muestra que la mayoría de los trabajos se han realizado a través de la evaluación del comportamiento del equilibrio líquido-vapor de los sistemas ternarios etanol-agua-agente de separación [6]. El líquido iónico tetrafluoroborato de 1-etil-3-metil-imidazolio [EMIM] [BF4] es un excelente agente de separación para la destilación extractiva, especialmente en la separación de la mezcla etanol-agua y el proceso requiere menos energía que el proceso convencional utilizando 1,2 etanodiol como arrastrador. La adición de [EMIM][BF4] a la mezcla etanol –agua produce un incremento de la fracción molar del vapor de etanol. Esto es debido a las fuertes interacciones selectivas entre el líquido iónico y las moléculas de agua.
Para las mezclas azeotrópicas etanol-agua y tetrahidrofurano (THF)-agua que contienen líquidos iónicos tales como [EMIM][BF4], tetrafluoroborato de 1-butil-3-metil-imidazolio [BMIM][BF4], cloruro de 1-butil-3-metil-imidazolio [BMIM][Cl] o tetrafluoroborato de 1-octil-3-metil imidazolio [C8MIM][BF4] se han reportado datos termodinámicos del equilibrio líquido-vapor y equilibrio líquido-líquido ternario [10].
La mayoría de los líquidos iónicos estudiados hasta el momento como agentes de arrastre para el sistema etanol-agua muestran un efecto de desplazamiento salino que aumenta la volatilidad relativa del etanol y puede incluso eliminar el fenómeno azeotrópico con un contenido del líquido iónico específico [6, 7]. El líquido iónico cloruro de 1-hexil-3-metil-imidazolio [C6MIM] [Cl] muestra un efecto negativo en el sistema ya que al adicionar diferentes concentraciones, entre 10 y 50 % (% másico), el azeótropo se desplaza hacia una menor fracción de etanol y difícil eliminación del azeótropo de la mezcla etanol-agua. Sin embargo, el cloruro de 1-butil- 3-metil- imidazolio [C4MIM][Cl] es capaz de eliminar el azeótropo de la mezcla etanol-agua con una concentración del solvente líquido entre 10% y 50% (% másico) [4].
Los líquidos iónicos (apróticos) metiltrioctilamonio bis [((trifluorometil) sulfonil)] imida ([N8,8,8,1+][NTf2-], tetrafluoroborato de 1-metil-3-octilmidazolio [OMIM+] [BF4-], hexafluorofosfato de 1-butil-3-metilimidazolio [BMIM+][PF6-], {bis (trifluorometil) sulfonil} imida de 1-butil-3-metilimidazolio [BMIM+][NTf2-], bromuro de trihexil (tetradecil) fosfonio [Hex3TDP+][Br-], dicianamida de trihexil (tetradecil) fosfonio [Hex3TDP+] [dca-], cloruro de tetradecil (trihexil) fosfonio [Hex3TDP+] [Cl-], trihexil (tetradecil) fosfonio bis 2,4,4-(trimethilpentil) fosfonato [P6,6,6,14+][TMPPhos-] y tributiltetradecilfosfonio metil sulfonato [P4,4,4,1+][BeSO3-]) también son capaces de eliminar el azeótropo de la mezcla etanol-agua. Algunos de estos líquidos iónicos permiten un porcentaje de extracción superior al 50% tales como el [Hex3TDP+] [Br-], [Hex3TDP+][Cl-] y el [P6,6,6,14+][TMPPhOS-] y los líquidos iónicos [Hex3TDP+][dca-], [N8,8,8,1+][NTf2-] y [P4441+][BeSO3-] permitieron un porcentaje de extracción similar o superior al 40% [48]. Pereiro [6] reporta 43 líquidos iónicos que han sido utilizados para separar la mezcla etanol-agua.
Almeida [3] estudió el efecto del líquido iónico cloruro de 1-butil-3-metilimidazolio utilizando un ebullómetro. Utilizó, además el modelo COSMO-RS (Conductor-like Screening Models-Realistic Solvents) para el estudio de los líquidos iónicos hidrogenosulfato de 1-butil- 3-metilimidazolio [C4mim][HSO4], dimetilfosfato de 1,3-metilimidazolio [C1mim][DMP], tetrafluoroborato de 1-butil-3-metilimidazolio [C4mim] [BF4] y acetato de 1-butil-3- metilimidazolio [C4mim] [Ac]; demostrando que este modelo es adecuado para la predicción del equilibrio líquido-vapor.
Todos los líquidos iónicos mencionados anteriormente son de naturaleza aprótica; en el caso de los líquidos iónicos de naturaleza prótica solo se ha empleado el acetato de 2- hidroxidietanolamina (2-HDEAA) [35] para la separación de la mezcla etanol-agua, de acuerdo a la búsqueda realizada. El dispositivo utilizado para este experimento fue un ebullómetro de Fischer. Se obtuvieron resultados favorables en la separación, o sea, un aumento de la concentración de etanol en la fase vapor. Además se empleó el modelo COSMO-SAC (Conductor-like Screening Models-Segment Activity Coefficient) para el estudio de los líquidos iónicos acetato de 2-hidroxietanolamina (2-HEAA), acetato de 2- hidroxidietanolamina (2-HDEAA), propionato de 2-hidroxietanolamina (2-HEAPr), propionato de 2-hidroxidietanolamina (2-HDEAPr). Todos los líquidos iónicos estudiados muestran un desplazamiento del azeótropo hacia concentraciones mayores de etanol.
Equilibrio líquido-vapor
Los datos del equilibrio líquido-vapor isobárico para sistemas etanol-agua que contienen los líquidos iónicos dimetilfosfato de 1-metil-3-metil-imidazolio [MMIM] [DMP], dietilfosfato de 1-etil-3-metil-imidazolio [EMIM][DEP], bromuro de 1-butil-3-metil-imidazolio [BMIM][Br], cloruro de 1-butil-3-metil-imidazolio [BMIM][Cl], hexafluorofosfato de 1-butil-3-metil-imidazolio [BMIM][PF6] se han medido a la presión atmosférica. Los resultados obtenidos indican que todos estos líquidos iónicos estudiados muestran un efecto de desplazamiento salino lo cual aumenta la volatilidad relativa del etanol y elimina el fenómeno azeotrópico a una concentración específica del líquido iónico [7].
El efecto de la naturaleza del anión de un líquido iónico ha sido estudiado para xetanol= 0,1 y xetanol= 0,95, pues existe una gran diferencia en la volatilidad relativa en el punto azeotrópico o cerca del mismo y a bajas concentraciones de etanol. El azeótropo etanol-agua se presenta aproximadamente a xetanol = 0,95. Exactamente en este intervalo actúa el propio agente de separación con una proporción del 10% en moles en la fase líquida. Además los factores de separación son mayores a bajas concentraciones de etanol (alrededor de diez para líquidos iónicos más eficaces) que en el punto crítico o cerca del mismo (alrededor de dos para la mayoría de los líquidos iónicos efectivos). En el punto azeotrópico los aniones de líquidos iónicos más prometedores son el cloruro [Cl]- y el acetato [OAc]-.
El conocimiento y la evaluación de las interacciones entre el anión y ambos componentes de la mezcla son muy importantes para la comprensión de los bajos valores de la volatilidad relativa en el punto azeotrópico. Sin embargo el análisis de los coeficientes de actividad de varios líquidos iónicos con el agua y con el etanol muestra que la interacción de los aniones con agua y etanol siguen el mismo orden: acetato [OAc]- ≈ cloruro [Cl]- > dicianamida [N(CN)2]- > tetrafluoroborato [BF4]- , anulando la mayor parte del efecto [6].
Solamente dos cationes 1-etil-3-metilimidazol [EMIM]+ y 1-etil-3-metil piridinium [EMpy]+ con el anión etil sulfato [EtSO4]- se han ensayado como agentes de arrastre para el sistema etanol-agua. A bajas concentraciones de etanol, el 1-etil-3-metilimidazol etil sulfato [EMIM][EtSO4] conduce a mayor volatilidad relativa que el 1-etil-3-metil piridinium etil sulfato [EMpy][EtSO4]; a xetanol=0,2 ambos líquidos iónicos tienen efectos similares sobre la volatilidad relativa en este sistema [6]. Para xetanol=0,2 el factor de separación de la mezcla etanol-agua aumenta considerablemente con el aumento de la concentración de muchos líquidos iónicos.
El efecto de la cadena del catión ([EMIM]+ y [BMIM]+) se investigó para los siguientes aniones acetato [OAc]- , dicianamida [N(CN)2]- y tetrafluoroborato [BF4]-; para el anión cloruro [Cl]- se realizaron estudios utilizando ([EMIM]+, [BMIM]+ y [HMIM]+. Para todos estos líquidos iónicos el aumento de la longitud de la cadena del catión condujo a una menor eficacia del agente de separación ya que la volatilidad relativa disminuye. Esto indica que los cationes pequeños poseen interacciones líquido iónico-agua más fuertes que los grandes, con lo que la volatilidad relativa se incrementa [6].
Simulación de procesos
Algunas de las técnicas de deshidratación de etanol más utilizadas, que han tenido aplicación industrial [50], se han perfeccionado con la ayuda de los simuladores de procesos químicos, los cuales han permitido el estudio de los procesos de una forma más rápida, económica y completa que en la planta real [51].
El proceso de destilación extractiva con líquidos iónicos y polímeros ha sido simulado utilizando el simulador ASPEN PLUS. El proceso para evaluar el potencial de separación del azeótropo de la mezcla etanol-agua por destilación extractiva consiste en una columna y una unidad de regeneración del arrastrador, energéticamente optimizada y comparada con el proceso convencional de destilación extractiva utilizando 1,2-etanodiol como arrastrador. Para la simulación del proceso de destilación extractiva se utilizó el siguiente líquido iónico [EMIM]+[BF4]- [11].
Para ajustar los parámetros de la ecuación de Antoine, extendida a Aspen, se tuvo en cuenta la no volatilidad del líquido iónico y del polímero. Se utilizó el modelo NRTL y debido a la simplicidad del líquido iónico [BMIM]+ [BF4]- se trató como un componente no disociado. La fase vapor se consideró ideal por lo tanto el equilibrio líquido-vapor investigado se describió por las concentraciones de líquido, los coeficientes de actividad y las presiones de vapor de las sustancias puras.
Como la base de datos de ASPEN no proporciona datos de los líquidos iónicos fue necesario determinar parámetros adicionales del modelo. Para describir la dependencia de la capacidad calorífica a presión constante (Cp) con la temperatura se utilizó una ecuación polinomial. Los parámetros se determinaron para un intervalo de temperatura de 293 K- 403 K. Se creó una base termodinámica extensa por el ajuste de los parámetros NRTL de los sistemas agente de separación-etanol y agente de separación-agua (conjuntos de datos a 343,15; 363,15; 373,15; 378,15; 383,15; y 403,15 K para el líquido iónico [EMIM]+ [BF4]-) para la simulación de la separación de la mezcla etanol-agua por destilación extractiva utilizando líquidos iónicos [11].
Ventajas de la utilización de los líquidos iónicos en la destilación extractiva
Los líquidos iónicos son una prometedora alternativa frente a los agentes de extracción convencionales. Algunas de estas ventajas son: la contaminación del destilado es mínima [3, 11, 30, 49], pues tienen un punto de ebullición elevado y son térmicamente estables [48]; se reducen las utilidades de calentamiento y enfriamiento [3, 11]; no se necesita una sección de la columna principal ni componentes internos para la separación del agente de arrastre del producto [11]; es posible una variedad de opciones factibles para la regeneración del agente de separación [11]; pueden ofrecer selectividades y capacidades altas debido a la selección de diferentes posibilidades de líquidos iónicos [3, 49]; la destilación extractiva puede ser energéticamente eficiente por una disminución de la relación de reflujo cuando se utiliza un agente de separación favorable como los líquidos iónicos y los agentes de extracción no volátiles, tales como los líquidos iónicos, pueden regenerarse mediante extracción, evaporación, secado o cristalización [49].
IV. CONCLUSIONES
Varios líquidos iónicos se han estudiado para la separación de la mezcla etanol-agua, eliminando el azeótropo. Los líquidos iónicos más utilizados para la separación de la mezcla etanol-agua son los basados en el catión imidazolio. La mayoría de los líquidos iónicos empleados para la separación de esta mezcla azeotrópica son de naturaleza aprótica. La utilización de líquidos iónicos como disolventes no volátiles es más ventajosa que la de los disolventes convencionales, tales como: la contaminación del destilado es mínima, se reducen las utilidades de enfriamiento y calentamiento, presentan alta selectividad, la regeneración del agente de separación puede ser por varios procesos, entre otras.
V. REFERENCIAS BIBLIOGRÁFICAS
1. Cornejo J.L. "Deshidratación de etanol por medio de sales iónicas". Director: Agustín Jaime Castro. Tesis en opción al título de Ingeniero Químico, Universidad Michoacana de San Nicolás de Hidalgo, 2009. [ Links ]
2. Torres A., Aplicación de la modelación matemática en el análisis de diferentes esquemas de producción integrada de alcohol, azúcar y electricidad. Revista ICIDCA, vol. XLI, núm. 2, 2007, pp. 26-30. [ Links ]
3. Almeida H.S., Seleção de solventes para destilação extrativa de etanol. Directores: Joao Manuel da Costa y Araújo Pereira Coutinho. Tesis de Maestría, Universidad de Aveiro, Brazil, 2011. [ Links ]
4. Ngema P.T., Separation processes for high purity ethanol production. Directores: Mr Suresh Ramsuroop, V. L Pillay and Deresh Ramjugernath. Tesis de Maestría, Durban University of Technology, 2010. [ Links ]
5. Quintero J.A., et al. Evaluación de la deshidratación de alcohol carburante mediante simulación de procesos. Revista Facultad de Ciencias Agropecuarias, vol. 5, núm. 2, 2007, pp. 73 - 83. [ Links ]
6. Pereiro A.B; et al. Ionic liquids in separations of azeotropic systems. Journal of Chemical Thermodynamics, vol. 46, 2012, pp. 2 - 28. [ Links ]
7. Zhao J.; et al. Isobaric vapor-liquid equilibria for ethanol-water system containing different ionic liquids at atmospheric pressure. Fluid Phase Equilibria, vol. 242, núm. 2, 2006, pp. 147-153. [ Links ]
8. Romero A., Líquidos iónicos a temperatura ambiente: un nuevo medio para las reacciones químicas. Real Academia de Ciencias Exactas, Físicas y Naturales, vol. 102, núm. 1, 2008, pp. 79-90. [ Links ]
9. Singh G.; Kumar A., Ionic liquids: physico-chemical, solvent properties and their applications in chemical processes. Indian Journal of Chemistry, vol. 47A, núm. 4, 2008, pp. 495 – 503. [ Links ]
10. Jork C.; et al. Influence of ionic liquids on the phase behavior of aqueous azeotropic systems. Journal of Chemical and Engineering Data, vol. 49, núm.4, 2004, pp. 852 - 857. [ Links ]
11. Seiler M.; et al. Separation of azeotropic mixtures using hyperbranched polymers or ionic liquids. American Institute of Chemical Engineers Journal, vol. 50, núm. 10, 2004, pp. 2439 - 2454. [ Links ]
12. Valderrama J. O; Rojas R. E. Avances en la Predicción de Propiedades Físicas, Físico- Químicas y de Transporte de Líquidos Iónicos. Información Tecnológica, vol. 20, núm. 4, 2009, pp. 149 - 160. [ Links ]
13. Jastorff B., Strategy and recent results in evaluation of risk potential of ionic liquids: a basis for eco-design of sustainable products. Conference in 1st International Congress on Ionic Liquids (COIL-1), Salzburg, Austria, June 19-22, 2005. [ Links ]
14. Aznar M. Correlation of liquid + liquid equilibrium of systems including ionic liquids, Brazilian Journal of Chemical Engineering, vol. 24, núm. 01, 2007, pp. 143 - 149. [ Links ]
15. Cortés, T, Evaluación de pretratamiento con líquidos iónicos próticos para la producción de bioetanol de segunda generación, Directora: María Elena Lienqueo, Tesis en opción al título de ingeniero civil químico, Universidad de Chile, 2013. [ Links ]
16. Freitas A.C.D; et al. Modeling vapor liquid equilibrium of ionic liquids + gas binary systems at high pressure with cubic equations of state. Brazilian Journal of Chemical Engineering, vol. 30, núm. 01, 2013, pp. 63 - 73. [ Links ]
17. Chirinos, J; et al. Líquidos iónicos en catálisis: avances en dimerización, oligomerización y/o polimerización de olefinas. Revista de la Universidad del Zulia, vol. 3, núm. 6, 2012, pp. 78-101. [ Links ]
18. Reina M.M., González E.A., Índices de refracción, densidades y propiedades derivadas de mezclas binarias de solventes hidroxílicos con líquidos iónicos (1-etil-3-metilimidazolio etilsulfato y 1-metil-3- metilimidazolio metilsulfato) de 298,15 a 318,15 K. Revista Colombiana de Química, vol. 40, núm. 2, 2011, pp. 247-268. [ Links ]
19. Greaves T.L, et al, Protic ionic liquids: Solvents with tunable phase behavior and physicochemical properties, Journal of Physical Chemistry B, vol. 110, núm. 45, 2006, pp. 22479-22487. [ Links ]
20. Tigelaar D.A, et al. Study of the incorporation of protic ionic liquids into hydrophilic and hydrophobic rigid-rod elastomeric polymers, Polymer, vol. 47, núm. 12, 2006, pp. 4269-4275. [ Links ]
21. Wu Q; et al, Transesterification of Cottonseed oil catalyzed by bronsted acidic ionic liquids, Industrial & Engineering Chemistry Research, vol. 46, núm. 24, 2007, pp. 7955-7960. [ Links ]
22. Ghandi K., A Review of Ionic Liquids, Their Limits and Applications. Green and Sustainable Chemistry, vol 4, núm. 1, 2014, pp. 44-53. [ Links ]
23. Rojas M.F. Síntesis y caracterización del líquido iónico acetato de 1-etil-3-metilimidazolio. [Tesis en opción al título de Ingeniero químico]. Bucaramanga: Universidad Industrial de Santander; 2011. [ Links ]
24. Borja F.C. Líquidos iónicos: métodos de síntesis y aplicaciones. Conciencia Tecnológica, núm. 49, 2015, pp. 52-56. [ Links ]
25. Santos R.F.D. Estudo da corrosividade de líquidos iónicos base 2-hidroxietanolamina em aco carbono AISI 1004 [Tesis en opción al título de Máster en ingeniería]. Porto alegre: Universidade Federal do Rio Grande do Sul; 2014. [ Links ]
26. Fernández F.J.H., Desarrollo de nuevos procesos biotecnológicos basados en el uso de líquidos iónicos, fluidos supercríticos y tecnología de membranas [Tesis presentada en opción al título de Doctor en Ciencias]: Universidad de Murcia 2008. [ Links ]
27. Cota I., et al. New short aliphatic chain ionic liquids: synthesis, thermodynamics and catalytic activity in aldol condensations, Journal of Chemical Physics B, vol. 111, núm. 43, 2007, pp. 12468-12477. [ Links ]
28. Iglesias M., et al. Effect of temperature on mixing thermodynamics of a new ionic liquid: 2-hydroxy ethylammonium formate (2-HEAF) + short hydroxylic solvents, Journal of Chemical Thermodynamics, vol. 40, núm. 1, 2008, pp. 119-133. [ Links ]
29. Pérez A.; Los líquidos iónicos como nuevos medios de reacción y separación en reacciones de transesterificación enzimáticas. Directores: Maria Gloria Víllora Cano y Demetrio Gómez Pérez, Tesis de Doctorado, Universidad de Murcia, 2007. [ Links ]
30. Cortés, E; et al. Síntesis del líquido iónico bmim+HSO4- mediante una sola etapa, para aplicaciones en hidrometalurgia, Información Tecnológica, vol. 21, núm. 3, 2010, pp. 67-76. [ Links ]
31. Valderrama J.O.; Robles P.A., Critical properties, normal boiling temperatures, and acentric factors of fifty ionic liquids. Industrial Engineering Chemical Research, vol. 47, núm. 4, 2008, pp. 1318–1330. [ Links ]
32. Valderrama J.O.; Sanga W.; Lazzús J., Critical properties, normal boiling temperatures, and acentric factors of another 200 ionic liquids. Industrial Engineering Chemical Research, vol. 47, núm 4, 2008, pp. 1318–1330. [ Links ]
33. Valderrama, J; Reátegui A; Rojas R., Density of ionic liquids using group contribution and artificial neural networks, Industrial Engineering Chemistry Research, vol. 48, núm. 6, 2009, pp. 3254–3259. [ Links ]
34. Jork C., et al. Tailor-made ionic liquids, Journal of Chemical Thermodynamics, vol. 37, núm. 6, 2005, pp. 537–558. [ Links ]
35. Maciel J.C.S.L. Estúdio do equilíbrio líquido-vapor do sistema agua+etanol+líquido iónico visando a separação do álcool anidro. Director: Dr. Osvaldo Chiavone, Tesis de Maestría, Univesidade Federal do Rio Grande do Norte, 2012. [ Links ]
36. Sun X.Q; et al. Application of room temperature ionic liquid-based extraction for metal ions, Chinese Journal of Analytical Chemistry, vol. 35, núm. 4, 2007, pp. 597-604. [ Links ]
37. Zhao H.; Xia S.Q; Ma P.S, Use of ionic liquids as green solvents for extractions, Journal of Chemical Technology and Biotechnology, vol. 80, núm. 10, 2005, pp. 1089-1096. [ Links ]
38. Welton T., Ionic liquids in catalysis, Coordination Chemistry Reviews, vol. 248, núm. 21-24, 2004, pp. 2459-2477. [ Links ]
39. Zhao D.B, et al. Ionic liquids: applications in catalysis, Catalysis Today, vol. 74, núm. 1-2, 2002, pp. 157-189. [ Links ]
40. Sanes J.; Carrión F.J.; Bermúdez M.D., Interacciones de nanopartículas con líquidos iónicos, X Congreso Nacional de Materiales Donostia - San Sebastián, 18-20 Junio 2008. [ Links ]
41. Puga A., Líquidos iónicos como electrolitos estables para baterías de litio y otros dispositivos de almacenamiento de energía, Revista Anales de la Real Sociedad Española de Química, vol. 108, núm. 3, 2012, pp. 298-305. [ Links ]
42. Plechkova N.V.; Seddon K.R., Applications of ionic liquids in the chemical industry, Chemical Society Review, vol. 37, núm. 1, 2008, pp. 123- 150. [ Links ]
43. Shamsi S.A; Danielson N.D., Utility of ionic liquids in analytical separations, Journal of Separation Science, vol. 30, núm. 11, 2007, pp. 1729-1750. [ Links ]
44. Cieniecka-Roslonkiewicz A.; et al. Ionic liquids for the production of insecticidal and microbicidal extracts of the fungus Cantharellus cibarius, Chemistry & Biodiversity, vol. 4, núm. 9, 2007, pp. 2218-2224. [ Links ]
45. Liu J.F; Jonsson J.A; Jiang G.B., Application of ionic liquids in analytical chemistry, Trac- Trends in Analytical Chemistry, vol. 24, núm. 1, 2005, pp. 20-27. [ Links ]
46. Uyazán A.M., Producción de alcohol carburante por destilación extractiva: Simulación del proceso con glicerol. Revista Ingeniería e Investigación, vol. 26, núm. 1, 2006, pp. 45-50. [ Links ]
47. Neagu M; Cursaru D., Bioethanol dehydration by extractive distillation with propylene glycol entrainer, Revista de Chimie, vol. 64, núm. 1, 2013, pp. 92-94. [ Links ]
48. Uyazán A.M., et al. Deshidratación del etanol. Revista Ingeniería e Investigación, vol. 24, núm. 3, 2004, pp. 49-59. [ Links ]
49. Castilla M., Estudio de la separación etanol-agua mediante líquidos iónicos. Directores: Francisco Hernández Fernández, Antonia Pérez de los Ríos, Patricio Zapata Henríquez. Tesis de Maestría. Universidad Politécnica de Cartagena, 2013. [ Links ]
50. Kumar S. et al. Anhydrous ethanol: A renewable source of energy. Renewable and Sustainable Energy Reviews, vol. 14, núm. 7, 2010, pp. 1830–1844. [ Links ]
51. Hansmeier A.R. Ionic liquids as alternative solvents for aromatics extraction. Director: A.B. de Haan. Tesis de doctorado, Technische Universiteit Eindhoven, 2010. [ Links ]












 uBio
uBio