Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salus
versión impresa ISSN 1316-7138
Salus vol.18 no.1 Valencia abr. 2014
Oculomicosis: una infección subestimada en Venezuela
Margarita Rodríguez Durán1, Fernando Gómez Daza2
1 Cátedra de Cirugía, Dpto. Clínico Integral del Sur. Universidad de Carabobo. Valencia. Venezuela.
2 Laboratorio de Micología. Ciudad Hospitalaria "Dr. Enrique Tejera" Valencia. Venezuela.
Correspondencia: Margarita Rodríguez Durán
E-mail: mird65@hotmail.com
RESUMEN
Venezuela, debido a su localización geográfica, clima y situación social, tiene el perfil para que las enfermedades oculares de origen fúngico se presenten. Aunque, en el país, la incidencia y prevalencia de las oculomicosis no ha sido suficientemente documentada, la mayoría de los oftalmólogos han tenido que atenderla en su consulta tanto pública como privada. La queratitis micótica es la forma más frecuente de presentación oftalmológica de las infecciones de origen fúngico que puede tener complicaciones irreversibles, incluso ceguera monocular, especialmente para aquellas personas que viven en comunidades agrícolas de países en vías de desarrollo. La enfermedad es fácilmente desapercibida, y los diagnósticos tardíos son comunes. Este hecho, hace que aumente las probabilidades de secuelas severas y la necesidad de intervenciones quirúrgicas. Los hongos filamentosos son los microorganismos causantes más frecuentemente asociados con traumatismos oculares o al uso de lentes de contacto. El propósito de este estudio, es presentar una revisión clínico-epidemiológica actualizada que incluye estrategias de tratamiento y diagnóstico de un problema subestimado en Venezuela e incentivar futuros estudios epidemiológicos con el objetivo de conocer los factores de riesgo asociados y medidas preventivas necesarias a ser implementadas en la región.
Palabras clave: oculomicosis, queratitis-micótica, Venezuela.
Ocular mycosis: an underestimated infection in Venezuela
ABSTRACT
Due to its climate, geographical and social situation, Venezuela has the profile for fungal ocular diseases. Even though the incidence and prevalence of this ocular morbidity is undetermined in our country, most of the ophthalmologist have encountered the disease yearly in public or private practice. Fungal keratitis is the most frequent form of presentation of ocular mycosis, it can lead to irreversible complications and even monocular blindness, especially for people living in the agricultural communities of the developing world. The disease is easily overlooked or missed, and delayed diagnosis is common. This fact increases the likelihood of severe sequelae and surgical interventions. Filamentous fungi are most frequently the causative organism for fungal keratitis associated with ocular trauma or contact lens wear. The purpose of this study is to present a clinical-epidemiological review-update, which includes diagnosis and treatment strategies of this underestimated disease in Venezuela, as well as to encourage future epidemiological studies to recognize risk factors and preventive treatment in our region.
Key words: ocular mycosis, mycotic-keratitis, Venezuela.
Recibido: noviembre 2013 Aprobado: abril 2014
INTRODUCCION
Las oculomicosis son un grupo de patologías, producidas por hongos oportunistas que parasitan el tejido ocular, principalmente la córnea, predomina en zonas de clima tropical y subtropical de países en vías de desarrollo o subdesarrollados y suelen aparecer en personas jóvenes sanas que viven o trabajan en ambiente rural y sub-urbano, especialmente agricultores (1). Dado que esta condición ha sido subestimada en nuestro medio, y en ocasiones el diagnóstico se realiza en etapas avanzadas de la enfermedad, el objetivo de esta revisión es "problematizar" la patología desde una aproximación clínico-epidemiológica-diagnóstica y terapéutica, contribuyendo en divulgar información acerca de la misma como problema de salud, ya que, cuando se presenta en la mayoría de los casos tiene secuelas irreversibles para el paciente.
En climas cálidos los géneros de hongos más involucrados en la producción de las queratitis micóticas son los filamentosos como Fusarium, Aspergillus y Penicillium; y en algunas ocasiones dematiáceos como Curvularia y Alternaria (2,3), a diferencia de los reportados en climas templados, donde también se incluyen con frecuencia hongos levaduriformes, del género Candida (4).
Los leucomas corneales que se producen por la cicatrización posterior a traumatismos o infecciones, son una causa importante de ceguera monocular en estos países (5-7).
Comúnmente, estos hongos no son capaces de penetrar el epitelio corneal intacto, por lo cual se considera que la invasión suele ser secundaria a un traumatismo con material orgánico, de preferencia vegetal o animal, éste es el responsable de implantar las esporas directamente en el estroma o en el epitelio de la córnea. Otros factores de riesgo que han sido asociados a las queratitis micóticas son: el uso de lentes de contacto, el tratamiento con esteroides tópicos, la inmunosupresión, enfermedad subyacente y alteraciones de la superficie ocular (8-12).
Los agentes etiológicos que pueden ocasionar queratitis micótica conforman una gran lista de hongos oportunistas o contaminantes, que viven de forma saprofítica en el suelo y en los vegetales, habiéndose relacionado más de setenta especies pertenecientes a cuarenta géneros fúngicos (2) (Tabla 1).
Las micosis oculares diferentes a las queratitis micóticas también pueden ser consecuencia de la extensión local de una micosis localizada en los tejidos vecinos como mucormicosis rinocerebral, criptococosis del sistema nervioso central, esporotricosis diseminada, paracoccidioidomicosis muco-cutánea o una diseminación hematógena de una micosis sistémica como la candidosis (2).
Internacionalmente, se ha publicado, que aproximadamente el 30% de las queratitis infecciosas son de etiología micótica, pero estos datos pueden variar dependiendo del país y del clima entre 6% y 61,9% (1,3,13,14).
En una publicación realizada en el Norte de China, en el 2006, donde se estudiaron 654 casos, el factor de riesgo reportado con mayor frecuencia 51,4 % sigue siendo traumatismos oculares con materia orgánica (14), a diferencia de un estudio multicéntrico de los EEUU (733 casos), publicado en el 2011, donde el factor de riesgo más importante, en 37% de los casos, está relacionado al uso de lentes de contacto, traumatismos oculares en el 25%, y alteraciones de la superficie ocular 30%. Los agentes causales aislados con mayor frecuencia en ambos estudios fueron hongos filamentosos en el 85,4% y 78% de los casos, respectivamente (14,15).
En los últimos 10 años, en Venezuela, no se encontraron trabajos publicados sobre oculomicosis. En 1996, se reportó un estudio de 23 casos, en el cual la lesión ocular más común fue la queratitis micótica, y los agentes etiológicos aislados con mayor frecuencia fueron: Fusarium sp. y Aspergillus sp; le siguieron la rinosporidiosis, las lesiones palpebrales, la retinitis granulomatosa, la endoftalmitis, y la obstrucción de la arteria central de la retina, cada una de ellas con baja frecuencia (16).
La Tabla 2, muestra los agentes causales de 44 casos (44 ojos) evaluados por la Unidad de Oftalmología de la Ciudad Hospitalaria ¨Dr. Enrique Tejera¨, ubicada en la ciudad de Valencia del Estado Carabobo, diagnosticados como queratitis microbiana de probable etiología micótica, que fueron referidos al Laboratorio de Micología del Servicio de Dermatología del mismo hospital; en un período de 10 años, con la finalidad de realizar el estudio micológico de las muestras corneales. Siendo Fusarium sp., el agente etiológico cultivado en la mayoría de los pacientes, lo que coincide con lo reportado en la literatura internacional (14,15).
Presentación clínica de las oculomicosis.
Queratitis micótica: Los pacientes pueden referir sensación de cuerpo extraño y fotofobia, la progresión de la enfermedad puede ser entre días a meses. La intensidad de los síntomas y signos puede variar, pero generalmente son de menor intensidad con respecto a lo observado en las infecciones bacterianas (13,17).
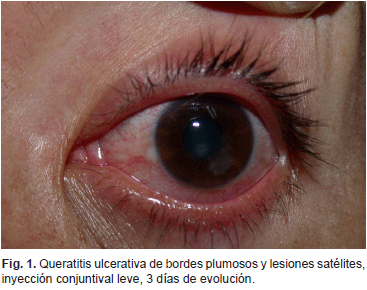
La lesión corneal suele presentarse como un infiltrado blanco-grisáceo que tiene bordes delicados y de apariencia plumosa, puede ser indolora y lentamente progresiva (Fig. 1); sin embargo, puede presentarse de forma fulminante, dependiendo del agente causal y la agresividad del mismo (13,17).
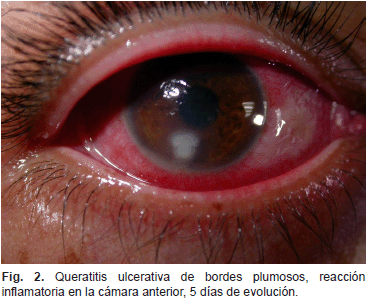
Eventualmente, pueden presentarse múltiples infiltrados satélites, ubicados en el extremo profundo del estroma, acompañada de una placa endotelial y de hipopión. La invasión de las hifas a la cámara anterior puede producirse a través de la membrana de Descemet incluso estando intacta (13) (Fig 2 y 3).

En la queratomicosis causadas por Candida sp. los bordes suelen ser regulares y el edema corneal es discreto, las lesiones satélites pueden estar ausentes, el infiltrado inflamatorio es denso y localizado por debajo de la lesión epitelial, las lesiones son indoloras en el 60% de los casos (18).
Si la queratitis micótica progresa y se desarrolla una intensa supuración, la lesión puede extenderse hacia la cámara anterior, y confundirse con una infección bacteriana. El diagnóstico clínico de la queratitis no es fácil, lamentablemente uno de los factores limitantes es la falta de sospecha por parte del oftalmólogo, o del personal de atención primaria, pero una vez planteada la misma, el protocolo a seguir es el estudio micológico para confirmar la infección (13).
Retinitis, coroiditis y endoftalmitis endógena fúngica: Al alcanzar la retina por vía endógena, los hongos producen coroiditis, retinitis o retinocoroiditis y cuando este proceso se extiende en el vítreo produce inflamación que puede llevar hasta una endoftalmitis (18). Los agentes causales de endoftalmitis fúngica son los géneros Candida, y Aspergillus, además de las especies Blastomyces dermatitides, Coccidioides immitis, Crytococcus neoformans, Histoplasma capsulatum, Pseudallescheria boydii. Aunque todos estos organismos son capaces de producir endoftalmitis, en ocasiones el proceso puede limitarse a una retinocoroiditis focal o a la formación de un granuloma (19). La primera descripción de una infección fúngica intraocular fue publicada en 1902 por Romer, quien aisló el Aspergillus de un ojo enucleado posterior a un traumatismo ocular (20).
Retinitis por Candida: El factor de riesgo más común son los pacientes inmunocomprometidos (pacientes en unidad de cuidados intensivos, catéteres en vía venosa central, antibióticos de amplio espectro, nutrición parenteral) o aquellos drogadictos que abusan a través de la vía endovenosa (21).
Los síntomas que suelen referir son: pérdida de agudeza visual progresiva, no dolorosa, acompañada de fotofobia y enrojecimiento ocular. Las lesiones fuera de la mácula o en la periferia producen pocos o ningún síntoma visual, todo lo contrario sucede cuando existen lesiones maculares o vítreas donde los síntomas son notorios. El signo de retinocoroiditis más evidente durante la oftalmoscopia, es una lesión bien delimitada de color blanco-cremoso que compromete la retina y la coroides; la lesión puede ser única o múltiple, y se presenta de forma uni o bilateral. Las lesiones pueden tomar un patrón satélite como aquellos descritos en la queratitis fúngica, son blanquecinas, pueden estar rodeadas de hemorragias intra-retinianas. Las opacidades en el vítreo son blanco-amarillentas y se pueden conectar por "cordones" dando la impresión de "collar de perlas", la vitreítis puede ser tan severa que impide la visualización del fondo ocular (21).
La necrosis retiniana focal y su cicatrización, combinada posteriormente con la formación de membranas vítreo-retinianas son una de las causas principales de pérdida de la visión. Otras características clínicas que han sido descritas son inyección conjuntival, precipitados retroqueráticos, inflamación de la cámara anterior e hipopión, epiescleritis, escleritis, formación de membranas pupilares, edema del disco óptico y perivasculitis (22, 23).
Retinitis por Aspergillus: Una de las características clínicas de la infección por Aspergillus comprende la aparición de retinitis necrotizante por oclusión vascular; esto explica en parte la progresión tan rápida de la enfermedad. Los pacientes se presentan con una pérdida de la agudeza visual severa, súbita y dolorosa; el segmento anterior puede parecer normal, sin embargo, en algunos casos, el paciente puede quejarse de dolor, fotofobia y presentar iridociclitis (19). La severidad del daño de la retina puede variar desde infiltrados subretinianos y subhialoideos, y hemorragias hasta necrosis retiniana en todo su espesor. Precisar el diagnóstico no es fácil, la presencia de los factores de riesgo puede inducir la sospecha, sin embargo, es difícil aislar el microorganismo, es por ello, que en algunas oportunidades la vitrectomia sirve de diagnóstico y tratamiento (24).
Diagnóstico micológico: El diagnóstico específico de las oculomicosis debe obtenerse lo más pronto posible, porque los tejidos oculares son muy vulnerables a la inflamación y su lesión conduce a la pérdida de agudeza visual.
La microscopia confocal in vivo, ha resultado ser una buena alternativa, no invasiva, en los casos de queratitis micótica y por Acanthamoeba, sin embargo, presenta variabilidad dependiendo de los observadores y el número de organismos invadiendo la córnea (25).
Las técnicas más empleadas y las de referencia, se basan en la visualización del hongo a través del microscopio óptico y del aislamiento del agente etiológico, debiéndose obtener material suficiente para procesamiento de las muestras corneales con la técnica de queratectomía superficial, o biopsia de capas profundas del estroma corneal.Otras técnicas son el aspirado de la cámara anterior o del humor vítreo o bien, el estudio del exudado conjuntival, palpebral y lagrimal (26).
La muestra para el estudio micológico debe tomarse antes de instaurar tratamiento antimicótico. No existe consenso sobre el instrumento o el procedimiento a seguir para la toma de la muestra. Se pueden utilizar tanto espátulas de Kimura, como hojas de bisturí número 15. Las mismas, permiten escindir la capa superficial y acceder a los microorganismos que invaden las capas más profundas, se debe desbridar tanto el fondo de la úlcera como los bordes (2, 26).
La toma de la muestra debe realizarse previa anestesia tópica en la lámpara de hendidura o bajo el microscopio, debido a la dificultad del acto técnico y lo escaso de la muestra. Esta práctica presenta varios inconvenientes como es la de mantener varios medios de cultivo en la consulta del oftalmólogo; además de entrenamiento para sembrar en la superficie del agar, al utilizar la hoja de bisturí, sobre todo para personal no experimentado en las técnicas microbiológicas. El manejo de medios enriquecidos fuera del ambiente controlado del laboratorio favorece su contaminación y deshidratación; por último, una vez realizada la siembra hay que enviar las placas con rapidez al laboratorio para su incubación en una atmósfera apropiada. Por todo lo anterior, se recomienda una cercanía del laboratorio de micología con el consultorio oftalmológico.
El material obtenido, en caso de ser abundante, se divide en dos para realizar el examen directo en un portaobjeto con KOH al 10% con o sin tinta Parker® azul, lugol, negro de clorazol, calcoflúor o blancoflúor, los dos últimos requieren de microscopio de inmunofluorescencia. La microscopia óptica demostrará abundancia de elementos fúngicos tipo hifas hialinas, hifas pigmentadas o levaduras según el agente causal que esté parasitando el tejido ocular; esto permitirá el diagnóstico preliminar rápido que puede orientar el tratamiento antifungico de forma temprana (27). También se puede realizar frotis en lámina portaobjeto y efectuar diversas coloraciones como Giemsa, Wright, Gram, PAS o Gomori-Grocott y visualizar los elementos fúngicos antes descritos (28).
El resto de la muestra obtenida se siembra directamente rompiendo el agar sólido, formando líneas o estrías (en forma de C, para caracterizar las muestras provenientes de la córnea) en los medios de cultivo como el agar sangre y/o agar Sabouraud con Cloranfenicol pero sin clicloheximida, ya que, este antibiótico va impedir el crecimiento de los hongos oportunistas causantes de ésta entidad clínica, luego se incuban los cultivos a temperatura ambiente (2, 28). La lectura se debe de realizar entre las 24 a 72 horas de la inoculación y descartar los cultivos negativos después de los 30 días a la espera de hongos de crecimiento lento.
Los agentes causales aislados con mayor frecuencia en los casos de queratitis micótica son Fusarium solani y Aspergillus fumigatus (7), pudiéndose encontrar otras especies de estos géneros causando esta patología, las cuales, son de difícil diagnóstico debido a que morfológicamente son muy parecidas y requieren de medios especiales para su clasificación. En medios de cultivo como el agar Sabouraud las colonias de Fusarium y Aspergillus presentan un crecimiento rápido que suele ocupar toda la placa o tubo de ensayo en una semana de incubación a temperatura ambiente. El color que desarrollan los hongos del género Fusarium en agar Sabouraud depende de la especie y puede ser blanquecino, crema, anaranjado, rosa, rojizo, púrpura, etc. El micelio aéreo suele ser abundante y de aspecto algodonoso. La velocidad de crecimiento, la morfología macro/microscópica y la pigmentación de la colonia son datos importantes para la identificación de las diferentes especies productoras de queratitis micótica (2, 29).
En el examen de KOH o calcofluor blanco, y en los cortes histológicos, las hifas de las especies de Aspergillus son hialinas, septadas, de ancho uniforme (cerca de 4µm) y con ramificaciones dicotomizadas. Para la identificación definitiva de los agentes etiológicos se requiere correlacionar el examen directo de la muestra en estudio, las características macroscópicas y microscópicas del cultivo, pruebas fisiológicas, bioquímicas e inclusive recurrir a técnicas moleculares.
La toma de una biopsia corneal para estudio micológico, está indicada si la infección no responde al tratamiento, o si los cultivos de los raspados han sido negativos y continúa la sospecha clínica de queratitis micótica, o la infección se localiza en las capas profundas del estroma inaccesible al raspado. El procedimiento de la biopsia lo efectúa el oftalmólogo llevando a cabo la trepanación no penetrante, se pueden utilizar los trépanos de 3 mm, utilizados en dermatología y se aconseja trasladar la muestra al laboratorio de micología lo más rápido posible en medios de transporte como Culturette (Marion Scientific®) o similares (12, 28, 29).
Se puede enviar la muestra a laboratorios especializados en biología molecular para investigar hongos utilizando la Reacción en Cadena de la Polimerasa (PCR). Existen varios motivos que justifican el empleo de la PCR en las infecciones oculares fúngicas, cuando el diagnóstico clínico, las tinciones y los cultivos no son concluyentes; la sensibilidad del cultivo en los casos de las queratitis no supera el 75-80% debido a lo escaso del inóculo; el estudio de biología molecular es más sensible y temprano que el cultivo, el procedimiento de cultivo e identificación puede requerir más de una semana, lo que demora la instauración precoz de tratamiento adecuado, y con la PCR se pueden obtener resultados inmediatos. Es importante, evitar la utilización innecesaria de antifúngicos de forma empírica dados los efectos tóxicos que muchos de ellos producen (31, 32).
La desventaja de las pruebas de biología molecular es que requieren de laboratorios y personal especializado, además implican mayor costo económico.
Actualmente, se disponen de una variedad de técnicas basadas en la PCR. La sensibilidad de las pruebas de PCR "anidadas", suele ser mayor que las de PCR convencional, y el PCR en tiempo real es el método más rápido, pero aun así pueden reportarse falsos positivos con ellas (33-37).
La mayoría de las técnicas moleculares publicadas para el diagnóstico etiológico de las queratitis micótica, se enfocan en la amplificación del gen ribosomal (ARN-r) por presentar una secuencia nucleotídica altamente conservada. Algunos autores han utilizado las secuencias de los genes que codifican para las subunidades ribosomales 18S ARN-r ó 28S ARN-r, pero la mayoría utiliza las regiones de ARN no funcional ITS1 e ITS2 que flanquean el gen 5,8 ARNr, por ser secuencias que presentan una gran variación entre las especies relacionadas (33,35).
Se ha propuesto que la técnica de PCR convencional es mejor, ya que, permite "secuenciar el ADN amplificado", mientras que las técnicas como PCR "anidado" y PCR en tiempo real se basan en cebadores específicos (35).
Tratamiento.
Queratitis micótica: El tratamiento para las infecciones oculares micóticas puede representar un verdadero desafío para el oftalmólogo. El número de medicamentos antimicóticos es escaso, considerando la cantidad de hongos con capacidad para afectar el ojo.
La natamicina es el primer antifúngico creado específicamente para uso tópico oftalmológico. Su mecanismo de acción implica la unión al ergosterol, que induce el daño de las membranas celulares (38). Ha sido recomendada como la droga de elección en el tratamiento de infecciones para las diferentes especies de Fusarium (39). La presentación comercial es la suspensión al 5% (Alcon®, Ft. Worth,Tx) pudiéndose mantener a temperatura ambiente o refrigerada, pero no debe ser congelada, expuesta al calor, ni a la luz. Se puede comenzar con una gota cada 30 minutos, para continuar con una gota cada hora dependiendo de la evolución del caso. La concentración de la natamicina aumenta significativamente luego de realizar la desbridación del epitelio corneal. Actualmente, en nuestro país es un problema el alto costo del medicamento y la baja disponibilidad del mismo (Fig. 4).
La anfotericina B tópica es generalmente efectiva en la mayoría de los casos de queratomicosis por Candida albicans y Aspergillus sp, pero su actividad en contra de las diferentes especies de Fusarium sp es limitada.
Se enlaza con firmeza al ergosterol de la membrana celular, alterando la fluidez de la membrana, el intercambio iónico, y de moléculas pequeñas, provocando así la muerte celular. En el tratamiento de la queratitis micótica la concentración de la solución tópica es de 0,15%. El uso intravenoso de anfotericina B, puede producir fiebre, escalofríos, disnea e hipotensión, además de nefrotoxicidad (40).
El itraconazol es un antimicótico de amplio espectro que tiene acción contra diferentes especies de Candida como: C. albicans, C. glabrata, C. lusitaniae, además de Paracoccidioides brasiliensis, y H. capsulatum, pero no tiene actividad en contra de Fusarium sp (41), la dosis indicada es de 100 a 200 mg/día, vía oral. El fluconazol se recomienda administrarlo vía oral a dosis de 150 a 300 mg/día, tiene una vida media de aproximadamente 30 horas y una biodisponibilidad del 90% después de la administración por vía oral o endovenosa. La vía oral tiene buena penetración en el ojo alcanzando niveles de aproximadamente 65% en relación a su concentración plasmática, aparentemente tiene buena tolerancia y puede utilizarse en aquellos pacientes que no toleran la anfotericina B. También se recomienda el voriconazol, el cual es un compuesto triazólico derivado del fluconazol que presenta un espectro de actividad más amplio, con actividad marcada in vitro frente a Candida sp, Aspergilus sp, Fusarium sp, se ha aplicado por vía tópica (1%), vía intracameral (10 μg/0,1ml), vía oral (200-400 mg/ día) y vía intravenosa (4 mg/kg/12 horas) siendo una de las limitaciones para su uso el alto costo (42). Asímismo, se ha propuesto el tratamiento en el caso de queratitis recalcitrante el uso de voriconazol por vía intraestromal (50 μg/0,1ml) en conjunto con natamicina al 5% por vía tópica, sin embargo no se encontró diferencias significativas en comparación con el grupo control de voriconazol tópico y natamicina al 5% (43).
En estudio multicentrico (en fase 3) no se pudo demostrar la superioridad del voriconazol tópico con respecto a la natamicina tópica, por el contrario, se sugiere que el voriconazol no debería ser usado como monoterapia en los casos de queratitis filamentosa (44-46).
Existen importantes diferencias en el perfil de susceptibilidad antifúngica y evolución clínica de las diferentes especies de Fusarium y se ha sugerido que la identificación específica con técnicas de PCR rápidas puede representar información importante con respecto al pronóstico y tratamiento adecuado en la queratitis por Fusarium (47).
La solución de ketoconazol al 1%, se puede aplicar por vía subconjuntival, además de la tópica y por vía oral en dosis de 200 a 400 mg/día, alcanza altas concentraciones corneales y al desbridar el epitelio estos niveles aumentan considerablemente (48). Se ha sugerido, que el ketoconazol puede ser empleado en situaciones de alto riesgo como profilaxis para las queratitis micóticas. Sin embargo, su espectro de acción ha sido reportado como variable según los diferentes modelos de experimentación, pero en general se considera que tiene buena actividad en contra de C. albicans (37).
Cuando el tratamiento primario fracasa, hecho que ha sido reportado en el 31% de los casos (49), algunos autores consideran, que la queratoplastia penetrante es la opción quirúrgica para controlar la infección fúngica, sin embargo muchas complicaciones han sido reportadas como rechazos, errores refractivos y cataratas secundarias (50, 51). El fracaso de la queratoplastia penetrante está condicionado a la presencia de hipopión, y la extensión de la infección hacia la esclera (52).
Retinitis por Candida. La estrategia de tratamiento incluye medicamentos antifúngicos sistémicos e intravítreos, y en algunos casos vitrectomia vía parsplana (53). Se recomienda la anfotericina B por vía endovenosa a una dosis de 0,3 a 1 mg/kg/día, administrado en 500 ml de dextrosa al 5% en un período de 4 a 6 horas. Debe iniciarse con una dosis de prueba de 1 mg diluido en 20 ml de dextrosa al 5%, en un período de 30 minutos; sino se presentan efectos secundarios significativos como hipotensión y arritmias, el tratamiento se continúa con 0,3-0,7 mg/kg/día hasta llegar a un mínimo de dosis acumulada de 200 mg para los casos de retinocoroiditis, en los cuales el vítreo no está afectado (21, 24). Si hay una intensa vitreítis se puede sumar al tratamiento fluocitosina y el tratamiento con anfotericina B debe aumentarse hasta una dosis de 1 y 1,5 g, prolongándose hasta que las lesiones retinianas desaparezcan. La alta probabilidad de toxicidad sistémica de la anfotericina B ha hecho de la vía intravítrea una opción viable. Para evitar la toxicidad retiniana, ésta debe ser administrada lentamente y en el centro del vítreo, tan lejos de la retina como sea posible, la dosis es de 5 a 10 μg (21,24).
El uso aislado de la fluocitosina no se recomienda, pues se ha descrito que el 47% de las especies de Candida pueden ser resistente a este medicamento, pero a diferencia de la anfotericina B tiene una excelente biodisponibilidad, excelente absorción gastrointestinal y buena penetración al vítreo. Sin embargo, debe combinarse con el uso de anfotericina B, ya que, juntos tienen buena actividad sinérgica (21).
Los derivados de los azoles como el fluconazol, tienen buena biodisponibilidad, la dosis del fluconazol para el tratamiento de retinocoroiditis sin endoftalmitis es de 200 a 400 mg/ día dividido en dos dosis, hasta 1.600 mg/día han sido utilizados en pacientes con problemas sistémicos severos (54). Especies de Candida diferentes a C. albicans como C. krusei y C. gIabrata, así como Aspergillus sp y Fusarium sp. han demostrado cierta resistencia al fluconazol.
El tratamiento contra la retinitis por Aspergillus es controversial y la anfotericina B sigue siendo el tratamiento de elección tanto por vía sistémica como intravítrea.
Debido a la baja permeabilidad de los medicamentos sistémicos, a través, del epitelio pigmentado de la retina, los antimicóticos se utilizan por vía intravítrea, cuando el tratamiento sistémico no es eficaz, o después de procedimientos como la toma de muestra del vítreo, o la vitrectomia. Las dosis recomendadas son anfotericina B (5μg/0,1mL), otros pueden ser voriconazol (100μg/0,1 mL) fluconazol (10gr/0,1mL) y miconazol (25μg/0,1mL); asociadas estas, a medicamentos vía oral que pueden extenderse hasta 6 meses, en los casos de endoftalmitis endógena. El uso de esteroides intravítreos está contraindicado en los casos de infección micótica (24).
Comentarios finales. Las oculomicosis son un problema en Venezuela, específicamente la queratitis micótica, ya que nuestro país tropical, y en vías de desarrollo, tiene las características de riesgo que han sido publicadas a nivel internacional (1,3,6). Aunque aún no poseemos datos suficientes que muestren la magnitud real del problema, podemos asegurar que todos los especialistas han tenido que enfrentar la patología en el curso de su práctica médica en instituciones públicas o privadas.
Por su complejidad y graves secuelas para la visión del paciente, plantea un reto diagnóstico y de tratamiento para el oftalmólogo general o el sub-especialista en córnea, sin embargo, frecuentemente quien realiza el primer contacto con el paciente es el médico general, a nivel rural y sub-urbano, lo cual no garantiza su manejo adecuado; y por ello, debería ser este personal, el primero en ser informado integralmente acerca de la entidad y sus factores de riesgo; con el objetivo de referir lo más pronto posible al especialista y, paciente sospechoso o en riesgo de padecer la patología, a pesar de lo benigno que pudiesen parecer los síntomas y signos iniciales.
El uso de medicamentos sin la evaluación por parte del oftalmólogo, retrasa el diagnóstico y tratamiento de esta emergencia, empeorando el pronóstico y la evolución del caso, sobre todo cuando se asocian antibióticos y esteroides para el tratamiento inicial de lo que en realidad es una infección micótica. De ahí, que es necesario llamar la atención sobre esta patología subestimada con la finalidad de, adicionalmente, incentivar futuros trabajos de investigación que permitan caracterizar desde el punto de vista clínico-epidemiológico el problema, conocer las áreas geográficas de mayor riesgo así como las épocas del año donde aumenta su incidencia; un ejemplo de ello, es la época de la zafra de la caña de azúcar en la región central de Venezuela.
Una vez más, el abordaje de este problema involucra el trabajo interdisciplinario del personal de salud y las instituciones formadoras de este personal a nivel profesional, con el objetivo general de realizar el diagnóstico precoz, así como planificar y desarrollar programas de educación y prevención de las oculomicosis, principalmente en las zonas de mayor riesgo.
Agradecimientos. A nuestros pacientes, objetivo principal de la práctica médica. Por su apoyo y guía al Dr. Cruz Manuel Aguilar, Dra. María Elvira Blank, Dra. Carolina Cannova. Lic. Raquel Ramos y al TSU. Alejandro Aguilar por el apoyo en la presentación fotográfica.
REFERENCIAS
1. Whitcher JP, Srinivasan M. Corneal ulceration in the developing world--a silent epidemic. Br J Ophthalmol 1997; 81:622-623. [ Links ]
2. Arenas R. Oculomicosis. En: Micología Médica Ilustrada. 3ª Edición. 2008 McGraw-Hill. México DF. p. 118-122. [ Links ]
3. Thomas PA. Mycotic keratitis--an underestimated mycosis. J Med Vet Mycol 1994; 32: 235-256. [ Links ]
4. Sedo S, Iribarne Y, Fossas M, Vendrell C, Ortiz F. Queratitis Fúngica. Annals dOftalmologia 2003; 11: 168-175. [ Links ]
5. Rapoza PA, West SK, Katala SJ, Taylor HR. Prevalence and causes of vision loss in Central Tanzania. Int Ophthalmol 1991; 15:123-129. [ Links ]
6. Khan MU, Hague E, Khan MR. Prevalence and causes of blindness in rural Bangladesh. Indian J. Med. Res 1985; 82:257-262. [ Links ]
7. Gonzáles CA, Srinivasan M, Whitcher JP, Smolin G. Incidence of Corneal Ulceration in Madurai district, south India. Ophthalmic Epidemiol 1996; 3:159-166. [ Links ]
8. Chang Dc, Grant GB, O´Donnell K, Wannemuehler KA, Noble-Wang J, Rao CY, et al. Multistate outbreak of Fusarium keratitis associated with the use of a contact lens solution. JAMA 2006; 296: 953-963. [ Links ]
9. Xie L, Dong X, Shi W. Treatment of fungal keratitis by penetrating keratoplasty. Br J Ophtalmol 2001; 85:1070-1074. [ Links ]
10. Chowdhary A, Singh K. Spectrum of fungal keratitis in north India. Cornea 2005; 24:8-15. [ Links ]
11. Leck AK, Thomas PA, Hagan M, Kaliamurthy J, Ackuaku E, John M et al. Aetiology of suppurative corneal ulcers in Ghana and South India, and epidemiology of fungal keratitis. Br. J. Ophthalmol 2002; 86:1211-1215. [ Links ]
12. Klotz SA, Penn C, Negvesky G, Butrus SI. Fungal and parasitic infections of the eye. Clin Microbiol Rev 2000; 13: 662-685. [ Links ]
13. Foster SC. Fungal Keratitis. In: Principles and Practice of Ophthalmology, Clinical Practice. Albert DM, Jakobiec FA. W.B Saunders Company 1994; 1: 171-179. [ Links ]
14. Xie L, Zhong W, Shi W, Sun S. Spectrum of Fungal Keratitis in North China. Ophthalmology 2006; 113:1943-1948. [ Links ]
15. Keay LS, Gower EW, Iovieno A, Oeschler RA, Alfonso EC, Matoba A, et al. Clinical and microbiological characteristics of fungal keratitis in the United States, 2001-2007: Multicenter study. Ophthalmology 2011; 118:920-926. [ Links ]
16. Bastardo de Albornoz MC. Micosis oculares. En: Bastardo- Albornoz MC, Editora. Tema de Micología Médica. Caracas: Litografía y tipografía ELALCA s.r.l.; 1996. p 263-274. [ Links ]
17. Thomas PA, Leck AK, Myatt M. Characteristic clinical features as an aid to the diagnosis of suppurative keratitis caused by filamentous fungi. Br J Opththalmol 2005; 89:1554-1558. [ Links ]
18. Del Palacio Hernanz A, Cuétara García MS, Sánchez Rivas JL, et al. Ulcera corneal por Candida tropicalis en un paciente VIH seropositivo. Rev Iberoam Micol 1992;9:85-87. [ Links ]
19. Pettit TH, Edwards JE Jr, Purdy EP, et al. Endogenous fungal endophthalmitis. In: Pepose JS, Holland GN, Wihelmus KR, editors. Ocular Infections and Immunity. St Louis: Mosby CV; 1996. p.1292. [ Links ]
20. Romer P. Eine intraoculare schimmelpilz infection. Kin Monatsbl augenheilkd 1902; 40: 331-333. [ Links ]
21. Hamza HS, Loewenstein A, Haller JA. Fungal retinitis and endophthalmitis. In: O´Brien T, guest editor. Ocular Infections: update on therapy. Ophthalmology Clinics of North America. Philadelphia: W.B Saunders Company; 1999 .p.89-108. [ Links ]
22. Edwards JE Jr, Foos RY, Montgomerie JZ, et al. Ocular manifestations of Candida septicemia. Review of seventy six cases of hematogenous Candida endophthalmitis. Medicine (Baltimore) 1974; 53: 47-75. [ Links ]
23. Edwards JE Jr. Candida Species. In: Mandell G.I, Douglas RG Jr, Bennett JE editors. Principles and Practice of Infections Diseases, 3rd edition. New York: Churchill Livingstone; 1990. p. 1943- 1985. [ Links ]
24. Arevalo JF, Aliza J, Chee SP, Zeballos DG. Endogenous endophthalmitis in the developing world. Internat Ophthalmol Clinics 2010; 50: 173-187. [ Links ]
25. Vaddavalli PK, Garg P, Sharma S, Sanwan VS, Rao GN. Role of confocal microscopy in the diagnosis of fungal and Acanthamoeba keratitis. Ophthalmology 2011; 118: 29-35. [ Links ]
26. Dahlgren M, Lingappan A, Wilhelmus K. The clinical diagnosis of microbial keratitis. Am J Ophthalmol 2007;143: 940-944. [ Links ]
27. Punia RS, Kundu R, Chander J, Arya SK, Handa U, Mohan H. Spectrum of fungal keratitis: clinicopathologic study of 44 cases. Int J Ophthalmol 2014; 7(1):114-117. [ Links ]
28. Sharma S, Kunimoto DY, Gopinathan U, Athmanathan S, Garg P, Rao GN. Evaluation of corneal scraping smear examination methods in the diagnosis of bacterial and fungal keratitis. Cornea 2002; 21: 643-647. [ Links ]
29. Kaye SB, Rao PG, Smith G, Scott JA, Hoyles S, Morton CE, Willoughby C, Batterbury M, Harvey G. Simplifying collection of corneal specimens in cases of suspected bacterial keratitis. J Clin Microbiol 2003; 41: 3192-3197. [ Links ]
30. McLeod S, Kumar A, Cevallos V, Srinivasan M, Whitcher JP. Reliability of transport medium in the laboratory evaluation of corneal ulcers. Am J Ophthalmol 2005; 14: 1027-1031. [ Links ]
31. Keay L, Edwards K, Naduvilath T, et al. Microbial keratitis: predisposing factors and morbidity. Ophthalmology 2006; 113: 109-116. [ Links ]
32. Gaudio PA, Gopinathan U, Sangwan V, Hughes TE. Polymerase chain reaction based detection of fungi in infected corneas. Br J Ophthalmol 2002; 86: 755-760. [ Links ]
33. Badiee P, Nejabat M, Alborzi A, et al. Comparative study of gram stain, potassium hydroxide smear, culture and nested PCR in the diagnosis of fungal keratitis. Ophthalmic Res 2010; 44: 251-256. [ Links ]
34. Ferrer C, Colom F, Frasés S, Mulet E, Abad JL, Alió JL. Detection and identification of fungal pathogens by PCR and by ITS2 and 5.8S ribosomal RNA typing in ocular infections. J Clin Microbiol. 2001; 39: 2873-2879. [ Links ]
35. Ferrer C, Alió JL. Evaluation of molecular diagnosis in fungal keratitis. Ten years of experience. J Ophthalmic Inflam Infect 2011;1:15-22. [ Links ]
36. Itahashi M, Higaki S, Fukuda M, Shimomura Y. Detection and quantification of pathogenic bacteria and fungi using real-time polymerase chain reaction by cycling probe in patients with corneal ulcer. Arch Ophthalmol 2010; 128: 535-540. [ Links ]
37. Palomares J. C., Cuenca Estrella M., Ferrer C., Colom Mª F. Diagnóstico micológico mediante técnicas de biología molecular en Revista Iberoamericana de Micología - 2007 ISBN: 978-84-611-8776-8). [ Links ]
38. O´Brien T. Therapy of ocular fungal infections. In: O´Brien T, guest editor. Ocular Infections: update on therapy. Ophthalmology Clinics of North America. Philadelphia: W.B Saunders Company; 1999 .p. 33-50. [ Links ]
39. Jones DB, Foster R, Rebell G. Fusarium solani keratitis treated with natamycin (Pimaricin). Arch Ophthalmol 1972; 88:147-154. [ Links ]
40. Johns KJ, O´Day D. Pharmacologic management of keratomycoses. Surv Ophthalmol 1988; 11: 178-188. [ Links ]
41. Bloom PA, Laid DA, Easty DL, et al. Treatment failure in a case of fungal keratitis caused by Pseudalesheria boydii. Br J Ophthalmol 1992; 76: 367-368. [ Links ]
42. Ferrer R, Colom MF, Peréz-Santonja JJ. Queratitis fúngica. En: Peréz-Santonja JJ, Hervás-Hernandis JM, Queratitis infecciosas. 2006 Ergon. Madrid. p 109-133. [ Links ]
43. Sharma N, Chacko J, Velpandian T, et al. Comparative evaluation of topical versus intrastromal voriconazol as an adjunct to natamycin in recalcitrant fungal keratitis. Ophthalmology 2013; 120:677-681. [ Links ]
44. Prajna NV, Mascarenhas J, Krishnan T, et al. Comparison of natamycin and voriconazole for the treatment of fungal keratitis. Arch Ophthalmol 2010; 128: 672-678. [ Links ]
45. Boucher HW, Groll AH, Chiou CC, Walsh TJ. Newer systemic antifungal agents: pharmacokinetics, safety and efficacy. Drugs 2004; 64(18): 1997-2020. [ Links ]
46. Prajna NV, Krishnan T, Mascarenhas J, et al. The mycotic ulcer treatment trial a randomized trial comparing natamycin vs voriconazole. Arch Opthalmol 2013; 131:422-429. [ Links ]
47. Oechsler RA, Feilmeier MR, Miller D, Shi W, Hofling-Lima AL, Alfonso EC. Fusarium keratitis: genotyping, in vivo susceptibility and clinical outcomes. Cornea 2013; 32(5):667- 673. [ Links ]
48. Hemady Rk, Chu W, Foster CS. Intraocular penetration of ketaconazole in rabbits. Cornea 1992; 11: 329-333. [ Links ]
49. Lalitha P, Prajna NV, Kabra A, Mahadevan K, Srinivasan M. Risk Factors for treatment outcome in fungal keratitis. Ophthalmology 2006; 113(4):526-530. [ Links ]
50. Sanders N. Penetrating Keratoplasty in treatment of fungus keratitis. AM. J. Opthalmology 1970; 70:24-30. [ Links ]
51. Foster RK, Rebell G. The diagnosis and managment of keratomycoses II. Medical and surgical management. Arch. Ophthalmol 1975; 93: 1134-1136. [ Links ]
52. Lixin X, Jianzhang H, Weiyun S. Treatment failure after lamelar keratoplasty for fungal keratitis. Ophthalmology 2008; 115:33- 36. [ Links ]
53. Barrie T. The place of elective vitrectomy in the management of patients with Candida endophthalmitis. Graefes Arch. Clin. Exp. Ophthalmol, 1987; 225: 107-113. [ Links ]
54. Aguilar WA, Blumentkranz MS, Egbert PR, et al. Candida endophthalmitis after intravenous drug abuse. Arch. Ophthalmol 1979; 97-96. [ Links ]