Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salus
versión impresa ISSN 1316-7138
Salus vol.20 no.1 Valencia abr. 2016
Composición química y toxicidad aguda oral del aceite esencial de Lippia alba en ratones
Chemical composition and oral acute toxicity of Lippia alba essential oil in mice
Yalitza Aular1,2,3, Merlin Villamizar1,2,4, Yesenia Pérez1, Víctor Pérez5
1 Maestría en Toxicología Analítica. Facultad de Ciencias de la Salud. Universidad de Carabobo. Campus Bárbula. Valencia. Venezuela.
2 Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo. Campus Bárbula. Valencia. Venezuela.
3 Departamento de Farmacología. Escuela de Ciencias Biomédicas y Tecnológicas. Facultad de Ciencias de la Salud. Universidad de Carabobo. Campus Bárbula. Valencia. Venezuela.
4 Departamento de Ciencias Morfológicas y Forenses. Escuela de Ciencias Biomédicas y Tecnológicas. Facultad de Ciencias de la Salud. Universidad de Carabobo. Campus Bárbula. Valencia. Venezuela.
5 Laboratorio instrumental de la Facultad de Ciencias y Tecnología.
Autor de Correspondencia: Yalitza Aular.
E-mail: yaularz@gmail.com
RESUMEN
La Lippia alba (L. alba), de la familia Verbenaceae, conocida popularmente como Cidrón o poleo; dependiendo de su ubicación geográfica, el suelo donde se desarrolla y tejido o órgano, presenta aceites esenciales en su composición, que son empleados en medicina natural y tradicional para el tratamiento de trastornos digestivos, respiratorios, enfermedades de la piel y sedante, a través de infusión o decocción de hojas, partes aéreas o flores. Por lo que posee un elevado potencial terapéutico, siendo importante detectar posibles efectos tóxicos post administración. Por lo cual, el objetivo del estudio fue evaluar la composición química y la toxicidad aguda oral del aceite esencial de L. alba a dosis única y dosis repetida. Se extrajo el aceite esencial de las hojas y partes aéreas, por destilación con arrastre de vapor utilizando una Trampa de Clevenger y se analizó por cromatografía de gases acoplada a detector de masas. Se evaluó la toxicidad, utilizando ratones NRMI de ambos sexos y las Guías OECD 423 y 407. Se obtuvieron 34 constituyentes del aceite esencial, los mayoritarios fueron: geranial (45,30%), neral (30,23%), beta-farnesol (7,78%), cariofileno (2,85%), azuleno (2,52%) y beta- irceno (2,38%). Se evidenciaron (Guía OECD 423) signos y síntomas de daño neurológico y motor moderado (900 mg/Kg del aceite esencial) con 100% de supervivencia y severo (1500 mg/ Kg) letales para los machos y, con 2000 mg/Kg todos los animales fallecieron. Se concluye que en el aceite esencial predominaron los constituyentes geranial y neral; clasificados como quimiotipo citral y que de acuerdo a la Clasificación de Toxicidad del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (ONU-SGA, 2011), corresponde a la categoría 4 (DL50 se ubica entre 300-2000 mg/Kg).
Palabras clave: Lippia alba, composición química, toxicidad aguda oral, aceite esencial
ABSTRACT
The Lippia alba (alba L.) of the Verbenaceae family, popularly known as Cidrón or pennyroyal; depending on your geographic location, soil which develops and tissue or organ, presents essential oils in its composition, which are used in natural and traditional medicine for the treatment of digestive, respiratory, skin diseases and sedative disorders through infusion or decoction of leaves, aerial parts or flowers. So it has a high therapeutic potential, being important to detect possible toxic effects post administration. Therefore, the aim of the study was to evaluate the chemical composition and oral acute toxicity of essential oil of L. alba single dose and repeat dose. the essential oil of the leaves and aerial parts extracted by steam stripping using a Clevenger trap and analyzed by gas chromatography coupled to mass detector. Toxicity was evaluated using NRMI mice of both sexes and OECD Guidelines 423 and 407. 34 constituents of the essential oil, the majority were were obtained: geranialdehyde (45.30%), neral (30.23%), beta-farnesol (7.78%), caryophyllene (2.85%), azulene (2.52%) and myrcene beta (2.38%). (OECD Guidelines 423) were evident signs and symptoms of neurological damage and moderate engine (900 mg / kg of essential oil) with 100% survival and severe (1500 mg / kg) lethal for males and with 2000 mg / kg all the animals died. It is concluded that in the essential oil predominated geranialdehyde and neral constituents; classified as citral chemotypes and according to the Classification of toxicity Globally Harmonized System of Classification and Labelling of Chemicals (UN GHS, 2011), corresponds to category 4 (LD50 is between 300-2000 mg / kg).
Key words: Lippia alba, chemical composition, oral acute toxicity, essential oil.
Recibido: 19/01/2016 Aprobado: 30/04/2016
INTRODUCCIÓN
La Lippia alba (L. alba) (Mill) N.E. Brown, conocida, popularmente, como erva-cidreira (Brasil), prontoalivio (Colombia), Cidrón, hierba luisa, poleo (Venezuela) (1), es un arbusto originario del bosque seco tropical americano, que pertenece a la familia de las Verbenáceas. Se encuentra a 1.800 m de altura desde Texas hasta Argentina y en el Caribe.
La composición química de la planta incluye flavonoides, alcaloides y aceites esenciales. Los aceites esenciales son mezclas complejas de compuestos volátiles con diversa estructura química. Se componen de metabolitos secundarios que las plantas producen para su supervivencia, pueden aislarse de cualquier parte de las plantas aromáticas y son ampliamente utilizados en cosméticos, industria de alimentos y productos farmacéuticos (2).
Los aceites esenciales de la L. alba pueden presentar cambios en la composición química dependiendo del estado de desarrollo de la planta, la parte empleada para la extracción, la ubicación geográfica, las características fisicoquímicas del suelo y el clima (humedad, concentración de oxígeno e intensidad lumínica) donde se desarrolla la planta, entre otras. Esta variabilidad en la composición química se ve reflejada en diversos estudios sobre esta especie cultivada en diferentes regiones del mundo (3).
Así, para la esencia de L. alba se han descrito muchos quimiotipos, los cuales, son diferenciados por la presencia de componentes mayoritarios (4). En Brasil se han descrito tres quimiotipos, clasificados por la esencia extraída de las hojas, siendo los componentes mayoritarios citral (geranial y neral), carvona y linalol. En Uruguay, dos quimiotipos han sido reportados: el primero contiene alcanfor y 1,8-cineol y el segundo posee linalol como constituyente principal. En América Central, los marcadores reportados son limoneno y piperitona, para Guatemala; la carvona en Cuba, y en Costa Rica se han definido el quimiotipo limoneno y el de la carvona (1).
En Colombia, se han identificado tres quimiotipos diferentes de L. alba: carvona, citral/geranial y carvona/citral. Otros constituyentes mayoritarios presentes en este aceite esencial incluyen limoneno, bicyclosesquifelandreno, piperitenona, piperitona and b-bourboneno (5). En Venezuela, un estudio realizado en la región central mostró la presencia de geranial, neral, geraniol y germacreno (6).
La Planta de L. alba se ha utilizado comúnmente en medicina natural y tradicional en Latinoamérica para el tratamiento de trastornos digestivos (vómitos, flatulencia diarrea, dolor abdominal), infecciones respiratorias (bronquitis, dolor de garganta, gripe, tos, resfriado), anemia y enfermedades de la piel (7), antiespasmódico, diaforético, diurético, expectorante, laxante y sedante (8) preparada como infusión o decocción utilizando las hojas, partes aéreas y flores, administrada oralmente (9).
Además, estudios con diferentes tipos de compuestos no volátiles aislados a partir de esta planta han demostrado propiedades antioxidante, neurosedante (10,11), anti convulsivantes y antimicrobianos, mientras que su aceite esencial ha demostrado ser antiespasmódico (12), anti fúngico (13,14), antioxidante (15), y anestésico local (16). En consecuencia la L. alba es considerada una planta con elevado potencial terapéutico y constituye una alternativa farmacológica de marcado interés en el tratamiento de muchas enfermedades. De ahí la importancia de realizar estudios preclínicos con el propósito de detectar posibles efectos tóxicos post administración (17).
No obstante, la información sobre su toxicidad es escasa. La literatura disponible ha reportado un perfil toxicológico a dosis altas con severos daños neurológicos, motores y hepáticos (9) y en función de su composición química; que incluyen la peroxidación lipídica y daño hepático (17,18). Sobre la base de estos planteamientos el presente estudio tiene como objetivo evaluar la composición química y la toxicidad aguda oral del aceite esencial de L. alba a dosis única y dosis repetida en ratones.
MATERIALES Y MÉTODOS
Colección del material vegetal. La recolección de las hojas y partes aéreas de la planta de L. alba, se realizó en horas tempranas de la mañana en el patio de la casa de la Familia Yánez, dedicados al cultivo de plantas medicinales, en Bárbula - Municipio Naguanagua – Estado Carabobo - Venezuela. Para la identificación botánica se obtuvo una muestra del material vegetal, la cual fue depositada en el Herbario Dr. Víctor Manuel Ovalles de la Facultad de Farmacia de la Universidad Central de Venezuela, Caracas, Distrito Capital, con el número de Voucher: MYF26621.
Obtención del aceite esencial de Lippia alba. La obtención del aceite esencial se realizó en el Departamento de Farmacología, Escuela de Ciencias Biomédicas y Tecnológicas, de la Facultad de Ciencias de la Salud de la Universidad de Carabobo (UC); para ello, se trituraron 500 gramos de las hojas, y flores frescas de la planta con agua desmineralizada en una licuadora de cuatro (4) litros 110 voltios Marca Met Visa, con la finalidad de facilitar el proceso de extracción. El licuado fue vertido a un balón aforado de 2000 ml, se agregó agua desmineralizada hasta completar 600ml y se sometió a destilación por arrastre de vapor durante 45 minutos. El balón que contenía el material vegetal se conectó a una Trampa de Clevenger, con la finalidad de atrapar el aceite en la parte superior de ésta y separarlo fácilmente de la fase inferior acuosa. Una vez extraído el aceite, se procedió a secarlo sobre sulfato de sodio anhídrido, se midió el volumen obtenido y se realizó el cálculo de la densidad del mismo, dando un valor de 0,83 g/ml. Para protegerlo de la luz se colocó en un vial de vidrio color ámbar y se conservó en nevera a temperatura menor de 0°C.
Caracterización del aceite esencial de L. alba. Una vez extraído el aceite esencial de L. alba, se realizó el análisis por CG/MS utilizando un cromatógrafo de gases (GC 6890N), acoplado a detector de masas (MSD5973), ambos marca AgilentTecnologic, ubicados en el Laboratorio Instrumental del Departamento de Química de la Facultad Experimental de Ciencias y Tecnología (FACYT) de la Universidad de Carabobo. Los constituyentes se separaron en una columna capilar HP-5MS (30m x 0.25mm x 0.25μm) de fase estacionaria de 5% metilpolisiloxano. Las condiciones de operación fueron: Gas portador de Helio, flujo 1,8 mL/min, Split: 50:1, temperatura del horno: Inicial: 100ºC x 0 min, temperatura del injector: 250ºC, temperatura del detector MS: 230ºC, temperatura de la rampa: 20ºC/min hasta 230 ºC x 10 min, tiempo total corrida 16,5 min.
Identificación. Los constituyentes del aceite esencial se identificaron mediante sus índices de retención, por comparación de sus espectros de masa con los publicados en la literatura (19) y por comparación visual usando la base de datos del equipo.
Ensayo de toxicidad oral aguda del aceite esencial de Lippia alba en ratones. Para evaluar la toxicidad oral aguda del aceite esencial en ratones, se utilizaron ratones NRMI de ambos sexos provenientes del Bioterio de la Facultad de Ciencias de la Salud de la UC, con pesos corporales entre 25-30 gramos. La diferencia de peso entre los animales no excedió del 20 % del valor promedio del grupo para que no hubiese diferencia entre ellos.
Los animales cumplieron con un período de readaptación de 7 días. Tanto el grupo control como los experimentales recibieron agua y alimento comercial, Rataharina (Protinal), ad libitum. Los animales de experimentación se mantuvieron en jaulas de polipropileno con rejilla, agrupados por sexo y grupo de 5 animales por jaula, marcados en la cola y distribuidas de acuerdo al ensayo.
La temperatura del laboratorio se mantuvo alrededor de 22 ºC ± 3ºC con humedad relativa de 30-70 %. Se controló la luz del cuarto; 12 horas luz y 12 horas oscuridad. Todos los ensayos se realizaron de acuerdo a las Buenas Prácticas de Laboratorio (20-22).
Para la toxicidad aguda a dosis única, se empleó la Guía de la Organización para la Cooperación y el Desarrollo Económicos (OECD) 423. Se utilizaron 50 animales; 10 animales (5 hembras y 5 machos) para el grupo control (Aceite de girasol) y 10 animales (5 hembras y 5 machos) para el grupo experimental (aceite esencial de L. alba), de acuerdo a la dosis. La dosis inicial fue de 2000 mg/kg de peso corporal, como se observó letalidad en el 100 por ciento de los animales en estudio, se aplicaron las dosis inmediatamente inferiores de 1500, 900 y 300 mg/kg de peso corporal del aceite esencial, hasta lograr la dosis discriminante, es decir, aquella que no provocó muerte pero si toxicidad manifiesta (23).
Para la toxicidad aguda a dosis repetida, 28 días, se empleó la Guía OECD 407. Se utilizaron 20 animales; 10 animales (5 hembras y 5 machos) para el grupo control (Aceite de girasol) y 10 animales (5 hembras y 5 machos) para el grupo experimental (100 mg/kg del aceite esencial de Lippia alba).
El aceite esencial a la dosis correspondiente, de acuerdo al ensayo realizado, fue administrado por vía oral utilizando intubación intra gástrica con una cánula curva metálica, previo ayuno antes de la administración de las sustancias en estudio. El volumen del aceite esencial administrado no excedió de 0.5 ml/100 g de peso corporal.
Los animales de todos los grupos estudiados se observaron de forma individual a partir de los quince minutos posterior a la administración del aceite de girasol o del aceite esencial hasta las cuatro horas, teniendo especial atención los primeros 30 minutos y periódicamente durante las primeras 24 horas, continuando con las observaciones hasta los 14 días y 28 días de acuerdo al ensayo. Se registraron diariamente los parámetros clínicos (signos de toxicidad), asimismo, el peso individual de los animales se realizó en una balanza (Marca Kern, modelo 474-42) los días 0, 7, 14 y 28 de experimentación, de acuerdo al ensayo.
Parámetros clínicos. Se evaluaron los signos clínicos de toxicidad de los sistemas nervioso, circulatorio, respiratorio, tales como: parálisis anterior, parálisis posterior, reacción de alarma, palidez, erección de la cola, pilo erección, micción, defecación, convulsión, cianosis, hipotermia, irritabilidad, letargia (23). Los animales que murieron en el estudio se necropsaron y los animales que quedaron vivos se sacrificaron por dislocación cervical (24). A continuación se realizó una necropsia completa donde se examinó la superficie corporal, cavidades y órganos como: estómago, hígado, riñones, corazón, pulmón (25). Los órganos se seccionaron y dispusieron, la tinción de preparaciones se realizó con hematoxilina y eosina, y descritas al observarlas bajo un microscopio simple, Carl Zeiss.
Análisis estadístico. Los resultados se presentaron como media ± DS, valores absolutos, porcentajes y analizados estadísticamente a través de la prueba no paramétrica Kruskal- Wallis, utilizando el programa SPSS 19.
RESULTADOS
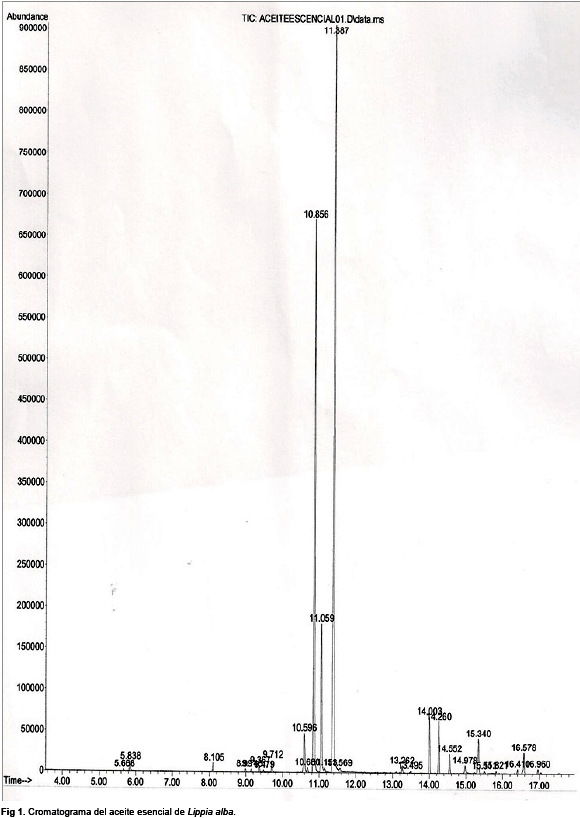
Caracterización química del aceite esencial de Lippia alba. El análisis del aceite esencial de L. alba por cromatografía de gases acoplada a espectrometría de masas permitió la identificación de 34 constituyentes diferentes del aceite esencial de L. alba. Los de mayor concentración fueron geranial (45,30%), neral (30,23%), beta-Farnesol (7,78%), cariofileno (2,85%), azuleno (2,52%) y beta-mirceno (2,38) (Tabla 1) y (Fig. 1). El rendimiento del aceite esencial de L. alba fue de 0.83 g/ml.
Toxicidad aguda a dosis fija (OECD 423) y repetida (OECD 407) del aceite esencial de Lippia alba.
Supervivencia.
Toxicidad aguda a dosis fija (OECD 423). La administración del aceite esencial a la dosis límite de 2000 mg/kg de peso corporal produjo la muerte de todos los animales en estudio, antes de las 4 horas de observación. La dosis de 1500 mg/ kg las hembras tratadas con el aceite esencial mostraron una supervivencia del 60 %, hasta las 4 horas mientras que los machos no sobrevivieron. A las dosis de 900 y 300 mg/ kg de peso corporal se observó supervivencia de todos los grupos experimentales (machos y hembras).
Toxicidad aguda a dosis repetida (OECD 407). Los animales (machos y hembras) que recibieron dosis repetidas (28 días) del aceite esencial de L. alba a la dosis de 100 mg/ kg de peso corporal por vía oral, presentaron 100 por ciento de supervivencia.
Variaciones de Peso. Los animales de todos los grupos que sobrevivieron, mostraron ganancia de peso a lo largo de las semanas de experimentación. Sin embargo, los machos control y tratados ganaron más peso que las hembras (control y tratadas) (Tablas 2 y 3).

Parámetros clínicos. La observación de los grupos tratados con aceite esencial de L. alba, por el método de dosis fijas (OECD 423) durante las primeras 4 horas continuas, mostró a la dosis de 2000 mg/kg, ataxia y letargia acentuada a partir de los 15 minutos, evidenciándose la muerte en los grupos tratados (machos y hembras) antes de los 30 minutos. A la dosis de 1500 mg/kg de peso corporal del aceite esencial de L. alba a los grupos tratados (machos y hembras), se observó ataxia y letargia de moderada a acentuada (50 %) hasta los 60 minutos, después de ese tiempo todos los animales machos murieron. Las hembras tratadas evidenciaron cambios similares a los machos tratados, excepto la presencia de convulsión (leve) con inicio a los 30 minutos y desaparición a los 60 minutos. Para ambos grupos tratados (machos y hembras), la salivación fue moderada. A la dosis de 900 mg/kg de peso corporal, se observó ataxia acentuada (50 % en machos y hembras) y letargia acentuada (100 % de los machos y 83.3 % de las hembras) a los 30 minutos, convulsión moderada (100 % de los machos) entre los 15-30 minutos con desaparición a los 60 minutos (Tabla 4). La micción y defecación presentes, con parámetros normales de consistencia y color. A las dosis de 300 mg/kg de peso corporal, el comportamiento de los animales en estudio fue similar al grupo control que recibió aceite de girasol, durante todo el período experimental.
En el ensayo a dosis repetida (28 días) de 100 mg/kg de peso corporal del aceite esencial de L. alba (OECD 407), no se observaron cambios en los parámetros clínicos en los grupos (control y tratados) para ambos sexos, durante el período de experimentación.
Estudio Histopatológico. El estudio histopatológico de los animales que fallecieron antes de las 24 horas y los animales que sobrevivieron no presentaron alteraciones patológicas en los órganos analizados (corazón, hígado, pulmón, riñón y estómago), con relación al control.
DISCUSIÓN
La L. alba, de la familia Verbenaceae, resulta de gran interés por la diversidad química de los metabolitos secundarios volátiles, presentes en sus aceites esenciales, y la variedad de usos botánicos y etnofarmacológicos.
Hasta ahora, basándose en la composición y las vías de biosíntesis de los diferentes aceites esenciales (11) se han propuesto 7 quimiotipos: I (citral, linalol, β-cariofileno), II (tagetenona), III (limoneno-carvona ó limoneno-monoterpenos/cetónicos), IV (mirceno), V (γ- terpineno), VI (alcanfor 1,8-cineol) y VII (estragol).
En el presente estudio, el análisis cromatográfico GC/MS del aceite esencial mostró predominio de geranial y neral; identificados en los aceites clasificados como quimiotipo citral. En concordancia una investigación (6) para determinar los constituyentes de L. alba recolectadas en dos poblaciones (Tasajera y Guigue) pertenecientes a la región central en Venezuela, se evidenció que los constituyentes mayoritarios fueron los mismos. Asimismo, Agudelo-Gómez y col, 2010 (8), evaluaron la composición química, de aceites esenciales de L. alba de diferentes regiones de Colombia, mostrando la presencia de dos quimiotipos (citral y carvona); siendo el citral el quimiotipo mayoritario (42-56%). De manera similar, estudios realizados en Bahía, Paraná y Brasilia (Brasil) han identificado plantas con el quimiotipo citral, como constituyente mayoritario (26, 27).
En relación a la toxicidad, entre los ensayos de primera barrera se encuentran los estudios de toxicidad aguda a dosis única y dosis repetida (28 días), imprescindibles en la estimación del potencial tóxico de una sustancia, referido como el estudio cualicuantitativo de los fenómenos tóxicos y de su aparición en función del tiempo tras la administración de una dosis única de la sustancia o de dosis repetidas en el transcurso de 28 días (28). En este sentido, los procedimientos de dosis única y dosis repetida fueron adoptados en las Guías de la OECD números 423 y 407 respectivamente como alternativa a la prueba clásica de toxicidad aguda (23).
El ensayo de toxicidad oral aguda proporciona información sobre los efectos adversos que pueden acaecer, en un breve período de tiempo, como consecuencia de la ingestión de una única dosis de la sustancia que se estudia. Desde el punto de vista regulatorio se acepta que no es necesario definir un valor puntual de la dosis letal media (DL50) para una sustancia y que resulta prácticamente suficiente ubicar dicha dosis en un intervalo. Las regulaciones para la ejecución de este tipo de estudio de toxicidad aguda plantean que si no existen informes anteriores de toxicidad de la(s) sustancia(s) que se investigan es posible utilizar una dosis límite de 2000 mg/kg de masa corporal, lo que se ajusta al presente estudio, dado que para el aceite esencial de L. alba administrado por vía oral, no existen investigaciones en el país.
En este estudio experimental, usando la Guía OECD 423 se observó que la dosis de 900 mg/kg, el aceite esencial de L. alba, por vía oral, produjo signos y síntomas de daño neurológico y motor moderado, con efectos letales a 2000 mg/Kg del aceite esencial, en un periodo de cuatro horas. De manera similar una investigación en ratones, utilizando dosis agudas mayores de 1000 mg/kg de un aceite de L. alba, quimiotipo citral, mostró también severo daño neurológico y a la dosis de 2500 mg/kg fue letal antes de las 24 horas, pero utilizando la vía intraperitonial (7). Reportes previos de toxicidad aguda (9), utilizando Artemia franciscana, para determinar CL50, de diferentes especies del género Lippia, mostraron que el 80 % de los aceites esenciales presentan toxicidad moderada.
Además, un estudio (29), utilizando las pruebas de laberinto, campo abierto y rota rod mostraron que ratones expuestos a dosis entre 50-200 mg/kg de tres quimiotipos de aceite esencial de la planta presentaron cambios conductuales, que variaron de acuerdo al quimiotipo utilizado. Los mecanismos para estos cambios no están claros. Sin embargo, para el quimiotipo citral, podrían estar implicados efectos sobre el SNC, probablemente como resultado de una deficiencia de ácido retinoico (30).
Por otra parte, los hallazgos del presente estudio sugieren, de acuerdo a la Clasificación de toxicidad del Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (ONU-SGA, 2011), que el aceite esencial de la L. alba corresponde a la categoría 4, que muestra que probablemente la DL50 se ubica entre 300-2000 mg/kg. Asimismo, este aceite esencial podría clasificarse como nocivo (DL50 entre 200-2000 mg/kg) (23), conforme a las dosis discriminantes utilizadas, puesto que a la dosis de 2000 mg/kg todos los animales fallecieron, mientras que a la dosis de 900 mg/kg, no ocurrieron muertes pero si toxicidad manifiesta y a la dosis de 300 mg/kg hubo 100 por ciento de supervivencia sin evidencias de toxicidad.
En el ensayo de toxicidad oral a dosis repetida (100 mg/ kg) diariamente por 28 días; utilizado para medir la toxicidad subcrónica de la preparación, los animales de experimentación mostraron que en las condiciones del estudio la supervivencia fue del 100 por ciento, sin signos evidentes de toxicidad, durante el período de experimentación.
En relación al peso corporal, parámetro de gran valor en la evaluación toxicológica de una sustancia pues su disminución podría considerarse como un efecto de toxicidad al organismo (29), en esta investigación se observó un aumento de peso en todos los grupos a lo largo de los períodos experimentales, indicando que las manifestaciones tóxicas del aceite esencial fueron en las primeras 24 horas sin repercusiones en el peso corporal. Tampoco se observaron alteraciones histológicas en las muestras analizadas.
Tomando en consideración los resultados del presente estudio que muestran toxicidad moderada en administración oral aguda y que en medicina popular tradicional, la infusión o decocción de las hojas, Flores y partes aéreas de L. alba se utilizan para el tratamiento de diversas afecciones, es de interés planificar futuras investigaciones con la planta proveniente de otras regiones del país, que permitan la caracterización de los aceites esenciales, en diferentes épocas del año, condiciones climáticas y de suelos, para establecer un perfil fitoquímico, farmacológico y toxicológico de los quimiotipos de L. alba, que crecen en el país, que garantice un recurso medicamentoso potencialmente útil por su actividad farmacológica y condiciones de seguridad.
CONCLUSIONES
El análisis cromatográfico GC/MS del aceite esencial de L. alba mostró que los constituyentes mayoritarios fueron: geranial (45,30 %), neral (30,23 %), beta- Farnesol (7,78 %), cariofileno (2,85 %), azuleno (2,52 %) y beta- mirceno (2,38), con predominio de geranial y neral; identificados en los aceites clasificados como quimiotipo citral.
El ensayo de toxicidad a dosis única discriminante (300, 900, 1500 y 2000 mg/kg), por vía oral, de acuerdo a la ONU-SGA (2011), mostro que probablemente la DL50 del aceite esencial se ubica entre 300-2000 mg/kg (categoría 4) mientras que el ensayo de toxicidad oral a dosis repetida (100 mg/kg) diariamente por 28 días; evidenció supervivencia del 100 por ciento sin signos evidentes de toxicidad, durante el período de experimentación.
Financiamiento. Este trabajo fue subvencionado parcialmente por CDCH-UC a través de la ayuda menor AM-310-08.
Agradecimiento. Al Dr.Stephen Tillett por su apoyo en la identificación botánica de la planta de L. alba, en el Herbario Dr. Víctor Manuel Ovalles de la Facultad de Farmacia de la Universidad Central de Venezuela. Asimismo, a la Dra. Marianella Zavala, quien realizó el estudio histopatológico de los tejidos.
REFERENCIAS
1. Medina-López L, Araya-Barrantes J, Tamayo-Castillo R. Comparación de metodologías de extracción para limoneno y carvona en Lippia alba usando cromatografía de gases. Ciencia y Tecnología, 2011; 27: 1-13. [ Links ]
2. Stashenko E. Propiedades y caracterización de los aceites esenciales. En: Aceites esenciales. División de publicaciones UIS - Universidad Industrial de Santander, Bucaramanga, Colombia, 2009. p. 85-124. [ Links ]
3. Duran D, Monsalve L, Martínez J, Stashenko E. Estudio comparativo de la composición química de aceites esenciales de Lippia alba proveniente de diferentes regiones de Colombia, y efecto del tiempo de destilación sobre la composición del aceite. Scientia et Técnica. 2007; 13: 435-38. [ Links ]
4. Fitzgerald A, Alves L, Arrigoni-Blank M, Baldin J, Matos T, Niculau N, Barreto AU. Chemical Diversity in Lippia alba (Mill.) N. E. Brown Germplasm. The Scientific World Journal. 2015. Article ID 321924. Disponible: http://dx.doi.org/10.1155/2015/321924. [ Links ]
5. Stashenko E, Jaramillo E, Martinez R. Analysis of volatile secondary metabolites from Colombian Xylopia aromatica (Lamarck) by different extraction and headspace methods and gas chromatography. J Chromatogr A. 2004; 1025: 93-103. [ Links ]
6. Ortega S. Comparación de la posible toxicidad hepática y renal en conejos tratados con aceites esenciales de plantas de Lippia alba, provenientes de dos zonas de la región Central. Tesis de Maestría no publicada. Valencia. Universidad de Carabobo. Facultad de Ciencias de la Salud. Maestría en Toxicología Analítica. 2002, 163 pp. [ Links ]
7. Olivero-Verbel J, Guerrero-Castilla A, Stashenko E. toxicity of the essential oil of the cytralchemotype of Lippia alba (Mill.) N. E. Brown. Acta Toxicol. Argent. 2010; 18: 21-27. [ Links ]
8. Agudelo-Gómez L, Gómez G, Durán D, Stashenko E, Betancur-Galvis L. Composición química y evaluación de la actividad antiherpética in vitro de aceites esenciales de Lippia alba (Mill) N.E. Brown y sus componentes mayoritarios. Salud UIS. 2010; 42: 230-240. [ Links ]
9. Olivero-Verbel J, Guette-Fernandez J, Stashenko E. Acute toxicity against Artemia franciscana of essential oils isolated from plants of the genus Lippia and Piper collected in Colombia. BolLatinoam Caribe Plant Med Aromát. 2009; 8: 419-427. [ Links ]
10. Zetola M, De Lima TCM, Sonaglio D. CNS activities of liquid and spray-dried extracts from Lippia alba-Verbenaceae (Brazilian false melissa). J Ethnopharmacol. 2002; 82: 207–215. [ Links ]
11. Hennebelle T, Sahpaz S, Joseph H, Bailleul F. Ethnopharmacology of Lippia alba. J Ethnopharmacol 2008; 116: 211-222. [ Links ]
12. Blanco MA, Colareda GA, van Baren C, Bandoni AL, Ringuelet J, Consolini AEJ. Efectos antiespasmódicos y composición de los aceites esenciales de dos quimotipos Suramericanas de Lippia alba. J Ethnopharmacol. 2013; 149: 803-809. [ Links ]
13. Teixeira G, Siqueira J, Rosa L, Pessoa de Siqueira E, Johann S, Rodríguez L. In vitro antifungal activities of leaf extracts of Lippia alba (Verbenaceae) against clinically important yeast species. Revista da Sociedade Brasileira de Medicina Tropical, 2014; 47: 247-250. [ Links ]
14. Rojas J, Palacios O, Ortiz J, López de la Peña L. Evaluación de la toxicidad del aceite esencial de Aloysia triphylla Britton (cedrón) y de la actividad anti-Trypanosoma cruzi del citral, in vivo. An Facmed. 2015; 76: 129-134. [ Links ]
15. Martínez R, Ortega M, Herrera J, Kawas J, Zárate J, Soriano R. Uso de aceites esenciales en animales de granja. Interciencia. 2015; 40: 744-750. [ Links ]
16. Sousa D. G, Sousa S. D. G, Silva R. E. R, Silva-Alves K. S, Ferreira-da-Silva F. W, Kerntopf M. R, Menezes I. R. A, Leal-Cardoso J. H, Barbosa R. Essential oil of Lippia alba and its main constituyente citral block the excitability of rat sciatic nerves. Brazilian Journal of Medical and Biological Research, 2015; 48: 697-702. [ Links ]
17. Sztajnkrycer MD, Otten EJ, Bond GR, Lindsell CJ, Goetz RJ. Mitigation of pennyroyal oil hepatotoxicity in the mouse. Acad Emerge Med. 2003; 10: 1024-1028. [ Links ]
18. Akdogan M, Ozguner M, Aydin G, Gokalp O. Investigation of biochemical ande histopathological effects of Mentha piperita Labiatae and Menthas picata Labiatae on liver tissue in rats. Hum ExpToxicol. 2004; 23: 21-28. [ Links ]
19. Mclafferty F. W, Tureček F. Interpretation of mass spectra, 4th edition F. W. Published by University Science Books, Mill Valley. 1993, 371 pp. [ Links ]
20. Organización para la Cooperación y el Desarrollo Económicos (OCDE). Principles of Good Laboratory Practice. Series on Principles of Good Laboratory Practice and Compliance Monitoring. OECD Environment Health and SafetyPublications.1998. [ Links ]
21. AVECAL. Manual para la producción y uso ético de los animales de laboratorio. Ministerio del Poder Popular para la Ciencia y Tecnología. 2009, 93 pp. [ Links ]
22. Ministerio del Poder Popular para la Ciencia, Tecnología e Industrias Intermedias. Código de ética para la vida. Disponible: http://www.Coordinv.ciens.ucv.ve/investigacion/ coordinv/index/CONCIENCIA/codigoe.pdf [ Links ]
23. Repetto M, Repetto G. Toxicología Fundamental. España: Díaz de Santos. 2009. 587 pp. [ Links ]
24. Laboratory Animal. Recomendaciones para la eutanasia de los animales de experimentación. Sociedad Española para las ciencias del animal de laboratorio. 1997; 52 pp. [ Links ]
25. Lagarto A, Tillan J, Bueno V, Chavez I, Guerra I, Vega Y. y Col. Toxicidad aguda oral y subcrónica en ratas de una extracto acuoso liofilizado de Ocimun tenuiflorum L. Rev. Toxicol. 2005; 22:175-179. [ Links ]
26. Jannuzzi H, Mattos J, Silva D, Gracindo I, Vieira R. Avaliação agronômica e química de dezesseteacessos de erva-cidreira [Lippia alba (Mill.) N.E.Brown] - quimiotipo citral, cultivados no Distrito Federal. Rev. Bras. Pl. Med., Botucatu. 2011; 13: 258- 264. [ Links ]
27. Glamočlija J, Soković M, Teević V, Linde G, Barros N. Chemical characterization of lippia alba essential oil: an alternative to control green moldes. Brazilian Journal of Microbiology, 2011; 42: 1537-1546. [ Links ]
28. Pérez M, Boffil M, Méndez R, Verdecia B. Evaluación de la toxicidad aguda por el procedimiento de dosis fijas de un extracto de Boldoa purpurascens Cav. REDVET. Revista electrónica de Veterinaria. 2008. [ Links ]
29. Vale TG, Matos FJ, De Lima TC, Viana GS. Behavioral effects of essential oils from Lippia alba (Mill.) N.E. Brown chemotypes. J Ethnopharmacol. 1999; 67:127-133. [ Links ]
30. Zhang M, Wan C, Ji B, Zhang Z, Zhu H, Tian N, La Y, Huang K, Jiang L, He G, Gao L, Zhao X, Shi Y, Huang G, Feng G, He L. Proteome alteration of U251 human astrocytoma cell after inhibiting retinoic acid synthesis. Mol Cell Biochem. 2009; 323: 185-193. [ Links ]
31. Organización de Naciones Unidas. Sistema Globalmente Armonizado de Clasificación y Etiquetado Productos Químicos. Parte 3: Efectos sobre la Salud (ONU-SGA 2011) Disponible: http://www.unece.org/es/trans/danger/publi/ghs/ghs_rev04/04files_s.html [Consulta: 03-12-2015] [ Links ]