Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salus
versión impresa ISSN 1316-7138
Salus vol.20 no.2 Valencia ago. 2016
Evaluación de técnicas de coloraciones para el diagnóstico de la Leishmaniasis cutánea
Colorations assessment techniques for diagnosis of cutaneous Leishmaniasis.
Domenica Cannova1, Emily Brito2, María Isabel Simons1.
1 Laboratorio de Leishmaniasis, Departamento de Parasitología, Escuela de Ciencias Biomédicas, Facultad de Ciencias de la Salud, Universidad de Carabobo. Sede Carabobo, Naguanagua Edo. Carabobo.
2 Escuela de Patología médica, Facultad de ciencias de la Salud, Universidad Arturo Michelena. San Diego, Edo. Carabobo.
Autor de Correspondencia: Domenica Cannova
E-mail: dcannova@gmail.com
RESUMEN
La Leishmaniasis es una protozoosis causada por parásitos del género Leishmania. Desde el punto de vista clínico se clasifican en formas cutánea, cutáneo-mucosa y visceral. El diagnóstico clásico de Leishmaniasis está basado en la verificación de amastigotas mediante la observación al microscópico de frotis, tomados por aspirados o biopsia de la lesión y teñidos con coloraciones tipo Romanowsky. En el presente estudio se planteó evaluar la utilidad de diferentes técnicas de coloración citológicas para el diagnóstico parasitológico de Leishmaniasis. Se elaboró un instrumento de medición usado con escala de estimación. Se utilizaron hámster (Mesocricetus auratus) inoculados experimentalmente con un aislado del parásito causante de Leishmaniasis cutánea, mantenidos en el bioterio experimental del Instituto de investigaciones Biomédicas de la Universidad de Carabobo sede Aragua (BIOMED-UC). Se seleccionaron aquellos hámsteres con seis meses hasta un año de inoculación que presentaban la formación de un nódulo en el lugar de inoculación. Se realizaron 60 frotis por aposición de los fragmentos de los nódulos y se clasificaron en tres grupos de 20 láminas cada uno, para colorearlas con 3 técnicas de coloración: Giemsa, Gaffney y Pap-mart®, luego fueron observadas al microscopio óptico con objetivo de 100X por 3 expertos en el diagnóstico de Leishmania y se evaluó cada coloración mediante una lista de cotejo debidamente validada. Los resultados de la investigación permitieron determinar que a pesar de que la tinción de Giemsa es la óptima y adecuada para demostrar las formas amastigotas en los frotis citológicos por observarse las estructuras con mayor nitidez y precisión, la coloración con Pap-Mart también permite hacer el diagnóstico de esta parasitosis, la cual pudiera ser utilizada como una alternativa en el momento que no se cuente con el reactivo de Giemsa en el mercado.
Palabras Clave: Leishmaniasis cutánea, diagnóstico, técnicas de coloración.
ABSTRACT
Leishmaniasis is a protozoal infections caused by parasites of the genus Leishmania. Clinicalyis are classified in cutaneous, muco-cutaneous, difuse and visceral forms. The classic diagnosis of leishmaniasis is based on the verification of amastigotes by observing microscopic smears, aspirates or taken by biopsy of the lesion and stained with Romanowsky type stains. In the present study it was proposed to evaluate the usefulness of different staining techniques for cytological diagnosis parasitologicof Leishmaniasis. A measuring instrument used to estimate scale was developed. Hamster (Mesocricetus auratus) experimentally inoculated with an isolate of the parasite that causes cutaneous leishmaniasis, kept in the experimental animal facility of the Institute of Biomedical Research at the University of Carabobo Aragua headquarters (BIOMED-UC) were used. Hamsters were selected those six months to a year inoculation presenting a nodule formation at the site of inoculation. 60 smears were performed by apposition of the fragments nodules were classified into three groups of 20 sheets each, to color with 3 coloring techniques: Giemsa, Gaffney and Pap-Mart®, then were observed under an optical microscope with objective 100X by 3 experts in diagnosing Leishmania, and each color was evaluated by a list of matching properly validated. The research results allowed determining that although Giemsa staining is optimal and adequate to demonstrate the amastigote forms in cytological smears observed structures more clearly and accurately, staining with Pap-Mart also allows the diagnosis of this parasitosis, which could be used as an alternative at the time is not counted with Giemsa reagent on the market.
Key words: Cutaneous leishmaniasis, diagnosis, coloring techniques.
Recibido: 11/11/2015 Aprobado: 01/07/2016
INTRODUCCIÓN
La Leishmaniasis constituye un grupo de afecciones parasitarias causadas por protozoos del género Leishmania, que abarcan varias especies de parásitos heteroxénicos, los cuales requieren un vector y un mamífero como el hombre para cumplir su ciclo, clínicamente se clasifican en Leishmaniasis visceral, cutánea, cutánea-mucosa y cutánea difusa(1). Es una enfermedad que afecta a las poblaciones más pobres del planeta, endémica en 98 países y hay más de 350 millones de personas en riesgo. Las cifras publicadas indican una incidencia de 2 millones de casos nuevos al año (2).En Venezuela, la incidencia en el quinquenio 2003 -2007 fue de 9,89 por cada 100.000 habitantes; la Leishmaniasis cutánea localizada representa el 98,8% de los casos positivos, con la aparición de una sola lesión en 69% de ellos (3,4).
El diagnóstico definitivo de Leishmaniasis está basado en métodos directos o parasitológicos para la verificación de amastigotas de Leishmania, para ello, se ha utilizado por excelencia la coloración con Giemsa de frotis o en extendidos de elementos citológicos (3, 5); este colorante tiene la capacidad de exponer hemoparásitos presentes en los extendidos. Consiste en un colorante metacromático, tiñe sustancias con un color diferente (púrpura-rojizo) al original del colorante (azul) y presenta un pH de 7,0. Está conformada por azul de metileno el cual se basa en un tinte de anilina que cuando se disuelve en agua forma un líquido azul intenso, se usa para teñir sustancias basófilas (7). Y con eosina que es un ácido débil y pertenece al grupo de las fluoresceínas, tiñe el citoplasma, las fibras colágenas y el tejido conjuntivo de un color rojo fuerte (7,8).En la actualidad existe dificultad en conseguir en el mercado las marcas comerciales de este colorante de óptima calidad, por lo que al utilizar otras marcas no se observan las formas diagnósticas de manera precisa. En la búsqueda de alternativas viables para la obtención un1 diagnóstico certero de esta parasitosis, al consultar la bibliografía, se pudo constatar que no existen estudios donde se utilicen otras técnicas de coloración diferentes al Giemsa, solo se pudo consultar estudios de algunos autores que evalúan la utilidad del Giemsa y otras coloracionescomo Hematoxilina-eosina (HE) para identificación de otros microorganismos en frotis citológicos, como el Helicobacterpilory, obteniendo que la coloración con HE no supera a la de Giemsa (9).
Sin embargo, en la literatura se han descrito algunas modificaciones en la técnica de coloración con Giemsaentre ellas se puede citar la de Gaffney que consiste en Giemsa acidificado (10), la cual ha sido utilizada en estudios de botánica con muy buenos resultados en la caracterización de especies de plantas (11,12). Esta técnica está compuesta por el colorante Giemsa y una solución acidificada de ácido acético glacial y agua destilada. Se fundamenta en lograr un pH 4, igual al de los amastigotas de Leishmania y así tener afinidad con los mismos (13). La modificación del pH pudiera constituir un elemento que mejore la estabilidad del colorante Giemsa para teñir amastigotas, esto a su vez pudiera mejorar la calidad del colorante Giemsa cuyas marcas comerciales disponibles actualmente en el mercado venezolano, no están dando resultados óptimos en el laboratorio.
También se dispone en el mercado la técnica de Pap-mart®, resultado de una modificación de la tinción de Papanicolaou definida como una técnica diferencial (policrómica) que consta de una tinción nuclear y un contraste citoplasmático, desarrollada para visualizar los distintos estadios de maduración de las células pavimentosas vaginales sobre del ciclo menstrual (14). Esta modificación fue ideada y elaborada por parte del farmacólogo venezolano Arfilio Martínez, de allí su nombre: Pap por Papanicolaou y Mart por Martínez, esta se encuentra como kit de diagnóstico disponible comercialmente y podría ser una alternativa excelente por su fácil procedimiento (15).
Por todo lo antes expuesto, en el presente estudio se planteó evaluar la utilidad de 3 técnicas de coloraciones: Giemsa, Pap-mart® y Gaffney para el diagnóstico parasitológico de Leishmaniasis cutánea.
MATERIALES Y METODOS
Se trató de un estudio tipo descriptivo transversal, el cual se llevó a cabo en el laboratorio de Leishmaniasis del Departamento de Parasitología de la Facultad de Ciencias de la Salud de la Universidad de Carabobo, Valencia, entre Mayo y Octubre del 2014.
Material biológico: se seleccionaron hámsteres (Mesocricetus auratus) infectados en sus patas traseras con un aislado de Leishmania a partir del macerado de la lesión de un paciente con Leishmaniasis cutánea, que tuvieran entre 6 meses a 1 año de inoculados y nódulos característicos de la infección. Estos animales eran mantenidos en el Bioterio Experimental del Instituto BIOMED-UC, de la Facultad de Ciencias de la Salud de la Universidad de Carabobo, Edo. Aragua, gentilmente donados por la Dra. María Dora Feliciangeli coordinadora de dicho Bioterio. Una vez seleccionado el hámster con nódulos óptimos para su procesamiento se procedió al sacrificio del mismo y la disección de los nódulos para realizar un total de 60 frotis por aposición de material linfático, para ello se debió mantener la isquemia en forma continuada y observando una coloración blanquecina con presencia de acúmulos tipo grumos del material extraído de nódulos disecados. El material se extendió finamente con la ayuda de una pinza, en un área aproximada de ¾ partes de las láminas portaobjetos limpios y desengrasados, debidamente rotuladas enumerándolas del 001 al 060. Una vez extendido el material, se dejó secar por un lapso de tiempo de 15 minutos. A continuación se procedió a fijar el material de la siguiente manera: desde la lámina 001 hasta la 040 con metanol y desde la lámina 041 hasta la 060 con el fijador comercial en aerosol (Citofix), que contiene una mezcla de alcohol etílico 96 % y propilenglicol, el cual es muy útil para la fijación de muestras citológicas (16-18).
Técnicas de coloración: Se desarrollaron las tres técnicas de coloración para demostrar la presencia de los amastigotas y estructuras citológicas antes mencionadas, mediante la observación en microscopio óptico con objetivo de 40x y 100X.
En primer lugar, las láminas fijadas con metanol comprendidas entre los números 001 y 020 fueron teñidas con Giemsa según protocolo convencional Giemsa (9), se preparó la solución en un beaker de 100 ml teniendo en cuenta la proporción 10 % en agua corriente, luego las láminas fueron sumergidas en la solución por 45 minutos, una vez transcurrido el tiempo se lavaron con agua corriente y se cubrieron con resina acrílica en este caso con la marca comercial Montex.
En segundo lugar, las láminas restantes fijadas con metanol comprendidas entre los números 021 y 040 fueron coloreadas según la técnica de Gaffney (9). La solución se preparó en un beaker mezclando 1mLGiemsa con 5 mL agua acidulada. El agua acidulada se preparó disolviendo 25 μL de ácido acético glacial en 100 mL de agua destilada, seguidamente esta se mezcló con Giemsa para lograr una solución con un pH 4 y se sumergieron las láminas por 1 hora. Transcurrido el tiempo, las muestras se lavaron con agua corriente, luego se sumergieron en alcohol puro por 2 minutos y seguidamente en xilol durante 2 minutos. Por último las láminas fueron cubiertas con resina acrílica para ser conservada en este caso con la marca comercial Montex.
El tercer grupo de láminas fijadas con citofix comprendidas entre la 041 y la 060 fueron coloreadas con Pap-mart® (15), el cual consta de los siguientes pasos: hidratación, coloración nuclear, deshidratación, coloración citoplasmática, diferenciación del colorante, aclaramiento y montajetuvieron como paso inicial hidratar la muestra con una solución 50% agua y 50% alcohol, luego se realizó la coloración nuclear con hematoxilina de Mayer la cual se diferenció con agua, seguidamente se deshidrataron las muestras con tres alcoholes en forma creciente, prosiguió la coloración citoplasmática con Pap-mart® formada por verde luz, pardo birsmarck, eosina amarillenta, ácido fosfotúngstico y Orange G, que posteriormente se diferenció con tres alcoholes puros, una vez finalizado este paso se procedió a realizar el aclaramiento con xilol y por último se realizó el montaje de la lámina con resina acrílica.
Finalmente la totalidad de las muestras coloreadas se observaron en un microscopio óptico marca Globe modelo L1800, en un aumento de 40x y 100x, y se procedió a la observación de las láminas por parte de los expertos, abarcando todo el extendido en forma de zig-zag en sentido vertical para la evaluación de cada técnica de coloración y determinar su utilidad en el diagnóstico parasitológico de la Leishmaniasis cutánea, a través de los elementos reflejados en la escala de estimación.
Los resultados se obtuvieron mediante el registro sistemático, válido y confiable de un conjunto de categorías y subcategorías. Se utilizó un instrumento de medición contentivo a una escala de estimación donde se registró la información o datos sobre las variables definidas (lista de cotejo), mediante la observación de las características y estructuras citológicas diagnósticas como: formas amastigotas, kinetoplastos, macrófagos, linfocitos, polimorfonucleares, hematíes y células referidas a otro extirpe celular. Esta caracterización se llevó a cabo por 3 profesionales expertos en el diagnóstico parasitológico de Leishmaniasis, utilizando una escala de 4 categorías describiendo la observación de cada aspecto a evaluar en: Bien visible, Medianamente visible, Poco visible, No visible. Cada categoría se caracterizó de manera consensuada por los expertos, como se describe a continuación: Bien visible: cuando se observan con nitidez, exactitud y de manera uniforme en todos los campos del preparado citológico, las características morfológicas y organelas específicos de cada estirpe celular, como membrana celular, núcleos bien definido, amastigotas y su organelas como kinetoplasto cuya coloración contrasta muy bien del resto del contenido celular.
Medianamente visible: en esta categoría las características morfológicas y organelas específicas no son completamente nítida y poco contrastante del resto de las estructuras, no habiendo una uniformidad en todos los campos observados, sin embargo, si se logra reconocer amastigotas.
Poco visible: cuando al observar todos los campos la visualización de las características morfológicas y organelas específicas no son nítidas, poco definidas que no permita la identificación de las estructuras y estirpes celulares correspondientes.
No visible: cuando no se puedan visualizar y/o identificar las características morfológicas delas amastigotas y organelas específicas, para lograr el diagnóstico de la parasitosis.
RESULTADOS
Una vez desarrollada las tres técnicas de coloración: Giemsa, Pap-mart® y Gaffney, a los frotis de las muestras de la lesiones de hámster infectados con aislado de Leishmania, fueron examinados por expertos, quienes coincidieron en reportar uniformidad en las láminas, en cuanto a distribución del frotis, contenido celular y coloraciones. Con respecto a la visualización e identificación de estructuras y organelas específicas para el diagnóstico de Leishmaniasis, se analizaron las respectivas listas de cotejo reportadas por los expertos y se obtienen los resultados que se describen a continuación.
En la Fig.1 se compara la capacidad que tienen las 3 coloraciones evaluadas para visualizar e identificar las amastigotas de Leishmania, observándose que con la coloración de Giemsa estas fueron bien visibles en el 90% de las láminas, observándose su formas ovaladas de aproximadamente 2 a 4 mm, presentado un núcleo definido. Con Pap-mart® el 75% fueron reportadas como medianamente visible y con Gaffney en el 40% de la láminas no son visibles.
Una de las organelas que permiten el diagnóstico del parásito de Leishmania es el Kinetoplasto, la Fig. 2, muestra como mediante el Giemsa el 80 % son bien visibles, en Pap-mart® el 70% de las láminas fueron medianamente visible y en Gaffney no se pudo identificar en ninguna de las láminas.
Los resultados obtenidos se pueden corroborar en las figuras del 3 al 5, donde se comparan las tres coloraciones en frotis por aposición para la observación de amastigotas y el kinetoplasto, aunque la nitidez y definición del Giemsa supera a Papmart®, con ambas coloraciones se puede identificar estas estructuras, permitiendo hacer el diagnóstico de Leishmaniasis cutánea, no así con la coloración de Gaffney.
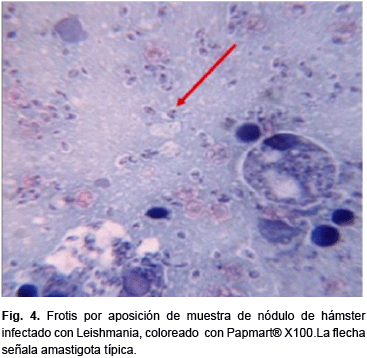
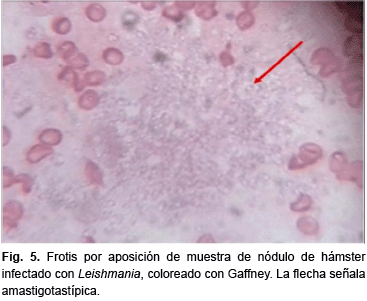
Por otra parte, se evaluó la eficacia de las tres coloraciones para diferenciar otros elementos celulares contenidos en el frotis por aposición del material obtenido del nódulo del hásmter infectado con Leishmania, como Macrófagos (MO), Polimorfonucleares (PMN), Linfocitos (L), Hematíes (H), y otros estirpes celulares como, células epiteliales y plaquetas. Estos resultados se presentan en la tabla 1.
Se corroboró que mediante la coloración de Giemsa y Pap-mart® se logra identificar de manera óptima otros elementos celulares en todas las láminas, sin embargo, mediante la coloración Gaffney solo se identificaron de forma óptima, los hematíes.
DISCUSIÓN
Las técnicas de coloración para el diagnóstico de hemoparásito fundamentadas en la tinción diferencial de la cromatina y el citoplasma, ha sido de gran utilidad desde los primeros estudios de Laveran en 1880(19), quién logró determinar que la malaria era causada por un hemoparásito y no una bacteria como se creía, mediante la coloración celular. Es a partir de allí que se inician numerosos estudios para conseguir la mezcla ideal de reactivos químicos que permitieran obtener esa diferenciación entre citoplasma, diferentes estructuras y la cromatina de una célula, lo cual conlleva al diagnóstico preciso de agentes infecciosos en el humano, es así como el Giemsa logra obtener una mezcla de colorantes que ha sido de gran utilidad en el estudio de enfermedades infecciosas (7,8).
En Leishmaniasis, el examen parasitológico directo mediante la coloración con Giemsa se utiliza para confirmar el diagnóstico tanto en humano y en reservorios animales, que complementa el criterio clínico–epidemiológico. Esto fue corroborado en un estudio realizado en Argentina donde se evaluó que el método parasitológico directo para diagnosticar amastigotas mediante la coloración de Giemsa, concluyendo sus autores que es el recomendado tanto en humanos como animales, presentando una alta sensibilidad (20).
Es así como la mayoría de los estudios referidos a evaluación de métodos de diagnóstico de Leishmaniasis incluyen al método parasitológicos mediante la coloración con Giemsa como el óptimo para la identificación y diagnóstico de amastigotas (5, 20,21), sin embargo, no hay reportes de estudios que evalúen otras coloraciones citológicas que puedan ser usadas como alternativas.
En el análisis de los resultados obtenidos de la evaluación citológicos en la presente investigación, con las tinciones de Giemsa, Pap-mart® y Gaffney de 60 muestras obtenidas de un Mesocrisetus auratus inoculado experimentalmente con leishmanias proveniente de biopsia de lesión depaciente con Leishmaniasis cutánea, se pudo demostrar que ciertamente, la tinción de Giemsa es la óptima para dar el diagnóstico definitivo de la enfermedad. Por otra parte, la coloración de Papmart® no presenta la nitidez y definición de las estructuras de forma óptima como el Giemsa, lo cual puede deberse a que la combinación de reactivos de Hematoxilina, Orange G 6 y Eosina acidificada están entremezclados con soluciones que hidratan, deshidratan pudiendo afectar la integridad de estas estructuras, cosa que no ocurre con el Giemsa donde la mezcla de los colorantes (Azul de metileno, azur II y eosina),se añade simultáneamente al preparado de la muestra luego de su fijación con metanol (9). Sin embargo, Papmart® permite reconocer las amastigotas, lo cual es suficiente para el diagnóstico de esta parasitosis. A esta coloración se le describe su utilidad principalmente en el despistaje de infecciones cervico-vaginales, especialmente del VPH como causante de cáncer de cuello uterino, sin embargo, también se ha descrito su utilidad en la detección del protozoario Trichomonasvaginalis (22), pero no se ha reportado en la literatura su uso en el diagnóstico de Leishmaniasis. Luego de estos resultados se puede recomendar el Papmart® como una coloración alternativa cuando no se cuente en el mercado la coloración de Giemsa.
Y por último, la coloración de Gaffney no logró alcanzar el objetivo deseado, ya que aunque se pensó que la acidificación del colorante Giemsa propiciaría una mayor afinidad por los amastigotes, no se tomó en cuenta la estabilidad del resto de los componentes del Giemsa a este pH ácido y en consecuencia pudiera afectar la absorción de las membranas y estructuras celulares esto impidió que se lograra el contraste entre citoplasma y cromatinas que es en lo cualse fundamentan estas coloraciones. Esto se pone en evidencia, por el hecho que solo se observaron muy bien los eritrocitos, dado que estos no poseen cromatina en su interior.
En conclusión, la combinación de colorantes que componen la mezcla de Giemsa presenta las condiciones de pH y estabilidad ideal que permite un contraste óptimo para la identificación con precisión y nitidez de estructuras intra y extracelulares de los amastigotas en frotis, lo que la hace la coloración óptima para el diagnóstico parasitológico de Leishmaniasis, sin embargo, el Papmart® puede ser una buena alternativa útil en el diagnóstico de Leishmaniasis cuando no se cuente con el reactivo Giemsa en el mercado.
REFERENCIAS
1. Rey L. Parasitología. 3ra. Edición Editorial Guanabara Koogan, Río de Janiero. Brasil. 1999: 215-226. [ Links ]
2. Organización Mundial de la Salud. Control de las Leishmaniasis. Serie de informes Técnicos. No 949. Ginebra. 2010. [ Links ]
3. De Lima H., Borges R. Leishmaniasis cutánea americana en Venezuela: un análisis clínico epidemiológico a nivel nacional y por entidad federal, 1988-2007. Boletín de Malariología y Salud Ambiental 2010; 2: 283 – 300. [ Links ]
4. Zerpa O, Borges R, Loyo N, Galindo W, Belisario D, Sosa A, Convit J. Comparación de cinco métodos para el diagnóstico de Leishmaniasis cutánea. Dermatol Venez. 2002:106-110. [ Links ]
5. Cuba C. Diagnóstico parasitológico de la Leishmaniasis tegumentaria Americana. Rev Peru Med Exp y Salud Pública. 2000; 17:1-4. [ Links ]
6. Castro MI, Abratte O, Barocchi M, Musacchio ML. Coloración de Papanicolaou y su importancia en el diagnóstico de las infecciones cervicovaginales. Acta bioquím. clín. latinoam. 2004; 38(2):199-202. [ Links ]
7. Giemsa G. Eine Vereinfachung und Vervollkommung meiner Methylenazur-Methylenblau-Eosin Farbemethode Zur Erzielung der Romanowsky-Nochtsen Chromatinfarbung. Zentralbl Bakteriol 1. 1904; 37:308-11. [ Links ]
8. Perea-Sasiaín J. Cien años del colorante de Giemsa. Biomédica 2003; 23:5-18. [ Links ]
9. Toro Arias M. Comparación de las tinciones hematoxilinaeosina y Giemsa para la identificación de Helicobacter pylori en muestras de biopsia gástrica de pacientes del hospital iessriobamba entre octubre y diciembre del 2009. (Tesis pregrado). Quito – Ecuador: Pontifica universidad católica del Ecuador; 2010. [ Links ]
10. Gaffney E. A modified one hour Giemsa. Histo-logic Tech bull Histotech 1971; I(1):3. [ Links ]
11. Gallo Agudelo DM, Pardo Cardona VM, Salazar Yepe M, Buriticá Cespedes P. Pucciniaschultesianthi, nueva especie biteliomórfica sobre solanaceae. Rev Fac Nac Agron 2011; 69(1): 5815-5819. [ Links ]
12. Hiratsuka Y, Morf W, Powell JM. Cytology of the aeciospores and aeciospore germ tubes of Peridermiumharknesii and P. stalactiforme of the Cronartiumcoleosporioides complex. Can J of Bot 1966; 44(12): 1639-1643. [ Links ]
13. Glaser TA, Baatz JE, Kreishman GP, Mukkada AJ. pH homeostasis in Leishmaniadonovani amastigotes and promastigotes. Proc Natl Acad Sci U S A. 1988, 85(20): 7602– 7606. [ Links ]
14. Castro MI, Abratte O, Barocchi M, Musacchio ML. Coloración de Papanicolaou y su importancia en el diagnóstico de las infecciones cervicovaginales. Acta Bioquím Clín latinoam 2004, 38:199-202. [ Links ]
15. Blandenier C, Montenegro E. Compendio de coloraciones histológicas. Facultad de Medicina. Universidad Central de Venezuela. Caracas: BOD, 2004. [ Links ]
16. Victoria Peralta P, De la Vega G. Estudios citológicos en el Hospital ABC. AnMed 1993; 38(1):11-14. [ Links ]
17. Riesgo Lobaina N, Moreira Díaz E, Cathcart Poca F. Caracterización citológica cuantitativa de la encía en adolescentes clínicamente sanos. Rev Cubana Estomatol 1996; 33(3): 109-115. [ Links ]
18. Sanoja LM. Detección y tipificación del virus del papiloma humano mediante reacción en cadena de polimerasa, en muestras cervicales de estudiantes: Universidad de Carabobo. Venezuela. Comunidad y Salud [Internet]. 2013; 11(2): 1-10. [ Links ]
19. Laveran A. Note sur un nouveau parasitetrouvédans le sang de plusieursmaladesatteints de fièvre palustre. CR Acad Sc 1880, 92:1268. [ Links ]
20. Fernández G, Maidana H, Perez Valega E, Maccio O, Gorordner J. Examen parasitológico directo en el estudio de la Leishmaniasis tegumentaria en animales y humanos. Descripción y análisis. Universidad Nacional del Nordeste Comunicaciones Científicas y Tecnológicas. Argentina 2004. Resumen V-012 [ Links ]
21. Gamboa Arend R. Leishmaniasis cutánea (revisión bibliográfica). Rev Med Costa Rica y Centroamerica. 2009, LXVI (588): 169-172. [ Links ]
22. Otárola UC, Briceño FJ, Bahamondes MMI, Muñoz MR, Lorca HM. Frecuencia de Tricomonasvaginalis detectadas mediante papanicolaou en cuatro servicios de salud, 1997-2002. Rev. chil. obstet. ginecol. [Internet]. 2000; 70(1): 3-7. [ Links ]

















