Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. v.1 n.2 Mérida jun. 2003
Prolactina sérica en pacientes con lupus eritematoso sistémico
Roald Gómez-Pérez; Rosa Roa*; Lilia Uzcátegui
Unidad de Endocrinología. Instituto Autónomo Hospital Universitario de Los Andes, Facultad de Medicina, Universidad de Los Andes. Mérida. *Departamento de Medicina Interna . Hospital Universitario de Maracaibo. Edo Zulia. E-mail: roaldg@hotmail.com Teléfono /fax: 0274-2631462
Resumen
Objetivo: Diversos estudios han reportado niveles elevados de prolactina (PRL) en sujetos con Lupus Eritematoso Sistémico (LES). La causa de tal alteración no es completamente conocida. Este estudio se realizó para evaluar los niveles séricos de PRL en sujetos femeninos con LES.
Métodos: Se estudiaron 18 mujeres en edades comprendidas entre 17 y 48 años y diagnóstico de LES sin insuficiencia renal ni otra condición clínica o farmacológica que pudiese causar hiperprolactinemia (HPRL) fueron seleccionadas de la consulta externa de Reumatología del Hospital Universitario de Maracaibo, (grupo A: 9 con crisis lúpica y grupo B: 9 asintomáticas). En condiciones basales se cuantificó la concentración sérica de PRL y se registraron las manifestaciones clínicas de actividad de LES. Ambos grupos de pacientes recibían tratamiento con la misma dosis de prednisona, la cual fue incrementada en períodos de actividad de la enfermedad.
Resultados: El grupo A mostró niveles séricos de PRL significativamente más elevados (P < 0.05) que el grupo B (37.95 ± 33.78 ng/ml vs 10.84 ± 3.64 ng/ml, respectivamente). El 67 % de las pacientes del grupo A presentaron HPRL (> 20 ng/ ml).
Conclusiones: Los resultados sugieren un efecto bifásico de la PRL, donde tanto la HPRL como la hipoprolactinemia pudieran ocasionar un inmunocompromiso que se traduce en crisis lúpica.
Palabras claves: prolactina, lupus.
Abstract
Objetive: to evaluate prolactin (PRL) serum levels in female patients with Systemic Lupus Erythematosus (SLE).
Methods: Eighteen women with the diagnosis of SLE, with ages between 17 and 48 years, without any other clinical condition, and without any kind of medications that may cause hyperprolactinemia, were selected from the Reumathology out patient clinic from the Hospital Universitario de Maracaibo. Nine patients (group A) with active disease, and 9 asymptomatic patients (group B). On basal and fasting conditions PRL serum levels were measured, and the clinical manifestations of SLE were recorded. Both groups of patients were receiving a 5 mg daily dose of prednisone, which further was increased in patients with active disease. Results: Group A patients showed serum PRL levels significantly higher (p < 0.05) than the group B patients (37.95 ± 33.78 ng/mL vs 10.84 ± 3.64 ng/mL, respectively). From group A patients, 67 % of them had hyperprolactinemic, greater than 20 ng/mL.
Conclusions: A biphasic prolactin behavior was observed in this group of patients, suggesting that both, the hyperprolactinemic and the hypoprolactemic conditions, may be the cause of an immunodeficiency state, which would be translated with disease activity.
Key words: prolactin, lupus.
Recibido: Noviembre 2002; Aceptado: Febrero 2003.
Introducción
El Lupus Eritematoso Sistémico (LES) es una enfermedad multisistémica que afecta predominantemente a las mujeres en etapa reproductiva en una relación 10:1 comparada con los hombres1. En vista de esta alta incidencia, se ha estudiado la relación del LES con las hormonas sexuales2,3. Niveles elevados de estrógenos y progestágenos favorecen la actividad de la enfermedad, mientras que los andrógenos disminuyen la presencia y la actividad de la misma, ejerciendo así un efecto protector contra la enfermedad4-7.
Los estrógenos y la prolactina (PRL) tienen una relación endocrina reciproca y ambas hormonas tienen efectos pleiotrópicos en el sistema inmune6. La PRL esta involucrada en la patogénesis del LES por sus efectos sobre la inducción de la síntesis de receptores de interleuquina 2 (IL-2) en linfocitos y como un factor de crecimiento linfocitario, estimulando así tanto la respuesta inmune de tipo humoral como la celular8,9. Además, linfocitos T y B sintetizan PRL y poseen receptores para la misma10.
Berczi y colaboradores11 y Nagy y cols12 demostraron la importancia de la PRL en mantener la respuesta inmune normal, ya que las ratas hipofisectomizadas reducen su respuesta inmune mediada por células, mientras que este efecto es activado con la administración de PRL. Estudios experimentales, realizados en modelos animales, sugieren que la PRL tiene efectos deletéreos en las enfermedades inmunes. La hiperprolactinemia (HPRL) creada en ratas por inyección exógena de PRL o por transplante de hipófisis, incrementa la formación de anticuerpos contra eritrocitos de ovejas13. En ratas New Zealand Black / New Zealand White (NZB/NZW), las cuales desarrollan una enfermedad similar al LES, la HPRL inducida acelera la aparición de complejos inmunes14 y la producción de anticuerpos contra el ácido desoxirribonucleico (ADN), lo que resulta en hipergammaglobulinemia y produce una enfermedad renal temprana y muerte prematura. Contrario a esto, la administración de bromocriptina, un inhibidor de la secreción de PRL, produce normoprolactinemia retardando la aparición de anticuerpos anti-ADN y mejorando la sobrevida de los animales15.
Niveles de PRL séricas elevados y aun HPRL son un hallazgo común en pacientes con LES, aunque la causa del mismo es incierta. Leaños-Miranda y cols16 encontraron HPRL en 15,8% de pacientes con LES, lo cual también ha sido observado por otros autores17,19. La HPRL reportada en pacientes con LES varía entre 15,3% y 31% 17,18,20 y cuando el intervalo de confianza esta calculado al 95% esta frecuencia puede variar entre 6,9% - 50,2%, dependiendo del número de pacientes estudiados21. Estos resultados han sugerido una estrecha relación entre niveles séricos elevados de PRL y actividad clínica y serológica del LES17,19,22. Alvárez-Nemegyei y cols23, estudiaron la efectividad de la bromocriptina como un adjuvante a la terapia convencional para el LES en pacientes con crisis lúpica, concluyendo que a pesar de no haber diferencias absolutas en el número de crisis entre ambos grupos, el número medio de crisis/paciente/mes estuvo disminuido en el grupo con bromocriptiva comparado con el grupo control. Blanco-Favela y cols21 analizaron 5 estudios en relación con HPRL y presencia de crisis lúpica, observando sólo en un estudio una correlación positiva entre HPRL y actividad de la enfermedad. El presente trabajo tiene como objetivo estudiar en pacientes femeninas con LES la posible relación entre la concentración sérica de PRL y la crisis lúpica.
Métodos
Sujetos: Se estudiaron 18 pacientes del sexo femenino con edades comprendidas entre 17 y 48 años con diagnóstico de LES, quienes ingresaron al Departamento de Medicina Interna del Hospital Universitario de Maracaibo, en las áreas de consulta externa y hospitalización. Los pacientes con insuficiencia renal crónica establecida, embarazo y otra causa conocida de HPRL fueron excluidas.
Las pacientes se agruparon de acuerdo al estado de actividad de la enfermedad. Grupo A: pacientes (n=9) con crisis lúpica y el grupo B pacientes (n=9) sin evidencia clínica de actividad de la enfermedad. Se consideró crisis lúpica o actividad de la enfermedad, aquellos pacientes quienes presentaron una puntuación mayor o igual a 4 puntos según el índice de SLEIDAI24 en el momento de la venopunción.
Al ingreso todas las pacientes recibían prednisona. De las pacientes del grupo A, ocho ameritaron elevación de la dosis de mantenimiento a una dosis del 1 mg/kg/día, una ameritó elevación a 2mg/kg/ día debido a anemia hemolítica, en el momento de ingresar al estudio. Todas los pacientes del grupo B mantuvieron la dosis habitual de prednisona (5 mg día), dos de las cuales recibieron una combinación terapéutica a base de prednisona y cloroquina.
A cada paciente se le realizó una ficha que contenía datos correspondiente a sexo, edad, procedencia, tiempo de evolución de enfermedad, criterios diagnóstico, manifestaciones clínicas, complicaciones, tratamiento y el estado de enfermedad para el momento del ingreso al estudio.
Protocolo clínico: Luego de un ayuno de 12 horas y en reposo, a cada paciente, se le tomó muestra de sangre de la vena antecubital derecha, se obtuvo el suero por centrifugación y este fue almacenado a -20ºC, para la posterior determinación de la PRL. Considerando la variación diurna de los niveles de PRL, todas las muestras fueron tomadas entre las 8:00 y 11:00 am. La cuantificación de la PRL se realizó por radio inmunoensayo, utilizando el estuche comercial de ACS :180 de Ciba Corning. Se corrieron las muestras por duplicado. (Rango de PRL sérica basal normal: 3,30-20,00 ng/ml ). Coeficiente de variación intra e inter ensayo fueron del 5 y 7 % respectivamente. Niveles superiores a 20,00 ng/ml fueron considerados como HPRL y niveles inferiores a 3,30 ng/ml se consideraron como hipoprolactinemia.
Análisis estadístico: Los resultados fueron expresados en promedio ± desviación estándar. La prueba t-Student se utilizó para comparar entre sí los promedios. Los datos fueron analizados utilizando un programa estadístico de SPSS versión9. La presencia de manifestaciones clínicas y su relación con los niveles de PRL se expreso en porcentajes (%). Un valor de p £ 0,05 se consideró estadísticamente significativo.
Resultados
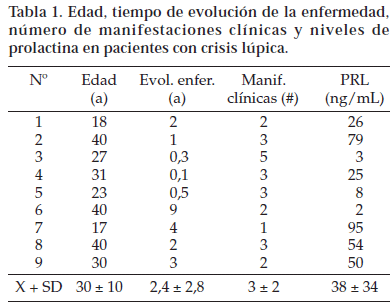
Se estudió una población de 18 pacientes femeninas con LES, clasificados en dos grupos: grupo A pacientes en crisis lúpica y grupo B pacientes asintomáticas. El promedio de edad fue 29,56± 9,5 y 29,5 ± 9,89 años (a) respectivamente. La media de duración de la enfermedad fue 2,42 ± 2,79 años para el grupo A y 4,7 ± 3,97 años para el grupo B. No hubo diferencias significativas estadísticamente en estas variables. La concentración promedio de PRL sérica fue de 37,95 ± 33,78 ng /dL para el grupo A y de 10,84 ± 3,64 ng/dL para el grupo B, una diferencia estadística significativa (Fig. 1, tabla 1).
Las pacientes del grupo A presentaron HPRL en el 67 % de los casos, hipoprolactinemia en el 22% y el 11% presentó normoprolactinemia. La manifestación clínica más frecuente fue el compromiso renal (67%), de las cuales el 50% presentaron HPRL, el 33% hipoprolactinemia y el 17% normoprolactinemia. La anemia no hemolítica fue la segunda manifestación clínica en frecuencia (56%), de los cuales el 60% presentaron HPRL y el 20% hipoprolactinemia. Las otras manifestaciones clínicas observadas fueron: el eritema facial y la artritis, ambas con un 44% de frecuencia. La anemia hemolítica, las ulceras orales, la caída del cabello y la serositis se presentaron con una frecuencia del 11%.
Discusión
En nuestro estudio encontramos una asociación entre la HPRL y la actividad de la enfermedad (67%). Otros autores17,19,25,26 obtuvieron una correlación entre la actividad de la enfermedad tanto clínica como serológica con los niveles de PRL. En pacientes embarazadas con LES, un modelo clínico diferente de la enfermedad, los niveles más altos de prolactina sérica fueron encontrados en las pacientes con LES activo y en pacientes con exacerbación del LES en el período puerperal4. A pesar de estos hallazgos, existe discrepancia entre los resultados aportados por otros autores, quienes no observaron una relación estadísticamente significativa entre los niveles de PRL y actividad del LES. En este sentido, Ostendorf y cols27 hallaron que solo 4 de 182 pacientes (2%) tenían niveles elevados de PRL.
Diferentes hipótesis han sido postuladas para explicar la presencia de HPRL en pacientes con crisis lúpica. Russell y cols10 demostraron la presencia de receptores de prolactina en células del sistema inmunológico así como, la secreción de la PRL por los linfocitos. Parece improbable que la PRL generada por los linfocitos sea tan alta que permita ser medida a nivel sérico, sin embargo, podría actuar localmente de manera paracrina y autocrina, favoreciendo la proliferación de los linfocitos17,28,29.
La HPRL también ha sido relacionada con la inhibición de la función inmune30. Experimentalmente se ha demostrado disminución de la función de las células natural killer (NK) después de HPRL inducida por destrucción selectiva del sistema tuberoinfundibulador en ratas31.
El receptor de PRL esta ampliamente distribuido en el sistema inmunológico, compartiendo los sitios de síntesis con otros receptores como el de la superfamilia de receptores que incluyen la cadena α de la IL-2, IL-3, IL-4, IL-6, IL-7, hormona de crecimiento y eritropoyetina31. Por otra parte, la PRL a través de segundos mensajeros intracelulares, activa la proteína cinasa C, la cual favorece la síntesis de receptores de interleuquina que actúan como factor de crecimiento, activando a los linfocitos; hecho corroborado por Mukherjee y cols32 quienes observaron inducción de receptores de IL-2 en linfocitos esplénicos de ratas por la prolactina. En los estados de HPRL en pacientes lúpicos con enfermedad del sistema nervioso central (SNC), se ha encontrado un incremento de la IL-6. Niveles altos de esta IL favorecen la secreción de PRL a nivel hipofisario33. Así mismo HPRL y niveles elevados de IL-6 se han encontrado en pacientes con LES activo que presentan nefritis y cerebritis, lo que sugiere que la HPRL participa en la actividad de la enfermedad. La HPRL podría ser el reflejo de una comunicación anormal entre el sistema inmunológico y el sistema neuroendocrino en el LES activo34.
La HPRL en el LES, también es atribuida a la presencia de anticuerpos anti-PRL, sin embargo, los factores que inducen la producción de anti-cuerpos anti-PRL no son del todo claros. Se involucran factores ambientales y genéticos, así como cambios estructurales en la molécula de PRL que la hacen más antigénica16. Todos los pacientes con autoanticuerpos anti-PRL tiene HPRL, lo cual sugiere que los autoanticuerpos producen la HPRL. Existen dos posibles mecanismos para que los auto-anticuerpos puedan aumentar los niveles de PRL sérica, el primero es que el complejo auto-anticuerpo-PRL, forma una macro molécula que escapa de la degradación renal; el segundo, este complejo puede bloquear el mecanismo de retrocontrol del sistema hipotálamo hipófisis en la secreción de PRL.
La asociación entre HPRL y actividad lúpica es conocida, sin embargo existe estudios en los cuales no se ha demostrado esta correlación, esto pudiera ser explicado por la presencia de anticuerpos anti-PRL, los cuales al unirse a la PRL, disminuyen su actividad biológica e interfieren con los valores reales de PRL16. En nuestro estudio dos de las pacientes presentaron crisis lúpica con niveles de PRL sérica por debajo del rango normal, nosotros no evaluamos los niveles de autoanticuerpos que podrían explicar disminución de la bioactividad de la molécula de PRL reportada por otros autores16.
Es posible considerar que el efecto inmunomodulador de la PRL es de naturaleza bifásica: tanto la hiperprolactinemia como la hipoprolactinemia pueden modular la respuesta inmunológica, y como en el caso del LES esta se traduce en actividad de la enfermedad. El mecanismo de inmunocompromiso podría estar relacionado con la producción de interferón alfa, el cual disminuye en los animales hipoprolactinémicos, y está relacionado con la actividad de algunas células del sistema inmune31. Lo cual sugiere que se requieren niveles adecuados de PRL para una función óptima del sistema inmune. Nagy y cols12 encontraron que la función inmune en ratas hipofisectomizadas estaba disminuida, mejorando la misma con la administración del hormona de crecimiento y PRL. En nuestros pacientes con LES sin crisis los niveles de PRL estaban normales, lo cual parece corroborar la importancia de la normoprolactinemia para la función adecuada del sistema inmunológico.
Para hablar de actividad lúpica se requiere que existan exacerbaciones de las manifestaciones clínicas propias del LES o aparición de nuevos síntomas más que por el número de los mismos. Algunas de las manifestaciones clínicas parecieran estar ligadas más estrechamente a los valores séricos de PRL, es de hacer notar que en nuestra serie, la paciente cuya única manifestación clínica fue serositis, presentó el nivel más alto de PRL, este hallazgo ha sido descrito en pacientes con HPRL quienes cursan con nefritis y cerebritis lúpica22,33.
Aunque el número de pacientes estudiados fue relativamente pequeño, nuestros resultados coinciden con las observaciones que sugieren un efecto bifásico de la hormona, donde tanto la HPRL como la hipoprolactinemia pudieran ocasionar un inmunocompromiso que se traduce en crisis lúpica, aunque esta, se observó con predominio de la HPRL.
Referencias bibliográficas
1. Wallace D.J. The clinical presentation of systemic lupus erythematosus. In: Wallace D.J., Hahn B.H., eds. Dubois´lupus erythematosus. Baltimore: William & Wilkins; 1997: 627-633. [ Links ]
2. Talal N. Sex steroid hormones and systemic lupus erythematosus. Arthritis Rheum 1981; 24: 1054-1056. [ Links ]
3. Elbourne K.B., Keisler D., McMurray R.W. Differential effects of estrogen and prolactin on autoimmune disease in the NZB/NZW F1 mouse model of systemic lupus erythematosus. Lupus 1998; 7: 371-375. [ Links ]
4. Jara-Quezada L., Graef A., Lavalle. Prolactin and gonadal hormones during pregnancy in Systemic Lupus Erythematosus. J Rheumatol 1991;18 : 349-356. [ Links ]
5. Sequeira J.F., Keser G., Greenstein B. Systemic lupus erythematosus: sex hormones in male patients. Lupus 1993; 2: 315-317. [ Links ]
6. McMurray R.W. Estrogen, prolactin, and autoimmunity: actions and interactions. Int Immunopharmacol 2001; 1: 995-1008. [ Links ]
7. McMurray R.W. Prolactin in murine systemic lupus erythematosus. Lupus 2001;10:742-747. [ Links ]
8. Walker S., and Jill D, Jacobson. Roles of Prolactin and gonadotropin-releasing hormone in rheumatic diseases. Rheum Dis Clin North Am 2000; 26: 713-736. [ Links ]
9. Peeva E., Michael D., Cleary J., Rice J., Chen X., Diamond B. Prolactin modulates the naive B cell repertoire. J Clin Invest 2003; 111: 275-283. [ Links ]
10. Rusell D.H., Kibler R., Matrisian R., Larson D.F., Poulos B., Magun B.E. Prolactin receptors on human T and B lymphocytes: antagonism of prolactin binding by cyclosporine. J Immunol 1987; 134: 3021-3031. [ Links ]
11. Berczi I., Nagy E., Kovacs K. Regulation of humoral immunity in rats by pituitary hormones. Acta Endocrinologica 1981; 98: 506-513. [ Links ]
12. Nagy E., Berczi L., Friesen H. Regulation of immunity in rats by lactogenic and growth hormones. Acta endocrinologica 1983;102 :351-357. [ Links ]
13. Cross R.J., Campbell J.L., Roszman T.L. Potentiation of antibody responsiveness after the transplantation of a syngeneic pituitary gland. J Neuroimmunol 1989; 25: 29-35. [ Links ]
14. Mc.Murray R., Keisler D., Kanuckel K., Izui S., Walker S. Prolactin influences autoimmune activity in the female B/W mouse. J Immunol 1991;147 :780-787. [ Links ]
15. Hahn B.H. Animal models of systemic lupus erythematosus. In: Wallace OJ, Hahn BH eds. Dubois´Lupus Erythematosus; Baltimore Williams & Wilkins: 1997, 339-380. [ Links ]
16. Leaños-Miranda A., Pascoe-Lira D., Chávez-Rueda K., Blanco-Favela F. Antiprolactin Autoantibodies in Systemic Lupus Erythematosus: frequency and correlation with prolactinemia and disease activity. J Rheumatol 2001; 28: 1546-1553. [ Links ]
17. Jara L.J., Gomez-Sanchez C., Silveira L.H., Martinez- Osuna P., Vassey F.B., Espinoza L.R. Hyperprolactinemia in systemic lupus erythematosus: association with disease activity. Am J Med Sci 1992; 303: 222-226. [ Links ]
18. Neidhart M. Elevated serum prolactin or elevated prolactin/ cortisol ratio are associated with autoimmune processes in systemic lupus erythematosus and other connective tissue diseases. J Rheumatol 1996; 23: 476- 478. [ Links ]
19. Pacilio M., Migliaresi S., Meli R., Ambrosone L., Bigliardo B., Di Carlo R. Elevated bioactive prolactin levels in systemic lupus erythematosus association with disease activity. J Rheumatol 2001; 28: 2216-2221. [ Links ]
20. Pauzner R., Urowitz M.B., Gladman D.D., Cough J.M. Prolactin in systemic lupus erythematosus. J Rheumatol 1994; 21: 2064-2067. [ Links ]
21. Blanco-Favela F., Quintal-Alvarez G., and Leaños-Miranda A. Association between prolactin and disease activity in systemic lupus erythematosus: Influence of statistical power. J Rheumatol 1999; 26: 55-59. [ Links ]
22. Miranda J.M., Prieto R.E., Paniagua R. Clinical significance of serum and urine prolactin levels in lupus glomerulonephritis. Lupus 1998; 7: 387-391. [ Links ]
23. Alvarez-Nemegyei J., Cobarrubias-Cobos A., Escalante- Triay F., Sosa-Munoz J., Miranda J.M., Jara L.J. Bromocriptine in systemic lupus erythematosus: a double-blind, randomized, placebo-controlled study. Lupus 1998; 7: 414-419. [ Links ]
24. Gladman D., Ibañez D., Urowitz M. Systemic Lupus Erythematosus disease activity Index 2000. J Rheumatol 2002; 29: 288-291. [ Links ]
25. Folomev M. Prolactin levels in men with SLE and RA. J Rheumatol 1990;17 : 1569. [ Links ]
26. Jacobi A.M., Rohde W., Ventz M., Riemekasten G., Burmester G.H., Hiepe F. Enhanced serum prolactin (PRL) in patients with systemic lupus erythematosus: PRL levels are related to the disease activity. Lupus 2001; 10: 554-561. [ Links ]
27. Ostendorf B., Fisbcher R., Santen R. Hyperprolactinemia in systemic lupus erythematosus. Scand J Rheumatol 1996; 25: 97-102. [ Links ]
28. Sabharwal P., Glaser R., Lafuse W. Prolactin synthesized and secreted by human peripheral blood mononuclear cells: an autocrine growth factor for lymphoproliferation. Proc Natl Acad Sci 1992; 89: 7713- 7716. [ Links ]
29. Matera L. Prolactin as an autocrine growth factor for the jurkat human T leukemic cell line. J Neuroimmunol 1997; 79: 12-21. [ Links ]
30. Vidaller A., Guadarrama F., Llorente L. Hyperprolactinemia inhibits natural killer (NK) cell function in vivo and its bromocriptine treatment not only corrects it but makes it more efficient. J Clin Immunol 1992; 12: 210-215. [ Links ]
31. Mellai M., Giordano M., DAlfonso S., Marchini M., Scorza R., Giovanna Danieli M., Leone M., Ferro I., Liguori M., Trojano Richiardi P. Prolactin and prolactin receptor gene polymorphisms in multiple sclerosis and systemic lupus erythematosus. Hum Immunol 2003;64: 274-284. [ Links ]
32. Mukherjee P., Mastro A., Hymer W. Prolactin induction of interleukin -2 receptors on rat splenic lymphocytes. Endocrinology 1990;126 :88-94. [ Links ]
33. El-Garf A., Salah S., Shaarawy M., Zaki S., Anwer S. Prolactin hormone in juvenile systemic lupus erythematosus: a possible relationship to disease activity and CNS manifestations. J Rheumatol 1996; 23: 374-377. [ Links ]
34. Jara L.J., Vera-Lastra O., Miranda L.M., Alcala M., Alvarez- Nemegyei J. Prolactin in human systemic lupus erythematosus. Lupus 2001; 10: 748-756. [ Links ]