Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. v.3 n.2 Mérida jun. 2005
Adicción al azúcar: ¿mito ó realidad?
Pedro Rada1,2, Nicole M. Avena2 y Bartley G. Hoebel2
1 Laboratorio de Fisiología de la Conducta, Facultad de Medicina, Universidad de los Andes, Mérida-Venezuela 5101-A.
2 Department of Psychology, Princeton University, Princeton, NJ, 08544
Resumen
Popularmente se habla de adictos a los dulces, sin embargo, nunca se ha estudiado de manera sistemática la existencia de este tipo de adicción a un alimento. Este concepto es de gran importancia cuando en los países desarrollados surge una gran lucha legal contra las grandes cadenas de comida rápida por asegurar, los litigantes, que estas compañías manejan estrategias que favorecen a la adicción y que son responsables de una de las calamidades médicas mas importantes del momento que es la obesidad. La adicción se define como el uso compulsivo e incontrolable de una droga de adicción. Los expertos en el área describen 3 etapas en la adquisición y desarrollo de esta enfermedad. La primera que consiste en el escalamiento y atracón de la droga, seguido en una segunda instancia de la dependencia y por último, el deseo imperioso y recaída. A continuación presentaremos un modelo animal de dependencia al azúcar con características muy semejantes a los que se observan con las drogas de adicción y que nos señalan que los sistemas neurales para la conducta alimentaria son probablemente compartidos por las drogas de adicción.
Palabras claves: Adicción, azúcar, dulce.
Abstract
A person with a sweet tooth has a weakness for sugar and is popularly considered addicted to sweets. However, so far there has been no systematic research on the existence of an addiction to a natural food. This concept of addiction to a food has gained great importance in developed countries where a fierce legal battle against the major fast food chains has started. It has been suggested that these companies use food strategies that promote an addictive behavior and could be responsible for one of the worst epidemics of our history, obesity. Experts in the field define drug addiction as a compulsive and uncontrollable use of a drug. They describe a series of stages in the acquisition and development of this disease. The first stage is bingeing and escalation of the drug use, followed by dependence, and a last stage determined by craving and relapse. In the present review, we will show a new animal model of sugar dependence with characteristics that mimic those of a drug of abuse. This research shows that foods, especially sugar, and drugs of addiction probably share the same neural systems.
Key words: Addiction, sweet.
Recibido: Enero 2005; Aceptado: Marzo 2005
Introducción
La obesidad ha surgido recientemente, en los países desarrollados y en vía de desarrollo, como un problema de salud público1, 2. Es un factor de riesgo importante en la aparición de enfermedades vasculares (hipertensión arterial, aterosclerosis, infarto cardíaco y cerebral)3-5 y endocrinas (síndrome metabólico, diabetes)6, 7. Una de las razones de esta elevación en el número de obesos se debe a la ingesta y disponibilidad de comidas hipercalóricas, incluyendo las bebidas carbonatadas y chucherías. Popularmente se define como un adicto al dulce a aquella persona que se torna ansiosa luego de períodos largos sin ingesta de dulces. Igualmente los pacientes obesos sometidos a dietas estrictas presentan cuadros depresivos y de ansiedad que asemejan a los estados de abstinencia de las drogas de adicción, lo que nos lleva a preguntar ¿Existe la adicción al azúcar?
Definición de Adicción
La adicción se define como el uso compulsivo, incontrolable, de una droga de abuso, a expensas de casi todas las actividades cotidianas y en ciclos que cada vez se intensifican mas8-10. Los investigadores en el área han definido la existencia de 3 etapas en el desarrollo de la adicción. La primera etapa denominada en inglés bingeing, que se traduce como atracón, consiste en el consumo de una gran cantidad de la droga en una oportunidad e indica que ésta pasó de una droga de uso a ser una droga de abuso. Esta etapa se caracteriza por el incremento progresivo de la cantidad de droga que se usa (escalamiento). Igualmente en esta etapa se da la sensibilización de varios elementos conductuales. En modelos animales el más evidente es el de hipermotricidad, que va en aumento a medida que el animal se hace adicto. Este fenómeno es similar al que se produce en el drogadicto con una elevación de la actividad motora en la búsqueda y preparación del consumo11. La segunda etapa se caracteriza por la aparición de signos y síntomas que conforman el síndrome de abstinencia y señalan la etapa de dependencia. Por último, la tercera etapa caracterizada por el deseo imperioso de consumir la droga (craving) y las recaídas.
La Dopamina y el Reforzamiento
La primera etapa de la drogadicción está vinculada a los efectos reforzadores (placer) de la droga. Se define como reforzador positivo a todo estímulo que provoque la repetición de la conducta para conseguir el reforzador. En esta categoría caen todas las drogas de adicción que se comportan como reforzadores positivos, al menos en etapas iniciales. Uno de los sistemas neurales involucrados en el placer o reforzamiento positivo es el dopaminérgico mesolímbico12-15. Está constituido por neuronas productoras de dopamina ubicadas en el área ventrotegmental del mesencéfalo que se proyectan a la porción ventral del estriado, un área de gran importancia en el cerebro, que se considera la interfase entre el sistema límbico y el sistema motor, denominado núcleo accumbens16. Todas las drogas de adicción (con excepción de las benzodiazepinas) incrementan la liberación de dopamina en el accumbens17-24. Y al contrario, la inyección local de antagonistas dopaminérgicos disminuyen el consumo de la droga20, 25-27. Estos resultados confirman la importancia del sistema dopaminérgico en la adicción.
¿Qué diferencias hay entre las conductas naturales y la drogadicción?
La elevación de la dopamina, como evento neuroquímico primordial en el reforzamiento producido por las drogas de adicción, también ocurre con las conductas naturales. El comer, beber y apareamiento elevan los niveles de dopamina en el núcleo accumbens, e igualmente podemos suprimir estas conductas al suministrar localmente antagonistas dopaminérgicos19, 28. Entonces, la pregunta a hacerse es ¿cuál es la diferencia entre las conductas naturales no adictivas y las drogas de adicción? Una diferencia es que, al menos en el comer, un sabor agradable libera dopamina en una primera prueba, pero no en subsiguientes pruebas, a pesar de que el animal come y es evidente que le gusta29-33. Estos experimentos por DiChiara y colaboradores abrieron el debate sobre la función específica de la dopamina en el núcleo accumbens. Ellos sugieren que la dopamina funciona en la detección de algo novedoso y promueve la repetición de la conducta a través de otros sistemas neurales. Las drogas de adicción, a diferencia de las comidas, liberan siempre cantidades significativas de dopamina cada vez que se usan34.
Mecanismos Colinérgicos de la Saciedad
Otra diferencia entre la drogadicción y las conductas naturales es que estas últimas poseen saciedad. Este hecho nos planteó hace varios años la necesidad de estudiar cual sería el neurotransmisor involucrado en este proceso, ¿acaso sería la misma dopamina o un sistema aparte? Partiendo de que el núcleo accumbens es un área cerebral importante en los mecanismos de reforzamiento y que este núcleo es realmente la porción ventral del estriado, cabía preguntarse si existía, como sucede en el funcionamiento motor, un sistema colinérgico que antagoniza la función de la dopamina. Debe recordarse que la enfermedad de Parkinson se produce por lesión de las neuronas dopaminérgicas en la sustancia negra que lleva a varios eventos negativos como son la bradiquinesia y la rigidez. Ambas son tratadas con drogas anticolinérgicas, lo cual nos hizo sospechar que una disminución de la dopamina está asociada a una elevación de la acetilcolina y que este último neurotransmisor puede antagonizar el efecto límbico de la dopamina en el núcleo accumbens. Esta hipótesis parece ser cierta para las conductas naturales. En experimentos, demostramos que la ingesta de una comida eleva los niveles de acetilcolina en el núcleo accumbens, pero esta elevación ocurre hacia el final de la comida, cuando el animal dejaba de comer, lo que sugiere que esta sustancia química podría estar involucrada en señalar la saciedad28. Otros experimentos realizados posteriormente demostraron que la inyección de péptidos, como la colecistoquinina, que inyectados en el núcleo paraventricular del hipotálamo inducen estados de saciedad en ratas hambrientas, provocaban elevaciones significativas 3 Adicción al azúcar: ¿mito o realidad? en los niveles de acetilcolina en el núcleo accumbens35. Finalmente, la inyección de antagonistas muscarínicos en el núcleo accumbens favorecen el comer, retardando el momento de la saciedad, mientras que la inyección de agonistas hacen que animales hambrientos se sientan saciados (comunicación personal).
Para confirmar la hipótesis de si una elevación de la acetilcolina estaba involucrada en la aparición de la saciedad decidimos estudiar otra conducta natural, en este caso escogimos la conducta sexual, reconociendo que en el macho una vez producida la eyaculación se produce un período refractario, en el cual el macho evita cualquier contacto con la hembra en celo. En este modelo medimos los niveles de acetilcolina en los diferentes períodos del apareamiento y observamos que los niveles de acetilcolina solo se elevaron significativamente en el período refractario de la rata macho, lo que refuerza la posible función del sistema colinérgico en el núcleo accumbens como señal de saciedad (Hoebel, B. G., Armendáriz, K and Rada, P. en preparación).
El Balance entre la Dopamina/Acetilcolina en el Núcleo Accumbens durante la Aversión
Los estados de saciedad son estados placenteros aunque se detiene la conducta. Esto ocurre por una elevación de la dopamina en el núcleo accumbens que promueve la conducta, simultáneamente hay elevación tardía de la acetilcolina que sirve para frenar la conducta. Eso nos llevó a preguntar de que manera funcionaría este sistema dual (dopamina/ acetilcolina) en respuestas aversivas o desagradables. Como modelo animal inicial estudiamos el condicionamiento aversivo al sabor. Normalmente la rata toma grandes cantidades de kool aid, pero aprende a evitarlo, si la ingesta está asociada a un estímulo desagradable (en este caso cloruro de litio que le produce cólicos y malestar general). Al obligarla a tomar la bebida que previamente se asoció al litio, los niveles de acetilcolina se elevan significativamente en el núcleo accumbens, mientras que los de dopamina disminuyen, lo que sugiere que la elevación de acetilcolina asociado a una disminución de la dopamina en el núcleo accumbens señalan un estado desagradable36. Es más, la administración de un agonista colinérgico en el núcleo accumbens es suficiente para inducir un condicionamiento aversivo37.
Uno de los eventos más desagradables y aversivos que existen es el síndrome de abstinencia de las diferentes drogas de adicción. ¿Se repetirá la respuesta opuesta entre los neurotransmisores dopamina y acetilcolina en el núcleo accumbens durante el síndrome de abstinencia? Efectivamente, este fenómeno se verificó en la abstinencia de la morfina, nicotina, diazepam y etanol23, 38-41, confirmando la hipótesis de que un desbalance entre la dopamina y acetilcolina en el núcleo accumbens es un signo neuroquímico de un estado desagradable, posiblemente aversivo.
Asociacion entre la conducta alimentaria y las drogas
No es extraño pensar que pueda existir la adicción a un alimento natural. Existe una estrecha relación entre la conducta alimentaria y la drogadicción. La mayoría de las drogas de adicción actúan como anoréxicos y una disminución de la ingesta alimentaria mejora el placer producido por las drogas42, 43. Igualmente, las enfermedades de la conducta alimentaria (anorexia, bulimia) predisponen a una mayor probabilidad de ser drogadicto44. Más aún, los pacientes adictos, al entrar a etapas de abstinencia, consumen altas cantidades de azúcar para aliviar este estado desagradable45, 46. También se sabe que el consumo de comidas gustosas, especialmente dulces, liberan grandes cantidades de opioides endógenos47-49. Tanto es así que la ingesta de dulces actúa como analgésico en modelos animales50, 51. Debemos también recordar que popularmente cuando un niño se golpea, el dolor es calmado con la ingesta de dulces y este efecto se debe a la liberación de opioides endógenos. Como puede verse no es descabellado pensar en la existencia de una adicción al azúcar.
Primera etapa de la adicción al azúcar en un modelo animal
Atracón
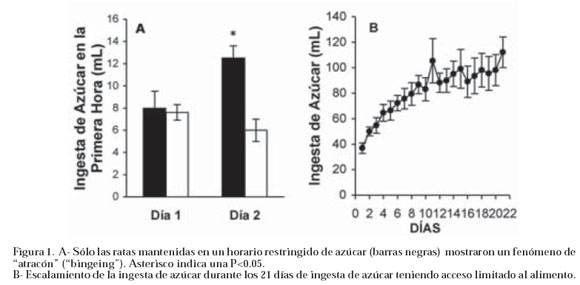
La primera pregunta que nos hicimos fue como administrar el azúcar, y vimos que la mejor manera era disolviéndola en agua a una concentración similar a la que se encuentra en nuestras bebidas gaseosas, una solución de sucrosa al 10%. Luego se nos planteó una segunda interrogante, ¿que horario sería el mejor? Podíamos darlo libremente (ad libitum) o hacerlo de manera restringida. Sabemos que en los modelos animales de alcoholismo, adicción a la cocaína y otras drogas, la adicción se consigue más fácil si a los animales se les restringe el horario. El acceso limitado a las drogas, hace que cuando la tienen, la consumen en grandes cantidades (atracón), lo que aumenta significativamente los niveles de dopamina y parece que este efecto contribuye a la adicción52. Ciertamente, los drogadictos no tienen disponibilidad permanente de la droga y el abuso es de manera restringida. Así que en un experimento inicial probamos diferentes horarios y luego medimos el consumo durante la primera hora de consumo. Se pudo demostrar que si se restringía la comida y azúcar a 12 horas al día, dándole acceso a la comida y azúcar 4 horas después de apagarse la luz (comienzo del período de actividad en las ratas), como si perdieran el desayuno, durante 28 días producía una ingesta grande (>10% de la ingesta total del día) la primera hora de acceso, similar al atracón que se observa con las drogas de adicción y que definen el bingeing (ver figura 1A), parte importante de la primera fase de la drogadicción21.
Escalamiento
A continuación, usando el modelo de 12 horas de acceso restringido de azúcar al 10%, medimos el consumo diario de la solución para ver si se producía el escalamiento. Al igual que las drogas de adicción, se produjo un aumento progresivo de la ingesta, de 20 mL/día de azúcar el primer día hasta superar los 100 mL/día durante el día 28, alcanzando un máximo a los 11 días de iniciado el experimento (ver figura 1B). El escalamiento del consumo de la bebida azucarada no se debe a neofobia (los animales ante la presencia de un sabor agradable sólo prueban una pequeña cantidad para asegurarse que no se enferman) por que vemos como en nuestros experimentos la ingesta se incrementó progresivamente hasta el día 11, cuando llega a un límite, seguramente establecido por la capacidad gástrica21. Si se tratase de neofobia, el incremento de la ingesta de azúcar alcanzaría un máximo en el segundo ó tercer día.
Sensibilización conductual
Ya con los experimentos de los párrafos anteriores había elementos semejantes al observado con el consumo de drogas de adicción, sin embargo faltaba el elemento de sensibilización para demostrar que el azúcar al igual que otras drogas de adicción cumplía con los parámetros de la primera etapa. La sensibilización es el aumento o exageración de algunas conductas, especialmente motoras y está asociado al aumento de la administración de la droga y a la drogadicción. En modelos animales se observa un aumento significativo de la actividad motora que progresa a medida que el animal se hace cada vez más adicto a la sustancia. Animales que han sido sensibilizados a una droga también muestran sensibilización cruzada. Esto significa que un animal sensibilizado con cocaína, aumentará su actividad locomotora al ser inyectado con otra droga de adicción. En este momento decidimos ver si el azúcar sensibilizaba de manera similar a las otras drogas de adicción. En un experimento pudimos ver que las ratas hechas adictas al azúcar al inyectarle anfetamina mostraban hiperactividad como si hubiesen sido inyectadas con anfetamina los días previos, cuando lo que recibieron fue azúcar, y al contrario, ratas sensibilizadas con anfetamina al darles acceso al azúcar (si eran adictas al azúcar) aumentaban la actividad motora como si el azúcar hubiese suplantado a la anfetamina. Estos resultados confirmaron el fenómeno de sensibilización cruzada con el azúcar53, 54 y agrega más evidencias a favor de la adicción.
Sensibilización de receptores dopaminérgicos y opioides en el accumbens
Hay estudios que demuestran que la sensibilización se produce por cambios en diferentes receptores y en áreas específicas del cerebro21. Es por eso que decidimos ver si las ratas hechas adictas al azúcar presentaban cambios a nivel de receptores en núcleos cerebrales del sistema límbico. Específicamente utilizamos la técnica de autoradiografía para medir los cambios en los receptores opioides mu y dopaminérgicos en el núcleo accumbens, área ventro-tegmental, caudado, corteza frontal, tálamo; sólo se observaron cambios en los receptores dopaminérgicos y opioides mu en el núcleo accumbens, similares a los obtenidos durante la adicción a la cocaína. Estos resultados confirman que la sensibilización al azúcar observada en los experimentos conductuales tiene una base molecular semejante a la observada en otras adicciones55, 56.
Liberación de la dopamina en ratas adictas al azúcar
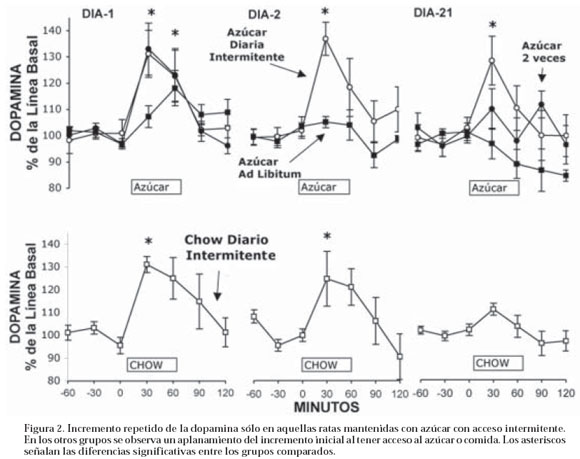
Desde el punto de vista neuroquímico, estudiamos el efecto de la ingesta de azúcar en ratas adictas al azúcar comparadas con ratas que tuvieron sólo dos exposiciones al azúcar. En primer lugar, replicamos los experimentos realizados por el grupo de DiChiara quienes consiguieron que la exposición repetida de un alimento gustoso para el animal sólo libera dopamina en la primera exposición y no en las subsiguientes exposiciones30, 32. Efectivamente, las ratas a las que se les permitió acceso al azúcar en 2 oportunidades mostraron un incremento significativo de la dopamina en el núcleo accumbens solo en la primera prueba, pero no así en las siguientes, en cambio las ratas hechas adictas al azúcar mostraron un reiterado incremento durante varias pruebas, similar a la respuesta obtenida con la inyección de las drogas de adicción (ver figura 2). Estos resultados sugieren que el sistema
dopaminérgico cambia, al someter al animal a horarios de restricción del alimento y que la dopamina parece constituir un elemento fundamental en la búsqueda de la droga (azúcar)57. Todos los experimentos hasta ahora citados, demuestran que las ratas expuestas a azúcar en un horario restringido presentan cambios conductuales y neuroquímicos semejantes a los observados en otras drogas durante la primera etapa de la adicción.
Segunda etapa de la adicción: dependencia
La segunda etapa consistía en demostrar que las ratas adictas al azúcar eran dependientes de la sustancia. Por experiencia propia sabemos que las ratas hechas dependientes a la morfina, un agonista exógeno del sistema opioide, se les puede inducir un síndrome de abstinencia al ser inyectadas con el antagonista específico, la naloxona38, 39. El síndrome de abstinencia consiste en la aparición de sacudidas como perro mojado (wet dog shakes), piloerección, castañeteo de los dientes (teeth chattering), acicalamiento y diarrea. Sabiendo que el azúcar comparte su efecto analgésico mediante activación del sistema opioide endógeno nos hizo sospechar que el probable mecanismo mediante el cual el azúcar puede causar adicción es activando este sistema, por este motivo decidimos inyectarles naloxona, un antagonista opioide específico para los receptores mu, a ratas adictas al azúcar y observar los cambios conductuales y neuroquímicos para ver si se producía un síndrome de abstinencia similar al producido en ratas adictas a la morfina. Los grupos controles no mostraron cambio alguno, sin embargo las ratas con acceso limitado al azúcar mostraron signos de un síndrome de abstinencia opioide con la aparición de castañeteo de los dientes, piloerección, sacudidas como perro mojado, aunque de menor magnitud al observado en ratas adictas a la morfina (ver figura 3A)58 confirmando la hipótesis inicial del azúcar actuando a través del sistema opioide para provocar la adicción.
Incremento de la ansiedad durante la abstinencia
El síndrome de abstinencia inducido por la inyección de naloxona en ratas adictas a la morfina provoca también un estado de gran ansiedad. El grado de ansiedad en animales de experimentación puede medirse utilizando la técnica del laberinto cruzado de más (plus-maze), que consiste en un laberinto construido como el símbolo +, con dos de las alas cubiertas por paredes y las otras dos alas opuestas sin paredes. El laberinto se coloca a 1,20 metros de altura y el animal es colocado en el medio del símbolo y se cuenta el tiempo que la rata pasa en cada una de las alas. Normalmente las ratas son muy curiosas y exploran sin mucho temor las alas con pared y sin pared, sin embargo las ratas ansiosas se limitan a las alas con pared. En el caso de las ratas adictas al azúcar se pudo ver como al inyectarlas con naloxona se arriesgaban muy poco a explorar los brazos sin pared, similar a las adictas a la morfina, confirmando la aparición de un síndrome de abstinencia y que este depende de una dependencia a los opioides endógenos (ver figura 3B)58.
Signos neuroquímicos de la abstinencia
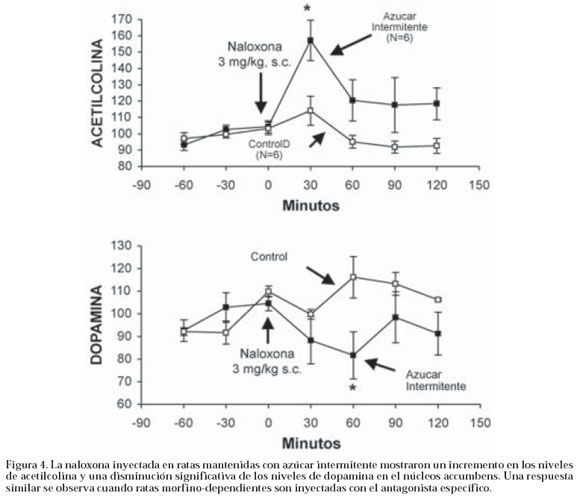
A un grupo separado de ratas también hechas adictas al azúcar se les midió los niveles de dopamina y acetilcolina en el núcleo accumbens después de inyectarles naloxona, las ratas adictas al azúcar mostraron un incremento significativo en los niveles extracelulares de acetilcolina y una disminución simultánea de la dopamina58. Estos cambios neuroquímicos que señalan un estado aversivo son iguales a los observados en ratas adictas a la morfina, lo que confirma que la ingesta de azúcar activa al sistema opioide endógeno y crea un estado similar al de dependencia de la morfina (ver figura 4). Esto significa que las ratas con una dieta que incluye una solución de azúcar semejante a la existente en las bebidas gaseosas y con acceso limitado a la misma, presentan signos conductuales y neuroquímicos sugestivos de una dependencia opioide.
Tercera etapa de la adicción: el deseo por la droga
La tercera etapa que debemos demostrar para poder hablar de adicción al azúcar es el aumento del deseo por la droga (craving), ese deseo imperioso por consumirla, que forma parte importante de la drogadicción. Necesitamos entrar, aunque superficialmente, en el área de la psicología. Una conducta operante es una forma de aprendizaje por asociación en la que se le enseña a un animal a asociar la presión sobre una palanca con la aparición de un reforzador (comida, agua, etc.). Se establece una asociación entre bajar la palanca con la aparición del reforzador y repite la conducta para obtenerlo. El fenómeno de extinción se refiere a la disminución y eventual desaparición de la conducta cuando el animal presiona la palanca y deja de aparecer el reforzador. El número de veces que el animal presione la palanca sin recibir el reforzador (extinción) nos da una idea del deseo imperioso por la droga. En experimentos realizados por otros autores se ha visto que animales adictos presentan gran resistencia a la extinción. En el caso de las ratas adictas al azúcar se observó una mayor resistencia a la extinción que las ratas control sugiriendo que existe el deseo por el azúcar (droga) y corrobora que el acceso al azúcar en horarios restringidos puede determinar cambios conductuales similares a las drogas de adicción (Avena, N. Comunicación personal).
Nos faltaría demostrar el efecto de la recaída como parte de la tercera etapa de la adicción. Normalmente un adicto que ha dejado de consumir la droga, sin saber por qué, y sin existir una causa específica (puede ser una memoria, el observar en el cine o TV a alguien inyectándose, consumo de alcohol en una fiesta) recae y, por lo general, lo hace con mayor intensidad. Un fenómeno similar se ha observado en modelos animales de adicción, especialmente en ratas alcohólicas privadas de alcohol por 3 semanas, cuando se le da acceso al alcohol, toman casi el doble de lo que tomaban cuando se les retiro el alcohol59, 60. Este fenómeno se denomina efecto de privación y aun no se ha demostrado en las ratas adictas al azúcar61.
Conclusión
No es de extrañar que las conductas naturales (comer) y las drogas de adicción probablemente comparten los mismos sistemas neurales12, 13. La búsqueda de alimentos nutritivos en tiempos de escasez como los de la prehistoria, debieron establecer mecanismos de adicción pues al hallarlos el consumo era máximo, lo que permitió la sobrevivencia en períodos prolongados de inanición. Estos mecanismos de adicción no sólo son útiles en la conducta alimentaria, se observa que el consumo de cocaína por los indígenas de los Andes, al igual que la cafeína por los trabajadores nocturnos, son también necesarios para la sobrevivencia, ya que mejora el rendimiento físico en dos situaciones difíciles.
En lo que respecta a la heroína, marihuana y alcohol es difícil explicar su consumo y abuso excepto como una aberración farmacológica. Sin embargo, uno puede suponer que el sistema opioide se activa normalmente con la comida, y el comer evolucionó como una adicción. Hay evidencia experimental que apoya esta hipótesis. La literatura científica demuestra que los dulces y la morfina prolongan el tiempo de una comida y este efecto se bloquea con naloxona45,47,48. Ingerir comidas gustosas, especialmente dulces, actúan como analgésicos mediante la liberación de opioides endógenos. Aún mas, la pérdida de peso (dietas) sensibiliza a los receptores opioides y aumenta la ingesta de comida inducida por opioides45, 47, esto en parte explica el efecto de rebote que se observa en los pacientes que comienzan dietas estrictas para perder peso. Le Magnen observó signos de abstinencia opiácea en animales mantenidos en una dieta de cafeteria62, sin embargo estos investigadores no continuaron los experimentos para demostrar la existencia de adicción. No es extraño entonces que si un animal de experimentación es colocado en períodos de acceso limitado al azúcar, se observen elementos conductuales y neuroquímicos suficientes para hablar de adicción al azúcar. Como vimos en los experimentos expuestos en esta revisión, el azúcar actúa de manera semejante a como lo hacen las droga de adicción, y pudieran explicar, al menos parcialmente, ciertas enfermedades de la conducta alimentaria (anorexia, bulimia y obesidad), las cuales se comportan como una alteración en los sistemas de reforzamiento similar al observado en la drogadicción.
Referencias Bibliografícas
1. Brink S. Eat this now! How savvy marketing is contributing to the nations obesity epidemic. US News World Rep 2005; 138: 56-58. [ Links ]
2. Daubressse JC, Cadiere GB,Sternon J. Obesity in adult patients: check up and treatment. Rev. Med. Brux. 2005; 26: 33-42. [ Links ]
3. (CDC). Racial/ethnic and socioeconomic disparities in multiple risk factors for heart disease and stroke United States 2003. Morb Mortal Wkly Rep 2005; 54: 113-117. [ Links ]
4. Gupta R, Sarna M, Thanvi J, Rastogi P, Kaul V,Gupta V. High prevalence of multiple coronary risk factors in Punjabi Bhalia community. Inidian Heart J. 2004; 56: 646-652. [ Links ]
5. Ruland S, Hung E, Richardson D, Nisra S,Gorelick PB. Impact of obesity and the metabolic syndrome on risk factors in African American stroke survivors: a report from the AAASPS. Arch. Neurol. 2005; 62: 386-390. [ Links ]
6. Morabia A,Costanza MC. The obesity epidemic as harbinger of a metabolic disorder epidemic: trends in overweight, hypercholesterolemia, and diabetes treatment in Geneva, Switzerland, 1993-2003. Am. J. Public Health 2005; 95: 632-635. [ Links ]
7. Stumvoll M, Goldstein BJ,van Theften TW. Type-2 diabetes: principles of pathogenesis and therapy. Lancet 2005; 365: 1333-1346. [ Links ]
8. Berke JD,Hyman SE. Addiction, dopamine, and the molecular mechanisms of memory. Neuron 2000; 25: 515-532. [ Links ]
9. Koob GF, Ahmed SH, Boutrel B, Chen SA, Kenny PJ, Markou A, ODell LE, Parsons LH,Sanna PP. Neurobiological mechanisms in the transition from drug use to drug dependence. Neuroscience and Biobehavioral Reviews 2004; 27: 739-749. [ Links ]
10. Melichar JK, Daglish MRC,Nutt DJ. Addiction and withdrawal- current views. Current Opinion in Pharmacology 2001; 1: 84-90. [ Links ]
11. Kalivas PW, Sorg BA,Hooks MS. The pharmacology and neural circuitry of sensitization to psychostimulants. Behav. Pharmacol. 1993; 4: 315-334. [ Links ]
12. Hoebel BG. Neuroscience and Motivation: pathways and peptides that define motivation. En: R. Atkinson, R. J. Hermstein, G. Lindzey,R. D. Luce Stevens Handbook of Experimental Psychology. Wiley and Sons, 1988: 547-625. [ Links ]
13. Hoebel BG, Rada P, Mark GP,Pothos E. Neural systems for reinforcement and inhibition of behavior: relevance to eating, addiction, and depression. En: D. Kahneman, E. Diener,N. Schwartz Well-Being: the Foundations of Hedonic Psychology. Russell Sage Foundation, 1999: 558-572. [ Links ]
14. Wise RA. Drug-activation of brain reward pathways. Drug Alcohol and Dependence 1998; 51: 13-22. [ Links ]
15. Wise RA. Dopamine, learning and motivation. Nat. Rev. Neurosci. 2004; 5: 483-494. [ Links ]
16. Mogenson GJ, Jones DL,Yim CY. From motivation to action: fundamental interface between the limbic system and the motor system. Progress in Neurobiology 1980; 14: 69-97. [ Links ]
17. Di Chiara G,Imperato A. Drugs abused by humans preferentially increase synaptic dopamine concentrations in the mesolimbic system of freely moving rats. Proc. Natl. Acad. Sci. U. S. A. 1988; 85: 5274-5278. [ Links ]
18. Hernandez L, Lee F,Hoebel BG. Simultaneous microdialysis and amphetamine infusion in the nucleus accumbens and striatum of freely moving rats: increase in extracellular dopamine and serotonin. Brain Res. Bull. 1987;
19: 623-628. 19. Hernandez L,Hoebel BG. Food reward and cocaine increase extracellular dopamine in the nucleus accumbens as measured by microdialysis. Life Sci. 1988; 42: 705-712. [ Links ]
20. Ikemoto S, Glazier BS, Murphy JM,McBride WJ. Role of dopamine D1 and D2 receptors in the nucleus accumbens in mediating reward. J. Neurosci. 1997; 17: 8580-8587. [ Links ]
21. Colantuoni C, Schwenker J, McCarthy J, Rada P, Ladenheim B, Cadet JL, Schwartz GJ, Moran TH,Hoebel BG. Excessive sugar intake alters binding to dopamine and mu-opioid receptors in the brain. Neuroreport 2001; 12: 3549-52. [ Links ]
22. Pothos E, Rada P, Mark GP,Hoebel BG. Dopamine microdialysis in the nucleus accumbens during acute and chronic morphine, naloxone-precipitated withdrawal and clonidine treatment. Brain Res. 1991; 566: 348-350. [ Links ]
23. Rada P,Hoebel BG. Acetylcholine in the accumbens is decreased by diazepam and increased by benzodiazepine withdrawal: a possible mechanism for dependency. Eur J Pharmacol 2005; 508: 131-138. [ Links ]
24. Rada P, Mark GP, Pothos E,Hoebel BG. Systemic morphine simultaneously decreases extracellular acetylcholine and increases dopamine in the nucleus accumbens of freely moving rats. Neuropharmacology 1991; 30: 1133-6. [ Links ]
25. Petit HO,Justice JB. Dopamine in the nucleus accumbens during cocaine self-administration as studied by in vivo microdialysis. Pharmacol. Biochem. Behav. 1989; 34: 899-904. [ Links ]
26. Phillips GD, Robbins TW,Everitt BJ. Bilateral intraaccumbens self-administration of d-amphetamine: antagonism with intra-accumbens SCH 23390 and sulpiride. Psychopharmacology 1994; 114: 477-485. [ Links ]
27. Samson HH, Hodge CW, Tolliver GA,Haraguchi M. Effects of dopamine agonists and antagonists on ethanol- reinforced behavior. Brain Res Bull 1993; 30: 133- 141. [ Links ]
28. Mark GP, Rada PV, Pothos E,Hoebel BG. Effects of feeding and drinking on acetylcholine release in the nucleus accumbens, striatum and hippocampus of freely behaving rats. J. Neurochem. 1992; 58: 2269-2274. [ Links ]
29. Bassareo V,Di Chiara G. Differential influence of associative and nonassociative learning mechanisms on the responsiveness of prefrontal and accumbal dopamine transmission to food stimuli in rats fed ad libitum. The Journal of Neuroscience 1997; 17: 651-661. [ Links ]
30. Bassareo V,Di Chiara G. Modulation of feeding-induced activation of mesolimbic dopamine transmission by appetitive stimuli and its relation to motivational state. Eur J Neurosci 1999; 11: 4389-4397. [ Links ]
31. Bassareo V,Di Chiara G. Differential responsiveness of dopamine transmission to food-stimuli in nucleus accumbens shell/core compartments. Neuroscience 1999; 89: 637-641. [ Links ]
32. Di Chiara G,Tanda G. Blunting of reactivity of dopam- ine transmission to palatable food: a biochemical marker of anhedonia in the CMS model? Psychopharmacology 1997; 134: 351-3; discussion 371-7. [ Links ]
33. Di Chiara G. Nucleus accumbens shell and core dopamine: differential role in behavior and addiction. Behav Brain Res 2002; 137: 75-114. [ Links ]
34. Carboni E, Imperato A, Perezzani L,DiChiara G. Amphetamine, cocaine, phencyclidine and nomifensin increase extracellular dopamine concentrations preferentially in the nucleus accumbens of freely moving rats. Neuroscience 1989; 28: 653-661. [ Links ]
35. Helm KA, Rada P,Hoebel BG. Cholecystokinin combined with serotonin in the hypothalamus limits accumbens dopamine release while increasing acetylcholine: a possible satiation mechanism. Brain Res 2003; 963: 290-7. [ Links ]
36. Mark GP, Weinberg JB, Rada PV,Hoebel BG. Extracellular acetylcholine is increased in the nucleus accumbens following the presentation of an aversively conditioned taste stimulus. Brain Res 1995; 688: 184-8. [ Links ]
37. Taylor KM, Davidson K, Mark GP, Rada P,Hoebel BG. Conditioned taste aversion induced by increase acetylcholine in the nucleus accumbens. Soc Neurosci Abstr 1992; 18: 1066. [ Links ]
38. Rada P, Pothos E, Mark GP,Hoebel BG. Microdialysis evidence that acetylcholine in the nucleus accumbens is involved in morphine withdrawal and its treatment with clonidine. Brain Res 1991; 561: 354-356. [ Links ]
39. Rada PV, Mark GP, Taylor KM,Hoebel BG. Morphine and naloxone, i.p. or locally, affect extracellular acetylcholine in the accumbens and prefrontal cortex. Pharmacol Biochem Behav 1996; 53: 809-16. [ Links ]
40. Rada P, Jensen K,Hoebel BG. Effects of nicotine and mecamylamine-induced withdrawal on extracellular dopamine and acetylcholine in the rat nucleus accumbens. Psychopharmacology 2001; 157: 105-110. [ Links ]
41. Rada P, Johnson DF, Lewis MJ,Hoebel BG. In alcoholtreated rats, naloxone decreases extracellular dopamine and increases acetylcholine in the nucleus accumbens: evidence of opioid withdrawal. Pharmacol Biochem Behav 2004; 79: 599-605. [ Links ]
42. Pothos E, Creese I,Hoebel BG. Restructureed eating with weight loss selectively decreases extracellular dopamine in the nucleus accumbens and alters dopamine response to amphetamine, morphine, and food intake. J. Neurosci. 1995; 15: 6640-6650. [ Links ]
43. Carroll ME, France CP,Meisch RA. Food deprivation increases oral and intravenous drug intake in rats. Science 1979; 205: 319-321. [ Links ]
44. Brewerton TD, Lydiard RB, Herzog DB, Brotman AW, ONeil PM,Ballenger JC. Comorbidity of axis I psychiatric disorders in bulimia nervosa. J. Clin. Psychiatry 1995; 56: 77-80. [ Links ]
45. Jain R, Mukherjee K,Singh R. Influence of sweet tasting solution on opioid withdrawal. Brain Res. Bull. 2004; 64: 319-322. [ Links ]
46. Specker SM, Lac ST,Carroll ME. Food deprivation history and cocaine self-administration: an animal model of binge eating. Pharmacol Biochem Behav 1994; 48: 1025-9. [ Links ]
47. Glass MJ, Billington CJ,Levine AS. Opioids, food reward, and macrobutrient selection. En: H. R. Berthoud,R. J. Seeley Neural and Metabolic Control of Macronutrient Intake. CRC Press, 2000: [ Links ]
48. Ragnouth A, Moroz M,Bodner RJ. Multiple opioid receptors mediate feeding elicited by mu and delta opioid receptors subtype agonists in the nucleus accumbens shell in rats. Brain Res 2000; 876: 76-87. [ Links ]
49. Sclafani A, Anavich PF,Xenakis S. Dopaminergic and endorphinergic mediation of a sweet reward. En: B. G. Hoebel,D. Novin The Neural Basis of Feeding and Reward. Haer Institute, 1982: 507-515. [ Links ]
50. Kanarek RB, White ES, Biegen MT,Merks-Kaufman R. Dietary inlfuence on morphine-induced analgesia in rats. Pharmacol. Biochem. Behav. 1991; 38: 681-684. [ Links ]
51. Blass EM,Hoffmeyer LB. Sucrose as an analgesic in newborn infants. Pediatrics 1991; 87: 215-218. [ Links ]
52. Koob GF,Le Moal M. Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology 2001; 24: 97-129. [ Links ]
53. Avena NM,Hoebel BG. A diet promoting sugar dependency causes behavioral cross-sensitization to a low dose of amphetamine. Neuroscience 2003; in press: [ Links ]
54. Avena NM,Hoebel BG. Amphetamine-sensitized rats show sugar-induced hyperactivity (cross-sensitization) and sugar hyperphagia. Pharmacol Biochem Behav 2003; 74: 635-639. [ Links ]
55. Vanderschuren LJ,Kalivas PW. Alteration in dopaminergic and glutamatergic transmission in the induction and expression of behavioral sensitization: a critical review of preclinical studies. Psychopharmacology 2000; 151: 99-120. [ Links ]
56. Unterwald EM, Kreek MJ,Cuntapay M. The frequency of cocaine administration impacts cocaine-induced receptor alterations. Brain Res 2001; 900: 103-109. [ Links ]
57. Rada P, Avena NM,Hoebel BG. Daily bingeing on sugar repeatedly releases dopamine in the accumbens shell. Neuroscience 2005; In Press: [ Links ]
58. Colantuoni C, Rada P, McCarthy J, Patten C, Avena NM, Chadeayne A,Hoebel BG. Evidence that intermittent, excessive sugar intake causes endogenous opioid dependence. Obes Res 2002; 10: 478-88. [ Links ]
59. Le AD,Shaham Y. Neurobiology of relapse to alcohol in rats. Pharmacology & Therapeutics 2002; 94: 137- 156. [ Links ]
60. Potgeiter AS, Deckers F,Geerlings P. Craving and relapse measurement in alcoholism. Alcohol & Alcoholism 1999; 34: 254-260. Pedro Rada y cols [ Links ]
61. Avena NM, Long K,Hoebel BG. Sugar-dependent rats show enhanced responding for sugar after abstinence: evidence of a sugar deprivation effect. Physiol. Behav. 2005; 84: 359-362. [ Links ]
62. Le Magnen J. A role for opiates in food reward and food addiction. En: E. D. Capaldi,T. L. Powley Taste, Experience, and Feeding. American Psychological Association, 1990: 241-254. [ Links ]