Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. v.9 n.9 Mérida abr. 2011
Respuesta de insulina a la carga oral de glucosa en niños y adolescentes con sobrepeso y obesidad
Joalice Villalobos , Loida Gáffaro de Valera , Matilde García de Blanco , Nora Maulino , Gisela Merino , Marvelys Pérez , Marisol Bolívar .
Servicio de Endocrinología del Hospital de Niños "J. M. de Los Ríos" Caracas, Venezuela.
Dirigir correspondencia a: Dra. Joalice del Carmen Villalobos Robles.joalice@cantv.net
RESUMEN
Objetivos: : Evaluar la respuesta de insulina a la carga oral de glucosa en niños y adolescentes con sobrepeso y obesidad. Métodos: Se seleccionaron 220 niños y adolescentes, que consultaron por síntomas inespecíficos de hipoglucemia o exceso de peso en el Servicio de Endocrinología del Hospital JM de Los Ríos, Caracas, Venezuela. Hipoglucemia y/o alteración del metabolismo de los carbohidratos fueron descartadas. La muestra estudiada se categorizó en cuatro grupos de acuerdo al estadio puberal e índice de masa corporal (IMC): Grupo A: prepuberales (Tanner I), IMC < P90); Grupo B: adolescentes (Tanner II-V), IMC < percentil 90; Grupo C: prepuberales (Tanner I), IMC > P90; Grupo D: adolescentes (Tanner II-V), IMC > P90. Glucosa e insulina plasmática se cuantificaron en condiciones basales y a los 30, 60 y 120 minutos posterior a una carga oral de glucosa (1,75 g/kg). Resultados: Respecto al estadío puberal, la insulinemia basal fue significativamente más alta en los adolescentes y en los grupos con exceso de peso. La respuesta máxima de secreción de insulina se observó a los 30 minutos post carga de glucosa en todos los grupos con incrementos relacionados con el IMC y estadío puberal, con valores máximos en el grupo de adolescentes con exceso de peso (p<0,01). No se encontraron diferencias significativas en relación a la historia familiar de diabetes. Conclusiones: Nuestros resultados sugieren que la prueba de tolerancia oral a la glucosa puede ser de utilidad en los niños y adolescentes con exceso de peso para la evaluación de su riesgo metabólico e iniciar las estrategias de prevención primaria a futuro.
Palabras clave: Prueba de tolerancia oral a glucosa, insulinemia, niño, adolescente.
ABSTRACT
Objectives: To evaluate the insulin response to an oral glucose load in children and adolescents with overweight and obesity. Methods: Two-hundred subjects attending the out-patient endocrinology clinic of the Hospital JM de Los Ríos, Caracas, Venezuela, with unspecific symptoms of hypoglycemia or body weight excess were selected. Hypoglycemia and/or carbohydrate metabolism abnormalities were ruled out. Subjects were categorized according pubertal stage and body mass index (BMI); Group A: pre-pubertal: (Tanner I), BMI <P90); Group B: adolescents (Tanner II-V), BMI <P90; Group C: pre-pubertal (Tanner I), BMI >P90; Group D: adolescents (Tanner II-V), BMI> P90. Plasma glucose and insulin were measured at baseline and 30, 60 and 120 minutes after oral glucose load (1.75 g/kg). Results: Basal insulin was significantly higher in adolescents and groups with abnormal body weight, compared with pre pubertal and normal weight respectively. All groups showed a peak insulin response at 30 min post oral glucose load; the insulin response was higher as BMI and pubertal stage increased with the highest values in adolescents and body weight excess (p<0,01). No significant differences were observed according diabetes mellitus family history. Conclusions: Our results suggest that oral glucose tolerance test might be useful in children and adolescents with body weight excess in order to identify the subjects at risk of metabolic disorders leading to improve prevention strategies in this young population.
Key words: Oral glucose tolerance test, insulin values, overweight, children, adolescents.
Artículo recibido en: Abril 2009. Aceptado para publicación en: Junio 2010.
INTRODUCCIÓN
La resistencia a la insulina es una condición en la cual, por diferentes factores, existe una menor respuesta tisular a la insulina, con el consiguiente aumento compensatorio de sus concentraciones séricas. En la actualidad, se considera a la resistencia a la insulina como base fisiopatológica de enfermedades como la diabetes mellitus, hipertensión arterial y obesidad central1-3.
La prevalencia de diabetes mellitus tipo 2 en niños y adolescentes se ha incrementado de la misma manera como lo ha hecho la obesidad4. En Venezuela, según los datos de Landaeta-Jimenez y cols5, el sobrepeso se incrementó de 11 a 15% en niños de 7 años7; Ramírez y cols6 reportaron una frecuencia de sobrepeso del 11% y 14% de obesidad en escolares de la ciudad de Mérida. Según los datos del Sistema de Vigilancia Alimentario y Nutricional (SISVAN), la frecuencia de sobrepeso es 26,9% en niños menores de 2 años, 11% en el grupo de 2 a 6 años y 15,8% en los de 7 a 14 años7.
Es bien conocido que la obesidad en la infancia es un predictor importante del desarrollo del síndrome metabólico en la edad adulta y las variables asociadas con mayor riesgo son el índice de masa corporal (IMC) y el valor de insulina8,9. Según la Asociación Americana de Diabetes, un IMC en un percentil superior a 85 es considerado como un factor de riesgo para el desarrollo de diabetes tipo 2, incluso en niños10.
El objetivo de este estudio fue evaluar el efecto del exceso de peso sobre la concentración plasmática de insulina basal y su respuesta a la carga de glucosa oral en niños y adolescentes que acudieron al Servicio de Endocrinología del Hospital de Niños "J. M. de los Ríos", Caracas-Venezuela.
MATERIALES Y MÉTODOS
Se seleccionaron 220 niños y adolescentes que consultaron en el Servicio de Endocrinología del Hospital de Niños "J. M. de Los Ríos", por síntomas sugestivos de hipoglucemia o por exceso de peso durante los años 1986 a 2001. La presencia de hipoglucemia y/o cualquier alteración del metabolismo de los carbohidratos fue descartada según los criterios de la Asociación Americana de Diabetes11. Ningún paciente había padecido enfermedades previas ni había realizado modificaciones en su dieta habitual.
Se registraron las siguientes variables demográficas: edad, sexo, peso, talla, índice de masa corporal (IMC), estadío puberal (Tanner), motivo de consulta, antecedentes familiares de diabetes. De acuerdo a los estándares establecidos para nuestra población12, se consideraron las siguientes categorías de masa corporal (IMC: Kg/m2): sobrepeso: IMC >P90≤P97, obeso: IMC <P 97; déficit de peso: IMC < P10.
La muestra total fue dividida en cuatro grupos:
Grupo A: prepuberales sin exceso de peso, con estadio puberal Tanner I, IMC <P90.
Grupo B: adolescentes sin exceso de peso, estadio puberal Tanner II-V, IMC <P 90.
Grupo C: prepuberales con sobrepeso u obesidad, estadio puberal Tanner I, IMC >P90.
Grupo D: adolescentes con sobrepeso u obesidad, estadio puberal Tanner II-V, IMC >P 90.
Posterior a un ayuno de 12 horas, en posición decúbito supino, se colocó un catéter endovenoso mantenido permeable con solución salina al 0.9%. Se realizó una prueba de tolerancia a la glucosa oral (1,75 g/kg) (Glycolab® o Glucoland®). Se tomaron muestras de sangre venosa en tubos secos sin anticoagulante a los 0, 30, 60 y 120 minutos posterior a la carga de glucosa; en el suero obtenido por centrifugación se cuantificó la glucosa por el método de glucosa hexoquinasa; las alícuotas restantes se almacenaron a -20°C para posterior procesamiento de la insulina.
El 92% de las determinaciones de insulina se cuantificaron por radioinmunoensayo; el resto se cuantificó por inmunoensayo (INMULITE). Al momento de cambiar el método se comprobó la bioequivalencia entre ambos métodos. Los resultados se presentan como promedio±desviacion estándar. Para el análisis estadístico se utilizó t Student y coeficiente de correlación de Pearso cuando fue pertinente. La significancia estadística se estableció con una p< 0,05.
RESULTADOS
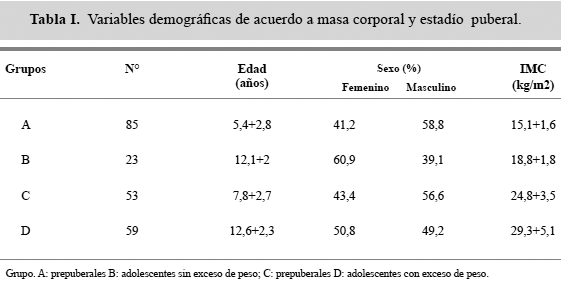
La tabla 1 muestra las variables demográficas de los grupos estudiados. El 30% del grupo A mostró déficit ponderal (IMC: 12,7+2,1), sin embargo al comparar su respuesta insulínica con los que no tenían ese déficit, no se encontró diferencia significativa, por lo que se mantienen en el mismo grupo. No hubo diferencia significativa en el género entre los grupos estudiados.
En la tabla II se muestra la concentración promedio de insulina basal y su respuesta en los cuatro grupos estudiados. En los pacientes sin sobrepeso (A y B) se evidencia la influencia de la pubertad en la concentración de insulina tanto basal como su respuesta, siendo esta significativamente mas alta en los adolescentes que en los prepuberales (p<0,01).
En los pacientes con exceso de peso (C y D) esta diferencia tan significativa no se observó. Al comparar los grupos (A con C) y (B con D) se observó que la insulina es significativamente mas alta en los prepuberales y en los adolescentes obesos (p<0,001).
En todos los grupos el pico máximo de secreción de insulina ocurrió a los 30 minutos; la respuesta en los adolescentes, sin exceso de peso (B), fue significativamente superior a la obtenida en los prepuberales (A) (p<0,01 en los tiempos 0, 30 y 120); p<0.05 en el tiempo 60). Entre los sujetos con exceso de peso, no se obtuvo diferencia significativa.
La respuesta de insulina fue significativamente mas alta tanto en los prepuberales como adolescentes con exceso de peso respecto a su controles normopeso (grupo A) (p<0,001). (Figura 1).
En relación al género, la respuesta insulinita fue superior en el sexo femenino del grupo prepuberal con sobrepeso en los tiempos 30, 60 y 120 minutos, y en el grupo de adolescentes con sobrepeso solo a los 120 minutos (p<0.05). (Tabla III).
La concentración plasmática basal de insulina se correlacionó positivamente con el IMC, (r=0,32 p<0,005). Dentro del grupo de pacientes con exceso de peso los niveles de insulina fueron normales en el 44% de los adolescentes y en 16,9% de los prepuberales, tomando como límites de referencia los resultados obtenidos en los pacientes sin sobrepeso (X+2DE); estos fueron, en prepuberales: 0 9,8 mU/mL; 30 76,3 mU/mL ; 60 60,2 mU/mL y 120 39,2 mU/mL En adolescentes: 0 15,7 mU/mL; 30 109,1 mU/mL; 60 97 mU/mL y 120 81,8 mU/mL.
Los antecedentes familiares para diabetes mellitus no mostraron influencia sobre los resultados.
DISCUSIÓN
En el presente trabajo se reporta la concentración promedio de insulina en ayunas y posterior a una carga de glucosa oral en un grupo de niños con diferentes grados de masa corporal y diferentes etapas puberales. Claramente se evidencia la influencia del estadio puberal en aquellos sin exceso de peso y el significativo efecto del exceso de peso sobre la concentración de insulina.
La resistencia a la insulina ha sido evaluada por diferentes índices2,13-16, sin embargo, hasta el momento ninguno de estos índices ha sido universalmente aceptado ni su aplicabilidad en niños ha sido comprobada. Uno de los índices más usados es el HOMA IR, sin embargo, para Yeni-Korsnshian y cols, éste índice es equivalente a utilizar el valor de insulina en ayunas, además, afirma que la resistencia a la insulina se correlaciona mejor con la respuesta integrada de insulina posterior al test de tolerancia oral a la glucosa17. Conwel y cols afirman lo mismo en su estudio de validación de índices de insulino-resistencia en niños y adolescentes obesos18.Diferentes autores han demostrado que los valores de insulina se incrementan a medida que aumenta la edad del sujeto estudiado19,20,21, sin embargo estos estudios incluyen grupos etarios muy amplios, incluso hasta 15 años, lo que hace suponer que incluyen pacientes con pubertad, período en el que se describe disminución en la sensibilidad a la insulina22,23,24,25.
En nuestro trabajo, al evaluar los prepuberales sin exceso de peso encontramos valores algo superiores en mayores de 7 años en relación a los menores, como previamente ha sido descrito19,20, pero estas diferencias no fueron significativas. Es bien conocido que la secreción de insulina estimulada por glucosa está normalmente incrementada durante la pubertad, respuesta que podría compensar la disminución de la sensibilidad a la insulina inducida por la misma26,27. En nuestro grupo los valores alcanzados en los pacientes puberales fueron significativamente superiores a los prepuberales, lo que corresponde a lo esperado y reportado por otros autores20,22.
Por otra parte, se ha demostrado que la sensibilidad a la insulina disminuye a medida que aumenta el IMC23; son muchos los trabajos que muestran valores de insulina en pacientes obesos superiores a sus homólogos no obesos 13,28,29,30. Esto se corresponde con la correlación que encontramos en nuestros resultados en relación al IMC, además de las diferencias alcanzadas al separar los pacientes de peso normal con aquellos con exceso de peso. A pesar de que algunos sujetos tenían déficit ponderal, la respuesta de insulina con el resto de su grupo no fue significativa.
Es importante resaltar que en nuestro grupo de pacientes con exceso de peso, los prepuberales tienen mayor porcentaje de anormalidad de los valores de insulina que los adolescentes, al compararlos con sus homólogos de peso normal. Esta situación es preocupante, ya que ubica a estos pacientes en situación de riesgo a edades muy tempranas de la vida, lo que podría empeorar el pronóstico de generaciones futuras de adultos, además de presentar las características de síndrome metabólico desde la infancia y podría estar asociado al aumento de frecuencia de diabetes tipo 2 en niños y adolescentes. Por otro lado, también debe estar claro que la presencia de obesidad no es necesariamente igual a valores elevados de insulina, ya que existe un grupo importante de pacientes, especialmente adolescentes con valores normales. Los niños obesos (C) ya tienen valores basales y en respuesta la glucosa que no difieren a la de un adolescente obeso (D), esto significa que independientemente de la edad un niño obeso ya tiene una respuesta anormal.
Ha sido señalado que la sensibilidad a la insulina varia de acuerdo al género. Algunos autores han asociado al sexo femenino con menor sensibilidad a la insulina23, mientras que otros no han encontrado diferencias significativas entre ambos sexos20. En nuestro estudio se evidenciaron valores de insulina superiores en el sexo femenino solo en el grupo de pacientes con exceso de peso, tanto en los valores basales como en los posteriores a carga de glucosa, lo que podría sugerir que el sobrepeso en el sexo femenino podría convertirse en un factor de riesgo agregado.
La asociación de historia familiar de diabetes tipo 2 como factor de riesgo para desarrollar resistencia insulínica ha sido controversial, con grupos a favor2,26,27 y otros en contra21,31, en nuestro grupo la historia familiar positiva no tuvo un impacto sobre la respuesta de insulina.
Respecto a los valores referenciales de insulina, existen diversos estudios previos en niños y adolescentes; con variabilidad en el tamaño de la muestra y en la metodología utilizada2,13,19,20,22,26, 28-30, 32, 33. Este trabajo realizado en una muestra seleccionada de niños y adolescentes de nuestra consulta, nos permite tener un valor de referencia, sin embargo, en virtud de los rangos tan amplios observados en las respuestas de insulina, la interpretación de los mismos debe hacerse con precaución, tomando en consideración las características clínicas y la evolución de los pacientes.
De los 220 pacientes analizados, el 36,4% presentaron valores de insulina fuera de los rangos establecidos para su grupo, al menos en uno de los tiempos, y de éstos, solo en un 5% los valores alterados fueron los intermedios (30 y 60 minutos), por lo que se propone, por razones de costo, cuando esté indicado realizar ésta exploración, utilizar sólo los tiempos basal y 120 minutos.
En conclusión, a pesar de que la prueba de tolerancia oral a la glucosa no está indicada en todos los niños y adolescentes con sobrepeso/obesidad, podría convertirse en una herramienta útil para la evaluación del pronóstico de estos pacientes, y con ello sentar las bases para establecer estrategias de prevención primaria.
REFERENCIAS BIBLIOGRÁFICAS
1. Consenso Mexicano de Resistencia a la Insulina y Síndrome Metabólico. Rev Mex Cardiol 1999;10:3-19. [ Links ]
2. Zimmet P, Alberti KG, Shaw J. Global and societal implications of the diabetes epidemic. Nature 2001;414:782-787. [ Links ]
3. Osuna AJ. Diabetes Mellitus tipo 2: sobrepeso y obesidad como factores de riesgo. Editorial. Rev Venez Endocrinol Metab 2004;2:1-2. [ Links ]
4. Darrell Nesmith J. Type 2 diabetes Mellitus in children and adolescents. Pediat Rev 2001; 22:147-152. [ Links ]
5. Landaeta-Jiménez M, Macias-Tomei C, Fossi M, García MN, Layrisse M, Méndez-Castellano H. Tendencia en el crecimiento físico y estado nutricional del niño Venezolano. Arch Venez Puer Ped 2002;65:13-20. [ Links ]
6. Ramirez I, Bellabarba A.S., Paoli-Valeri M, Arata-Bellabarba G. Frecuencia de obesidad y sobrepeso en escolares de la zona urbana de Mérida-Venezuela. Rev Venez Endocrinol Metab 2004;2:16-21. [ Links ]
7. Diagnóstico de la Situación Nutricional de los menores de 15 años, Venezuela 1990-2005. Caracas: Direcciòn SISVAN; 2006; p. 5. [ Links ]
8. Srinivasan SR, Myers L, Berenson GS. Predictability of childhood adiposity and insulin for developing insulin resistance syndrome (Syndrome X) in young adulthood. Diabetes 2002;51:204-209. [ Links ]
9. Paoli-Valeri M, Pereira A. Sìndrome metabolico en el niño y adolescente. Revisiòn. Rev Venez Endocrinol Metab 2006;4:3-14. [ Links ]
10. American Diabetes Association. Type 2 diabetes in children and adolescents. Diabetes Care. 2000;23:381-389. [ Links ]
11. American Diabetes Association. Report of the expert committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 2003; 26(suppl 1):S5-S20. [ Links ]
12. López M, Landaeta M, Méndez H, Colmenares R. Índice de masa corporal (Peso kg/m2). Arch Venez Puer Ped 1988; 51:10-15. [ Links ]
13. Steinberger J, Moorehead C, Katch V, Rocchini AP. Relationship between insulin resistance and abnormal lipid profile in obese adolescents. J Pediatr 1995; 126: 690-695. [ Links ]
14. Stumvoll M, Mitrakou A, Pimenta W, Jenssen T, Yki-Jarvinen H, Van Haeften T, Renn W, Gerich J. Use of the oral glucose tolerance test to assess insulin release and insulin sensitivity. Diabetes Care 2000;23:295-301. [ Links ]
15. Soonthornpun S, Setasuban W, Thamprasit A, Chayanunnukul W, Rattarasarn C, Geater A. Novel Insulin Sensitivity Index Derived from Oral Glucose Tolerance Test. J Clin Endocrinol Metab 2003; 88:1019-1023. [ Links ]
16. Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, Quon MJ. Quantitative Insulin Sensitivity Check Index: A Simple, Accurate Method for Assessing Insulin Sensitivity In Humans. J Clin Endocrinol Metab 2000; 85:2402-2410. [ Links ]
17. Yeni-Kornshian H, Carantoni M, Abbasi F, Reaven GM. Relationship between several surrogate estimates of insulin resistance and quantification of insulin-mediated glucose disposal in 490 healthy no diabetic volunteers. Diabetes Care 2000;23:171-175. [ Links ]
18. Conwel LS, Trost SG, Brown WJ, Bath JA. Indexes of insulin resistance and secretion in obese children and adolescents. Diabetes Care 2004;27:314-319. [ Links ]
19. Rosenbloom AL, Wheeler L, Bianchi R, Chin FT, Tiwary CM, Grgic A. Aged-adjusted analysis of insulin responses during normal and abnormal glucose tolerance tests in children and adolescents. Diabetes 1975; 24:820-828. [ Links ]
20. Lestradet H, Deschamps I, Giron B. Insulin and free fatty acid levels during oral glucose tolerance tests and their relation to age in 70 healthy children. Diabetes 1976;25:505-508. [ Links ]
21. Young-Hyman D, Schlundt DG, Herman L, De Luca F, Counts D. Evaluation of insulin resistance syndrome in 5- to 10-year-old overweight/obese African-American children. Diabetes Care 2001;24:1359-1364. [ Links ]
22. Caprio C, Plewe G, Diamond MP, Simonson DC, Boulware SD, Sherwin RS, Tamborlane WV. Increased insulin secretion in puberty: A compensatory response to reductions in insulin sensitivity. J Pediatr 1989; 114:963-967. [ Links ]
23. Travers SH, Jeffers BW, Bloch CA, Hill JO, Eckel RH. Gender and tanner stage in body composition and insulin sensitivity in early pubertal children. J Clin Endocrinol Metab 1995;80:172-178. [ Links ]
24. Viso ME, Solano L, Sánchez A. Insulina sérica en niños y adolescentes obesos y eutróficos. Ann Venez Nutr 2004;17:3-12. [ Links ]
25. Morales LM, Raleigh X, Fernandez V, Molero-Conejo E. Distribución de las concentraciones de glucosa e insulina basal, HOMA IR y HOMA ßcell en niños y adolescentes de la ciudad de Maracaibo, Venezuela. Rev Méd Chile 2007;135:205-211. [ Links ]
26. Danadian K, Balasekaran G, Lewy V, Meza M, Robertson R, Arslanian S. Insulin sensitivity in african-american children with and without family history of type 2 diabetes. Diabetes Care 1999; 22: 1325-1329. [ Links ]
27. Ryder E, Gómez ME, Fernández V, Campos G, Morales LM, Valbuena H, Raleigh X. Presence of impaired insulin secretion and insulin resistance in normoglycemic male subjects with family history of type 2 diabetes. Diabetes Res Clin Pract 2003;60:95-113. [ Links ]
28. Sudi K, Gallistl S, Payerl D, Aigner R, Möller R, Tafeit E, Borkenstein MH. Interrelationship between estimates of adiposity and body fat distribution with metabolic and hemostatic parameters in obese children. Metabolism 2001;50:681-687. [ Links ]
29. Paulsen EP, Richenderfer L, Ginsberg-Fellner F. Plasma glucose, free fatty acids, and inmunoreactive insulin in sixty-six obese children. Diabetes 1968; 17:261-269. [ Links ]
30. Martin MM, Martin AL. Obesity, hyperinsulinism, and diabetes mellitus in childhood. J Pediatr 1973;82:192-201. [ Links ]
31. Goran MI, Corongues K, Bergman RN, Cruz ML, Gower BA. Influence of family history of type 2 diabetes on insulin sensitivity in prepubertal children. J Clin Endocrinol Metab 2003;88:192-195. [ Links ]
32. Parker ML, Pildes RS, Chao KL, Cornblath M, Kipnis DM. Juvenile diabetes mellitus, a deficiency in insulin. Diabetes 1968;17:27-32. [ Links ]
33. Cole HS, Epel R. Serum insulin and growth hormone values in children during the oral glucose tolerance test. Diabetes 1972;21:16-22. [ Links ]