Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.10 no.3 Mérida oct. 2012
Diabetes mellitus tipo 1 y factores ambientales: La gran emboscada.
Miguel A Aguirre1,3, Joselyn Rojas2,3, Raquel Cano3,4, Marjorie Villalobos1,3, Mariela Paoli1, Lisbeth Berrueta2
1Unidad de Endocrinología – Instituto Autónomo Hospital Universitario de los Andes. 2Instituto de Inmunología Clínica – Universidad de los Andes. Mérida, Venezuela. 3Centro de Investigaciones Endocrino-Metabólicas "Dr. Félix Gómez – Universidad del Zulia. Maracaibo, Venezuela. 4Unidad de Endocrinología y Enfermedades Metabólicas del Hospital Universitario de Caracas. Caracas – Venezuela.
Dirigir correspondencia a: Dr. Miguel Aguirre; Email: miguelaguir@gmail.com
RESUMEN
La Diabetes Mellitus Tipo 1 (DM1) es una de las patologías más estudiadas en la actualidad, no solo por el aumento de su incidencia, sino también por su aparición a edades cada vez más tempranas. La DM1 es una enfermedad autoinmune de una alta complejidad genética y donde la susceptibilidad a factores ambientales parece jugar un papel preponderante. Elementos como parto por cesárea, deficiencia de vitamina D, exposición temprana a proteínas de la leche de vaca, exposición limitada a microorganismos durante la infancia y el incremento en la incidencia de obesidad infantil han sido relacionados con el desarrollo de esta entidad, convergiendo todos estos factores en un punto clave: la pérdida de la tolerancia inmunológica intestinal y la participación de células T auto-reactivas en pacientes susceptibles. Por su parte, la leche materna ofrece una serie de factores de crecimiento, inmunológicos, e incluso insulina, que son capaces de inducir una respuesta tolerogénica en el microambiente intestinal con la subsecuente disminución de la autoinmunidad. En esta revisión se expondrá la evidencia y los mecanismos fisiopatológicos propuestos por medio de los cuales los elementos mencionados desencadenarían una alteración de la inmunomodulación intestinal y un incremento en la predisposición al desarrollo de DM1.
Palabras clave: diabetes tipo 1, Autoinmunidad, Tolerancia Instestinal, Microbiota, Leche Materna.
ABSTRACT
Type 1 Diabetes Mellitus (T1DM) is one of the most studied pathologies to date, not only due to the elevating incidence but also because it is being diagnosed at even earlier ages. T1DM is an autoimmune disease with a very complex genetic background where environmental factors seem to play a very important triggering role. Elements like cesarean section, vitamin D deficiency, early exposure to cow milk proteins, limited exposure to microorganisms during infancy, and the increase of childhood obesity have been related to the development of this disease, converging all the factors into one key feature: loss of intestinal immunological tolerance and the participation of auto-reactive T cells from a susceptible patient. On the other hand, breast milk offers a series of growth and immunological factors, even insulin, which are able to induce a tolerogenic response in the intestinal microenvironment, lowering the probability of any autoimmune phenomena. The following review will expose evidence of the pathophysiological mechanisms involved in each environmental element associated with intestinal immunomodulation and the increase risk of T1DM.
Key Words: type 1 diabetes, autoimmunity, intestinal tolerance, microbiota, breast milk.
Articulo recibido en: Junio 2012. Aceptado para publicación en: Julio 2012.
La Diabetes Mellitus tipo 1 (DM1) es una de las enfermedades autoinmunes más estudiadas en la actualidad, no solo por su complejidad genética sino por su susceptibilidad a factores ambientales. Semejante a su contraparte Tipo 2, la DM1 se caracteriza por un defecto en el metabolismo de los carbohidratos, pero debido a la destrucción de las células β del páncreas mediado por mecanismos autoinmunes, manifestándose como ausencia absoluta de insulina. La genética de ésta enfermedad es ciertamente compleja y se caracteriza por un alto índice de Desequilibrio de Ligamiento (Linkage disequilibrium) entre los haplotipos de las clases del antígeno leucocitario humano (HLA), fenómeno que dificulta el detectar cuáles son los genes primariamente asociados a la misma1. Se han identificado regiones cromosomales de riesgo como lo son 6q26, 10q21.2, 20p12.3, 22q11.22, y 6p21 siendo éste último encontrado en las agrupaciones familiares con DM12. Varios alelos DQ y DR han sido asociados, algunos mostrando predisposición (DR4-DQ8 y DR3-DQ2) y otros mostrando protección (DR15-DR6)3 (Tabla I). El gen de la insulina (11p15) también es considerado un locus de susceptibilidad debido a una región de número variable de repeticiones en tándem(VNTR del inglés, variable number of tandem repeats) la cual modula la expresión de insulina en el timo durante la maduración de linfocitos T4. Con respecto a los estudios de gemelos, uno de los más importantes fue llevado a cabo en Finlandia, el país con la mayor prevalencia de DM1 en el planeta. De una cohorte de 303 gemelos, 247 casos tuvieron DM1 (116 femeninos y 131 masculinos), 28 tuvieron Diabetes Mellitus tipo 2 (DM2), 15 tuvieron diabetes secundaria y 13 tuvieron diabetes gestacional, con una incidencia acumulativa para 1998 de 0.54%5. En general, en gemelos monozigóticos la tasa de DM1es de 13-67,7%, en comparación a un 0-12,4% en gemelos dizigóticos3.
Varios proyectos han sido llevados a cabo para analizar el comportamiento epidemiológico de la misma en la población mundial, como el DiaMond6, el e-DiCARE7, el DIABFIN8, el Prevefin9, y el EURODIAB10, reportándose
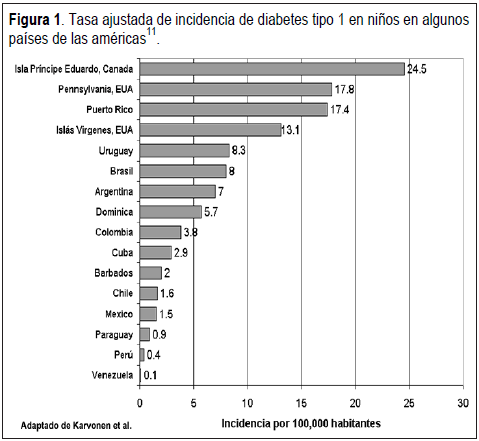
que son Finlandia e Italia (36,8-40,9/100.000 habitantes por año) los países con mayores prevalencias, mientras que Venezuela y China entran dentro de las más bajas con 0,1/100.000 habitantes por año. Si bien la enfermedad no es de alta prevalencia en nuestro país11 (Figura 1), la proyección para América Latina y el Caribe en el 2025 es de 40 millones de diabéticos (62% del total mundial proyectado), por lo que es menester continuar con el estudio de la patogenia de la enfermedad y lograr un programa de prevención efectiva en aquellos pacientes con susceptibilidad genética, especialmente cuando ya comienzan a observarse incrementos en la tasa de la enfermedad12 y se ha demostrado que los alelos HLA para Caucásicos ofrecen el mismo patrón de riesgo para los Latinoamericanos13,14, con haplotipos protectores DRB1*01-DQB1*0501, DRB1*15-DQB1*0602 y DRB1*1301-DQB1*0603 y haplotipos de susceptibilidad DRB1*03-DQA1*05-DWB1*02, DRB1*0301-DQA1*0501-DQB1*0201, y DRB1*0401-DQA1*0301-DQB1*0302.
SISTEMA INMUNE INTESTINAL – MUCHO MÁS QUE UNA SIMPLE BARRERA
Si bien se han descrito los factores genéticos para la DM1, se han considerado varios factores ambientales capaces de inducir la autoinmunidad contra células β15: parto por cesárea16, deficiencia de vitamina D17, exposición temprana a proteínas de la leche de vaca18, exposición limitada a microorganismos durante la infancia19 y el incremento en la incidencia de obesidad infantil20. Todos estos factores convergen en un punto clave: la pérdida de la tolerancia inmunológica intestinal y la participación de células T auto-reactivas en pacientes susceptibles. Antes de hablar sobre la influencia de cada uno de éstos factores sobre la pérdida de tolerancia, debemos revisar el microambiente intestinal y su peculiar sistema inmunológico. Se han publicado varias revisiones elegantes sobre la anatomía del sistema digestivo y las características inmunológicas de dicho microambiente21,24, sin embargo se discutirán los aspectos más importantes.
Distribución y diversidad
Debido a la gran responsabilidad del sistema digestivo de separar y discriminar cuales sustancias alimentarias serán absorbidas y defenderse contra la colonización por una variedad de microorganismos, se requiere de un ejército celular capaz de llevar a cabo tales funciones, considerándose entonces como un órgano inmunológicamente privilegiado25.
Estos grupos celulares se encuentran divididos de la siguiente forma25 (Figura 2): a) Tejido Linfoide asociado a Intestino (Gut-Associated Lymphoid Tissues, GALT): el cual incluye a las Placas de Peyer (PP), Folículos linfoides aislados, el apéndice y los nódulos linfáticos mesentéricos (Mesenteric Lymph Nodes, MLN); y b) Células efectoras: encontrándose en la Lámina Propia (LP) con los linfocitos de la lámina propia (Lamina Propria Lymphocytes, LPL) y los linfocitos intraepiteliales (Intraepithelial Lymphocytes, IEL). Gracias a su disposición espacial, las barreras celulares de distribuyen de la siguiente manera:
1. Epitelio Intestinal, el cual es una barrera epitelial monocapa de células estrechamente unidas debido a la presencia de una zonula occludens constituida por occludina-1, E-cadherinas, cateninas, Claudina-1, Zonulina-1, JAM-1 y actina26. La propiedad principal de éste grupo celular es la absortiva (gracias a la presencia de microvellosidades) aunque no es la única, ya que estas son capaces de expresar MHC-II y liberarlos en forma de exosomas27,28, comportándose como células presentadoras de antígeno29 con tendencia a respuestas tolerogénicas porque carecen de los demás factores estimulantes21. Las células de Paneth forman parte del sistema de defensa mediante la secreción de sustancias antimicrobianas como por ejemplo óxido nítrico, péptidos antimicrobianos y enzimas proteolíticas30. Las células de Goblet por su parte se encargan de la secreción de mucina, factores trefoil y otros antimicrobianos31. La mucosa intestinal consta de dos fases: la fase interna densa, constituida por los agentes secretados por las células de Goblet y ausente de microbios y la fase externa más laxa, la cual aloja a las bacterias comensales. Las células M (microfold) representan una especialización de los enterocitos bajo la influencia de la Linfotoxina α1β2 (LTa1b2) expresada en las células B de los folículos linfoides aislados21,25. Debido a su pobre desarrollo microvellositario, las células M solo son capaces del macrotransporte de antígenos y microorganismos hacia los espacios subepiteliales, por ejemplo a las PP. Un grupo celular que se localiza junto a las células derivadas del epitelio intestinal son los IEL caracterizados por ser TCRαβ+CD4+, TCRαβ+CD8+, TCRγδ, TCRαβCD8αα+ 25. Los subtipos TCRαβ+CD8+ de memoria aun muestran función efectora citolítica, mientras que los TCRabCD8αα+ se comportan como supresores de la señalización TCR (CTLA-4+PD-1+FasL+RANTES+CD69+). Por último, las células dendríticas CD70+CX3CR1+ ofrecen prolongaciones hacia el epitelio intestinal, permitiendo el muestreo de antígenos de la luz intestinal y control del sistema adaptativo mediante la inducción de Th17 usando ATP24.
2. Sistema Innato, si bien localizado junto a las células del Sistema Adaptativo, las describiremos en dos apartados. En la LP se alojan los subtipos de células dendríticas, cada cual con funciones particulares. El subtipo CD11c+CD11b+TLR5+,
al igual que las CD70+CX3CR1+, son capaces de inducir el desarrollo de Th17, mientras que las CD103+ migran hacia los MLN para inducir a Foxp3+Treg mediante la secreción de ácido retinoico (AR) y TGF-β21,24. Las CD103+ se caracterizan también por inhibir la diferenciación hacia Th17 y Th1 por su falta secreción de IL-12 e IL-23 al ser estimuladas. Los macrófagos de la LP también son capaces de inducir Foxp3+Treg mediado por AR y TGF-β y, aunque perfectamente capaces de ejercer sus actividades bactericidas, bajo la influencia del microambiente rico en TGF-β, son incapaces de secretar citocinas tipo Th121,24.
3. Sistema Adaptativo, el cual se caracteriza por la presencia de subtipos de células T y células plasmáticas distribuidas en diferentes puntos anatómicos. En la LP se pueden encontrar todos los subtipos clásicos de células T25, especialmente Foxp3+CTLA-4+Treg inducidas por TGF-β proveniente de células dendríticas CD103+, junto a una producción constitutiva estable de Th17 ayudado por IL-6 y controlado por AR21,24.
Las PP están compuestas por áreas linfoides con células plasmáticas rodeadas por células T naive. El homing de las células B es mediado por la expresión de CCR9 y α4β7, lo cual permite retenerlas en las PP32, donde bajo la influencia de TGF-β33 y la expresión de BAFF, APRIL y CD40L por células dendríticas productoras de óxido nítrico y TNF (Tip-DC) y estromales las cuales modulan el cambio hacia la producción de IgA de una manera T-independiente y T-dependiente (Figura 3)34-35.
Bacterias Comensales
La adaptación entre las bacterias comensales y el reconocimiento bacteriano es un vals que se ha venido ejecutando desde los primeros años de la evolución del hombre, adquiriendo un rol fundamental en el desarrollo y diversificación del sistema adaptativo mediante una compleja simbiosis36-37 que incluso tiene influencia en el desarrollo de las interacciones cerebro-intestino las cuales son fundamentales a la hora de evaluar las patologías crónicas inflamatorias intestinales38-39. La adquisición de los microorganismos comensales se produce justo después del parto, donde por contacto vaginal y durante la lactancia materna permiten la colonización del microambiente estéril intestinal del recién nacido40. La densidad bacteriana varía según el área colonizada, donde en el estómago y duodeno se encuentran 103-105 organismos por mL de contenido luminal, mientras que en colon puede llegar a 1012 organismos por mL40. Si bien se reconoce que el contacto con el líquido vaginal y la leche materna son elementos claves para la colonización, se ha comprobado que la genética del sujeto modula el perfil de comensales que habitarán en el intestino41-42. Se han descrito unas 500 especies de bacteria en el intestino humano43, Arumugam y col.44 publican que los metagenomas intestinales pueden clasificarse en 3 enterotipos: Bacteroides, Prevotella y Ruminococcus, los cuales tienen la posibilidad de sintetizar vitaminas, siendo quizá esta propiedad la fuerza evolutiva de la simbiosis. Los Bacteroides ofrecen enzimas involucradas en la biosíntesis de biotina, riboflavina, pantoteno y ascorbato, Prevotella brinda tiamina y folato, y Ruminococcus expresan enzimas involucradas en el metabolismo del Hem.
El microambiente intestinal está polarizado hacia un perfil tolerogénico (Figura 4) en el cual el muestreo de los antígenos de la comida y las bacterias comensales es llevado a cabo por células dendríticas y/o IEL para luego presentarlo a CD4+ naive en los MLN o en las PP, donde se diferencian hacia Treg y/o Th321. Ambos grupos celulares expresan una cantidad amplia de receptores de reconocimiento de patrón (Pattern Recognition Receptor, PRR) para la detección de lipopolisacáridos, lipoproteínas, flagelina, y CpG desmetilado. Además también expresan receptores tipo dominio oligomerización fijadores de nucleótido (Nucleotide-binding Oligomerization Domain, NOD), lo cual le permite escanear cada uno de los antígenos del lumen intestinal40. La interrelación entre el intestino y las bacterias comensales se expresa en un circuito de inmunomodulación en el cual se inducen varios subtipos de células CD4+ reguladoras: Th3 (productores de TGF-β), Tr1 (productores de IL-10), y CD25+Foxp3+; otras formas reguladoras incluyen NKT, CD4+TCRγδ y las células T invariantes asociadas a mucosa (Mucosal-Associated Invariant T cell, MAIT)45.
La células MAIT se caracterizan por la expresión de la proteína 1 relacionada con MHC (Major histocompatibility complex class I-related gene protein, MR1)46, proteína relacionada con los demás miembros de la clase I del MHC.
El MR1 está altamente conservado entre los mamíferos, y se caracterizan por estar en la delgada línea roja entre el sistema adaptativo (ya que generan receptores mediante recombinación VDJ) y el sistema innato ya que tienen un espectro limitado de reconocimiento antigénico47.
El término "invariante" deriva de la estructura del TCR el cual está compuesto por una cadena α invariante con semiarreglos de la cadena β. Las MAIT se consideran doble negativas CD4-CD8- ó en algunos casos CD8αα+ o CD8αβ+ (el cual le permite escapar a selección negativa), los cuales en circulación presentan fenotipo "naive" CD8αβlowCD161+CD27+CD45RA+CD45ROlow, pero que al interactuar con células B o plasmáticas en intestino adquieren un fenotipo de "memoria" CD8αβlowCD161+CD44hiCD27+CD45RA-CD45RO+α4β7+ 48. Si bien aún no se reconocen los ligandos microbianos detectados por las MAIT, se ha establecido que MR1 es expresado in vivo por plasmablastos CD38+ o CD138+ IgA+ localizados en la mucosa intestinal, lo cual modula la producción de IgA por células plasmáticas maduras49-50.
LA GRAN EMBOSCADA
Como se mencionó en apartados anteriores, se han puntualizado 5 factores ambientales asociados con el desarrollo de DM1, los cuales serán descritos a continuación en base a lo ya explicado sobre la inmunotolerancia intestinal; ver (Figura 5).
Parto Vía Cesárea
Desde finales de la década de los 90, se ha reportado la asociación de parto vía cesárea y defectos en el sistema inmunológico. Grönlund y col.16 reportan que la función fagocítica está disminuida en aquellos niños nacidos vía vaginal en comparación con aquellos nacidos por cesárea, y que de hecho esta modulación fagocítica se mantenía hasta la adultez. Aquellos bebes nacidos vía abdominal presentan mayor actividad fagocítica y producción de especies reactivas de oxígeno, lo cual constituye un factor de riesgo para daño tisular. Ese mismo año, Grönlund51 publica su reseña sobre la flora intestinal entre lactantes menores nacidos por vía vaginal o cesárea, reportando que la colonización por Bifidobacterium y Lactobacillus fue retardada, y existía una menor colonización por Bacteroidis fragilis. Cinco años después, Salminen y col.52 analizan el perfil microbiológico de las heces de niños de 7 años nacidos por vía natural y vía quirúrgica, reportando diferencias significativas entre las especies de Bifidobacterium y Clostridium las cuales se han demostrado tienen impacto en el desarrollo de enfermedades alérgicas53. Salminen52 publica que los niños nacidos por cesárea presentan niveles más elevados de Clostridium, sugiriendo colonización más temprana con modificación de la flora intestinal. Un reciente meta-análisis54 reporta que existe un 20% de riesgo para DM1 en aquellos niños nacidos por cesárea, lo cual no se explica por otros factores de confusión (peso al nacer, edad gestacional, edad materna, orden de nacimiento, diabetes materno o incluso lactancia materna), lo que sugiere deberse a la exposición bacteriana temprana en la vida neonatal. Por último, Schlinzig y col.55 publican un hallazgo muy importante, aquellos niños nacidos por cesárea presentan un mayor número de metilaciones en ADN leucocitario en comparación con aquellos nacidos por vía natural, lo cual abre una nueva área de investigación no solo por las implicaciones de neuroinmunomodulación sino por demostrar la existencia de modificación epigenética importante en el período periparto.
Deficiencia de Vitamina D
La hormona derivada de colesterol, 1,25-dihidroxicolecalciferol [1,25(OH)2D3], es una hormona pleiotrópica la cual siendo originalmente reconocida por su papel en el metabolismo del calcio, realiza una importante función como inmunomodulador. De forma clásica, la síntesis de la vitamina D comienza en la piel con la acción de radiación ultravioleta-B modificando la estructura original del 7-deshidrocolesterol a colecalciferol mediante la ruptura del anillo B del ciclopentanoperhidrofenantreno y desplazamiento de enlaces covalentes para lograr estabilidad electrónica17,56. Luego, el colecalciferol debe ser hidroxilado en posición 25 por parte de la enzima 25-hidroxilasa hepática y luego hidroxilado en posición 1 por la 1α-hidroxilasa renal hasta 1,25-(OH)2D3. Sin embargo, en el sistema inmune, los linfocitos T, B y células dendríticas son capaces de expresar 1α-hidroxilasa y 24-hidroxilasa, por lo que son capaces de convertir el 25-(OH)D3 en vitamina D activa [1,25-(OH)2D3] para acciones autocrinas y paracrinas mediadas por su receptor nuclear (vitamin D receptor, VDR)56,57.
La principal acción inmunológica es la de incrementar la producción de cathelicidina (hCAP18) en neutrófilos, macrófagos y epitelio, la cual es luego clivada en cathelicidina activa (LL37) la cual actúa como microbicida debido a su acción desestabilizadora de membrana57. Además, la vitamina D impide la diferenciación hacia Th17 por parte de las células dendríticas, disminuye la capacidad de las Th17 de producir IL-17, induce la expresión de Foxp3 y CTLA-4 por lo que induce el subtipo Treg56,57 y finalmente favorece una respuesta Th2 asociado a activación de STAT6 y GATA-358. De hecho, la deficiencia de vitamina D se ha asociado con defectos en activación de receptores de tipo Toll (Toll-like receptor, TLR) en monocitos59, lo cual se relaciona estrechamente con los hallazgos Zipitis y Akobeng60, los cuales reportan que la suplementación temprana de esta vitamina pudiese ofrecer protección ante el desarrollo de DM1, por lo que se enfatiza su papel inmunomodulador intestinal en etapas tempranas de la vida.
Proteína de la Vaca
La muy controversial teoría de la leche de vaca como punto detonador de la DM1 se ha venido discutiendo desde hace más de 30 años. Si bien la teoría tiene detractores61-64, existen aquellos que defienden su papel en la patogenia de la enfermedad. Quizá la disputa más importante al respecto se ha llevado a cabo en Oceanía, entre la Autoridad de Seguridad Alimentaria de Nueva Zelanda65 y las autoridades Australianas66. La agencia de seguridad Neozelandeza propuso en el 2004 un plan para promover la producción de leche de vaca con mayor contenido de A2 β-caseína, en vez de A1 α-caseína la cual ha sido implicada en la patogenia de DM1. Ellos basaron su planteamiento en el hallazgo de la producción de "β casomorphin 7" (βCM-7), sustancia que deriva del clivaje de A1 y B β-caseína, capaz de ejercer funciones opioides67 e incluso inmunosupresoras68, por lo que se planteó que ella podría modular la tolerancia del intestino, hallazgo que concordaba con los reportes de Kostraba y col.69 y Pérez-Bravo y col.70 con respecto al riesgo relativo (11.3 y 13.1 respectivamente) de la exposición temprana a la leche de vaca y DM1. Sin embargo, Truswell en Australia publica que la agencia Neozelandeza no tiene evidencia suficiente para plantear tal propuesta basado en los siguientes argumentos: a) no hay información veraz con respecto al consumo total de leche de vaca procedente de las fórmulas infantiles; b) los estudios expuestos fueron realizados en una población de muy alto riesgo como lo es la Isla de Sardinia, por lo que el peso genético debe ser evaluado; y c) la lactancia materna exclusiva versus la mixta no ha tenido una valoración estadística adecuada.
Ahora bien, la evidencia sugiere que hay una asociación entre la leche de vaca y la DM1, pero quizá el enfoque haya estado mal ubicado. Berin & Shreffler71 publican que la disrupción de la permeabilidad intestinal afecta la tolerancia oral, y que usualmente se acompaña de cargas antigénicas elevadas. Por lo tanto se ha propuesto que un sujeto con susceptibilidad genética y un "intestino con goteras" (leaking gut) posee los problemas de base y deben ser considerados a la hora de evaluar la leche de vaca y otros antígenos asociados a la enfermedad72. Este goteo intestinal se ha asociado con bajos niveles de Claudina y elevación de Zonulina, permitiendo el paso de antígenos hacia el espacio subepitelial26,73-75. En este panorama, la leche de vaca es acompañada de la gliadina (gluten) como molécula diabetógena alimentaria76.
Exposición limitada a microorganismos
Propuesta en 1989, la teoría de la Higiene fue planteada por Strachan77 luego de analizar una muestra de 17.414 niños, en las que concluye que la industrialización ha modificado los factores socieconómicos que influyen en tipo de vivienda, número de hijos y educación, disminuyendo la tasa de infecciones en edad infantil. Más de diez años después, Bach propone que de forma paradójica las infecciones pueden modular de alguna manera las respuestas asociadas a alergia y desórdenes autoinmunes78. En la DM1 se ha observado una relación inversa entre el número de infecciones en infancia temprana y la aparición de la enfermedad, sugiriendo para ello un papel protector, mientras que las infecciones tardías actúan como disparadores en sujetos susceptibles79. La presunta inmunomodulación se basa en varios mecanismos resaltando los siguientes puntos: a) la desviación de la respuesta inmune crea un ambiente propenso a una respuesta tipo alergia, la cual resulta de una disminución en la producción de IL-12 por parte de las células dendríticas, por lo que la respuesta ante agentes inocuos es propensa hacia una respuesta Th280; b) inmunomodulación por parte de agentes infecciosos como Schistosoma mansoni, Trichinella spiralis, Heligmosomoides polygyrus, Mycobacterium avium, entre otros. En estas infecciones existe modulación de la expresión de IL-10 por parte de células dendríticas e inducción de subpoblación de Treg capaces de modular respuestas Th1 subsecuentes, que incluso se han llegado a catalogar como respuestas parásito-específicas que impiden la aparición de DM1 en modelos animales81; y c) finalmente se han descrito polimorfismos que resultan importantes en la patogenia de enfermedades autoinmunes e interacción con agentes externos como lo son CD14, TLR2, TLR4, TLR6, TLR10, NOD1, NOD2, CARD4 y CARD1582.
Hipótesis aceleradora y obesidad infantil
Esta teoría propuesta por Wilkin hace más de 40 años83, en la cual se asume que la DM2 y la DM1 son parte de un mismo espectro, se plantea que la insulinorresistencia está asociada a sobrepeso/obesidad y su severidad depende del genotipo heredado, quitándole el papel primordial a la autoinmunidad de la DM1. Si bien la teoría no ha sido acogida por la mayor parte de la comunidad científica, el autor mantiene su posición en base a los novedosos hallazgos de obesidad infantil, con hiperglicemia y autoanticuerpos presentes, lo cual genera confusión a la hora de establecer un diagnóstico, por lo que se han incluso sugerido los términos "doble diabetes"84 ó "diabetes híbrida" 85. Dabelea y el resto del equipo de SEARCH for Diabetes in Youth Study Group86 publica que si bien la obesidad se encuentra asociada a una edad de aparición más temprana de la DM1, este fenómeno no ocurre por autoinmunidad inducida por insulinorresistencia como plantea el Dr. Wilkin87, sino más bien, existe una progresión más rápida de la destrucción ya que las células β están lesionadas por el estrés metabólico al cual están sometidas, incluso, el número de células ya se encuentra disminuido al momento del ataque autoinmune88. De hecho, no existe evidencia de autoinmunidad inducida por insulinorresistencia.
Lactancia Materna, el Elemento Protector
Quizá, una de las opiniones compartidas a nivel científico es el papel protector de la Leche Materna en sujetos no solo susceptibles a DM189 sino también en aquellos con predisposición a obesidad, síndrome metabólico y cualquiera de sus espectros, asma bronquial, entre otras90,91. La Leche Materna, alguna vez calificada como una mera fuente de alimentos para el lactante menor, ahora es considerada parte de una fuerza evolutiva que permitió la oferta de nutrientes esenciales al cerebro humano para alcanzar el desarrollo y capacidades actuales junto a la adquisición de un sistema inmunológico avanzado a expensas de un aporte adecuado calórico92.
La composición de la lecha materna ha sido objeto de extensa investigación93-95, y su papel inmunomodulador se compone de96-97 citocinas (IL-1β, IL-6, IL-8, IL-10, TNF-α, GM-CSF, M-CSF, IFN-γ, MCP-1, RANTES, y TGF-β), Inmunoglobulinas tipo IgA, IgG y IgM solubles, lactoferrina, lisozimas, mucinas, oligosacáridos de leche humana (OLH)98-99, CD14 soluble, β-defensina, factor bífido, moléculas de adhesión celular y células del sistema inmune materno. La importancia de la modulación del sistema inmune fetal/neonatal por parte del compartimiento materno es radical para la supervivencia del feto, especialmente a la luz de las deficiencias propias del mismo al nacer: a) capacidad fagocítica macrofágica disminuida, b) capacidad limitada de producción de neutrófilos en presencia de infecciones, producción limitada neonatal de TNF-α, GM-CSF o casi absoluta de IL-3, IL-4, IL-5, IL-8, IL-10 e IFN-γ, y c) necesidad de inmunomodulación de la maduración de la mucosa intestinal, lo cual necesita de la diferenciación ofrecida por la leche materna.
CONCLUSIONES
La disputa sobre los factores ambientales asociados a la inmunopatogenia de la DM1 es un tema altamente controversial, en el cual aún no hay un consenso pleno a la vista. Es por ello que el análisis de la interacción ambiental y genética en la DM1 no debe manejarse como una asociación estadística, hay que evaluar en qué punto de la fisiología del sistema inmune encajan y son capaces de explicar las características observadas en dichos pacientes. Es fácil caer en el error de defender un punto de la historia natural de la enfermedad, pero la tendencia actual es tratar de llegar a una teoría unificadora la cual permita incluir aspectos influyentes pero que radique en una línea principal de ideación patológica.
REFERENCIAS
1. Throsby E, Lie BA. HLA associated genetic predisposition to autoimmune diseases: genes involved and possible mechanisms. Transplant Immunology 2005;14:175-182. [ Links ]
2. Hewagama A, Richardson B. The genetics and epigenetics of autoimmune diseases. J Autoimmun 2009;33:3 doi:10.1016/j.jaut.2009.03.007. [ Links ]
3. Huber A, Menconi F, Corathers S, Jacobson EM, Tomer Y. Joint genetic susceptibility to type 1 diabetes and autoimmune thyroiditis: from epidemiology to mechanisms. Endocr Rev 2008;29:697-725. [ Links ]
4. Bennett ST, Lucassen AM, Gough SCL, Powell EE, Undlien DE, Pritchard LE, Merriman ME, Kawaguchi Y, Dronsfield MJ, Pociot F, Nerup J, Bouzekri N, Cambon-Thomsen A, Rønningen KS, Barnett AH, Bain SC, Todd JA. Susceptibility to human type 1 diabetes at IDDM2 is determined by tandem repeat variation at the insulin gene minisatellite locus. Nat Genet 1995;9:284-292. [ Links ]
5. Hyttinen V, Kaprio J, Kinnunen L, Koskenvuo M, Tuomilehto J. Genetic liability of type 1 diabetes and the onset age among 22,650 Young Finnish Twin Pairs. Diabetes 2003;52:1052-1055. [ Links ]
6. Karvonen M, Viik-Kajander M, Moltchanova E, Libman I, LaPorte R, Tuomilehto J. Incidence of childhood type 1 diabetes worldwide. Diabetes Mondiale (DiaMond) Project Group. Diabetes Care 2000;23:1516-1526. [ Links ]
7. Fuziah MZ, Hong JY, Zanariah H, Harun F, Chan SP, et al. A national database on children and adolescent with diabetes (e-DiCARE): results from April 2006 to June 2007. Med J Malaysia 2008;63:37-40. [ Links ]
8. Buzzetti R, Galgani A, Petrone A, Del Buono ML, Erlich HA, Bugawan TL. Genetic predisposition of type 1 diabetes in a population with low frequency of HLA risk genotypes and low incidence of the disease (the DIABFIN study). Diabetes Metab Res Rev 2004;20:137-143. [ Links ]
9. Lorini R, Minicucci L, Napoli F, Padovani P, Bazzigaluppi E, Tortoioli C, Cherubini V, Bottazzo G, Pozzilli P, Falorni A, Buzzetti R. Screening for type 1 diabetes genetic risk in newborns of continental Italy. Primary prevention (Prevefin Italy) – preliminary data. Acta Biomed 2005;76:31-35. [ Links ]
10. Patterson CC, Dahlquist GG, Gyürüs E, Green A, Soltész G. Incidence trends for childhood type 1 diabetes in Europe during 1989-2003 and predicted new cases 2005-20: a multicenter prospective registration study. Lancet 2009;373:2027-2033. [ Links ]
11. PanAmerican Health Organization. La Diabetes en las Américas. Available online: http://www.paho.org/Spanish/sha/be_v22n2-diabetes.htm. [ Links ]
12. Carrasco E, Pérez-Bravo F, Dorman J, Mondragón A, Santos JL. Increasing incidence of type 1 diabetes in population from Santiago de Chile: trends in a period of 18 years (1986-2003). Diabetes Metab Res Rev 2006;22:34-37. [ Links ]
13. Rojas-Villarraga A, Botello-Corzo, Anaya JM. HLA-Class II in Latin American patients with type 1 diabetes. Autoimmun Rev 2010;9:666-673. [ Links ]
14. Cifuentes RA, Rojas-Villarraga A, Anaya JM. Human leukocyte antigen class II and type 1 diabetes in Latin America: a combined meta-analysis of associations and family-based studies. Hum Immunol 2011;72:581-586. [ Links ]
15. Ma RCW, Chan JC. Incidence of childhood type 1 diabetes: a worrying trend. Nat Rev Endocrinol 2009;5:529-530. [ Links ]
16. Grönlund MM, Nuutila J, Pelto L, Lilius EM, Isolauri E, Salminen S, Kero P, Lehtonen OP. Mode of delivery directs the phagocyte functions of infants for the first 6 months of life. Clin Exp Immunol 1999;116:521-526. [ Links ]
17. Grant WB. Hypothesis – ultraviolet-B irradiance and vitamin D reduce the risk of viral infections and thus their sequelae including autoimmune diseases and some cancers. Photochem Photobiol 2008;84:356-365. [ Links ]
18. Cavallo MG, Fava D, Monetini L, Barone F, Pozzilli P. Cell-mediated immune response to b casein in recent-onset insulin-dependent diabetes: implications for disease pathogenesis. Lancet 1996;348:926-928. [ Links ]
19. Wills-Karp M, Santeliz J, Karp CL. The germless theory of allergic disease: revisiting the hygiene hypothesis. Nat Rev Immunol 2001;1:69-75. [ Links ]
20. Fourlanos S, Harrison LC, Colman PG. The accelerator hypothesis and increasing incidence of type 1 diabetes. Curr Opin Endocrinol Diabetes Obes 2008;15:321-325. [ Links ]
21. Mowat AM. Anatomical basis of tolerance and immunity to intestinal antigens. Nat Rev Immunol 2003;3:331-341. [ Links ]
22. Winkler P, Ghadimi D, Schrezenmeir J, Kraehenbuhl JP. Molecular and cellular basis of microflora-host interactions. J Nutr 2007;137:756S-772S. [ Links ]
23. Izcue A, Powrie F. Special regulatory T cell review: regulatory T cells and the intestinal tract – patrolling the frontier. Immunology 2008;123:6-10. [ Links ]
24. Rescigno M, Di Sabatino A. Dendritic cells in intestinal homeostasis and disease. J Clin Invest 2009;119:2441-2450. [ Links ]
25. Van Wijk F, Cheroutre H. Intestinal T cells: facing the mucosal immune dilemma with synergy and diversity. Semin Immunol 2009;21:130-138. [ Links ]
26. Vaarala O, Arkinson MA, Neu J. The complex interplay between intestinal microbiota, gut permeability and mucosal immunity. Diabetes 2008;57:2555-2562. [ Links ]
27. Van Niel G, Mallegol J, Bevilacqua C, Candalh C, Brugiére S, Tomaskovic-Crook E, Heath JK, Cerf-Bensussan N, Heyman M. Intestinal epithelial exosomes carry MHC class II/peptides able to inform the immune System in mice. Gut 2003;52:1690-1697. [ Links ]
28. Büning J, von Smolinski D, Tafazzoli K, Zimmer KP, Strobel S, Apostolaki M, Kollias G, Heath JK, Ludwig D, Gebert A. Multivesicular bodies in intestinal epithelial cells: responsible for MHC class II-restricted antigen processing and origin of exosomes. Immunology 2008;125:510-521. [ Links ]
29. Mayer L, Eisendhardt D, Salomon P, Bauer W, Plous R, Piccinini L. Expression of class II molecules on intestinal epithelial cells in humans. Differences between normal and inflammatory bowel disease. Gastroenterology 1991;100:3-12. [ Links ]
30. Bevins CL, Salzman NH. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis. Nat Rev Microbiol 2011;9:356-368. [ Links ]
31. Gill N, Wlodarska M, Finlay BB. Roadblocks in the gut: barriers to enteric infection. Cell Microbiol 2011;13:660-669. [ Links ]
32. Mora JR, Iwata M, Eksteen B, Song SY, Junt T, Senman B, Otipoby KL, Yokota A, Takeuchi H, Ricciardi-Castagnoli P, Rajewsky K, Adams DH, von Andrian UH. Generation of gut-homing IgA secreting B cells by intestinal dendritic cells. Science 2006;314:1157-1160. [ Links ]
33. Stavnezer J, Kang J. The surprising discovery that TGF-b specially induces the IgA class switch. J Immunol 2009;182:5-7. [ Links ]
34. Tangye SG. Plasmocytoid DCs induce gutsy plasma cells. Immunity 2011;34:144-146. [ Links ]
35. Chorny A, Puga I, Cerutti A. Innate signaling networks in mucosal IgA class switching. Adv Immunol 2010;107:31-69. [ Links ]
36. Chow J, Lee SM, Shen Y, Khosravi A, Mazmanian SK. Host-bacterial symbiosis in health and disease. Adv Immunol 2010;107:243-274. [ Links ]
37. Lee YK, Mazmanian SK. Has the microbiota played a critical role in the evolution of the adaptive immune system? Science 2010;330:1768-1773. [ Links ]
38. Rhee SH, Pothoulakis C, Mayer EA. Principles and clinical implications of the brain-gut-enteric microbiota axis. Nat Rev Gastroenterol and Hepatol 2009;6:306-314. [ Links ]
39. Ochoa-Repáraz J, Mielcarz DW, Begum-Hague S, Kasper LH. Gut, bugs, and brain: role of the commensal bacteria in the control of central nervous system disease. Ann Neurol 2011;69:240-247. [ Links ]
40. Artis D. Epithelial-cell recognition of commensal bacteria and maintenance of immune homeostasis in the gut. Nat Rev Immunol 2008;8:411-420. [ Links ]
41. Khamatryan ZA, Ktsoyan ZA, Manukyan GP, Kelly D, Ghazaryan KA, Aminov RI. Predominant role of host genetics in controlling the composition of gut microbiota. PLoS ONE 2008;3:e3064. [ Links ]
42. Benson AK, Kelly SA, Legge R, Ma F, Low SJ, Kim J, Zhang M, Oh PL, Nehrenberg D, Hua K, Kachman SD, Moriyama EN, Walter J, Peterson DA, Pomp D. Individuality in gut microbiota composition is a complex polygenic trait shaped by multiple environmental and host genetic factors. Proc Natl Acad Sci USA. 2010;107:18933-18938. [ Links ]
43. Isolauri E, Sütas Y, Kankaanpää P, Arvilommi H, Salminen S. Probiotics: effects on immunity. Am J Clin Nutr 2001;73:444S-450S. [ Links ]
44. Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, Bertalan M, Borruel N, Casellas F, Fernandez L, Gautier L, Hansen T, Hattori M, Hayashi T, Kleerebezem M, Kurokawa K, Leclerc M, Levenez F, Manichanh C, Nielsen HB, Nielsen T, Pons N, Poulain J, Qin J, Sicheritz-Ponten T, Tims S, Torrents D, Ugarte E, Zoetendal EG, Wang J, Guarner F, Pedersen O, de Vos WM, Brunak S, Doré J; MetaHIT Consortium, Antolín M, Artiguenave F, Blottiere HM, Almeida M, Brechot C, Cara C, Chervaux C, Cultrone A, Delorme C, Denariaz G, Dervyn R, Foerstner KU, Friss C, van de Guchte M, Guedon E, Haimet F, Huber W, van Hylckama-Vlieg J, Jamet A, Juste C, Kaci G, Knol J, Lakhdari O, Layec S, Le Roux K, Maguin E, Mérieux A, Melo Minardi R, Mrini C, Muller J, Oozeer R, Parkhill J, Renault P, Rescigno M, Sanchez N, Sunagawa S, Torrejon A, Turner K, Vandemeulebrouck G, Varela E, Winogradsky Y, Zeller G, Weissenbach J, Ehrlich SD, Bork P. Enterotypes of the human gut microbiome. Nature 2011;473:174-180. [ Links ]
45. Corthésy B, Gaskins HR, Mercenier A. Cross-talk between probiotic bacteria and the host immune system. J Nutr 2007;137:781S-790S. [ Links ]
46. Miley MJ, Truscott SM, Yu YY, Gilfillan S, Fremont DH, Hansen TH, Lybarger L. Biochemical featured of the MHC-related protein 1 consistent with an immunological function. J Immunol 2003;170:6090-6098. [ Links ]
47. Gapin L. Where do MAIT cells fit in the family of unconventional T cells? PLoS Biol 2009;7:e1000070. [ Links ]
48. Martin E, Treiner E, Duban L, Guerri L, Laude H, Toly C, Premel V, Devys A, Moura IC, Tilloy F, Cherif S, Vera G, Latour S, Soudais C, Lantz O. Stepwise development of MAIT cells in mouse and human. PLoS Biol 2009;7:e1000054. [ Links ]
49. Gozalbo-López B, Gómez del Moral M, Campos-Martín Y, Setién F, Martín P, Bellas C, Regueiro JR, Martínez-Naves E. The MHC-related protein 1 (MR1) is expressed by a subpopulation of CD38+, IgA+ cells in the human intestinal mucosa. Histol Histopathol 2009;24:1439-1449. [ Links ]
50. Macpherson AJ, McCoy KD, Johansen F-E, Brandtzaeg P. The immune geography of IgA induction and function. Mucosal Immunol 2008;1:11-22. [ Links ]
51. Grönlund MM, Lehtonen OP, Eerola E, Kero P. Fecal microflora in healthy infants born by different methods of delivery: permanent changes in intestinal flora after cesarean delivery. J Pediatr Gastroenterol Nutr 1999;28:19-25. [ Links ]
52. Salminen S, Gibson GR, McCartney AL, Isolauri E. Influence of mode of delivery on gut microbiota composition in seven year old children. Gut 2004;53:1388-1389. [ Links ]
53. Sjögren YM, Jenmalm MC, Böttcher MF, Björkstén B, Sverremark-Ekström E. Altered early infant gut microbiota in children developing allergy up to 5 years of age. Clin Exp Allergy 2009;39:518-526. [ Links ]
54. Cardwell CR, Stene LC, Joner G, Cinek O, Svensson J, Goldacre MJ, Parslow RC, Pozzilli P, Brigis G, Stoyanov D, Urbonaite B, Sipetić S, Schober E, Ionescu-Tirgoviste C, Devoti G, de Beaufort CE, Buschard K, Patterson CC. Caesarean section is associated with an increased risk of childhood-onset type 1 diabetes mellitus: a meta-analysis of observational studies. Diabetologia 2008;51:726-735. [ Links ]
55. Schlinzig T, Johansson S, Gunnar A, Ekström TJ, Norman M. Epigenetic modulation at birth – altered DNA methylation in white blood cells after Caesarean section. Acta Pediatrica 2009;98:1096-1099. [ Links ]
56. Kamen DL, Tangpricha V. Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity. J Mol Med 2010;88:441-450. [ Links ]
57. Sun J. Vitamin D and mucosal immune function. Curr Opin Gastroenterol 2010;26:591-95. [ Links ]
58. Sloka S, Silva C, Wang J, Yong VW. Predominance of Th2 polarization by vitamin D through s STAT6-dependent mechanism. J Neuroinflammation 2011;24:56. [ Links ]
59. Walker VP, Zhang X, Rastegar I, Liu PT, Hollis BW, Adams JS, Modlin RL. Cord blood vitamin D status impacts innate immune responses. J Clin Endocrinol Metab 2011;96:1835-1843. [ Links ]
60. Zipitis CS, Akobeng AK. Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis. Arch Dis Child 2008;93:512-517. [ Links ]
61. Norris JM, Beaty B, Klingensmith G, Yu Liping, Hoffman M, Chase HP, Erlich HA, Hamman RF, Eisenbarth GS, Rewers M. Lack of association between early exposure to cow´s milk protein and beta cell autoimmunity. Diabetes Autoimmunity Study in the Young (DAISY). JAMA 1996;276:609-614. [ Links ]
62. Hummel M, Schenker M, Ziegler AB. Appearance of diabetes-associated antibodies in offspring of parents with type 1 diabetes is independent from environmental factors (Abstrac). Diabetologia 1998;41(Suppl 1):A91. [ Links ]
63. Couper JJ, Steele C, Beresford S, Powell T, McCaul K, Pollard A, et al. Lack of association between duration of breast-deeding or introduction of cow´s milk and development of islet autoimmunity. Diabetes 1999;48:2145-2149. [ Links ]
64. Couper JJ, Steele C, Beresford S, Powell T, McCaul K, Pollard A, Gellert S, Tait B, Harrison LC, Colman PG. Cow milk is not responsible for most gastrointestinal immune-like syndromes – evidence from a population-based study. Am J Clin Nutr 2005;82:1327-1335. [ Links ]
65. New Zealand Food Safety Authority. Beta casein A1 and A2 in milk and in human health. New Zealand - July, 2004. [ Links ]
66. Truswell AS. The A2 milk case: a critical review. Eur J Clin Nutr 2005;59:623-631. [ Links ]
67. Zoghbi S, Trompette A, Claustre J, El Homsi M, Garzón J, Jourdan G, Scoazec JY, Plaisancié P. "b-casomorphon-7 regulates the secretion and expression of gastrointestinal mucins through a m-opioid pathway". Am J Physiol Gastrointest Liver Physiol 2006;290:G1105-G1113. [ Links ]
68. Clemens RA. Milk A1 and A2 peptides and diabetes. Nestle Nutr Workshop Ser Pediatr Program 2011;67:187-195. [ Links ]
69. Kostraba JN, Cruickshanks KJ, Lawler-Heavner J, Jobim LF, Rewers MJ, Gay EC, Chase HP, Klingensmith G, Hamman RF. Early exposure to cow´s milk and solid foods in infancy, genetic predisposition and risk of IDDM. Diabetes 1993;42:288-295. [ Links ]
70. Perez-Bravo F, Carrasco E, Gutierrez-Lopez MD, Martinez MT, Lopez G, de los Rios MG. Genetic predisposition and environmental factors leading to the development of insulin-dependent diabetes in Chilean children. J Mol Med 1996;74:105-109. [ Links ]
71. Berin MC, Shreffler WG. Th2 adjuvants: implications for food allergy. J Allergy Clin Immunol 2008;121:1311-1320. [ Links ]
72. Harrison LC, Honeyman MC. Cow´s milk and type 1 diabetes. The real debate is about mucosal immune function. Diabetes 1999;48:1501-1507. [ Links ]
73. Vaarala O. Gut and the induction of immune tolerance in type 1 diabetes. Diabetes Metabol Res Rev 1999;15:353-356. [ Links ]
74. Visser J, Rozing J, Sapone A, Lammers K, Fasano A. Tight junctions, intestinal permeability, and autoimmunity: celiac disease and type 1 diabetes paradigms. Ann N Y Acad Sci 2009;1165:195-205. [ Links ]
75. De Kort S, Keszthelyi D, Masclee AA. Leaky gut and diabetes mellitus: what is the link?. Obes Rev 2011;12:449-458. [ Links ]
76. Funda DP, Kaas A, Taskalova-Hogenova H, Buschard K. Gluten-free but gluten-enriched (gluten+) diet prevent diabetes in NOD mice; the gluten enigma in type 1 diabetes. Diabetes Metabol Res Rev 2008;24:59-63. [ Links ]
77. Strachan DP. Hay fever, hygiene and household size. BMJ 1989;299:1259-1260. [ Links ]
78. Bach JF. The effect of infections on susceptibility to autoimmune and allergic diseases. N Eng J Med 2002;347:911-920. [ Links ]
79. Patterson CC, Carson DJ, Hadden DR. Epidemiology of childhood IDDM in Northern Ireland 1989-1994: low incidence in areas of highest population density and most household crowding. Nothern Ireland Diabetes Study Group. Diabetologia 1996;39:1063-1069. [ Links ]
80. Romagnani S. The increased prevalence of allergy and the hygiene hypothesis: missing immune deviation, reduced immune suppression, or both?" Immunology 2004;112:352-363. [ Links ]
81. Cooke A. Review series on helminths, immune modulation and the hygiene hypothesis: how might infection modulate the onset of type 1 diabetes?. Immunology 2008;126:12-17. [ Links ]
82. Okada H, Kuhn H, Feillet H, Bach JF. The hygiene hypothesis for autoimmune and allergic diseases: an update. Clin Exp Immunol 2010;160:1-9. [ Links ]
83. Wilkin TJ. The accelerator hypothesis: a review of the evidence for insulin resistance as the basis for type I as well as type II diabetes. Int J Obes 2009;33:716-726. [ Links ]
84. Pozzilli P, Guglielmi C. Double diabetes: a mixture of type 1 and type 2 diabetes in Youth. Endocr Develop 2009;14:151-166. [ Links ]
85. Pozzilli P, Guglielmi C, Pronina E, Petraikina E. Double or hybrid diabetes associated with an increase in type 1 and type 2 diabetes in children and youth. Pediatr Diabetes 2007;8:88-95. [ Links ]
86. Dabelea D, D'Agostino RB Jr, Mayer-Davis EJ, Pettitt DJ, Imperatore G, Dolan LM, Pihoker C, Hillier TA, Marcovina SM, Linder B, Ruggiero AM, Hamman RF; SEARCH for Diabetes in Youth Study Group. Testing the accelerator hypothesis. Body size, b-cell function, and age of onset of type 1 (autoimmune) diabetes. Diabetes Care 2006;29:290-294. [ Links ]
87. Betts P, Mulligan J, Ward P, Smith B, Wilkin T. Increasing body weight predicts the earlier onset of insulin-dependent diabetes in childhood: testing the accelerator hypothesis. Diabetes Med 2005;22:144-151. [ Links ]
88. Dabelea D. Testing the accelerator hypothesis: Body size, b-cell function, and age of onset of type 1 (autoimmune) diabetes. In response to Wilkin. Diabetes Care 2006;29:1463-1464. [ Links ]
89. Sadauskaité-Kuehne V, Ludvigsson J, Padaiga Z, Jasinskiené E, Samuelsson U. Longer breastfeeding is an independent protective factor against development of type 1 diabetes mellitus in childhood. Diabetes Metabol Res Rev 2004;20:150-157. [ Links ]
90. Virtanen SM, Knip M. Nutritional risk predictors of beta cell autoimmunity and type 1 diabetes at a young age. Am J Clin Nutr 2003;78:1053-1067. [ Links ]
91. Verhasselt V. Neonatal tolerance under breastfeeding influence: the transforming growth factor-beta in breast milk protects the progeny from allergic asthma. J Pediatr 2010;156:S16-S20. [ Links ]
92. Kuzawa CW. Adipose tissue in human infancy and childhood: an evolutionary perspective. Am J Phys Anthropol. 1998;Suppl 27:177-209. [ Links ]
93. Lönnerdal B. Nutritional and physiologic significance of human milk proteins. Am J Clin Nutr 2003;77:1537S-1543S. [ Links ]
94. Lönnerdal B. Bioactive proteins in human milk: mechanism of action. J Pediatr 2010;156:S26-S30. [ Links ]
95. Álvarez de Acosta T, Rossel-Pineda M, Cluet de Rodríguez I, Valbuena E, Fuenmayor E. Macronutrientes en la leche de madres desnutridas. Arch Lat Nutrición 2009;59:159-165. [ Links ]
96. Garofalo R. Cytokines in human milk. J Pediatr 2010;156:S36-S40. [ Links ]
97. Field CJ. The immunological components of human milk and their effect on immune development in infants. J Nutr 2005;135:1-4. [ Links ]
98. Gudiel-Urbano M, Goñi I. Oligosacáridos de la leche humana. Papel en la salud y en el desarrollo del lactante. ALAN 2001;51(4):332-339. [ Links ]
99. German JB, Freeman SL, Lebrilla CB, Mills DA. Human milk oligosaccharides: evolution, structures and bioselectivity as substrates for intestinal bacteria. Nestle Nutr Workshop Ser Pediatr Program 2008;62:205-222. [ Links ]