Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.10 supl.1 Mérida oct. 2012
Tratamiento con antihiperglucemiantes orales: clasificación, propiedades, combinaciones, indicaciones, contraindicaciones y eventos adversos.
Dra. Nancy Salaverría de Sanz, Dra. Gavis Palmucci, Dra. María Suniaga de Daza, Dra. Elsy Velásquez.
INTRODUCCIÓN
Conociendo el comportamiento epidémico de la DM2 y la importancia del control glucémico para prevenir o retardar la aparición de las complicaciones agudas y crónicas asociadas, es importante conocer los diferentes agentes farmacológicos que permitan lograr los objetivos terapéuticos para disminuir la morbimortalidad relacionada a esta enfermedad.
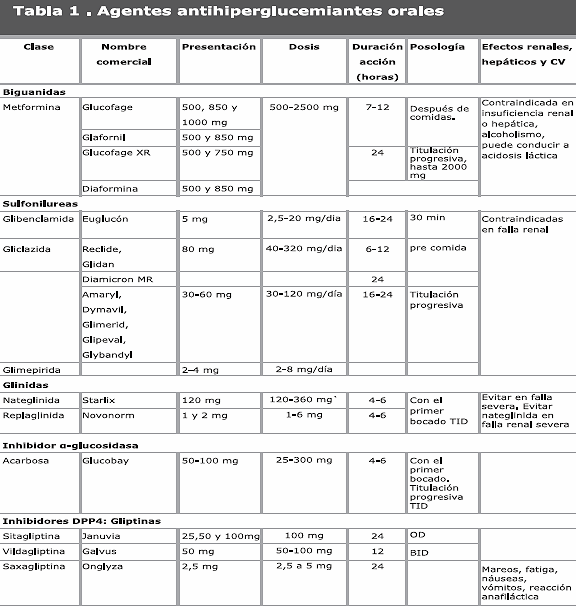
Actualmente existen múltiples opciones terapéuticas para el tratamiento de la DM2, las cuales utilizadas como monoterapia o en combinación pueden ofrecer al clínico diferentes medios para tratar esta enfermedad (Tabla 1).
Los diferentes agentes orales varían de acuerdo a su efectividad hipoglucemiante, efectos extrapancreáticos, perfil de seguridad, tolerabilidad y costos; sin embargo, la efectividad básicamente está relacionada con su capacidad para disminuir y mantener la concentración de HbA1c con buena tolerabilidad, baja incidencia de efectos colaterales y el más bajo costo.
AGENTES ANTIHIPERGLUCEMIANTES
Hasta el presente existen cinco clases terapéuticas de estos agentes orales:
1. Sensibilizadores de insulina: biguanidas y tiazolidinedionas, retiradas recientemente del mercado.
2. Sulfonilureas (SU).
3. Meglitinidas.
4. Inhibidores de la α-glucosidasa.
5. Inhibidores de la DPP4 o gliptinas.
1. SENSIBILIZADORES DE INSULINA:
Estos agentes no son hipoglucemiantes per-se ya que no aumentan la secreción de insulina. Mejoran la respuesta periférica a la misma favoreciendo un mejor control de la glucemia.
1.1 Biguanidas: La metformina disminuye la neoglucogénesis hepática por lo cual se reduce la concentración de la glucemia en ayunas; además, mejora la resistencia periférica a la insulina.
Se recomienda como monoterapia en la DM2 desde el momento del diagnóstico acompañado de cambios de estilo de vida (dieta y ejercicios adecuados). También se utiliza en combinación con otros agentes hipoglucemiantes.
Su administración se asocia con efectos pleiotrópicos beneficiosos como la disminución de la fibrinolisis, de los marcadores de inflamación y de la disfunción endotelial1,2 y una mejoría leve en la concentración de triglicéridos y LDL-C1,3. Además, en el estudio UKPDS4 fue el único agente oral que redujo eventos macrovasculares en sujetos con sobrepeso; en estudios controlados, la metformina ha demostrado que disminuye la concentración de HbA1c en 1-2%3,5. Por otra parte, diversos estudios han demostrado su utilidad en el tratamiento de las mujeres con síndrome de ovarios poliquísticos (SOP), con mejoría de la ovulación y de los parámetros metabólicos en este grupo de mujeres con resistencia a la insulina6. El estudio DPP demostró que la administración de metformina disminuye la tasa de conversión de prediabetes a diabetes franca en el 31% de los individuos tratado, pero fue inferior al 58% obtenido con dieta y ejercicio7.
Los efectos adversos más frecuentes ocurren a nivel gastrointestinal e incluyen: diarrea, náuseas, sabor metálico, meteorismo; estas manifestaciones pueden ser minimizados con titulación progresiva y son poco frecuentes con las presentaciones de liberación prolongada. Raramente se han descrito casos de acidosis láctica, anemia por disminución de la absorción de vitamina B12 y de acido fólico. A pesar de su contraindicación en casos de insuficiencia hepática y renal, recientemente se ha postulado8 que se puede administrar en pacientes con una depuración de creatinina
>30mL/min, tomando en cuenta que debe administrarse con precaución en pacientes con una depuración <60mL/min. Las cifras de creatinina en sangre (hombres: ≥1,5 mg/dL; mujeres ≥1,4mg/dL) pueden orientar en la determinación de la función renal utilizando las fórmulas Modification Diet in Renal Disease (MDRD) o la de Cockroft Gault para los mayores de 80 años (Véase capítulo 13 para más detalle).La disponibilidad de combinaciones de metformina con otros antihiperglucemiantes orales y su nivel de recomendación se cita a continuación:

1.2 Tiazolidinedionas (TZDs) o glitazonas.
Son activadores del factor de transcripción nuclear del proliferador de peroxisomas gamma (PPARγ) y modulan la actividad de ciertos genes vinculados al metabolismo de los carbohidratos y de los lípidos, con reducción de la lipólisis y aumento en la captación celular de la glucosa. Su administración induce además un aumento en la concentración de adiponectina, disminución de los ácidos grasos libres y del factor alfa de necrosis tumoral.
Su efecto más importante es aumentar la sensibilidad a la insulina y la utilización de la glucosa en el adipocito y músculo esquelético9. Se ha demostrado que disminuye la producción hepática de glucosa en menor grado que la metformina. Además de los efectos metabólicos, las TZDs tienen efectos beneficiosos sobre los factores de riesgo cardiovascular, incluyendo citoquinas, marcadores inflamatorios, lípidos, presión arterial, función endotelial y diversos procesos celulares y moleculares involucrados en el proceso de aterosclerosis10. El tratamiento induce una reducción de la HbA1c de 0,5-1,4%11.
Efectos adversos:
edema con aumento de peso (disminución de la excreción renal de sodio) el cual se agrava con la combinación de insulina; insuficiencia cardiaca congestiva y elevación de las transaminasas. Recientemente se ha comprobado una mayor frecuencia de fracturas osteoporóticas en hombres y mujeres, riesgo que se incrementa con la edad y duración del tratamiento, razón por la cual es necesario el seguimiento de la densidad mineral ósea y recomendación de ingesta de calcio con vitamina D12-14.En un meta-analisis conducido por Nissen y colaboradores15 se demostró que la rosiglitazona está asociada con un riesgo alto para infarto del miocardio y muerte por enfermedad cardiovascular. Debido a estos efectos, tanto la EMA (European Medicine Agency) como la FDA (Food and Drug Administration-EE.UU.) suspendieron su uso en la Unión Europea y EE.UU, respectivamente, lo cual fue también decidido por la autoridades sanitarias de Venezuela16-18. Igual situación enfrenta la pioglitazona por una mayor incidencia de cáncer de vejiga, razón por la cual fue retirada del mercado en Francia y Alemania19. Al igual que la FDA, la EMEA concluyó que la pioglitazona no debería indicarse en pacientes con antecedentes de cáncer de vejiga o aquellos en estudio por hematuria macroscópica20.
En Venezuela las autoridades sanitarias no han emitido ninguna resolución respecto al retiro de este medicamento; sin embargo, conociendo los riesgos cardiovasculares y los datos recientes sobre cáncer de vejiga, es recomendable evitar su uso en tales casos.
2. SULFONILUREAS (SU):
glibenclamida, gliclazida, glimepirida (segunda generación).
Estos agentes disminuyen la glucosa al estimular la secreción de insulina por la célula beta pancreática, lo cual se asocia con un aumento en las concentraciones circulantes de insulina; sin embargo su uso prolongado se asocia a una disminución progresiva de la capacidad de la célula beta para aumentar la secreción de insulina, lo cual es reconocido como falla secundaria. El tratamiento con SU generalmente determina una reducción de la HbA1c de 1-2%21. Se pueden utilizar como monoterapia y en combinación con otros agentes antihiperglucemiantes. Se recomienda su administración antes de las comidas. Los efectos adversos incluyen principalmente hipoglucemia y aumento de peso. Raramente se puede presentar: nauseas, reacciones cutáneas, hematológicas y hepáticas. Algunas SU como la glibenclamida se metabolizan tanto a nivel hepático como renal, por lo cual están contraindicadas en los estados de insuficiencia hepática y/o renal y en mujeres lactando. En la decada de los 70, el tratamiento con SU fue implicado como una posible causa de aumento de la mortalidad cardiovascular en el estudio del Programa de Diabetes del Grupo Universitario22, sin embargo estudios posteriores como el UKPDS23 y el ADVANCE24 no evidenciaron aumento de la mortalidad cardiovascular.
3. GLINIDAS (NATEGLINIDA Y REPAGLINIDA)
Al igual que las SU, estimulan rápidamente la secreción de insulina en la célula beta a través de un mecanismo dependiente de la concentración de glucosa, disminuyendo eficientemente la glucemia en el estado postprandial25. Tienen una vida media mas corta por lo cual deben administrase 3 veces al día, con las comidas. Su efectividad es similar a la metformina y SU ya que disminuyen la HbA1c en, aproximadamente, 1,5%; aunque la efectividad de la repaglinida es mayor26. Se pueden utilizar como monoterapia o en combinación con otros agentes orales. Los efectos secundarios son similares a los de las SU e incluyen trastornos gastrointestinales, hipoglucemia y aumento de peso, aunque en menor grado que las SU. Se recomienda su titulación progresiva para atenuar estos efectos.
4. INHIBIDORES DE LA Α-GLUCOSIDASA (ACARBOSA)
Estos fármacos no son hipoglucemiantes y su acción radica en limitar la absorción intestinal de glucosa a través de la inhibición de la enzima alfa glucosidasa; en consecuencia, su principal efecto es la reducción de la glucosa posprandial. Su efectividad para disminuir la HbA1c es 0,5-0,8%. En un estudio se demostró que acarbosa puede disminuir la tasa de conversión a diabetes en pacientes con intolerancia a la glucosa y reducir la frecuencia de eventos cardiovasculares27. Se utiliza como monoterapia o en combinación con SU, gliitazona, glinidas o metformina, previa individualización del paciente. Entre sus efectos adversos se señala flatulencia, distensión abdominal y diarrea en algunos pacientes, por lo que se recomienda administrar antes de las comidas con titulación progresiva para atenuar los efectos gastrointestinales. Está contraindicada en pacientes con colon irritable, cirrosis hepática, insuficiencia renal crónica, embarazo, lactancia y trastornos digestivos crónicos.
5. INHIBIDORES DE LA ENZIMA DPP4 (GLIPTINAS)
Fisiológicamente la ingesta alimentaria induce a la producción de péptidos intestinales que incrementan la secreción de insulina, inhiben la secreción de glucagon y disminuyen la glucosa en el estado posprandial. Esta acción ha sido denominada como efecto incretina. Las principales incretinas son el GLP-1 (Péptido similar al Glucagon 1) y el GIP (Péptido insulinotrópico dependiente de glucosa). Estos péptidos son degradados rápidamente por la enzima dipeptidilpeptidasa tipo 4 (DPP4) con lo cual disminuye su efecto insulinotrópico. La DPP4 es un miembro de la familia de proteínas de la membrana celular que se expresa en muchos tejidos incluyendo las células del sistema inmune. La inhibición de este sistema enzimático permite una vida media mayor de las incretinas liberadas lo cual favorece una prolongación de sus efectos fisiológicos. Actualmente existen: vildagliptina, sitagliptina, saxagliptina aprobados como monoterapia o en terapia combinada con metformina o TZD. Los estudios clínicos han demostrado que disminuyen los niveles de HbA1c en 0,6 – 0,9%, y tienen buena tolerancia. No causan hipoglucemia, interfieren en la función inmune lo cual plantea preocupación ya que se ha reportado un aumento en las infecciones respiratorias superiores.
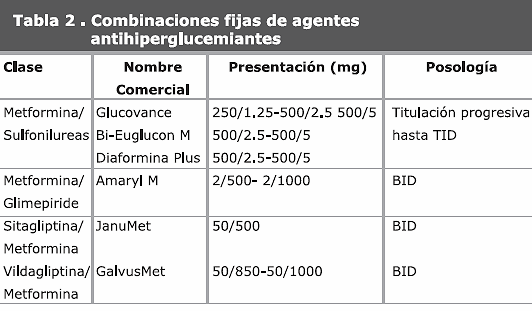
TERAPIA COMBINADA
La fisiopatología de la DM2 implica diversas alteraciones en la acción y secreción de la insulina, disfunción del islote pancreático con secreción inapropiada de glucagon y el deterioro progresivo de las células beta. Por lo anterior, es justificable la combinación de diferentes agentes farmacológicos con diferentes mecanismos de acción que permitan lograr las metas de control metabólico y prevenir o retardar las complicaciones agudas y crónicas
(Tabla 2)28.En la figura 1 se han resumido, bajo la estructura de un algoritmo, las diversas alternativas farmacológicas teniendo como punto de partida las modificaciones del estilo de vida y la cuantía de la cifra de HbA1c al iniciar el tratamiento.
CONCLUSIONES
El tratamiento farmacológico actual incluye diversos agentes que actúan en los mecanismos de la fisiopatología de la diabetes tipo 2 y de las etapas evolutivas de la enfermedad.
Por lo tanto, la elección adecuada del mismo requiere de la individualización adecuada de cada paciente que permita la selección del agente que garantice un control óptimo de la glucosa con la menor incidencia de efectos adversos (Tabla 3).
REFERENCIAS BIBLIOGRÁFICAS
1. Fontbonne A, Charles MA, Juhan-Vague I, Bard JM, Andre P, Isnard F, et al. The effect of metformin on the metabolic abnormalities associated with upper-body fat distribution. Diabetes Care 1996;19:920-926. [ Links ]
2. Mather KJ, Verma S, Anderson TJ. Improved endothelial function with metformin in type 2 diabetes mellitus. J Am Coll Cardiol 2001;37:1344-1350. [ Links ]
3. DeFronzo RA, Goodman AM. Efficacy of metformin in patient with non-insulin-dependent diabetes mellitus. N Engl J Med 1995;333:541-549. [ Links ]
4. U K Prospective Diabetes Study Group. Effect of intensive blood glucose control with metfomin on complications in overweight patient with type 2 diabetes (UKPDS 34). Lancet 1998;352:854-865. [ Links ]
5. Dornan T, Heller S, Peck G, Tattersall R. Double-Blind evaluation of efficacy and tolerability of metformin in NIDDM. Diabetes Care 1991;14:342-344. [ Links ]
6. Velazquez E, Mendoza S, Hamer T, Sosa F, Glucck C. Metformin therapy in women with polycistic ovary syndrome reduces hyperinsulinemia, insulin resistence, hyperandrogenemia and systolic blood pressure, while facilitating menstrual regularity and pregnancy. Metabolism 1994;43: 647-655. [ Links ]
7. Knowler WC, Barrett-Connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002;346:393–403. [ Links ]
8. de Jager J, Kooy A, Lehert P, Wulffelé MG, van der Kolk J, Bets D, et al. Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: randomised placebo controlled trial. BMJ 2010;340:c2181. [ Links ]
9. Yke-Jarvinen H. Drug therapy: thiazolidinediones. N Engl J Med 2004;351:1106- 18. [ Links ]
10. Haffner SM, Greenberg AS, Weston WM, Chen NH, Williams K, Freed ML. Effect of rosiglitazone treatment on non tradicional markers of cardiovascular disease in patient with type 2 diabetes mellitus. Circulation 2002;106:679-684. [ Links ]
11. Rosentock J, Shen SG, Gadlin MR, Foley JE. Combination therapy with nateglinide and a thiazolidinedione improves glicemic control type 2 diabetes. Diabetes Care 2002;25:1529-1533. [ Links ]
12. Meier C, Kraenzlin ME, Bodmer M, Jick SS, Jick H, Meier
CR. Use of thiazolidinediones and fracture risk. Arch Intern Med 2008;168:820-825. [ Links ]13. Riche DM, Travis King S. Bone loss and fracture risk associated with thiazolidinedione therapy. Pharmacotherapy 2010;30:716-27. [ Links ]
14. Lecka-Czernik B. Bone loss in diabetes: use of antidiabetic thiazolidinediones and secondary osteoporosis. Curr Osteoporos Rep 2010;8:178-84. [ Links ]
15. Nissen SE, Wolski K. Rosiglitazone Revisited: An Updated Meta-analysis of Risk for Myocardial Infarction and Cardiovascular Mortality. Arch Intern Med 2010; 170: 1191 - 1201. [ Links ]
16. Xiang AH, Peters RK, Kjos SL, Marroquin A, Goico J, Ochoa E, et al. Effect of pioglitazone on pancreatic ß-cell function and diabetes risk in hispanic women with prior gestational diabetes. Diabetes 2006;55:517-522. [ Links ]
17. FDA Drug Safety Podcast: FDA significantly restricts access to the diabetes drug Avandia, 2010/09/23 en http://www.fda.gov/Drugs/DrugSafety/DrugSafetyPodcasts/ucm227511.htm, acceso del 12.10.2010. [ Links ]
18. http://www.ema.europa.eu/docs/en_GB/document_library/Press_release/2010/09/WC500096996.pdf acceso del 12.10.2010 [ Links ]
19. Risque de cancer de la vessie chez les personnes diabétiques traitées par pioglitazone en France : une étude de cohorte sur les données du SNIIRAM et du PMSI. Caisse nationale de lassurance maladie, Paris, France. Rapport final du 7/06/2011 en http://www.afssaps.fr/var/afssaps_site/storage/original/application/b42a6bf9a1b63c3dbec7388d3914687b.pdf [ Links ]
20. Food and Drug Administration. FDA Drug Safety Communication: Updated drug labels for pioglitazone-containing medicines. August 4, 2011. [ Links ]
21. Groop L. Sulfonylureas in NIDDM. Diabetes Care 1992;15:737-747. [ Links ]
22. Meinert CL, Knatterud GL, Prout TE, et al. The University Group Diabetes Program: a study of the effect of hypoglycemic agents on vascular complications in patients with adult-onset diabetes. II Mortality results. Diabetes 1970;19 (Suppl. 1):789-830. [ Links ]
23. UK Prospective Diabetes Study (UKPDS) Group: Intensive blood glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complication in patients with type 2 diabetes (UKPDS 33). Lancet 1998;352:837- 853. [ Links ]
24. The ADVANCE Collaborative Group. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560-2572. [ Links ]
25. Hanefeld M, Bouter KP, Dickinson S, Guitard C. Rapid and short-acting mealtime insulin secretion with nateglinide controls both prandial and mean glycemia. Diabetes Care 2000;23:202-207. [ Links ]
26. Jovanovic l, Dailey G 3rd, Huang WC, Strange P, Goldstein TJ. Repaglinide in type 2 diabetes. Diabetes: a 24- week, fixed-dose efficacy and safety study. J Clin Pharm 2000;40:49-57. [ Links ]
27. Chiasson JL, Josse RG, Gomis R, Hanefeld M, Karasik A, Laakso M, The STOP- NIDDM trial Research Group. Acarbose treatment and the risk of cardiovascular disease and hypertension in patient with impaired glucose tolerance: The STOP- NIDDM Trial. JAMA 2003;290:486-494. [ Links ]
28. Nathan DM, Buse JB, Davidson MB, Ferrannini E, Holman RR, Sherwin R, Zinman B, American Diabetes Association; European Association for Study of Diabetes. Medical management of hyperglycemia in type 2 diabetes: a consensus algorithm for the initiation and adjustment of therapy: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2009;32:193-203. [ Links ]