Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.12 no.3 Mérida oct. 2014
La hormona de crecimiento durante el período de transición
Fideleff HL, Boquete HR, Suárez M, Azaretzky M.
Unidad de Endocrinología, Departamento de Medicina. Hospital T. Álvarez, Buenos Aires, Argentina.
Dirigir correspondencia a: Dr. Hugo Fideleff, Email: hugofideleff@arnet.com.ar
RESUMEN
La etapa de transición ha sido definida como el período de la vida que comienza hacia el fin de la pubertad y finaliza cuando se adquiere la maduración adulta completa. Esta fase dura aproximadamente 6 a 8 años y durante la misma se producen una serie de modificaciones cuantitativas y cualitativas en la esfera física y psíquica, caracterizadas por la adquisición de la talla y composición corporal adulta, del pico de masa ósea, la obtención de una plena capacidad fértil y, finalmente, de las características psicosociales propias del adulto. Deben recordarse los efectos que la hormona de crecimiento (GH) ejerce a lo largo de toda la vida del sujeto sobre el metabolismo, función y estructura cardíaca, hueso, composición corporal y calidad de vida. Sin embargo, hay datos conflictivos sobre la necesidad de continuar, sin interrupción, con la terapia de GH durante la etapa de transición. Se debe tener en cuenta, también, que existe un grupo de pacientes que adquieren la insuficiencia de GH durante el período de transición. Si bien existen claras evidencias que indican no discontinuar el tratamiento luego de haber finalizado la etapa de crecimiento, los pacientes deben ser reevaluados previamente para constatar si el déficit es suficientemente severo como para justificar mantener la terapéutica con GH. La respuesta a gran parte de estas dudas podrá resolverse con estudios randomizados y observacionales a largo plazo, desarrollados por equipos multidisciplinarios especializados.
ABSTRACT
Transition phase has been defined as the period of life starting in late puberty and ending with full adult maturation. This phase extends over approximately 6 to 8 years. A number of quantitative and qualitative changes occur during this phase both in physical and psychic aspects, which are characterized by attainment of adult height and body composition, peak bone mass, full reproductive potential and, finally, psychosocial characteristics inherent to adults. We should remember the effects exerted by growth hormone (GH) throughout the life of a subject on metabolism, cardiac function and structure, bone, body composition and quality of life. However, there are controversial data on the need to continue GH therapy during the transition period with no discontinuation. We should also take into account that there is a group of patients who develop GH deficiency during the transition period. Even if there is clear evidence against discontinuation of therapy after completion of the growth period, patients should be previously reevaluated to confirm if GH deficiency is severe enough to warrant continuation of GH therapy. The response to many of these issues may be obtained from long-term randomized and observational studies conducted by specialized multidisciplinary teams.
Articulo recibido en: Marzo 2014. Aceptado para publicación en: Junio 2014.
INTRODUCCIÓN
La etapa de transición ha sido definida como el período de vida que comienza hacia el fin de la pubertad y finaliza cuando se adquiere la maduración adulta completa. Esta fase dura aproximadamente 6 a 8 años y durante la misma se producen una serie de modificaciones cuantitativas y cualitativas en la esfera física y psíquica, caracterizadas por la adquisición de la talla y composición corporal adulta, del pico de masa ósea, la obtención de una plena capacidad fértil y finalmente, de las características psicosociales propias del adulto1,2. Este período en la especie humana es largo y complejo y es inapropiado considerarlo tanto como una extensión de la adolescencia, como un inicio de las primeras etapas de la adultez.
El crecimiento lineal y la adquisición de la talla final no significan el fin de la acción de la hormona de crecimiento (GH). Por el contrario, deben recordarse los efectos que la GH ejerce a lo largo de toda la vida del sujeto sobre el metabolismo, función y estructura cardíaca, hueso, composición corporal y calidad de vida1,2. Ello significa que ante la presencia de trastornos de la GH en la infancia, el perfil secretorio de la misma durante el período de transición debe ser reevaluado, y conjuntamente profundizar el estudio de factores de riesgo cardiovascular, perfil lipídico, metabolismo óseo, calidad de vida, etc3.
Los adultos jóvenes con deficiencia de hormona de crecimiento (GHD) constituyen un grupo heterogéneo, que pueden presentar empeoramiento en el perfil metabólico, en la composición corporal y calidad de vida (QoL), con buena respuesta a la terapia de reemplazo1,3. Tal heterogeneidad podría ser parcialmente relacionada al momento de comienzo de la enfermedad, ya que hay adultos con GHD de comienzo en la infancia (CO-GHD), quienes han completado su crecimiento, y pacientes que desarrollaron la deficiencia en forma tardía en la vida durante la adolescencia o en la adultez. El tratamiento con GH tiene como objetivo principal, en la infancia, estimular el crecimiento lineal, para llegar a una talla final acorde con la talla blanco genética. También en esta etapa de la vida, dicho tratamiento juega un rol importante en alcanzar y mantener la maduración somática, metabólica y la mineralización ósea. Por otra parte en adultos con GHD (AO-GHD) ha sido descrito disminución de la masa magra corporal, alteración del metabolismo lipídico, incremento del riesgo cardiovascular y alteración de la calidad de vida3-13. Esto plantea que en los pacientes con GHD de comienzo en la infancia (CO-GHD) deben reevaluarse para, una vez completada la etapa de crecimiento, corroborar si continúan siendo severamente insuficientes de hormona de crecimiento, lo cual justificaría continuar con el tratamiento sustitutivo14-18. Al respecto hay datos conflictivos19 sobre la necesidad de continuar con la terapia de GH durante la etapa de transición sin interrupción. La mayoría de los estudios sugieren que la continuación del tratamiento de GH podría prevenir el comienzo de las alteraciones metabólicas y el deterioro de la composición corporal, mientras que el impacto del tratamiento sobre la calidad de vida y el bienestar psicológico queda por establecerse20.
Finalmente se debe tener en cuenta que existe un grupo de pacientes que adquieren la insuficiencia de GH durante el período de transición21. Por todo ello, este conjunto de variables consignadas plantean una serie de interrogantes durante el período de transición.
1) ¿Quiénes deben ser reevaluados?
2) ¿Cuándo reevaluar?
3) ¿Cómo reevaluar?
Si se comprobara la persistencia del déficit de GH y se decidiera tratarla, se plantean otros nuevos interrogantes:
1) ¿Por qué tratar con GH?
2) ¿A quiénes tratar?
3) ¿Cómo tratar?
Estos aspectos conflictivos son, en gran parte, debidos a que el período de transición constituye una etapa sumamente dinámica por lo que podría considerarse en realidad, un blanco móvil.
La necesidad de reevaluar se debe a que la normalización de la secreción de GH, finalizado el período de crecimiento longitudinal, ha sido descrita hasta en un 44% de los pacientes con patología orgánica y/o deficiencia hipofisaria múltiple y hasta en un 88% en pacientes con déficit aislado e idiopático de GH8. Es importante consignar que el valor del pico de GH cuando se efectúa el diagnóstico de GHD en la etapa pediátrica, no predice el resultado de la reevaluación futura. Resulta interesante señalar al respecto que la deficiencia de tres hormonas hipofisarias, presenta un valor predictivo positivo del 96% para GHD, y que frente a la presencia de deficiencia de cuatro hormonas hipofisarias el mismo es del 99%14. También debe tenerse en cuenta que la dinámica secretoria de GH es distinta en los niños en crecimiento, de aquellos pacientes que están alcanzando la talla final adulta; por lo tanto la evaluación en las diferentes edades tiene patrones específicos según los respectivos momentos evolutivos. Al igual que en otras etapas de la vida, los factores que contribuyen a las dificultades diagnósticas, son las diferentes metodologías utilizadas para el dosaje de GH, acorde con el uso de diferentes calibradores de ensayos de GH, la heterogeneidad de la molécula, posibles interferencias con la proteína transportadora de hormona de crecimiento (GHBP), las diferentes especificidades para distintos epitopes de GH y anticuerpos, etc.
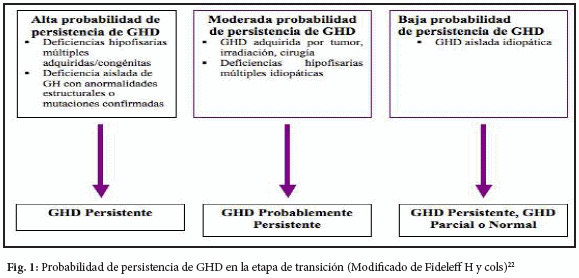
● ¿A QUIÉN RE-EVALUAR?:
Se deberían considerar tres posibles grupos de pacientes, según las posibilidades de persistencia de GHD sean altas, moderadas o bajas (figura 1)22. Esto adquiere fundamental importancia para la selección de la metodología más apropiada para la re-evaluación.
● ¿CUÁNDO RE-EVALUAR?:
Se han utilizado diferentes criterios, pero desde un punto de vista práctico, podría considerarse efectuarlo cuando los pacientes han alcanzado el 98-99% de la talla final adulta. Esto se puede definir por una velocidad de crecimiento menor de 1,5 a 2 cm/año o edad ósea superior a los 14-15 años en las niñas y 16-17 años en los varones23,24.
Además, debería suspenderse el tratamiento sustitutivo con GH durante 1 a 3 meses, aunque el tiempo de suspensión no ha sido suficientemente validado, ha sido recomendado por la GH Research Society25-27.
● ¿CÓMO RE-EVALUAR?:
Para contestar esta interrogante se deberían tener en cuenta los tres tipos de posibilidades previamente mencionadas: pacientes con alta, moderada o baja probabilidad de persistencia del déficit de GH.
Factor de crecimiento insulinosímil-I (IGF-I):
En pacientes con historia de GHD en la niñez, secundaria a lesiones estructurales o con insuficiencia hipofisaria múltiple o en aquellos originados en diferentes causas genéticas debidamente constatadas, una IGF-I baja podría ser suficiente para avalar el diagnóstico de insuficiencia de GH. Sin embargo, debe tenerse en cuenta la variabilidad de los distintos ensayos para IGF-I y las diferentes líneas de corte propuestas. Por tal razón, el consenso internacional de varias sociedades endocrinológicas en el 2007 enfatizó la necesidad de contar, para los dosajes, con calibradores universales que empleasen IGF-I recombinante de extrema pureza y además, expresar los valores de referencia para edad y género en términos de Score de Desvío Standard (SDS)15. Debe destacarse que en relación a las líneas de corte de normalidad, estas han sido ampliamente estudiadas para pacientes pediátricos y adultos, pero aun no existe suficiente experiencia en pacientes con GHD durante el período de transición. Finalmente, debe descartarse la presencia de estados catabólicos, diabetes o desnutrición, que puedan modificar los valores de IGF-I.
Pruebas dinámicas:
Durante los últimos años, diversos autores han sugerido que los tests de estímulo para GH deberían ser reemplazados en el momento actual por otras metodologías más específicas y sofisticadas28,29. Sin embargo y aún reconociendo estas limitaciones, los tests aún juegan un rol fundamental para el diagnóstico de la GHD. El test de hipoglucemia insulínica (ITT) es considerado el gold standard sin dejar de reconocer sus riesgos potenciales y la necesidad de un control estricto durante la realización del mismo. Otro test alternativo ha sido la utilización de la hormona liberadora de hormona de crecimiento (GHRH) + Arginina, sin embargo, desde hace varios años, el GH-RH no ha estado disponible en gran parte del mundo, por lo que se han sugerido métodos alternativos. En base a ello, se ha propuesto el test de glucagon, ya que ofrece ciertas ventajas, tales como pocos efectos secundarios, escasas contraindicaciones, buena tolerancia y eventualmente sirve para la evaluación simultánea del eje hipotálamo – hipófiso – suprarrenal2,30,31.
Es importante destacar que, a diferencia de lo aceptado en la edad pediátrica, durante la etapa de transición las líneas de corte, para definir la insuficiencia son diferentes (figura 2).
¿A QUIÉN Y CÓMO TRATAR?:
Durante los últimos años un gran número de autores han estudiado las consecuencias de discontinuar el tratamiento con GH en el corto y mediano plazo. Se han tenido en cuenta una serie de consideraciones clínicas referidas a alteraciones metabólicas, factores de riesgo cardiovascular, contenido y densidad mineral ósea y calidad de vida13,32,33. Los estudios han mostrado resultados contradictorios entre los diferentes grupos de investigadores y esto se podría explicar, por lo menos en parte, por la heterogeneidad de las poblaciones evaluadas y el relativo escaso número de pacientes estudiados durante la etapa de transición. También se debe mencionar que la presencia de otras deficiencias hipofisarias asociadas y su adecuado reemplazo, juegan un importante rol en estos hallazgos discrepantes.
En un análisis que realizamos sobre más de 1300 pacientes GHD durante la etapa de transición21, evaluamos separadamente aquellos que habían comenzado su deficiencia en la infancia de los que desarrollaron el déficit durante el período de transición. Una observación interesante fue que, a pesar de presentar diferente impacto clínico previamente al tratamiento con GH, la respuesta fue similar en ambos grupos luego de 3 años de terapéutica sustitutiva. Con respecto a los parámetros cardiovasculares, en muchos pacientes con GHD, se ha señalado una elevación de la tensión arterial (TA), particularmente diastólica, y a nivel cardíaco, se ha descrito una baja masa cardíaca, disminución del inotropismo y de la pre y post-carga. Estas alteraciones producirían deterioro de la función ventricular5,34,35 (Figura 3).
En nuestra experiencia, la evaluación cardiológica mostró variabilidad intra e inter-individual con mejoría intratratamiento de la masa cardíaca en pacientes con valores de índice de masa cardíaca menores a 60 g/m2 y descenso de la TA diastólica36.
Se ha descrito, bajo tratamiento sustitutivo con GH, un incremento en la masa magra y una tendencia a la disminución de la masa grasa, independientemente de los cambios en el índice de masa corporal y/o en la circunferencia de cintura37. También se han observado efectos favorables sobre el perfil lipídico, fundamentalmente sobre los niveles de colesterol total y en el subgrupo de pacientes CO-AGHD. Todos estos cambios podrían disminuir la agresión endotelial y el estado pro-ateroesclerótico descrito en pacientes GHD36,37.
Es conocido el efecto adverso que la GH ejerce sobre el metabolismo hidrocarbonado, sin embargo, diferentes estudios mostraron, en general, que los valores de glucemia permanecían normales durante el tratamiento sustitutivo con GH. De todos modos, es importante recordar las dificultades en la evaluación de estos pacientes, quienes están finalizando el período fisiológico de insulinorresistencia asociado con la pubertad36,38,39.
Diferentes grados de alteración de la masa ósea y su estructura han sido reportados, dependiendo ello, no sólo de la deficiencia de GH y su terapéutica, sino además del tratamiento de otros déficits de hormonas hipofisarias asociados. Han sido referidos también, trastornos en los parámetros bioquímicos de formación ósea40. Todas estas alteraciones se han visto reflejadas en un incremento del riesgo de fracturas. Las diferentes variables estudiadas en los distintos trabajos (contenido mineral óseo, densidad mineral ósea [DMO] areal y DMO volumétrica) han contribuido a las discrepancias en la interpretación de los resultados obtenidos por diferentes investigadores. Esto se ha observado, particularmente, en aquellos niños con una inadecuada terapéutica sustitutiva y mantenimiento de una baja estatura, lo cual condiciona una severa reducción de la DMO areal con conservación de una DMO volumétrica normal40. De todos modos, no ha sido establecido aun, el grado real de compromiso óseo durante la etapa de transición.
El estudio de la calidad de vida (QoL) en pacientes con GHD ha sido considerado un tema de trascendental importancia, por lo que se han desarrollado test psicométricos específicos para esta patología, para poder, de tal manera, efectuar una correcta evaluación y seguimiento de cada caso41. Empleando uno de dichos test, el Adult Growth Hormone Deficiency Assesment (AGHDA-Qol), pudimos observar, al igual que otros autores, que pacientes con GHD adquirida en edades mayores tenían peor QoL42. A pesar de que algunos autores no han encontrado alteraciones de la misma durante la fase de transición, es evidente que al descontinuar la terapéutica, un importante número de pacientes puede empeorar su QoL. En nuestra experiencia, intratratamiento, las áreas donde observamos mejorías significativas fueron en la sensación de distress, el nivel de energía, la reacción emocional y el aislamiento social42. Se ha especulado que la mejoría de la QoL durante el tratamiento con GH, podría depender del efecto lipolítico de esta hormona con el consecuente adelgazamiento de los pacientes. Sin embargo, nosotros pudimos constatar, en otro estudio, que el tratamiento con GH mejoraba la QoL independientemente de las modificaciones de los parámetros de obesidad evaluados (circunferencia de cintura, índice de masa corporal y porcentaje de grasa corporal medida por impedancia bioeléctrica)43. De todos modos, es importante destacar que la evaluación de QoL no ha sido efectuada con metodología y/o cuestionarios específicamente diseñados y validados para pacientes en la etapa de transición.
Independientemente de los beneficios, costos económicos y riesgos del mantenimiento de la terapéutica durante el período de transición, debemos entender que la deficiencia de GH constituye un continuum a lo largo de la vida. Por lo tanto, dependiendo de la severidad de la enfermedad, habrá pacientes seriamente afectados en quienes el beneficio de la continuidad del tratamiento resulte obvio, mientras que en otros casos, deberían evaluarse minuciosamente las posibles ventajas que pueden obtenerse sobre el metabolismo lipídico y óseo, los factores de riesgo cardiovascular y la QoL para definir si debe mantenerse la terapéutica sustitutiva. Por ello, cada caso debe ser evaluado en forma individual y resulta necesario incorporar al paciente y su familia en la toma de decisiones, informándoles que numerosos estudios revelan los efectos beneficiosos que se obtienen, independientemente si la enfermedad se manifestó durante la niñez o adolescencia, siempre que se constate la persistencia de una severa insuficiencia durante el período de transición.
Si bien no existe consenso y resultados definitivos, los esquemas de tratamiento que se adoptan, en general, son los mismos que para el adulto y no los que se emplean en la etapa pediátrica. Ello se basa en que el objetivo terapéutico no es una respuesta en términos de crecimiento longitudinal, sino efectos beneficiosos metabólicos, los cuales se obtienen habitualmente con dosis considerablemente menores. En nuestra opinión, el control de la dosis debe efectuarse mediante dosajes periódicos de IGF-I, tratando de mantener las concentraciones de la misma entre 0 y 2 SDS. Se deben recordar las interferencias con otros tratamientos hormonales y que el cambio de dosis de GH puede hacer necesario efectuar ajustes de las dosis de los restantes tratamientos sustitutivos en curso. También debe tenerse en cuenta que los estrógenos disminuyen la acción biológica de la GH, lo cual requiere un incremento de la dosis a administrar. Es importante tener en cuenta, además, que el tratamiento de novo puede desenmascarar un hipotiroidismo o una insuficiencia suprarrenal secundarias. Con respecto a la seguridad del tratamiento, no hay evidencias en relación a la inducción de crecimiento tumoral, ni aparición de nuevas neoplasias, aunque está contraindicado en pacientes con neoplasias en curso44. Finalmente, y como aspecto fundamental en el control del tratamiento, deberá tenerse en cuenta la favorable evolución de los parámetros clínicos y la eventual aparición de efectos adversos.
En conclusión, si bien existen claras evidencias que indican no discontinuar el tratamiento luego de haber finalizado la etapa de crecimiento, los pacientes deben ser reevaluados previamente para constatar si el déficit es suficientemente severo como para justificar mantener la terapéutica con GH. Este criterio se ve reforzado por el hecho de que el mantenimiento de un tratamiento crónico por vía inyectable de aplicación diaria es causal de un importante número de abandonos, por lo cual las preparaciones de GH de larga duración constituirán un recurso invalorable.
De todas maneras, siguen vigentes una serie de interrogantes:
¿La maduración tisular de las poblaciones GHD es diferente a la de los sujetos sanos?
¿El adecuado tratamiento puede contribuir a la maduración tisular en estos casos?
¿Es válido plantear períodos de descontinuación?
¿Podemos asegurar que niveles subóptimos de IGF-I son los responsables esenciales de las alteraciones de la función cardiaca, trastornos lipídicos, fenómenos ateroescleróticos prematuros, disminución de la actividad fibrinolítica y disfunción endotelial?
¿Hay evidencias suficientes de que en el largo plazo los pacientes se verán beneficiados?
¿Son adecuadas las dosis de GH utilizadas durante el período de transición?
La respuesta a gran parte de estas dudas podrá resolverse con estudios randomizados y observacionales a largo plazo, desarrollados por equipos multidisciplinarios especializados.
REFERENCIAS BIBLIOGRÁFICAS
1. Rosenfeld RG, Nicodemus BC. The transition from adolescence to adult life: Physiology of the transition phase and its evolutionary basis. Horm Res 2003; 60 (suppl 1): 74-77. [ Links ]
2. Hochberg Z. Evo-devo of child growth II: human life history and transition between its phases. Eur J Endocrinol 2009; 160: 135-141. [ Links ]
3. Drake WM. Transition of growth hormone-deficient patients from paediatric to adult endocrinologists, In Abs R, Feldt-Rasmussen U (Eds), Growth Hormone Deficiency in Adults-10 Years of KIMS, Oxford Pharmagenesis Ltd., Oxford; 2004: 209-218.
4. Shalet SM, Shavrikova E, Cromer M, Child CJ, Keller E, Zapletalová J, Moshang T, Blum WF, Chipman JJ, Quigley CA, Attanasio AF. Effect of growth hormone (GH) treatment on bone in postpubertal GH-deficient patients: a 2-year randomized, controlled, dose-ranging study. J Clin Endocrinol Metab 2003; 88: 4124–4129. [ Links ]
5. Tauber M, Jouret B, Cartault A, Lounis N, Gayrard M, Marcouyeux C, Pienkowski C, Oliver I, Moulin P, Otal P, Joffre F, Arnaud C, Rochiccioli P. Adolescents with partial growth hormone (GH) deficiency develop alterations of body composition after GH discontinuation and require follow-up. J Clin Endocrinol Metab 2003; 88: 5101–5106. [ Links ]
6. Clayton P, Gleeson H, Monson J, Popovic V, Shalet SM, Christiansen JS. Growth hormone replacement throughout life: insights into age-related responses to treatment. GH & IGF Res. 2007; 17: 369 – 382. [ Links ]
7. Fideleff HL, Boquete HR, Giaccio A, Sobrado P. Medium and long-term outcome of growth hormone therapy in growth hormone deficient adults. Medicina 2006; 66: 296 – 302. [ Links ]
8. Radovick S, DiVall S. Approach to the growth hormone-deficient child during transition to adulthood. J Clin Endocrinol Metab 2007; 92: 1195 – 1200. [ Links ]
9. Mauras N. GH use in the transition of adolescence to adulthood. Endocr Dev 2010; 18: 109 – 125. [ Links ]
10. Carroll PV, Drake WM, Maher KT, Metcalfe K, Shaw NJ, Dunger DB, Cheetham TD, Camacho-Hübner C, Savage MO, Monson JP. Comparison of continuation or cessation of growth hormone (GH) therapy on body composition and metabolic status in adolescents with severe GH deficiency at completion of linear growth. J Clin Endocrinol Metab 2004; 89: 3890 – 3895. [ Links ]
11. Vahl N, Juul A, Jorgensen JO, Skakkebaek NE, Christiansen JS. Continuation of growth hormone (GH) replacement in GH-deficient patients during transition from childhood to adulthood: a two-year placebo-controlled study. J Clin Endocrinol Metab 2000; 85: 1874 – 1881. [ Links ]
12. Shalet SM, Shavrikova E, Cromer M, Child CJ, Keller E, Zapletalová J, Moshang T, Blum WF, Chipman JJ, Quigley CA, Attanasio AF. Effect of growth hormone (GH) treatment on bone in postpubertal GH-deficient patients: a 2 year randomized, controlled, doseranging study. J Clin Endocrinol Metab 2003; 88: 4124 – 4129. [ Links ]
13. Colao A, Di Somma C, Salerno M, Spinelli L, Orio F, Lombardi G. The cardiovascular risk of GH-deficient adolescents. J Clin Endocrinol Metab 2002; 87: 3650– 3655. [ Links ]
14. Shalet SM. Stepping into adulthood: The transition period. Horm Res 2004; 62: 15–22. [ Links ]
15. Ho KKY, 2007 GH Deficiency Consensus Workshop Participants: Consensus guidelines for the diagnosis and treatment of adults with GH deficiency II: a statement of the GH Research Society in association with the European Society for Pediatric Endocrinology, Lawson Wilkins Society, European Society of Endocrinology, Japan Endocrine Society, and Endocrine Society of Australia. Eur J Endocrinol 2007; 157: 695–700.
16. Molitch ME, Clemmons DR, Malozowski S, Merriam GR, Vance ML. Evaluation and treatment of adult growth hormone deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96: 1587–1609. [ Links ]
17. Cook DM, Yuen KCJ, Biller BMK, Kemp SF, Vance ML. American Association of Clinical Endocrinologists medical guidelines for clinical practice for growth hormone use in growth hormone-deficient adults and transition patients. Endocr Pract 2009; 15(Suppl 2): 1–29. [ Links ]
18. Radovick S, DiVall S. Approach to the growth hormonedeficient child during transition to adulthood. J Clin Endocrinol Metab 2007; 92: 1195–1200. [ Links ]
19. Mauras N, Pescovitz OH, Allada V, Messig M, Wajnrajch MP, Lippe B; Transition Study Group. Limited efficacy of growth hormone (GH) during transition of GH-deficient patients from adolescence to adulthood: a phase III multicenter, double-blind, randomized two-year trial. J Clin Endocrinol Metab 2005; 90: 3946 – 3955. [ Links ]
20. Inzaghi E, Cianfarani S. The challenge of growth hormone deficiency diagnosis and treatment during the transition from puberty into adulthood. Front Endocrinol. 2013; 4: 1-8. [ Links ]
21. Fideleff HL, Jonsson BJ, Koltowska M, Boguszewski MC, Wilton P, Boquete HR. GH deficiency during the transition period: clinical characteristics before and after GH replacement therapy in two different subgroups of patients. J Pediatr Endocr Metab 2012; 25: 97–105. [ Links ]
22. Fideleff H, Boquete H, Suárez M, Azaretzky M. La hormona de crecimiento durante el período de transición. Ensayos sobre crecimiento y desarrollo. Fano V., Pino M., Caino S. Ed. Paidós, Buenos Aires 2011; 89-98.
23. Clayton PE, Cuneo RC, Juul A, Monson JP, Shalet SM, Tauber M, European Society of Paediatric Endocrinology. Consensus statement on the management of the GH-treated adolescent in the transition to adult care. Eur J Endocrinol 2005; 152: 165-170. [ Links ]
24. Attanasio AF, Shalet SM. Growth hormone and the transition from puberty into adulthood. Endocrinol Metab Clin North Am. 2007; 36: 187–201. [ Links ]
25. Growth Hormone Research Society. Consensus guidelines for the diagnosis and treatment of growth hormone(GH) deficiency in childhood and adolescence: summary statement of the GH Research Society. GH Research Society. J Clin Endocrinol Metab 2000; 85: 3990–3993.
26. Geffner ME. Transition to the adult endocrine clinic: testing pituitary function what tests and when? Growth Horm. IGF Res 2003; 13 (Suppl.A): 117–121. [ Links ]
27. Molitch ME, Clemmons DR, Malozowski S, Merriam GR, Shalet SM, Vance ML; Endocrine Societys Clinical Guidelines Subcommittee, Stephens PA. Evaluation and treatment of adult growth hormone deficiency: an Endocrine Society Clinical Practice Guideline. J. Clin.Endocrinol. Metab 2006; 91: 1621– 1634.
28. Badaru A, Wilson DM. Alternatives to growth hormone stimulation testing in children. Trends Endocrinol Metab 2004; 15: 252-258. [ Links ]
29. Gandrud LM, Wilson DM. Is growth hormone stimulation testing in children still appropriate? Growth Horm IGF Res 2004; 14: 185-194. [ Links ]
30. Geffner ME. Growth Hormone Replacement Therapy: Transition from adolescence to adulthood. J Clin Res Pediatr Endocrinol 2009; 1: 205-208. [ Links ]
31. Secco A, Iorgi N, Napoli F, Calandra E, Ghezzi M, Frassinetti C, Parodi S, Casini MR, Lorini R, Loche S, Maghnie M. The glucagon test in the diagnosis of growth hormone deficiency in children with short stature younger than 6 years. J Clin Endocrinol Metab 2009; 94: 4251– 4257. [ Links ]
32. Lanes R, Gunczler P, Lopez E, Esaa S, Villaroel O, Revel-Chion R. Cardiac mass and function, carotid artery intima-media thickness, and lipoprotein levels in growth hormone deficient adolescents. J Clin Endocrinol Metab 2001; 86:1061–1065. [ Links ]
33. Fideleff HL, Chervin A, Giaccio A, Sobrado P, Barmat R, Boquete H. Adult growth hormone deficiency: metabolic alterations and evaluation of different risk groups. Medicina 2004; 64: 13-19. [ Links ]
34. Fideleff HL, Boquete HR Growth hormone (GH) deficiency and GH replacement therapy: effects on cardiovascular function In Abs R, Feldt-Rasmussen U (Eds), Growth Hormone Deficiency in Adults-10 Years of KIMS, Oxford Pharmagenesis Ltd., Oxford; 2004: 149-159.
35. Brüel A, Christoffersen TE, Nyengaard JR. Growth hormone increases the proliferation of existing cardiac miocites and the total number of cardiac miocites in the rat heart. Cardiovasc Res 2007; 76: 400-408. [ Links ]
36. Fideleff HL, Boquete HR, Stalldecker G, Giaccio AV, Sobrado PG. Comparative results of a 4-year study on cardiovascular parameters, lipid metabolism, body composition and bone mass between untreated and treated adult growth hormone deficient patients. Growth Horm IGF Res 2008; 18: 318–324. [ Links ]
37. Lanes R, Soros A, Gunczler P, Paoli M, Carrillo E, Villaroel O, Palacios A. Growth hormone deficiency, low levels of adiponectin, and unfavorable plasma lipid and lipoproteins. J Pediatr 2006; 149: 324-329. [ Links ]
38. Maison P, Chanson P. Cardiac effects of growth hormone (GH) in adults with GH- deficiency. A metaanalysis. Circulation 2003; 108: 2648-2652. [ Links ]
39. Rosenfalck AM Maghsoudi S, Fisker S, Jorgensen JO, Christiansen JS, Hilsted J, Volund AA, Madsbad S. The effect of 30 months of low-dose replacement therapy with recombinant human growth hormone (rhGH) on insulin and C -peptide kinetics, insulin secretion, insulin sensitivity, glucose effectiveness, and body composition in GH-deficient adults. J Clin Endocrinol Metab 2000; 85: 4173 - 4181. [ Links ]
40. Bouillon R, Koledova E, Bezlepkina O, Nijs J, Shavrikhova E, Nagaeva E, Chikulaeva O, Peterkova V, Dedov I, Bakulin A, Oganov V, Attanasio AF. Bone status and fracture prevalence in Russian adults with childhood-onset growth hormone deficiency J Clin Endocrinol Metab 2004; 89: 4993 – 4998. [ Links ]
41. Kołtowska-Häggström M, Geffner ME, Jönsson P, Monson JP, Abs R, Hána V, Höybye C, Wollmann HA. Discontinuation of Growth Hormone (GH) Treatment during the Transition Phase Is an Important Factor Determining the Phenotype of Young Adults with Nonidiopathic Childhood-Onset GH Deficiency. J Clin Endocrinol Metab 2010; 95: 2646–2654. [ Links ]
42. Giaccio AV, Boquete HR, Sobrado PGV, Fideleff HL. Deficiencia de GH y calidad de vida: diferente impacto según de inicio del déficit y el sexo. Rev Arg Endocrinol Metab 2003; 40:139. [ Links ]
43. Abrams P, Boquete H, Fideleff H, Feldt-Rasmussen U, Jönsson PJ, Koltowska-Häggström M, Wilton P, Abs R. GH replacement in hypopituitarism improves lipid profile and quality of life independently of changes in obesity variables. Eur J Endocrinol. 2008; 159: 825 – 832. [ Links ]
44. Álvarez-Escoláa C, Fernández-Rodríguez E, Recio- Córdovac JM, Bernabéu-Morón I, Fajardo-Montañanad C. en representación del Área de Conocimiento de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición. Consensus document of the Neuroendocrinology area of the Spanish Society of Endocrinology and Nutrition on management of hypopituitarism during transition. Endocrinol Nutr 2014; 61: 68. [ Links ]