Boletín de Malariología y Salud Ambiental
versión impresa ISSN 1690-4648
Bol Mal Salud Amb v.51 n.2 Maracay dic. 2011
Presencia de epimastigotes de Trypanosoma cruzi en el plasma seminal de ratones con infección aguda
Trypanosoma cruzi epimastigotes in seminal plasma in acute infected mice
Maritza Alarcón1*, Elio Moreno1, Cesare Colasante2, Ana Lugo de Yarbuh1, Karina Cáceres1 & Sonia Araujo1
1 Laboratorio de Parasitología Experimental (LAPEX), Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela.
2 Laboratorio de Fisiología de la Conducta, Facultad de Medicina, Universidad de Los Andes, Mérida, Venezuela.
*Autor de correspondencia: amaritza@ula.ve.
RESUMEN
Se reporta la presencia de formas evolutivas de Trypanosoma cruzi en el plasma seminal (PS) de ratones NMRI, inoculados por vía subcutánea con 2x104 tripomastigotes metacíclicos cepa P6 obtenidos de Rhodnius prolixus. Al separar las muestras de sangre a los 15 días pos-infección, un ratón eyaculó espontáneamente y el examen directo del PS reveló la presencia de formas epimastigotes de T. cruzi en activo movimiento mezclados con los espermatozoides. Las preparaciones del PS coloreadas con Giemsa, mostraron formas epimastigotes libres y en división, tripomastigotes y amastigotes extracelulares y dentro de células fagocíticas. Los resultados de este estudio revelaron los diferentes estadios de T. cruzi en el PS de ratón, con morfogénesis similar a como ocurre en el insecto vector. El parasitismo encontrado en el PS del ratón con infección aguda, aporta importante información epidemiológica sobre la vía de transmisión sexual de T. cruzi, principalmente entre la población de reservorios silvestres que se encuentran en áreas endémicas y no endémicas para la enfermedad de Chagas.
Palabras clave: Trypanosoma cruzi, epimastigotes, plasma seminal, ratones.
SUMMARY
We report the presence of evolving forms of Trypanosoma cruzi in the seminal plasma (SP) of NMRI mice subcutaneously inoculated with 2x104 metacyclic trypomastigotes obtained from P6 strain Rhodnius prolixus. When taking blood samples at 15 days post-infection, the mouse spontaneously ejaculated and the direct SP exam revealed the presence of active epimastigotes of T. cruzi mixed with spermatozoids. SP preparations stained with Giemsa showed free and dividing epimastigotes, extracellular trypomastigotes and amastigotes, as well as, within phagocytic cells. The results showed the presence of T. cruzi at the different stages of its life cycle in the mouse PS, observing similar morphogenesis in the PS to the one known in the insect vector. The parasitism found in the SP of this mouse with acute infection, provides important epidemiological information about the T. cruzi pathway of sexual transmission, mainly among the population of wild reservoirs found in endemic and non-endemic areas for Chagas`disease.
Key words: Trypanosoma cruzi, epimastigotes, seminal plasma, mice.
Recibido el 06/09/2011 Aceptado el 14/10/2011
En América Latina existen 10 millones de personas infectadas y más de 25 millones en riesgo de contraer la infección por Trypanosoma cruzi el agente etiológico de la enfermedad de Chagas (OMS, 2010 http://www.who.int/mediacentre/factsheets/fs340/es/index.html). El parásito circula en la naturaleza tanto en hospedadores vertebrados como en insectos hematófagos (Hemiptera, Rediviidae, Triatominae) (Herrera, 2010. Bol. Mal. Salud Amb. 50: 3-15). En el hospedador vertebrado T. cruzi se encuentra bajo las formas de tripomastigotes libres en la sangre periférica y de amastigotes intracelulares los cuales se dividen por fisión binaria, mientras que en el triatomino la forma de división es el epimastigote (Deane et al., 1984. Mem. Inst. Oswaldo Cruz. 79: 513-515).
La infección natural en los vertebrados ocurre por la penetración activa de los tripomastigotes metacíclicos de T. cruzi a través de la piel o de las membranas mucosas. Igualmente, han sido reportados casos de infección por T. cruzi a través de transfusiones sanguíneas, las vías congénita, oral y otras menos frecuentes como la vía sexual (Amato Neto et al., 2000. Rev. Pat. Trop. 29: 115-129).
La infección de órganos del sistema reproductivo por T. cruzi ha sido señalada desde que se inició el estudio de la enfermedad de Chagas, aún cuando la transmisión sexual no ha sido comprobada en humanos, la presencia de amastigotes en los túbulos seminíferos de animales experimentalmente infectados, es un indicativo de que T. cruzi puede ser transmitido por esta vía (Lenzi et al., 1998. Acta Trop. 71: 117-129). En los órganos genitales masculinos de roedores, se ha descrito la presencia de amastigotes de T. cruzi durante la fase aguda de la infección, con patologías semejantes a las encontradas en los órganos genitales de pacientes chagásicos (Cabrine -Santos et al., 2003. Mem. Inst. Oswaldo Cruz. 98: 523-528).
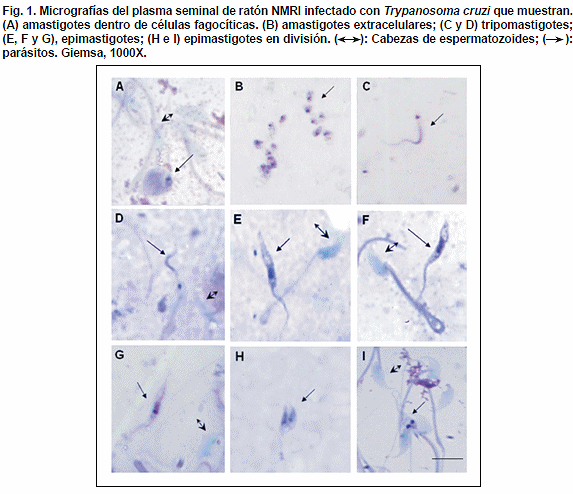
En este trabajo, 16 ratones machos NMRI de 20 gr. de peso y de dos meses de nacidos, fueron inoculados por vía subcutánea con 2x104 tripomastigotes metacíclicos/mm3 de la cepa P6 de T. cruzi TcI, aislada de un caso chagásico agudo infectado por contaminación oral en Chichiriviche de la Costa del estado Vargas, Venezuela (Alarcón de Noya et al., 2010. Bol. Mal. Salud Amb. 60: 135-138). A los 15 días post-infección y al momento de la toma de muestra de sangre caudal de los ratones para la determinación de la parasitemia, uno de los ratones eyaculó espontáneamente. En el examen directo del plasma seminal se observó la presencia de formas epimastigotes de T. cruzi activos mezclados con los espermatozoides. En las muestras de plasma seminal fijadas con metanol y coloreadas con Giemsa al 20%, se observó la presencia de formas epimastigotes, tripomastigotes y amastigotes intra y extracelulares (Fig. 1).
La presencia de T. cruzi ha sido señalada en la luz de las glándulas anales de Didelphis sp. en las cuales se han encontrado todas las formas del parásito con características comparables a las formas que se encuentran en el tubo digestivo de los triatominos, cumpliéndose en estos marsupiales las dos fases del ciclo biológico de T. cruzi (Deane et al., 1984. Mem. Inst. Oswaldo Cruz. 79: 513-515; Urdaneta-Morales & Nironi, 1996. Mem. Inst. Oswaldo Cruz. 91: 399-403).
Deane et al. (1984) consideran a las glándulas anales de los marsupiales como un ambiente adecuado para el establecimiento y multiplicación de los epimastigotes de T. cruzi, tanto por la disposición de los nutrientes necesarios para su desarrollo como por la protección contra la respuesta inmune del hospedador (Mem. Inst. Oswaldo Cruz. 79: 513-515).
En este estudio, el hallazgo de formas evolutivas de T. cruzi en el líquido seminal de un ratón, pudiera deberse a que éste es un medio adecuado para el desarrollo y división de los epimastigotes, tanto por la temperatura escrotal, la cual está entre dos y cuatro grados centígrados por debajo de la temperatura corporal (Catriona et al., 2009. Biol. Reprod. 80: 913-919), como por el contenido entre 15 y 30% de lípidos y colesterol del plasma seminal, constituyendo un ambiente semejante al epitelio glandular de los didelfidos rico en lípidos. (Zeledón & Ravinovich, 1981. Annu. Rev. Entomol. 2: 101-110), Igualmente, la acción de la temperatura escrotal pudiera ser la responsable de los efectos reguladores sobre la morfogénesis de T. cruzi, la cual permitiría mantener el estadío de tripomastigote e inducir su transformación en epimastigote vía amastigote como ocurre en los triatominos, debido a un mecanismo de activación de genes específicos como fue descrito para T. brucei (Van Der Ploeg et al., 1985. Science. 228: 1443-1446).
Alencar et al. (1987) observaron abundantes tripanosomas en el aparato genital masculino de ratones que fueron inoculados con el semen de ratones que cursaban infección por T. cruzi (TcI) (Mem. Inst. Oswaldo Cruz. 82: 89). Por otro lado, Pereira et al., (2009) mostraron que T. cruzi alcanza la luz de los túbulos seminíferos pudiendo ser transmitido a través del contacto sexual (Int. J. Exp. Pathol. 90: 52-57). En este sentido, la presencia del parásito observada en las muestras de semen del ratón NMRI con infección aguda, pudiera ser un indicativo de que la transmisión por T. cruzi en este grupo de mamíferos, podría estar ocurriendo por contacto sexual.
Aun cuando T. cruzi presenta características metabólicas diferentes respecto a sus hospedadores vertebrados e invertebrados, el hallazgo de tripomastigotes, amastigotes y epimastigotes de T. cruzi en la muestra de líquido seminal de ratón, indica un alto grado de adaptación del parásito a la familia Muridae como consecuencia de la evolución conjunta parásito-hospedador (Peña et al., 2009. Mem. Inst. Oswaldo Cruz. 104: 108-114). Por lo tanto, la metaciclogénesis observada en el plasma seminal del ratón pudiera estar contribuyendo con el
mantenimiento de la infección chagásica por contacto sexual ratón a ratón, aún en ausencia de triatominos en las áreas no endémicas para la enfermedad de Chagas. Este hallazgo, tiene gran importancia epidemiológica debido a la alta densidad poblacional de roedores implicados como reservorios de T. cruzi (Herrera, 2010. Bol. Mal. Salud Amb. 50: 3-15), los cuales se encuentran en estrecho contacto con la población humana, factores a tomar en cuenta en la transmisión oral de T. cruzi, debido a que el semen de los roedores infectados con el parásito, pudiera estar contribuyendo en la contaminación de alimentos junto con las excretas de triatominos, en áreas no endémicas para la enfermedad de Chagas.
Consideraciones éticas La manipulación de los animales en experimentación se llevó a cabo según lineamientos del Código de Bioética y Biodiversidad de FONACIT (2002).
CONFLICTOS DE INTERESES
Los Autores declaran que no se ha presentado para la realización y durante el desarrollo de este trabajo ningún tipo de conflicto de intereses.
AGRADECIMIENTOS
Al Dr. Rafael Bonfante Cabarcas, Unidad de Parasitología Médica. Decanato de Ciencias de la Salud. Universidad Centroccidental Lisandro
Alvarado, Barquisimeto, Venezuela, por proveer la cepa P6 de T. cruzi.











 uBio
uBio