Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. v.54 n.4 Maracay oct. 2004
Respuestas al déficit hídrico en las variedades de tomate Río Grande y PERA QUIBOR 1
Diana García M.*, Cecily Petzall K.* y Marisol Castrillo*
RESUMEN
Plantas de tomate, Lycopersicon esculentum (L.) Mill, de las variedades Pera Quibor (PQ) y Río Grande (RG), crecidas en invernadero fueron sometidas a un período de suspensión de riego, realizándose las siguientes mediciones: potencial hídrico del suelo (Yws), y foliar (Ywf), conductancia estomática (gs), número de hojas y de primordios florales, área foliar (ÁF), peso seco foliar (PSF) y contenido de prolina. Ocurrió disminución de Yws y Ywf y de gs; aumento en el contenido de prolina, disminución del número de hojas y de primordios florales (retraso en aparición), del ÁF y PSF. Se observó una elevada correlación entre el Ywf y el contenido de prolina, los coeficientes de correlación de Pearson son significativamente diferentes de 0 (a = 0,05) para ambas variedades, siendo mayor para PQ. La tendencia del Yws está yuxtapuesta y las respuestas de la gs son similares en ambas variedades. Hubo notables diferencias: RG alcanzó valores menores de Ywf que PQ, (ésta mantuvo valores semejantes los primeros 7 días); RG mantiene reducción en el número de hojas, mientras PQ reduce tardíamente y continúa su producción a severo estrés; la reducción en el ÁF fue mayor en RG; la disminución en el PS se presentó primero en RG y aumentó con el déficit hídrico siendo mayor en PQ, la única variable en la que RG aventaja. La reducción del número de yemas florales es mayor en RG. PQ obtenida empíricamente por los agricultores del valle de Quibor, presenta desempeño adecuado, comparable y hasta podría afirmarse que superior, frente al déficit hídrico, de RG, esta última obtenida en el exterior con mayor disponibilidad de recursos tecnológicos.
Palabras Clave: Lycopersicon esculentum (L.) Mill; área foliar; estrés hídrico; conductancia estomática; peso seco foliar; prolina; yemas florales.
SUMMARY
Plants of tomato, Lycopersicon esculentum (L.), Pera Quibor (PQ) and Rio Grande (RG) varieties, grown in greenhouse conditions, were subjected to water deficit. The following analysis and measurements were carried out: soil (Yws) and leaf (Ywf) water potentials, stomatal conductance (gs), leaves and floral buds number, leaf dry weight, leaf area, and prolina content. During the water deficit period, the Yws, Ywf and gs decreased, there was a reduction of the number of leaves and floral buds number, and there was a delay in the floral buds apparition. The leaf dry weight and foliar area were likewise reduced, and the proline content was increased. A high correlation coefficient between Ywf and proline content was found, the Pearson correlation coefficients were significantly different to 0 (a = 0.05) for both varieties, being higher for PQ. Although a similar behavior was observed in both varieties under water deficit (similar trends of Yws and gs) there were some differences: Ywf values were lower in RG than PQ (PQ kept the same values during the first seven days of water deficit period); the leaves number is slightly higher in PQ, because it maintain leaves production even at severe water stress. The leaf area was less reduced in PQ, which means probably a higher and longer photosynthetic performance at severe water deficit. The leaf dry weight was less reduced in RG. The flower buds number were lower in RG variety. The PQ variety, empirically obtained by our farmers at the Quibor valley, shows an appropriated, similar, or even better performance, to water deficit, that the RG variety.
Key Words: Lycopersicon esculentum (L.) Mill; leaf area, hydrics stress; stomatal conductance; leaf dry weight; prolina; floral buds.
INTRODUCCIÓN
La disponibilidad de agua es uno de los factores ambientales que limita la producción y calidad de los cultivos en todo el mundo (Lawlor, 1979). Estas restricciones han ganado importancia debido a la demanda de alimentos en una población mundial en crecimiento. El problema se complica aún más debido a la deficiencia en el suministro adecuado de agua, a los costos y riesgos de la irrigación (Hasegawa et al., 1984).
Una alternativa para disminuir la necesidad de riego intensivo es la búsqueda de cultivares con capacidad de soportar un marcado déficit hídrico (DH), a través de mecanismo de tolerancia a la sequía. Muchas de las respuestas al DH han sido resumidas por varios autores (Hsiao, 1973; Hanson y Hitz, 1982; Turner y Kramer, 1980; Paleg y Aspinal, 1981). Estas respuestas ocupan un amplio rango, desde metabólicas y fisiológicas hasta morfológicas.
En lo que a productividad de cultivos concierne, el énfasis debe estar sobre aquellas respuestas que se producen por DH debido a sequías pasajeras y no en aquellas respuestas que se producen bajo aridez severa (Hsiao et al., 1976).
La productividad económica, porción del cultivo que es cosechada para uso del hombre, depende de la acumulación de energía química en fotoasimilados y de su distribución en los órganos vegetales. La cantidad de fotoasimilados acumulados es función del área foliar (ÁF), de la cantidad de CO2 fijado por unidad de área y de la pérdida de CO2 por fotorrespiración y por respiración nocturna. Por otra parte, Lahlou et al. (2003) trabajando con cultivares susceptibles y resistentes de papa, encontraron que el peso seco foliar (PSF) fue reducido en todos los casos, mientras que en el número de tubérculos disminuyó en mayor proporción en las variedades susceptibles.
Se ha evidenciado que las plantas de tomate, Lycopersicon esculentum (L.) Mill, son muy sensibles al estrés hídrico (Waiester y Hudson, 1970); así mismo, la producción de tomate al ser comparada con otros vegetales, ha estado siempre asociada a la abundancia de agua (Srinivasa Rao et al., 2000).
Por otro lado, se presentan estudios comparativos acerca de las respuestas al DH entre cultivares de tomate, por ejemplo, diferencias genotípicas en el ajuste osmótico pueden significar un importante atributo en la resistencia a la sequía en tomate (Srinivasa Rao y Bhatt, 1992).
Adicionalmente, han sido señaladas respuestas ecofisiológicas diferentes en cultivares de tomate, susceptibles y resistentes a la sequía, (Rahman et al., 1999). En las dos variedades de tomate estudiadas, Pera Quibor (PQ) y Río Grande (RG) se observó una disminución de la actividad Rubisco y en los contenidos de clorofila y proteínas (Castrillo y Calcagno, 1989); sin embargo, esta actividad Rubisco mantuvo niveles altos cuando el DH fue leve y moderado, y disminuyó gradualmente a severo estrés en la variedad PQ (Castrillo et al., 2001).
Entre las repuestas metabólicas al DH, la acumulación del aminoácido prolina, es ampliamente utilizable para muchas especies (Aspinall y Paleg, 1981; Heuer, 1995). El incremento de prolina puede ser el resultado de la estimulación en la tasa de síntesis de la misma, de la proteólisis y la síntesis a partir de ácido glutámico y arginina y de la disminución en su tasa de utilización, para síntesis proteica y oxidación hacia otros compuestos (Stewart, 1981).
Diversas funciones son atribuidas a la acumulación de este metabolito, entre ellas, la de actuar como compuesto de reserva de carbono y nitrógeno (Aspinall y Paleg, 1981; Barnett y Naylor, 1966, Samaras et al., 1995), servir como desintoxicante del amonio durante el DH, protector contra radicales hidroxilos, fuente de energía para la recuperación (Blum y Ebercon, 1976; Samaras et al., 1995) y como estabilizador de las proteínas a valores bajo potenciales hídricos, contribuyendo así a la sobrevivencia de las funciones celulares (Schobert y Tschesche, 1978).
Prolina al ser altamente soluble en agua, es una de las sustancias que se acumula en las plantas y es considerada como soluto compatible, atribuyéndosele función protectora de proteína (Samaras, 1995). La acumulación de prolina se ha evidenciado ante diversos estrés (Aspinall y Paleg, 1981; Delauney y Verna, 1993; Hare y Cress, 1997). Por lo que se sugiere que esta acumulación es ventajosa, y podría ser utilizada como indicador en la selección de cultivares resistentes a la sequía (Singh y Rai, 1982; Singh et al., 1973), sin embargo, otros autores sugieren que la acumulación es un síntoma del daño que el DH ha causado en la planta (Hanson et al., 1977; Hanson et al., 1979).
Claussen (2002), por su parte, concluye que la acumulación de prolina es un indicador confiable de estrés ambiental impuesto en plantas de tomate mantenidas en condiciones hidropónicas.
El tomate es un cultivo de interés económico, la variedad PQ fue obtenida empíricamente por agricultores del estado Lara1 por lo que se hace necesario emprender estudios fisiológicos de esta especie para su mejor conocimiento en Venezuela; por otra parte, la variedad RG ha sido cultivada a gran escala a nivel nacional en el país2.
El objetivo del trabajo fue analizar y comparar las respuestas del potencial hídrico (Yws), la conductancia estomática (gs), el contenido de prolina, el número de hojas (NH), el área foliar (ÁF) y peso seco foliar (PSF) y el número de yemas florales en plantas de dos cultivares de tomate: PQ y RG sometidas a DH.
MATERIALES Y MÉTODOS
Se utilizaron semillas de RG (Sunblest Seeds, USA) con fruto tipo pera y PQ también fruto tipo pera suministrada por los Ing. Agrónomos Ramón Díaz y Juan Ohep de INIA (anteriormente FONAIAP).
El trabajo experimental se llevó a cabo utilizando las dos variedades simultáneamente. Las semillas fueron germinadas a 25 °C en bandejas de plástico con papel absorbente; cuando el 90% de las plántulas presentaban hojas cotiledonares, fueron transplantadas a bandejas que contenían arena de río, previamente desinfectada con solución de formalina, colocadas bajo una lámpara fluorescente ( 50mEm-2 s-1), regadas todos los días con agua destilada y cada 2 d con solución de Hoagland.
A los 23 d de la siembra cuando las plantas presentaban la primera hoja fueron transplantadas a potes plásticos de 5l de capacidad que contenían una mezcla de suelo franco-arcilloso y arena (3: 2) y colocados en el invernadero (una plántula por pote). Las plántulas fueron regadas utilizando el mismo volumen de agua y la misma frecuencia; dos veces por semana se regaban con 30 ml de solución de macronutrimentos y micronutrimentos y con fertilizante (POKON, Bendien-Naarden, Holland).
Las condiciones climáticas generales del invernadero fueron: temperatura mínima promedio: 18±2,3 °C, temperatura máxima promedio: 30±2,5 °C; promedio de la humedad relativa mínima (HR): 53±8%, promedio de la máxima HR: 97±2%; radiación solar promedio: 656 mmol m-2 s-1. Estas condiciones climáticas se mantuvieron durante el crecimiento y el período de DH.
La suspensión del riego comenzó después de 41 d de crecimiento: a un grupo de 40 plantas se le suspendió el riego (plantas bajo DH) y la superficie del suelo de estas plantas, se cubrió con esferas de arcilla expandida "Aliflor" con la finalidad de disminuir la evaporación. Otro grupo de plantas se continuó regando diariamente (plantas control).
Al suspender el riego fue suspendida también la aplicación de fertilizantes para ambos grupos. Se contó el número de hojas y de primordios florales durante el período de tratamiento en plantas bajo DH y controles. Las mediciones se realizaron en ambos grupos, de forma aleatoria, a intervalos de 2 d.
Se utilizaron 4 réplicas (4 plantas) en cada día de medición para ambos grupos. Todas las medidas fueron realizadas en la cuarta hoja expandida desde el ápice.
Potencial hídrico (Yw). Fue medido en muestras de suelo y en discos de hojas con un Microvoltímetro de Punto de Rocío HR-33T usando cámaras C-52 (Wescor, Logan, Utah, USA). Todas las medidas se realizaron entre las 5:30 y las 6:30 am.
Conductancia estomática (gs). Se determinó como el inverso de la resistencia difusiva foliar, utilizándose un autoporómetro Lambda Inst. Co. Mod. LI.65 y sensor LI-205. Las mediciones fueron llevadas a cabo entre las 8:00 y las 9:00 am, en el lado abaxial del folíolo.
Para la determinación del peso seco (PS) se colocaron los folíolos en una estufa a 80 °C por 48 h, determinándose el peso de las muestras. El ÁF fue medida con un planímetro (Lasiko-Est 1929, Los Angeles Scientific Instrument Co.,Inc., Los Angeles, California, USA). Las hojas se conservaron en nitrógeno líquido para los análisis del contenido de prolina.
Para la determinación de prolina, la extracción y determinación se llevó a cabo siguiendo el método descrito por Singh et al. (1973). La absorbancia a 515 nm de los productos disueltos en tolueno, medida en la capa superior metanol-agua, luego de la reacción con ninhidrina fue medida en un espectrofotómetro Shimadzu UV-160ª, construyendo curvas de calibración utilizando DL-prolina (Sigma). Los resultados estuvieron basados en pruebas paramétricas utilizando el programa SPSS-10 (Pearson).
RESULTADOS Y DISCUSIÓN
En el Cuadro se muestran los valores promedios del potencial hídrico del suelo (Yws) y foliar (Ywf) y del contenido de prolina en plantas control durante los días con DH.
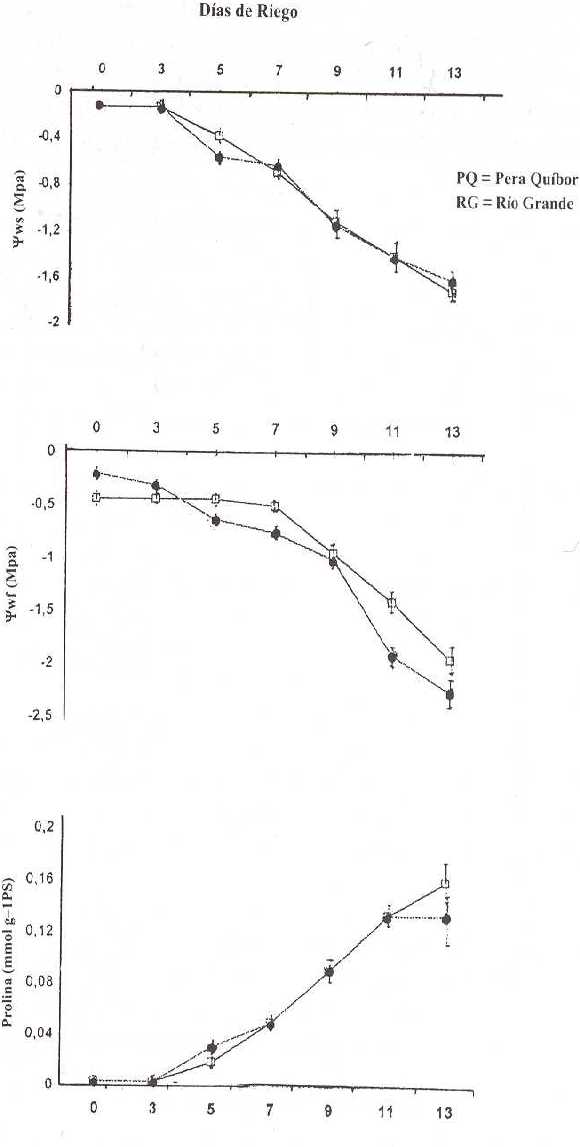
La Figura 1 muestra los valores promedios del Yws, Ywf y del contenido de prolina en las plantas sometidas a DH. Se observa disminución progresiva en los valores de Yws y Ywf y un aumento en el contenido de prolina, a medida que avanza el período de tratamiento en ambas variedades. En PQ el Ywf se mantiene en los primeros 7 d del período de tratamiento, mientras que en RG comienza a disminuir desde el 3er d; la disminución del Ywf es menor en PQ comparada con la de RG, esta diferencia se mantiene a lo largo del período de DH. El contenido de prolina muestra una tendencia semejante con un valor ligeramente mayor para PQ al final del período.
CUADRO. Valores promedios ± desviación estándar de los potenciales hídricos del suelo (Yws) y foliares (Ywf) y del contenido de prolina de plantas controles (regadas) durante los días de déficit hídrico.
| Yws (MPa) | Ywf (MPa) | Prolina mmol g-1 PS | |
| PQ | -0,13±0,01 | -0,38±0,03 | 0,003±0,0001 |
| RG | -0,13±0,01 | -0,20±0,02 | 0,003±0,0001 |
FIGURA 1. Potencial hídrico del suelo Yws (MPa), potencial hídrico foliar Ywf (MPa) y contenido de prolina (mmol g-1 PS) durante el período sin riego. Cada valor representa la media de cuatro réplicas ± de.
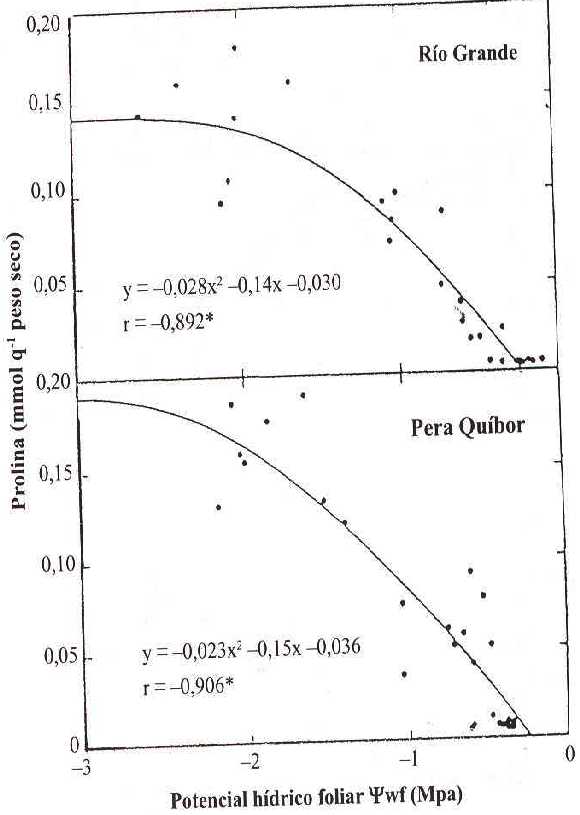
La Figura 2 muestra la relación entre el contenido de prolina (mmol g-1 PS) y el Ywf (MPa) en las plantas bajo DH de ambas variedades. Se observa una elevada correlación entre estos dos parámetros; a medida que disminuye el Ywf, el contenido de prolina va aumentando hasta aproximadamente -2,0 MPa en RG y -2,6 MPa en PQ, a partir de estos valores, no se observa aumento adicional, a pesar de que el DH continúa progresando.
FIGURA 2. Relación entre el contenido de prolina (mmol g-1 PS) y el potencial hídrico foliar Ywf (MPa) en plantas sometida a déficit hídrico (tratadas) de las variedades de tomate: * Coeficiente de correlación de Pearson significativamente diferente de 0 (a= 0.05).
Los coeficientes de correlación de Pearson se presentan significativamente diferentes de 0 (a = 0,05) para ambas variedades, siendo mayor para PQ. La semejanza entre ambas curvas sugiere que el patrón de acumulación de prolina es el mismo en los dos cultivares. Hanson et al., (1979) encontraron resultados similares en varios tipos de cebada e indicaron que el proceso que ocasiona la acumulación de prolina debe responder de igual forma ante el DH en cada tipo. Los resultados se diferencian de los señalados por otros autores (McMichael y Elmore, 1977; Fukutoku y Yamada, 1981a; Levi, 1983) donde la acumulación de este metabolito comienza antes de que se alcancen niveles severos de DH. Aunque en pequeña proporción, el incremento de prolina en los tejidos foliares de plantas sometidas a deficiencia de agua, puede ser atribuido a la hidrólisis de proteínas presentes a medida que se desarrolla el DH (Stewart, 1972; Stewart y Hanson, 1980).
Algunos trabajos (Singh et al., 1973; McMichael y Elmore, 1977; Fukutoku y Yamada, 1981b, 1984) han demostrado que la cantidad de prolina acumulada excede a la que se encuentra en las proteínas. De igual manera se evidenció que el efecto primario (Stewart 1981; Hanson y Hitz 1982) que induce la acumulación durante el DH es la síntesis de novo a partir del ácido glutámico.
Por su parte, Bogges et al. (1976) encontraron en hojas de cebada a las que se les suministró 14C – ácido glutámico, un rápido incremento de la radioactividad en la prolina acumulada cuando las hojas estaban sometidas a DH moderado, mientras que en hojas túrgidas el incremento se debía a la incorporación continua de este aminoácido a las proteínas.
Otro factor que contribuye a su acumulación es la inhibición de su oxidación, posiblemente por efecto del estrés sobre el metabolismo mitocondrial y el deterioro de la síntesis proteica (Stewart, 1972; Stewart y Hanson 1980). A tal efecto, Gibon et al. ( 2000) presentan una relación directa entre la acumulación de prolina y la actividad mitocondrial en discos de hojas de colza sometidos a estrés osmótico.
Se ha demostrado que la presencia de carbohidratos es indispensable para la síntesis de prolina ya que ellos proporcionan el carbono precursor y el hidrógeno o poder reductor necesario para dicha síntesis. Stewart, 1978; al igual que Petzall y Castrillo en el 2004 encontraron aumento en los niveles de sacarosa en hojas de tomate de estas dos variedades sometidas a DH (datos no publicados).
La fuente de nitrógeno para la síntesis de ese compuesto son las proteínas (Fukutoku y Yamada, 1984) y es obtenido cuando los aminoácidos son liberados y desaminados; el amonio así producido debe ser incorporado primero al ácido glutámico que luego es convertido en prolina (Fukutoku y Yamada, 1981b). Pérez-Alfocea et al. (1993) observan que en tomate la acumulación de prolina cuenta sólo como una pequeña fracción de la concentración total de solutos osmóticamente activos.
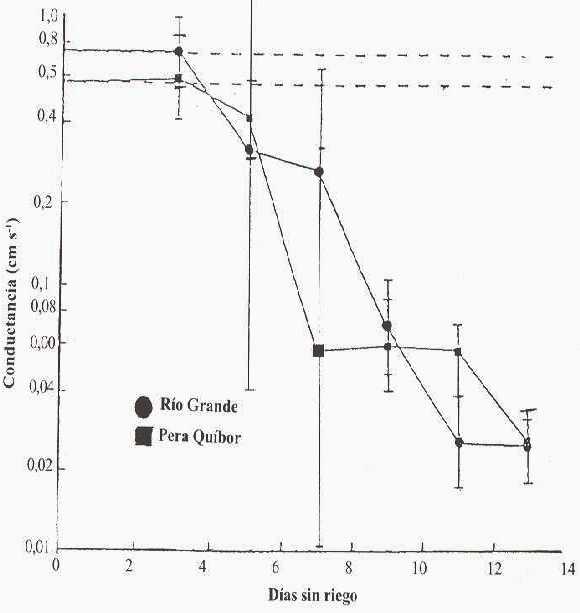
En la Figura 3 se presentan los valores de la gs durante el período de DH para los dos variedades; observando que su disminución comienza al 3er d en ambas variedades; las tendencias son semejantes y las desviaciones estándares se superponen particularmente al 5to d para RG (Ywf -0,63 MPa) y 7mo d para PQ (Ywf -0,50 MPa) en los cuales se presenta una muy elevada desviación estándar.
FIGURA 3. Conductancia estomática (cm s-1) en plantas tratadas de las dos variedades de tomate durante el período sin riego. Cada valor representa el promedio de la medición en cuatro réplicas ± de. La línea segmentada representa el promedio de los controles.
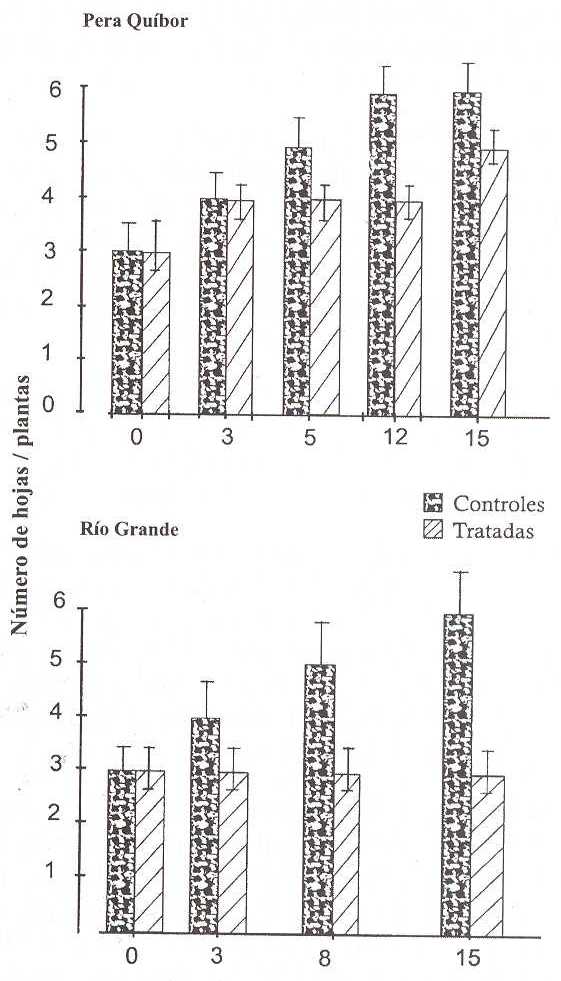
En la Figura 4 se observa el NH por planta en plantas control y bajo DH en las dos variedades. El NH total, es semejante en las plantas control de ambas variedades; en aquellas sometidas a DH, el NH se mantuvo constante en la variedad RG mientras que para la variedad PQ fue ligeramente mayor al final del período de DH.
FIGURA 4. Número de hojas en plantas controles y tratadas de las dos variedades de tomate durante el período sin riego. Cada valor representa el promedio de cuatro réplicas ± de.
A lo largo del tratamiento se observa que en el 3er d, RG ya presenta un porcentaje de disminución en el NH (-25%), mientras que en PQ es al 5to d (-20%); en RG en el 8vo d se obtuvo -40% y en el 15to d –50%, en la PQ en el 12do y 15to d se presentaron -33% y -17%, respectivamente, lo que muestra que en PQ hubo reducción en el porcentaje de disminución en la producción de hojas con respecto a las plantas control.
La variedad RG reduce el NH tempranamente y mantiene esta reducción, mientras que PQ reduce tardíamente y continúa la producción de hojas a DH avanzado.
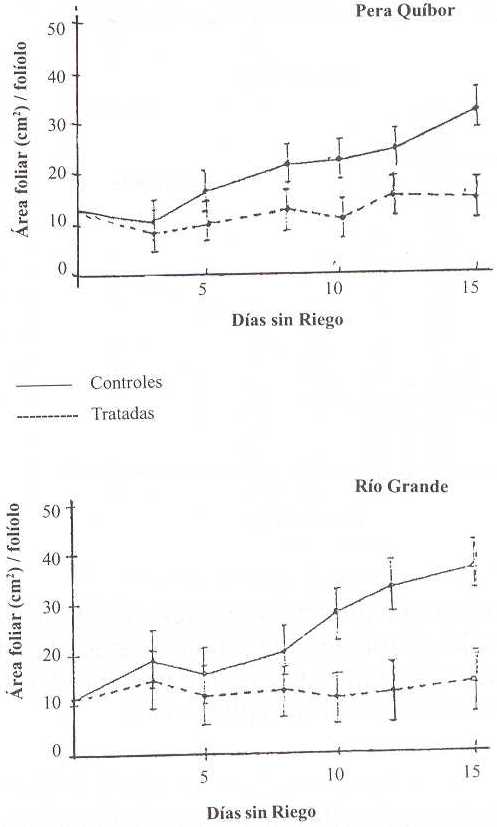
La Figura 5 muestra el ÁF por folíolo en plantas control y bajo DH de ambas variedades, observándose una disminución en el área de plantas bajo DH. Para los días 3, 5, 7, 9 10, 12 y 15 del período de DH los porcentajes de disminución fueron 15, 42, 36, 56, 44 y 53, respectivamente, para PQ, mientras que para RG éstos fueron 33, 87, 45, 64, 67 y 65, respectivamente. Puede observarse mayor porcentaje de disminución en el ÁF con respecto a las plantas control en RG.
Diversos autores señalan que la reducción en el ÁF es el efecto principal y más sensible del DH (Hsiao 1973; Turner y Kramer 1980; Hanson y Hitz 1982; Lawlor 1983). La mayor reducción en el NH y en el ÁF, podría interpretarse como una menor superficie fotosintética para RG.
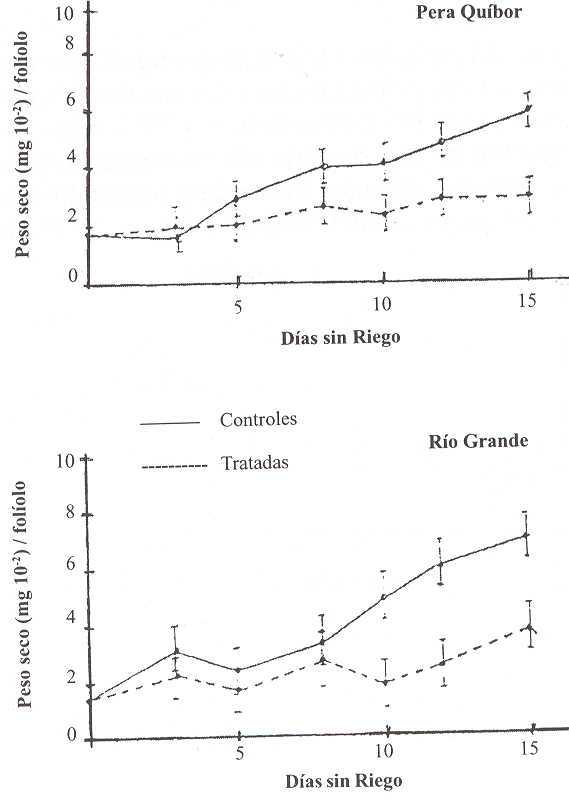
En la Figura 6 se muestra el PS en plantas control y tratadas de las dos variedades estudiadas. Para los días 5, 9, 10, 12 y 15 del período de DH los porcentajes de disminución fueron 33, 35, 41 42 y 53, respectivamente, para PQ, mientras que para RG en los días 3, 5, 9, 10, 12 y 15, éstos fueron 27, 33, 25, 25, 40 y 46, respectivamente. Es de observar que los mayores porcentajes de disminución de PS con respecto a los controles en las plantas tratadas de PQ.
En sus trabajos Lahlou et al. ( 2003) muestran una fuerte reducción del PSF en plantas de diferentes cultivares de papa sometidas a DH. Cabuslay et al. (2002) observaron en hojas de plantas de 27 cultivares de arroz, sometida a DH, una disminución en el PSF y en el ÁF, indicando que comparativamente la disminución es mayor en el ÁF, lo cual para los autores es indicativo de la mayor sensibilidad de la expansión foliar al DH, con respecto a la acumulación de materia seca.
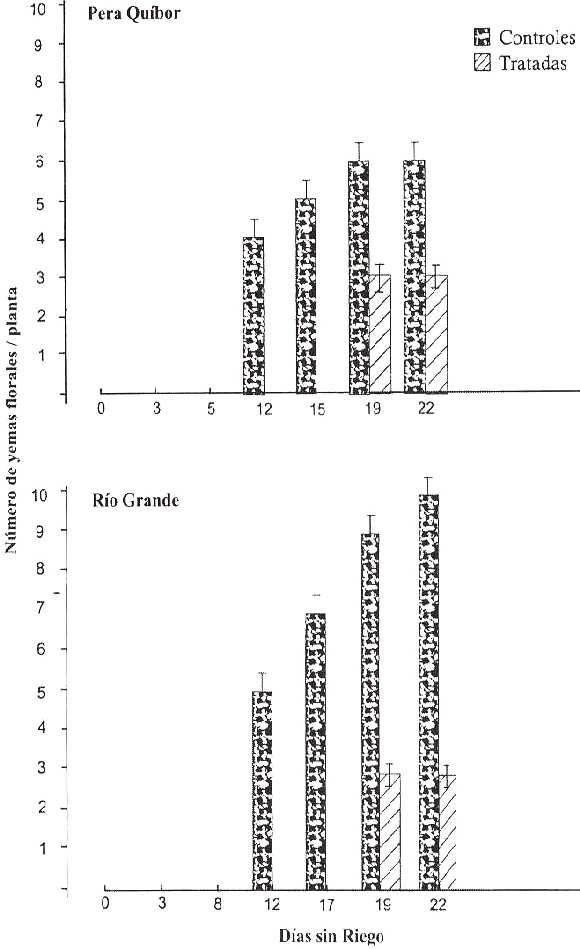
En la Figura 7 se presenta el número de yemas florales en plantas control y bajo DH de ambas variedades. En plantas control este número es mayor en RG, mientras que en plantas tratadas es semejante en ambas variedades. Se observa un retraso en la aparición de yemas florales en plantas bajo DH (día 19) con respecto al control (día 12).
Para los días 19 y 22 del período de DH el porcentaje de disminución en las plantas tratadas con respecto a las controles fue de 50% para ambos días en PQ, mientras que en RG fueron de 67% y 70%, respectivamente. Se sabe que la floración es muy sensible a la escasez de asimilados que puede producirse bajo condiciones limitantes, pudiendo conducir al retraso o absorción de yemas florales (Russell y Morris, 1983; Ho, 1984).
FIGURA 5. Valores promedios de área foliar de folíolos de plantas controles y tratadas de ambas variedades durante el período sin riego. Cada valor representa el promedio de la medición en cuatro réplicas ± de.
FIGURA 6. Valores promedios de peso seco de folíolos de plantas controles y tratadas de ambas variedades durante el período sin riego. Cada valor representa el promedio de la medición en cuatro réplicas ± de.
FIGURA 7. Número de yemas florales en plantas controles y tratadas de las dos variedades de tomate durante el período sin riego. Cada valor representa el promedio de cuatro réplicas ± de.
ShuBang et al. (2002) observaron disminución de la floración en plantas de macadamia bajo estrés hídrico. Rahman et al. (1999) trabajando con tomate, en dos cultivares sensibles y dos tolerantes al DH señalan una mayor disminución del Ywf, número de flores, producción de materia seca y gs en los cultivares sensibles, indicando que la disminución de la gs fue más conspicua en los cultivares tolerantes.
En el presente trabajo se evidencia el DH sufrido por las plantas al observar la disminuciones de Yws y Ywf producidas por la suspensión de riego en plantas de tomate de RG y PQ. La disminución del Ywf en plantas tratadas está asociada a la disminución de la gs, aumento en el contenido de prolina, disminución del NH, del ÁF y PSF, y del número de primordios florales unidos a un retardo en la aparición de éstos, comparado con las plantas control.
Ambas variedades presentan un comportamiento similar ante el tratamiento de DH, tales como la trayectoria de los valores de Yws que está yuxtapuesta, la tendencia similar de la gs y el aumento en el contenido de prolina a lo largo del período de DH.
Sin embargo, se observan notables diferencias: la RG alcanzó valores de Ywf menores que la PQ durante el período de DH (ésta última mantuvo valores semejantes durante los primeros 7 d); la RG reduce (Ywf -0,31 MPa) y mantiene esta reducción en el NH; la PQ reduce (Ywf -0,44 MPa) posteriormente, pero la producción de hojas es mantenida aún a severo DH; la reducción en el ÁF se presenta desde el principio en ambas variedades siendo mayor en RG, lo cual se mantiene durante todo el período de DH; la disminución en el PS se presenta primero en RG (Ywf -0,31MPa) y posteriormente en PQ (Ywf -0,44 MPa) esta disminución aumenta con el DH siendo mayor en PQ.
La reducción en el número de yemas florales es mayor en RG. De las variables analizadas sólo la disminución del PSF es menor en RG; ésta es la única en que aventaja a la PQ, obtenida a través de procedimientos empíricos por los agricultores del Valle de Quibor (estado Lara). La PQ, obtenida en el país, presenta un desempeño adecuado, que es comparable y podría afirmarse que superior, frente al DH, a la RG; esta última es obtenida en el exterior del país utilizando mejores recursos tecnológicos.
AGRADECIMIENTO
Los autores agradecen al INIA (anteriormente FONAIAP), por el suministro de semillas y por el intercambio que tuvimos con su personal, en particular con los Ing. Juan Ohep y Ramón Díaz.
BIBLIOGRAFÍA
1. Aspinall, D. and L. G. Paleg. 1981. Proline accumulation: physiological aspects. In: Paleg, L. G. y D. Aspinall (eds.). The Physiology and Biochemistry of Drought Resistance in Plantas. Academic Press, Australia. pp. 205-241. [ Links ]
2. Barnett, N. M. and A. W. Taylor. 1996. Amino acid and protein metabolism in bermuda grass during water stress. Pl. Physiol. 41:1.222-1.230. [ Links ]
3. Bogges, S. F., C. R. Stewart, D. Aspinall and L. G. Paleg. 1976. Effect of water stress on proline synthesis from radioactive precursors. Plant Physiol. 58:398-401. [ Links ]
4. Blum, A. and A. Ebercon. 1976. Genotypic responses to drought stress. III. Free proline accumulation and drought resistance. Crop Sci. 16:428-431. [ Links ]
5. Cabuslay, G. S., O. Ito and A. A. Alejar. 2002. Physiological evaluation of responses of rice (Oriza sativa L.) to water deficit. Pl. Sci. 163:815-827. [ Links ]
6. Castrillo, M. and A. M. Calcagno. 1989. Effects of water stress and rewatering on ribulose- 1,5-bis-phosphate carboxylase activity, chlorophyll and protein content in two cultivars of tomato. J. Hort. Sci. 64:717-724. [ Links ]
7. Castrillo, M., D. Fernández, A. M. Calcagno, I. Trujillo and L. Guenni. 2001. Responses of ribulose-1,5-bisphosphate, protein content and stomatal conductance to water in maize, tomato and bean. Photosynthetica 39:221-226. [ Links ]
8. Claussen, W. 2002. Growth, water use efficiency, and proline content of hydroponically grown tomato plants as affected by nitrogen source and nutrient concentration. Plant and Soil 247:199-209. [ Links ]
9. Delauney, A. J. and D. P. S. Verna. 1993. Proline biosynthesis and osmoregulation in plants. Plant J. 4:215-223. [ Links ]
10. Gibon, Y., R. Sulpice and F. Larher. 2000. Proline accumulation in canola leaf discs subjcted to osmotic stress is related to the loss of chlorophylls and to the decrease of mitochondrial activity. Physiol. p. 110:469-476. [ Links ]
11. Fukutoku, Y. and Y. Yamada. 1981a. Diurnal changes in water potential and free aminoacid contens of water-stressed and non-stressed soybeans plants. Sol Sci. Pl. Nutr. 21:195-204. [ Links ]
12. Fukutoku, Y. and Y. Yamada. 1981b. Sources of proline-nitrogen in water-stressed soybean (Glicine max). I. Protein metabolism and proline accumulation. Pl. Cell Physiol. 22:1.397-1.404. [ Links ]
13. Fukutoku, Y. and Y. Yamada. 1984. Sources of proline-nitrogen in water-stressed soybean (Glicine max). II. Fate of 15N- labelled protein. Physiol. Pl. 61:622-628. [ Links ]
14. Hanson, A. D., C. E. Nelsen and E. H. Everson. 1977. Evaluation of free proline accumulation as an index of drought resistance using two contrasting barley cultivars. Crop Sci. 17:720-726. [ Links ]
15. Hanson, A. D., W. D. Hitz, A. R. Pedersen and E. H. Everson. 1979. Capacity for proline accumulation during water stress in barley and its implications for breeding for drought resistance. Crop Sci. 19:489-493. [ Links ]
16. Hanson, A. D. and W. D. Hitz. 1982. Metabolic responses of mesophytes to plant water deficits. Ann. Rev. Pl. Physiol. 33: 163-203. [ Links ]
17. Hare P. D. and W. A. Cress 1997. Metabolic implications of stress induced proline Accumulation in plants. Pl. Growth Regul. 21:79-102. [ Links ]
18. Hasegawa, P. M., R. A. Bressan, S. Handa and A. K. Handa. 1984. Cellular mechanisms of tolerance to water stress. Hort. Sci. 19:371-377. [ Links ]
19. Heuer, B. 1994. Osmoregulation role of proline in water- and salt-stressed plants. In: Hand book of Plant and Crop Stress. Ed. M. Pessarakli, 363-381. Marcel Dekker. New York. [ Links ]
20. Ho, L. C. 1984. Partitioning of assimilates in fruiting tomato plants. Plant Growth Reg. 2:277-285. [ Links ]
21. Hsiao, T. C. 1973. Plant responses to water stress. Ann. Rev. Pl. Physiol. 24:519-570. [ Links ]
22. Hsiao, T. C., E. Acevedo, E. Fereres and D. W. Henderson. 1976. Water stress, growth, and osmoticadjustment. Philos. Trans. R. Soc. London 273:479-500. [ Links ]
23. Lahlou, O., S. Ouattar and J. F. Ledent. 2003. The effect of drought and cultivar on growth parameters, yield and yield components of potato. Agronomie 23:257-268. [ Links ]
24. Lawlor, D. W. 1979. Effects of water and heat stress on carbon metabolism of plantas with C3 and C4 photosynthesis. In: Mussel, H. y R. C. Staples (eds.), Stress Physiology in Crop Plantas. John Wiley & Sons, U.S.A. pp. 303-326. [ Links ]
25.Lawlor, D. W. 1983. Integration of biochemical processes in the physiology of water stressed plants. In: Marcelle, R., H. Clijters y M. van Pousse (eds.), Effects of Stress on Photosynthesis. Ed. M. Nijhoff/W. Junk, La Haya, pp. 35-44. [ Links ]
26. Levi, D. 1983. Water deficit enhancement of proline and –amino nitrogen accumulation in potato plants and its association with susceptibility to drought. Physiol. Pl. 57:169-173. [ Links ]
27. McMichael, B. L. and C. D. Elmore. 1977. Proline accumulation in water sressed cotton leaves. Crop Sci. 17:905-908. [ Links ]
28. Paleg, L. G. and D. Aspinall (eds.). 1981. The Physiology and Biochemistry of Drought Resistance in Plantas. Academic Press, Sydney. [ Links ]
29. Pérez-Alfocea, F., M. T. Estan, M. Caro and G. Guerrier. 1993 Osmotic adjustment in Lycopersicon esculentum and L pennellii under Na Cl and polyethylene glycol 6000 Iso-osmotic stresses. Physiol Plant. 87:493-498. [ Links ]
30. Rahman, S. M. L., E. Nawata and T. Sakuratani. 1999. Effect of water stress on growth, yield and eco-physiological responses of four tomato (Lycopersicon esculentum Mill.) cultivars. J. Japan. Soc. Hot. Sci. 68(3):499-504. [ Links ]
31. Russell, C. R. and D. A. Morris. 1983. Patterns of assimilate distribution and sorce-sink relationship in the young reproductive tomato plant (Lycopersicon esculentum Mill.). Ann. Bot. 52:357-363. [ Links ]
32. Samaras Y., R. A. Bressan, L. N. Csonka, M. G. García-Ríos, D¨Urso Paino and D. Rhodes. 1995. Proline accumulation during drought and salinity. In: Environment and Plant Metabolism. Ed. N. Smirnoff, 161-187. Bio Scientific Publisher Oxford. [ Links ]
33. Schobert, B. and H. Tschesche. 1978. Unusual solution properties of proline and its interaction with proteins. Biochim. Biophys. Acta 541:210-277. [ Links ]
34. ShuBang, N., L. JianFu, L. DaoGao, J. JianGuo, D. YingYi, H. XiYong, T. Li, C. GuoYun, X. GaoZhong and C. LiLan. 2002. Effect of water stress during flowering on macademia plantas. J. Southwest Agric. Univ. 24:34-37. [ Links ]
35. Singh, G. and V. K. Rai. 1982. Responses to two diferentially sensitive Cicer arietinum L. cultivars to water stress: protein content and drought resistance. Biol. Pl. 24:7-12. [ Links ]
36. Singh, T. N., D. Aspinall, L. G. Paleg and S. F. Bogges. 1973. Stress metabolism. Changes in proline concentration in excised plant tissues. Austr. J. Biol. Sci. 26:57-63. [ Links ]
37. Srinivasa Rao, N. K. and R. M. Bhatt. 1992. Response of tomato to moisture stress: Plant water balance and yield. Pl. Physiol. Biochem. 19:36-41. [ Links ]
38. Srinivasa Rao, N. K., R. M. Bhatt and A.T. Sadashiva. 2000. Tolerance to water stress in tomato cultivars. Photosynthetica 38:465-467. [ Links ]
39. Stewart, C. R. 1972. The effect of wilting on proline metabolism in excised bean leaves in the dark. Pl. Physiol. 51:508-511. [ Links ]
40. Stewart, C. R. 1978. Role of carbohydrates in proline accumulation in wilted barley leaves. Pl. Physiol. 61:775-778. [ Links ]
41. Stewart, C. R. and A. D. Hanson. 1980. Proline accumulation as a metabolic response to water stress. In: Turner, N. C. y P. J. Kramer (eds.), Adaptation of Plants to Water and High Temperature Stress. John Wiley & Sons, U.S.A. pp. 173-189. [ Links ]
42. Stewart, C. R. 1981. Proline accumulation: Biochemical aspects. In: Paleg, L. G. y D. Aspinall (eds.), The Physiology and Biochemistry of Drought Resistance in Plants Academic Press, Australia. pp. 243-259. [ Links ]
43. Turner, N. C. y P. J. Kramer (eds.).1980. Adaptation of Plants to Water and High Temperature Stress. John Wiley & Sons, U.S.A. [ Links ]
44. Waister, P. D. and J. P. Hudson 1970. Effects of soil moisture regimes on leaf water deficit, transpiration and yield of tomatoes. Hort. Sci. 45:359-370. [ Links ]
45. Younis, M. E., O. A. El-Shahaby, S. A. Abo-Hamed and A. H. Ibrahim. 2000. Effects of water stress on growth, pigments and 14CO2 assimilation in three sorghum cultivars. J. Agron. Crop Sci. 185:73-82. [ Links ]