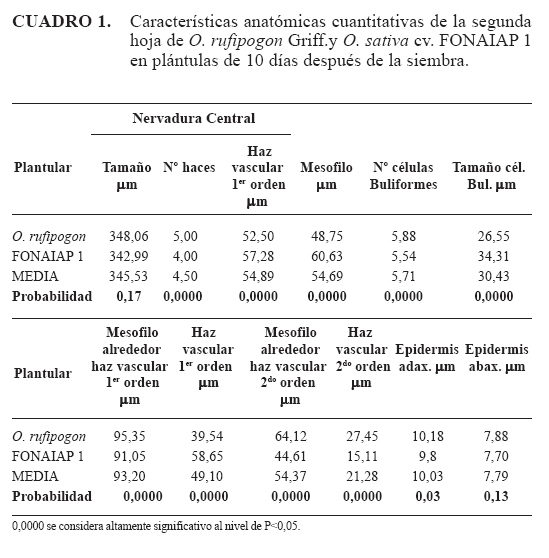
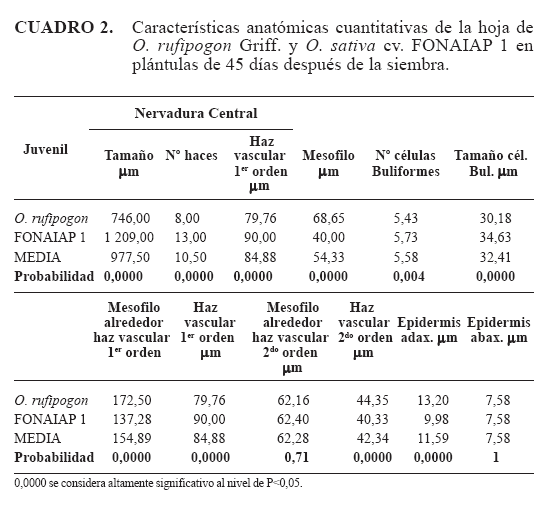
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. v.56 n.4 Maracay dic. 2005
Diferencias anatómicas en hojas de dos especies del género Oryza (Oryza rufipogon Griff., y Oryza sativa L. cv. FONAIAP 1) en tres fases del Ciclo Ontogenico
Diego J. Diamont Pérez *, Nancy M. Mariño Salcedo ** y José I. Askue ***
* Profesores. Universidad Central de Venezuela (UCV), Facultad de Agronomía. Apdo 457. Maracay, estado Aragua. Venezuela
** Profesor. Universidad Central de Venezuela (UCV), Morfoanatomía Vegetal. Departamento de Botánica
Facultad de Agronomía. Apdo 457. Maracay, estado Aragua. Venezuela
*** Profesor. Universidad Central de Venezuela (UCV), Centro de Microscopia Electrónica. Facultad de Agronomía.
Apdo 457. Maracay, estado Aragua. Venezuela.
RESUMEN
En cultivos de arroz, Oryza sativa (L.), el conocimiento de la estructura del mesófilo de la maleza arroz rojo Oryza rufipogon Griff., tiene importancia agronómica debido a que conduciría a un manejo más eficiente en el control de esta maleza durante las fases tempranas del desarrollo. El objetivo del trabajo fue el de comparar anatómicamente las hojas de Oryza rufipogon Griff., y Oryza sativa (L) cv. FONAIAP 1 durante tres fases de su ciclo ontogenético: plantular, juvenil y adulta. Las plantas crecieron en condiciones de invernadero, el muestreo fue llevado a cabo mediante selección al azar de cinco plantas de cada especie y colección de la hoja más reciente a total expansión para cada planta. Para el estudio al microscopio óptico se realizaron secciones en la porción más amplia de la lámina foliar y luego, estas secciones fueron preservadas en solución FAA 70%. Los cortes se realizaron a mano alzada y se tiñeron con azul de toluidina. Para el estudio de las epidermis al microscopio electrónico de barrido, utilizando la técnica de Cianocrilate según Castillo y Ferraroto. Las mediciones en los tejidos fueron obtenidas a través de un microscopio óptico marca Leitz, provisto de un ocular micrometrado. En la comparación de las variables en cada fase, se aplicó la prueba de t-Student con un nivel de significación del 5%. Estos resultados mostraron que las especies presentan diferencias significativas en cada una de las fases estudiadas, en relación a parámetros anatómicos tales como: tamaño de la nervadura central, número de los haces vasculares, tamaño del mesófilo, número y tamaño de las células buliformes, espesor de las epidermis adaxial y abaxial y el índice estomático medido durante la fase adulta. Estas características resultan importantes desde el punto de vista ecofisiológico como mecanismo de adaptación de estas dos especies particularmente de Oryza rufipogon Griff., a diferentes ambientes.
Palabras Clave: Ciclo ontogenético; anatomía; hoja; Oryza rufipogon Griff.; Oryza sativa cv.; FONAIAP 1.
SUMMARY
The knowledge of the mesophyll structure of the weed red rice, Oryza rufipogon Griff., has agronomical importance as it could lead to more efficient management practices of the rice crop with regards to weed control during early developmental phases. The objective of this study was to anatomically compare leaves of Oryza rufipogon Griff. And Oryza sativa (L.) cv. FONAIAP 1, during three phases of their ontogenetic cycle: seedling, juvenile and adult. Plants were grown in green house conditions; sampling was carried out by randomly selecting five plants from each species and taking the most recently fully expanded leaf per plant. Studies under the light microscope were performed by sectioning the widest part of the mesophyll leaves and preserving them in FAA solution 70%. Sections were obtained by hand and stained with toluidine blue. Epidermis was assayed with a scanning electron microscope using specimens prepared by the cianocrilate technique Castillo and Ferrarotto; tissue measurements were taken by using a Leitz photomicroscope fitted with a micrometered ocular eyepiece. Statistical analysis on the comparison of the obtained variables was made by using the t-Student test (5% significance). Results showed significant differences between the studied phases for each species in relation to anatomical parameters such as: size of central vein, number of vascular bundles, mesophyll size, number and size of bulliform cells, width of the adaxial and abaxial epidermis and stomatal index measured during adult phase. All these characteristics are important from an ecophysiological point of view as adaptation mechanisms of the two species, in particular Oryza rufipogon Griff., to different environments.
Key Words: ontogenetic cycle; anatomy; leaf; Oryza rufipogon Griff.; Oryza sativa cv. FONAIAP 1.
RECIBIDO: abril 25, 2005.
INTRODUCCIÓN
El arroz rojo (AR), Oryza rufipogon Griff., es considerado una maleza prohibida en campos de producción de semillas de arroz, porque existen cruces entre las especies, disminuye los rendimientos, la producción y la calidad de la semilla, por esto su control en los campos cultivados con arroz es imprescindible a nivel mundial y Venezuela no escapa a esta realidad. La especie presenta un alto porcentaje de desgrane y una latencia prolongada que permite la formación de un banco de semillas en el suelo, creando un problema permanente (Grist, 1975; Diarra et al., 1985, Kwon et al., 1992; Ortiz et al., 2000; Labrada, 2000; Delatorre, 1999). Es importante detectar la presencia del AR en la fase vegetativa, principalmente en la plantular ya que esta maleza en las primeras fases del ciclo presenta un desarrollo radical extenso que permite un establecimiento más temprano en relación al cultivo. En las gramíneas, las hojas presentan un patrón histológico en el cual no existe diferenciación en parénquima en empalizada y parénquima esponjoso. Este arreglo se correlaciona con su fisiología (Esau, 1972; Rodríguez 1989, Roth, 1992); en arroz el mesófilo presenta entre 3 y 5 capas de células (Matsuo et al., 1995), además se observan haces vasculares (HV) grandes y pequeños con una disposición regular y alterna, un parénquima formando una vaina que rodea a estos haces (Angladette, 1969). En la cara adaxial de la hoja, las células epidérmicas están cubiertas por una cutícula (Fahn, 1982) y en la epidermis abaxial están formada por células esclerotizadas (Matsuo et al., 1995). Todas estas características deben ser tomadas en cuenta al momento de combinar prácticas de control adecuadas para el manejo de la maleza. Labrada (2000) recomienda como estudios esenciales, la caracterización morfológica de los biotipos de AR existentes, que puedan ser de utilidad en la interpretación de aspectos agronómicos. Por tales razones se planteo como objetivo describir y comparar anatómicamente la hoja de Oryza sativa L. cv. FONAIAP 1 Oryza rufipogon Griff., durante las fases plantular, juvenil y adulta del ciclo ontogenético.
MATERIALES Y MÉTODOS
La investigación se realizó en plantas provenientes de diásporas de Oryza 571 sativa cv. FONAIAP1 y Oryza rufipogon Griff., obtenidas del Laboratorio de Semillas del Instituto de Agronomía, Facultad de Agronomía, Universidad Central de Venezuela (UCV), Maracay. La siembra para la obtención del material estudiado se llevó a cabo en el invernadero de la Cátedra de Fisiología Vegetal, su procesamiento y posterior análisis fue realizado en el Laboratorio de Morfoanatomía Vegetal Antonio Fernández. Se tomaron muestras de cada una de las fases del desarrollo de ambas especies y se depositaron en el Herbario MY Víctor M. Badillo del Instituto de Botánica. Para el estudio de la fase plantular, se sembró un total de 25 semillas de cada especie en bandejas plásticas, sin orificio y como sustrato se utilizó vermiculita esterilizada y saturada con agua. El inicio de la fase plantular se consideró desde la emergencia hasta la aparición de la segunda hoja, 10 días después de la siembra (DDS). La fase Juvenil fue delimitada desde la aparición de la tercera hoja hasta 45 DDS. La fase Adulta, fue considerada desde la aparición de la hoja bandera hasta el llenado de los granos 120 DDS. Para la obtención de muestras de las dos últimas fases, se realizaron siembras paralelas de 2 semillas pregerminadas por bolsa, en 50 bolsas plásticas sin orificios y con una capacidad de 6 kg; como sustrato se usó un suelo previamente esterilizado (50o C por 10 horas) y con una lámina permanente de agua. En cada fase señalada, el número de muestras tomadas en cada especie, fue de 5 hojas al azar, de las cuales se hicieron secciones de la parte media de la hoja en plena expansión. En la fase plantular fueron recolectadas muestras de la segunda hoja desarrollada a los 10 DDS, en la fase juvenil las muestras se tomaron de la última hoja desarrollada a los 45 DDS y en la fase adulta se escogieron muestras de la última hoja desarrollada anterior a la hoja bandera 120 DDS. Para el análisis anatómico en las tres fases se fijaron las muestras en FAA al 70% y realizando, luego, cortes transversales a mano alzada, preparándose láminas semipermanentes. Para la observación, medición y descripción de las epidermis en la fase adulta, se rasparon suavemente con hojillas las epidermis y simultáneamente fue aplicado hipoclorito de sodio comercial al 3% para eliminar la cera protectora. Luego las secciones se lavaron con agua destilada, tres veces a intervalos de 5 minutos cada uno, para después teñir con azul de toluidina y montar las láminas semipermanentes. Para determinar el índice estomático se utilizó la formula de Salisbury (1929).
Para la observación al Microscopio Electrónico de Barrido (MBE) de las papilas en las epidermis, sólo se utilizaron muestras de la fase adulta, preparándose 5 secciones de la parte media de la lámina de cada especie, las cuales fueron deshidratadas en una serie alcohólica ascendente, compuesta por alcohol butílico terciario, alcohol etílico y agua destilada en las siguientes concentraciones 50%, 70%, 85%, 95% y 100%. Después se secaron con la técnica del Secado por Punto Crítico, en un equipo Bal-Tec modelo SCD-30, colocando luego las muestras en porta-muestras y cubriéndose iónicamente con una capa de oro, de 30 nanómetros de espesor, en un equipo Bal-Tec modelo SCD-50. Posteriormente se observaron en un MEB, marca Phillips modelo XL20. Para la observación de los estomas se realizaron 3 impresiones foliares aplicando la técnica del Cyanocrilate (Castillo y Ferrarotto, 1998). Por último, fueron cubiertas con una capa de oro, con las mismas características y el mismo equipo mencionado anteriormente. Para la comparación de las variables cuantitativas estudiadas en cada fase se aplicó la prueba t-Student con un nivel de significación de 5%.
RESULTADOS Y DISCUSIÓN
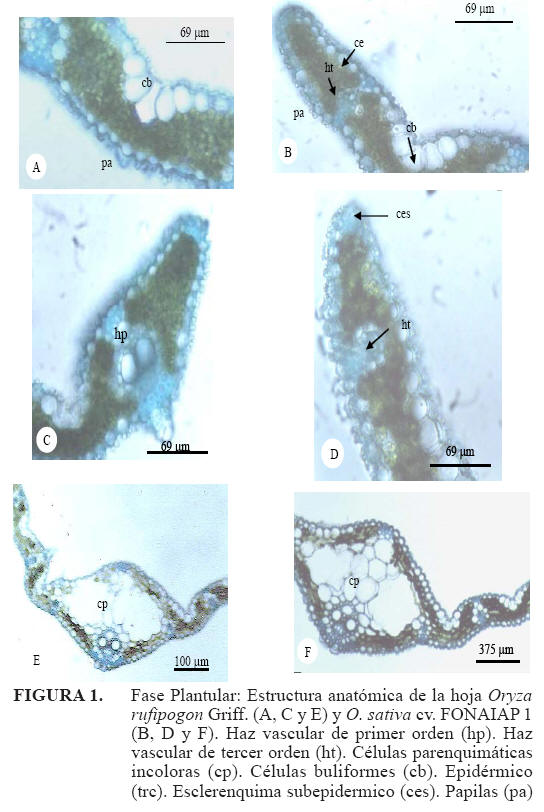
Fase plantular
Epidermis adaxial: en la sección transversal de la lámina foliar de ambas especies, fue evidente la presencia de células epidérmicas normales y buliformes; estas últimas se disponen en forma de abanico presentándose en grupos de 5 a 6 células y en algunos casos llegando hasta 7, cerca de la nervadura central. La célula buliforme central presentó una longitud de 26,55μm en O. rufipogon y en O. sativa cv. FONAIAP 1 34,31μm (Figura 1A, 1B y Cuadro1). En relación a las células epidérmicas normales fue evidente la presencia de papilas (Figura 1A y 1B), el tamaño promedio de estas células más la cutícula fue de 10,18μm para O. rufipogon y 9,88μm para O. sativa cv. FONAIAP 1 (Cuadro 1).
Epidermis abaxial: en la especie O. rufipogon Griff., esta epidermis presentó un grosor de 7,88μm y en O. sativa cv. FONAIAP 1 7,70μm (Cuadro 1).
Sistema fundamental: en la especie O. rufipogon Griff., el espesor 573 promedio del mesófilo alrededor de la zona de los HV de primer y segundo orden fue 95,35μm y 64,12μm, respectivamente; en el cultivar O. sativa cv. FONAIAP 1, los valores fueron 91,05μm y 44,61μm (Cuadro 1). Tejido vascular: en O. rufipogon Griff., el tamaño de los HV de primero y segundo orden fue de 39,54μm y 27,45μm, respectivamente y para O. sativa cv. FONAIAP1 fue de 58,65μm y 15,11μm (Cuadro 1). En los márgenes de la especie O. rufipogon se observó la presencia de HV de primer orden (Figura 1C), en el cultivar se observaron HV de tercer orden. (Figura 1D). Nervadura central: en la especie O. rufipogon la nervadura central presentó un tamaño de 348,06μm y en O. sativa cv. FONAIAP 1 342,99μm (Figura 1E, 1F y Cuadro 1). Las características cuantitativas descritas anteriormente presentaron diferencias altamente significativas. La presencia de haces conductores de tercer orden, se observaron con mayor frecuencia en el cultivar O. sativa cv. FONAIAP 1, esto pudiera ser considerado de importancia fisiológica debido a la función que tiene este tejido para el transporte de agua, pero aun cuando el cultivar presenta esta característica, la maleza mostró un mayor número de HV totales, lo que le permitiría desarrollarse en condiciones de baja humedad y ser más eficiente.
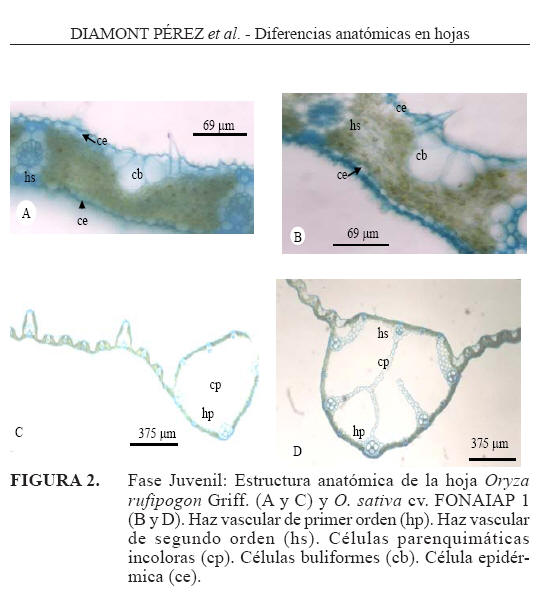
Fase juvenil
Epidermis adaxial: Las células buliformes forman grupos de 3 a 5 células y en algunos casos hasta 9 células hacia la nervadura central, la célula buliforme central en O. rufipogon presentó una longitud promedio de 30,18μm y en el cultivar O. sativa cv. FONAIAP 1 fue de 34,63μm (Cuadro 2), es importante destacar que en ambas especies el abanico formado por estas células en esta fase es más compacto que en la fase plantular. El tamaño promedio de las células epidérmicas normales más la cutícula fue de 13,2μm, para O. rufipogon y 9,98μm en O. sativa cv. FONAIAP 1 (Figura 2A, 2B y Cuadro 2).
Epidermis abaxial: el tamaño promedio de las células epidérmicas normales más la cutícula en O. rufipogon, fue de 7,88μm y en O. sativa cv. FONAIAP 1 7,70μm (Figura 2A, 2B y Cuadro 2).
Sistema fundamental: en O. rufipogon el espesor promedio del mesófilo, medido alrededor de la zona de los HV de primero y segundo orden fue de 172μm y 62,16μm, respectivamente y para O. sativa cv. FONAIAP 1 fue de 137,28μm y 62,4μm (Cuadro 2).
Tejido vascular: en O. rufipogon, el tamaño de los HV de primero y segundo orden fue 79,76μm y 44,35μm, respectivamente y en O. sativa cv. FONAIAP1 137,28μm y 62,4μm (Cuadro 2).
Nervadura central: en O. rufipogon se contaron 8 haces, de los cuales 3 de ellos son de primer orden y en O. sativa cv. FONAIAP 1 se contaron 13, de los cuales 5 de ellos son de primer orden, todos ubicados en la cara abaxial, estos HV se encuentran interconectados con los HV de segundo orden por medio de células parenquimáticas incoloras que atraviesan el espacio aerífero presente en la nervadura (Figura 2C y 2D).
El tamaño promedio de la nervadura fue de 746,2μm para O. rufipogon y 1.209,2μm en el cultivar (Cuadro 2).
Las características cuantitativas descritas en esta fase también presentaron diferencias altamente significativas, en O. sativa cv. FONAIAP 1 observándose los mayores valores en: el tamaño de las células buliformes estos resultados pudieran indicar que a elevada temperatura esta planta puede ser más eficiente en la retención de agua, en relación a el tamaño de la nervadura central y número de vasos presentes en ella, tamaño de los vasos de primer orden pertenecientes al mesófilo; son características que de alguna manera aumentan el flujo y distribución del agua (Shields citado por Fanh, 1978). En O. rufipogon el mesófilo resultó con mayor espesor, se pudiera señalar que esta especie muestra una mayor eficiencia fotosintética y sus productos pudieran estar destinados a la producción de órganos vegetativos. Una característica de interés taxonómico pudiera ser el número de haces conductores presentes en la nervadura central de cada especie y la forma cómo estas se interconectan a través de células parenquimáticas ( Figura 2C y 2D).
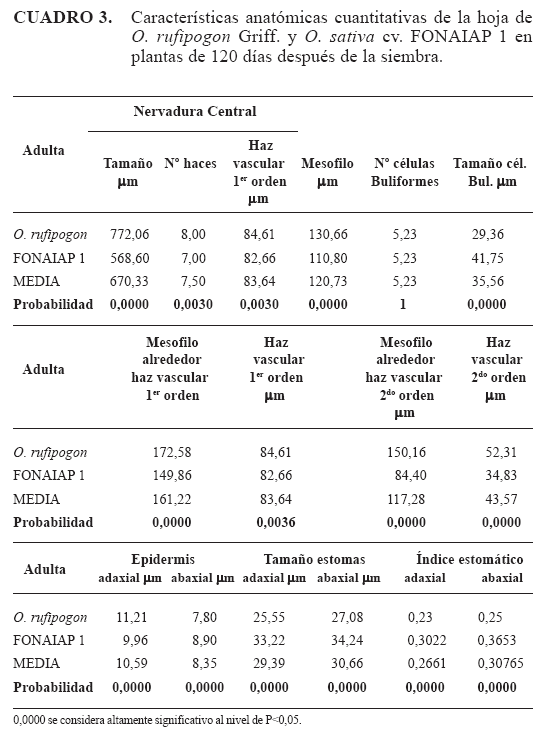
Fase adulta
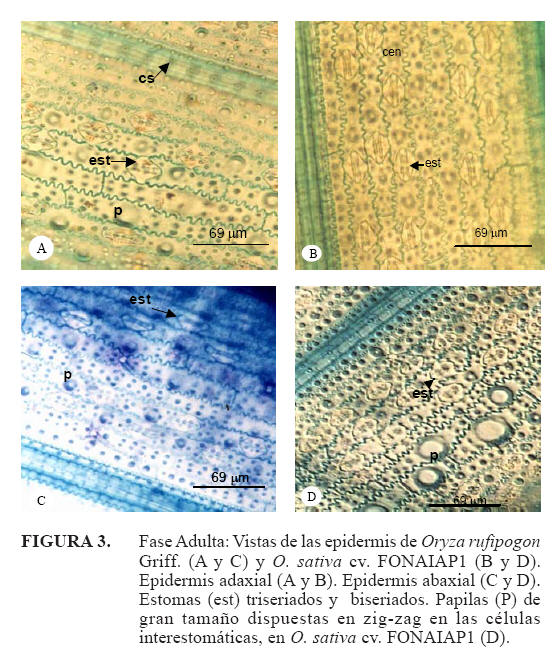
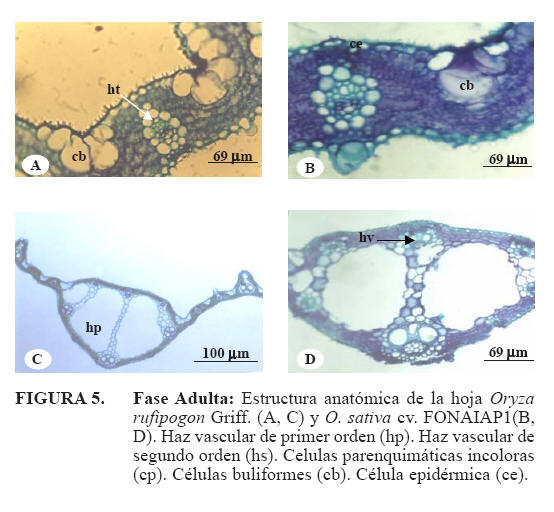
Epidermis adaxial: la epidermis más cutícula presentó un espesor promedio de: 11,21μm en O. rufipogon y en O. sativa cv. FONAIAP 1 9,96μm (Cuadro 3). Las células buliformes se observaron organizadas en grupos de 5 a 8 células, siendo más numerosas hacia la nervadura central. La célula buliforme central presentó una longitud de 29,36μm en O. rufipogon y 41,75μm en O. sativa cv. FONAIAP 1 (Figura 5A, 5B y Cuadro 3). Los estomas son de tipo parasíticos con células acompañantes en forma de domo, estos se ubican intercalados con células epidérmicas normales (Figura 3A, 3B, 3C y 3D) y con un tamaño promedio de 25,55μm en O. rufipogon y 33,22μm en O. sativa cv. FONAIAP 1, esta epidermis arrojó un índice estomático de 0,23 para O. rufipogon y 0,30 para O. sativa cv. FONAIAP 1 (Cuadro 3).
Adulta Adulta Adulta 579 FONAIAP 1, esta epidermis arrojó un índice estomático de 0,23 para O. rufipogon y 0,30 para O. sativa cv. FONAIAP 1 (Cuadro 3).
Epidermis abaxial: el conjunto de las células epidérmicas más la cutícula presentó un grosor de 7,86μm para la maleza y 8,9μm en el cultivar. Los estomas mostraron un tamaño promedio de 27,08μm en O. rufipogon y 34,24μm en el cultivar (Cuadro 3); esta epidermis evidenció un índice estomático de 0,25 para la maleza y 0,36 en el cultivar (Cuadro 3).
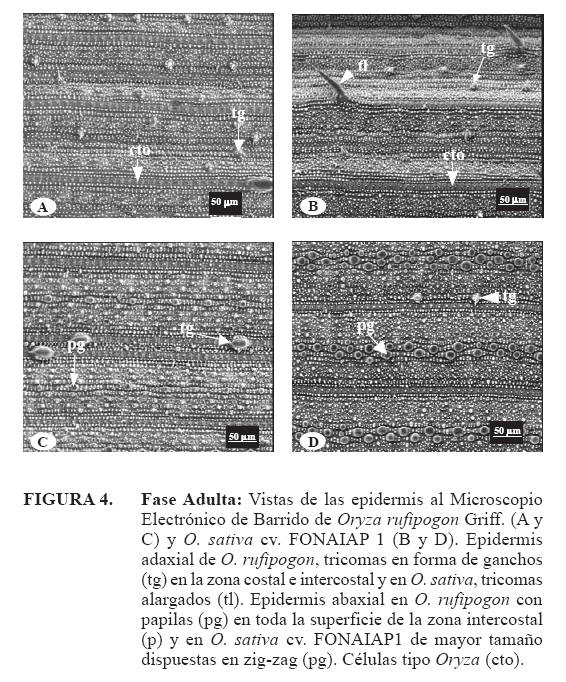
Además se pudo visualizar claramente a través del microscopio electrónico de barrido un arreglo muy particular de las papilas, las de menor tamaño presentan un arreglo más o menos lineal en ambas especies y en el caso del O. sativa cv. FONAIAP 1 las papilas de mayor tamaño se disponen en dos filas en forma de zigzag (Figura 3D y 4D).
Sistema fundamental: en O. rufipogon el espesor de éste medido desde la epidermis adaxial a la epidermis abaxial, en la zona de los HV de primer y segundo orden fue de 172,58μm y 150,16μm, respectivamente, y en O. sativa cv. FONAIAP 1 fue de 149,86μm y 84,4μm (Cuadro 3).
Tejido conductor: en O. rufipogon los HV de primer y segundo orden presentaron un tamaño de 84,61μm y 52,31μm, respectivamente y en O. sativa cv. FONAIAP 1 82,66μm y 34,83μm (Cuadro 3).
Nervadura central: en sección transversal se observan hasta 8 HV en O. rufipogon y 7 en O. sativa cv. FONAIAP 1 (Figuras 5C y 5D), los de primer orden se disponen en la cara abaxial, interconectándose por células parénquimaticas que atraviesan el espacio aerífero hasta los HV de segundo orden. En O. rufipogon Griff., esta estructura presentó un tamaño promedio de 772,06μm, mientras que O. sativa cv. FONAIAP 1 presentó un tamaño promedio de 568,60 (Cuadro 3). Al igual que en las dos fases anteriores descritas, las características anatómicas cuantitativas presentaron diferencias significativas entre las especies.
Así por ejemplo el grosor de la epidermis más cutícula, tamaño de los HV de primer y segundo orden, el tamaño de la nervadura central y el número de HV presentes en ésta, en la maleza resultaron con los mayores valores, siendo esto un indicativo de adaptación a condiciones de elevadas temperaturas y alta intensidad de luz que permite un uso mas eficiente en la retención del agua en esta fase, pero la célula buliforme central resultó de mayor tamaño en O. sativa cv. FONAIAP 1, lo que permite una disminución de la transpiración debido al doblez de la lámina (Shields citado por Fanh, 1978).
El índice estomático resultó diferente en ambas caras y para las diferentes especies, esta característica es considerada de valor taxonómico debido a que es un carácter más estable (Tichá, 1982). Los resultados encontrados indican los mayores valores siempre en la cara abaxial en ambas especies. En O. sativa cv. FONAIAP 1 el índice estomático resultó mayor mientras que en O. rufipogon fue menor, pero para ésta, los estomas presentaron mayor tamaño. La epidermis adaxial con costillas pronunciadas (característica que presentó los mayores valores en O. rufipogon) y epidermis papilosa, estos rasgos xeromorfos pudieran interpretarse como respuesta adaptativa a ambientes más secos (Alisconi, 2000); sin embargo, esta maleza es una especie que vive en condiciones de inundación.
El arreglo particular de las papilas en la pared tangencial externa de la epidermis abaxial en ambas especies (uniseriada y en zigzag) pudiera ser considerada una característica de interés taxonómico y pudiera tener alguna relación con las condiciones ambientales, ya que estas estructuras son consideradas como características de gramíneas de ambientes secos (Metcalfe, 1960) y de lugares salinos (Ellis, 1979). Páez (2001) señala que en muestreos hechos en Calabozo, estado Guárico, la especie O. rufipogon Griff., sólo crecía en los tanques donde se desarrollaba el cultivo. 583
CONCLUSIONES
- En términos generales las características anatómicas observadas, en las tres fases del ciclo ontogenético tales como: tamaño de la nervadura central, número de HV en la nervadura central, tamaño de los HV, tamaño del mesófilo, número y tamaño de la células buliformes, espesor de las epidermis (adaxial y abaxial), disposición y tamaño de las papilas en las epidermis y el índice estomático fueron variables en ambas especies.
- Estas características resultan importantes desde el punto de vista ecofisiológico, como mecanismo de adaptación a diferentes ambientes. En Oryza rufipogon Griff., se observó un mayor grosor del mesofilo en todas las fases, lo que pudiera indicar una mayor eficiencia fotosintética.
- En tal sentido el conocimiento de las características anatómicas ayudaría en la selección de labores apropiadas, para el control de la maleza y un eficiente manejo agronómico del cultivo, además pudieran tener importancia taxonómica para la identificación de las especies en la fase vegetativa.
BIBLIOGRAFÍA
1. ANGLADETTE, A. 1969. El arroz. Editorial BLUME. Barcelona, España. 45-76 p. [ Links ]
2. ALISCONI, S. 2000. Anatomía ecológica de algunas especies del género paspalum (Poaceae, panicoideae, paniceae). Darwiniana 38 ( 3-4): 187-207. [ Links ]
3. CASTILLOA, J. and M. FERRAROTTO. 1998. Cyanocrilate Glues: Alternative Meted for Making Fast, Inexpensive, and Study Plant Epidermis Impressions for Scanning Micros COPE Observation. The Journal Of Scanning Microscopies 20 ( 3): 246. [ Links ]
4. DIARRA, A., R. SMITH and R. TALBERT. 1985. Growth and Morphological Characteristics of Red Rice (Oryza sativa) Biotypes. Weed Science. Vol. 33: 310-314. [ Links ]
5. ELLIS, R. 1979. A procedure for standardizing comparative leaf anatomy in the Paceae II. The epidermis as seen in surface view. Bothalia 12: 641-671. [ Links ]
6. ESAU, K. 1972. Anatomía vegetal. Ediciones Omega. S.A. 779 pp. [ Links ]
7. FAHN, A. 1978. Plant Anatomy. Third Edition Great Britain 175-284 p. [ Links ]
8. FAHN, A. 1982. Anatomía Vegetal. Ed. H. BLUME. MADRID. 189 p. [ Links ]
9. GRIST, D. H. 1975. Rice. 5th Edition. Printed in Great Britain. 601 p. [ Links ]
10. KWON, S., R. SMITH and R. TALBERT. 1992. Comparative Growth and Development of Red Rice (O sativa) and Rice (O. sativa). Weed Science Vol. 40: 57-62. [ Links ]
11. LABRADA, R. 2000. El arroz rojo-maleza y contaminante del cultivo del arroz. In: Taller Global de Control de Arroz Rojo. Varadero, Cuba. Plant Production and Protection Division. FAO ROME,. 5-8 p. [ Links ]
12. MATSUO, T., K. KUMASAW, R. ISHII, K. ISHIARA y H. HIRATA. 1995. Science of the rice plant Vol. Two Physiology 491-531 p. [ Links ]
13. ORTIZ, A., L. LÓPEZ y J. LIZASO. 2000. Comparación de algunos componentes del rendimiento, latencia de las semillas y dimensiones de los granos entre poblaciones de arroz rojo y variedades de arroz (Oryza sativa L.) en Venezuela. Revista Facultad de Agronomía (Maracay) 26: 39-51. [ Links ]
14. PÁEZ, C. 2001. Algunos Aspectos Fitosociológicos y Anatómicos de las Principales Gramíneas Malezas en Campos de Arroz en el Sistema de Riego Río Guárico. Tesis de Postgrado. Maracay, Ven. Universidad Central de Venezuela. Facultad de Agronomía. p. 162. pp. [ Links ]
15. RODRÍGUEZ, P., 1989. Nota de Apoyo al Estudio de las Gramíneas. Editorial Americana. Caracas Venezuela. p. 171. [ Links ]
16. ROTH, I. 1992. Anatomía de las plantas superiores. Tercera edición. Ediciones de la Biblioteca. Universidad Central de Venezuela. Caracas. 273-287 p. [ Links ]
17. SALISBURY, F. y C. Ross. 1996. Fisiología Vegetal. Ed. Iberoamérica. México. 759 pp. [ Links ]
18. TICHÁ,. I. 1982. Photosynthetic characteristics during ontogenesis of leaves. 7. Stomata density and sizes. Photosynthetica 16: 375-471. [ Links ]