Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agronomía Tropical
versión impresa ISSN 0002-192X
Agronomía Trop. vol.64 no.3-4 Maracay dic. 2014
Efecto de diferentes dosis de extractos de plátano sobre el crecimiento de plantas in vitro del mismo cultivo en aclimatización
Giomar G. Blanco Espinoza1*, Blas A. Linares1, Roberto P. Guédez Falconete2, Julitt B. Hernández Fermín1 y Carmen A. Rincón1.
1Instituto Nacional de Investigaciones Agrícolas (INIA-Yaracuy).
2Ministerio del Poder Popular para la Agricultura Productiva y Tierras. *Correos electrónicos: gblanco@inia.gob.ve, gioma@hotmail.com
RESUMEN
La propagación in vitro es una alternativa para producir semillas sanas de plátano (Musa AAB); no obstante, es necesario mejorar la adaptación de las plantas in vitro a condiciones ex vitro. Para ello, pueden aprovecharse los restos de cosecha del plátano como fuente de extractos promotores del crecimiento en el mismo cultivo, siendo necesario determinar la dosis adecuada que permita las mejores respuestas. Con este fin, se sembraron vitroplantas en recipientes plásticos de 295 ml que contenían tierra, estiércol y concha de arroz en proporción 1:0,5:0,5; bajo un diseño experimental completamente aleatorizado y arreglo factorial 2x4 (tipo de extracto y dosis), con seis repeticiones. Los extractos estudiados fueron: pseudotallos y láminas foliares de plátano en dosis de 0, 10, 30 y 100%. Se evaluó la altura, número de hojas, materia seca de la parte aérea y subterránea, longitud radical, tasa de fotosíntesis neta, transpiración, conductancia estomática y concentración de pigmentos fotosintéticos. Se encontró que la mejor dosis fue la del 10%, independientemente del tipo de extracto, la cual produjo incrementos hasta del 4233,33%, en las variables evaluadas con respecto al testigo. Se concluye que la dosis de 10% fue suficiente para desencadenar respuestas morfofisiológicas conducentes a mejorar la adaptabilidad de plantas in vitro de plátano en aclimatización. Sin embargo, es recomendable continuar los estudios para clarificar el mecanismo de acción de estos extractos sobre las respuestas morfoanatómicas, fisiológicas y bioquímicas manifestadas por esta especie durante su adaptación a las nuevas condiciones ambientales.
Palabras clave: Musa AAB, Adaptación ex vitro, fotosíntesis, propagación in vitro.
Effect of differents doses of plantain extracts on the growth of in vitro plantlets in acclimatization of the same crop
ABSTRACT
In vitro propagation is an alternative to produce healthy plantain seeds (Musa AAB); however, it is necessary to improve the adaptation of plantlets to ex vitro conditions. As an option, the use of plantain crop residues allows the obstention of growth promoters in the same crop. However, it is necessary to determine the appropriate doses to trigger the best responses of the crop during acclimatization. For this purpose, plantlets were planted in plastic containers containing 295 ml of soil, manure and rice husk at a ratio of 1:0,5:0,5; under a completely randomized 2x4 factorial design (extract type and doses) with six replications. The extracts were pseudostems and leaf blades of plantain at doses of 0, 10, 30 and 100%. Height, number of leaves, dry matter of aerial and under ground parts, root length, net photosynthetic rate, transpiration, stomatal conductance and photosynthetic pigment concentration were evaluated. We found that the best dose was 10% regardless of the type of extract, which produced increases of up to 4233.33% in the evaluated variables relative to the control. It is concluded that the dose of 10% was sufficient to trigger morphophysiological responses to improve the adaptability of plantain plantlets during acclimatization; however, we recommend further studies to clarify the mechanism of action of these extracts and morphoanatomical, physiological and biochemical responses expressed by this species in their adaptation to new environmental conditions.
Key words: Musa AAB, Ex vitro adaptation, photosynthesis, in vitro propagation.
Recibido: 22/04/14 Aprobado: 24/05/15 Publicado: 31/03/17
INTRODUCCIÓN
Las musáceas constituyen una de las seis familias en el orden Zingiberales. Cuenta con unas 1000 especies, entre ellas los bananos y plátanos, los cuales son miembros del género Musa. La importancia de estos cultivos va desde su alto valor nutritivo hasta su uso artesanal (Belalcázar et al., 1991).
En Venezuela, la producción de musáceas es considerada de importancia económica, debido a que es comercializada a nivel nacional e internacional; además de ser un alimento de gran valor nutritivo. Sin embargo, al igual que en otros rubros, su producción está limitada por numerosos factores, entre los cuales está la disponibilidad de semillas sanas para el establecimiento de las plantaciones (Hernández y Zamora, 2001).
La propagación in vitro representa una opción para solventar la producción de semillas. Este proceso presenta sus difi cultades sobre todo durante la fase de aclimatización, ya que las plantas deben adaptarse progresivamente a las condiciones de campo (Lezcano, 2008; Agramonte et al., 1998), pudiendo ocurrir pérdidas alrededor del 25% (Acosta-Acosta y Galindo-Menéndez, 2013); lo que ha llevado a la búsqueda de alternativas para mejorar la adaptación de las plantas in vitro a las condiciones ex vitro.
Dentro de estas alternativas surge el uso de extractos vegetales provenientes de restos de cosecha del cultivo. Se conoce que el plátano genera gran cantidad de materia fresca, la cual, una parte importante son residuos de cosecha. En este sentido Belalcázar et al. (1991) señalan que durante la cosecha sólo se aprovecha de 20 a 30% de la biomasa generada por la planta, quedando el 70 a 80% por utilizar.
Según, Mazzeo et al. (2010), esto ha generado una de las principales problemáticas ambientales en este sistema de producción, puesto que en la mayoría de los casos, los restos vegetales son incinerados o vertidos a los cauces receptores sin tratamiento previo, lo que incrementa la degradación del ecosistema.
En otros casos, los residuos son dejados dentro de la misma plantación, lo que si bien contribuye al reciclaje de nutrientes, también constituye un reservorio para insectos plaga y enfermedades de importancia económica para el cultivo, tales como el gorgojo negro (Cosmopolites sordidus), el gorgojo rayado del plátano (Metamasius hemipterus) y la sigatoka negra (Mycosphaerella fijiensis); además de entorpecer las labores del cultivo. Es por ello, que cada vez ha tomado más importancia el aprovechamiento de estos residuos de cosecha.
En tal sentido, la literatura reporta el uso de estos residuos en la producción de metabolitos secundarios de interés farmacéutico y alimentario (Granda et al., 2005), así como en la elaboración de papel; y la obtención de harina y almidón (Mazzeo et al., 2010).
En el país, además del aprovechamiento para la obtención de harinas y almidón (Hernández et al., 2009), también es conocido el uso del pseudotallo (PS) de la planta para la alimentación del ganado durante la época de escasez de agua, la elaboración de artesanía y el aprovechamiento de las láminas foliares (LH) para la llamada hoja de hallaca, la cual es utilizada en la envoltura de este plato típico en la época decembrina (Hernández y Zamora, 2001).
Estudios realizados sobre extractos provenientes de raquis de plátano y de banano (Musa AAA) han demostrado un fuerte efecto antifúngico contra la sigatoka negra (Larco, 2004; Ortíz, 2009) y antibacterial sobre Ralstonia solanacearum causante del Moko o Hereque. Garcés (2010), comparando la calidad y los efectos de lixiviados obtenidos a partir de raquis de banano y plátano mediante transformación aeróbica y anaeróbica, reportó que ambos extractos en dosis del 100% incrementaron la altura en plantas in vitro de banano Williams.
Russo et al. (1995) reportan que extractos húmicos de raquis de banano (Musa AAB Cavendish) incrementaron el crecimiento en plantas del mismo cultivo. Sin embargo, poco se sabe del efecto de extractos provenientes de otros residuos de plátano, tales como PS y LH, y de la dosis a la cual deben ser aplicados los mismos.
El propósito de esta investigación fue evaluar el efecto de la dosis de extractos provenientes de PS y LH de plátano sobre el desarrollo de plantas in vitro del mismo cultivo.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en los laboratorios y cobertizo de la Unidad de Biotecnología Agrícola del Instituto Nacional de Investigaciones Agrícolas, Centro Nacional de Investigaciones Agropecuarias (INIA-CENIAP); Maracay, estado Aragua.
Obtención de las plantas in vitro
Para la propagación in vitro se siguió el protocolo establecido por el Instituto de Biotecnología de Plantas de la Universidad Central Martha Abreu de Las Villas, Cuba (2005); para ello, se utilizaron como explantes ápices de plátano Hartón (Musa AAB) obtenidos de plantas provenientes del banco de germoplasma del INIA-CENIAP, los cuales fueron colocados en un medio de cultivo conformado por sales propuestas por Murashige y Skoog (1962), con adición de auxinas y citocininas de acuerdo a la fase del cultivo in vitro: 6-bencilaminopurina (6-BAP) 2 mg l-1 y ácido indolbutírico (AIB) 0,023 mg l-1 (fase de establecimiento o iniciación), 6-BAP 3 mg l-1 y ácido indolacético (AIA) 1 mg l-1 (fase de multiplicación) y AIA 1,3 mg l-1 (fase de enraizamiento).
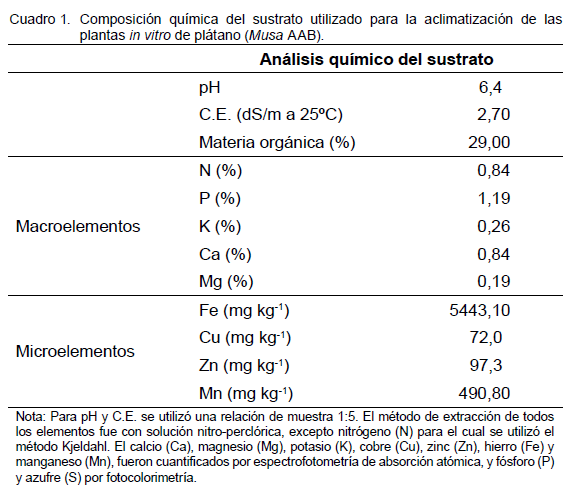
La fase de enraizamiento permitió homogeneizar la población de plantas in vitro, tanto en tamaño como en su estado fisiológico. Sin embargo, una vez obtenidas las plantas, fueron lavadas con agua para la eliminación de restos de medio de cultivo y se les eliminó las raíces para evitar enmascaramiento de los resultados, considerando solo las que se formen durante esta fase. Posteriormente, las plantas se sembraron en recipientes plásticos de 295 ml de capacidad, que contenían sustrato estéril compuesto de una mezcla de tierra, estiércol y conchas de arroz en proporción de 1:0,5:0,5; y cuya composición química fue determinada en el Laboratorio de suelos, agua y plantas del INIA Yaracuy (Cuadro 1).
Las plantas crecieron bajo condiciones de 80% de sombra dentro de un cobertizo por 75 días.
Características de los extractos de plátano utilizados
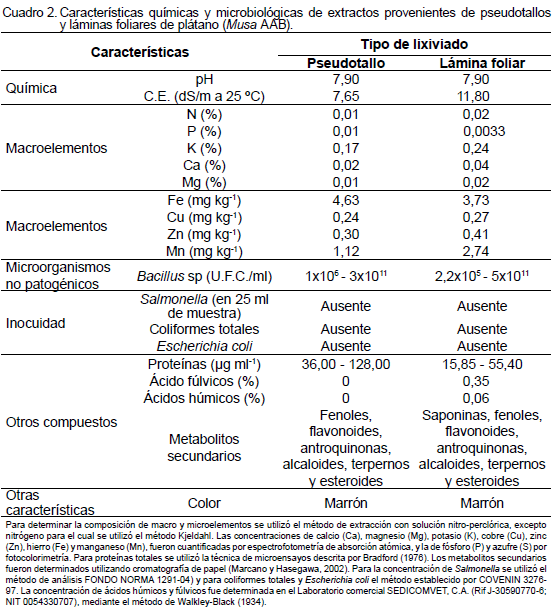
Los extractos usados fueron los obtenidos y caracterizados por Blanco (2014), quien utilizó el modelo diseñado por Linares (2009) basado en el uso de recipientes plásticos de 40 litros con tapa, donde se colocaron restos de cosecha de plátano (PS o LH) durante 90 días, para su descomposición y producción de lixiviados. La cantidad de materia fresca (MF) utilizada fue la necesaria para llenar por completo la capacidad de los recipientes (40 litros), 10 kg en el caso de PS y 5,5 kg para LH. Las características químicas y microbiológicas de los extractos producidos se muestran en el Cuadro 2.
Diseño experimental y arreglo de tratamientos
Se utilizó un diseño experimental completamente aleatorizado en arreglo factorial 2x4 con seis repeticiones, donde el primer factor corresponde al tipo de extracto (PS o LH) y el segundo a las dosis aplicadas (0, 10, 30 y 100%). La dosis de los extractos fueron calculadas considerando que el extracto original obtenido tiene una concentración del 100%, a partir del cual se hicieron diluciones con agua para obtener las restantes (10 y 30%). La dosis de 0% se corresponde a plantas no tratadas con los extractos. Se aplicaron 20 ml del extracto por cada planta con una frecuencia de 2 veces por semana.
Variables evaluadas
Morfológicas: Al final del período de aclimatización (75 días), se evaluaron las variables morfológicas en las plantas in vitro cultivadas: altura de la planta (cm), medida desde la base del PS hasta el punto de inserción de la hoja bandera; número de hojas, área foliar (AF; cm2), para lo cual se utilizó un medidor de AF CI-202, CID, Inc. La parte subterránea (cormo + raíces) fue separada del PS de las plantas y lavadas para medir la longitud radical (LR; cm) en las raíces principales emergidas directamente del cormo, utilizando una regla graduada. Posteriormente, se secaron en estufa a 70 °C por 48 h y se determinó materia seca (MS) de la parte aérea y la parte subterránea (g).
Adicionalmente, se determinó el porcentaje de sobrevivencia de las plantas al final de la aclimatización.
Fisiologicas: Se midio la tasa de fotosintesis neta (Pn) expresada en μmol m-2 s-1; ademas de la transpiracion (E) y la conductancia estomatica (C), ambas en mmol m-2 s-1, sobre la hoja mas joven recientemente expandida de cada vitroplanta, para lo cual se utilizo un sistema portatil de medicion Hand-Held Portable Photosynthesis System (CID, INC, U.S.A).
Las clorofilas a y b fueron extraidas por el metodo de Hiscox e Israelstam (1979), y se midio la absorbancia a 663 y 645 nm, para determinar su concentracion mediante las expresiones propuestas por Arnon (1949):
Concentración de clorofila a = 0,0127λ663 -0,00269 λ 645 (mg ml-1)
Concentración de clorofila b = 0,0229λ645 -0,00468 λ 663 (mg ml-1)
La clorofi la total se determinó como la suma de las concentraciones de clorofila a y clorofila b.
Los resultados fueron expresados con base a la MF.
Análisis de los resultados
Los resultados fueron analizados utilizando el programa Infostat®, a través del cual se efectuaron las pruebas estadísticas de normalidad, análisis de varianza y, en caso de detectar diferencias estadísticas entre tratamientos, la prueba de medias de Tukey con un nivel de significación del 0,05.
RESULTADOS Y DISCUSIÓN
Variables morfológicas
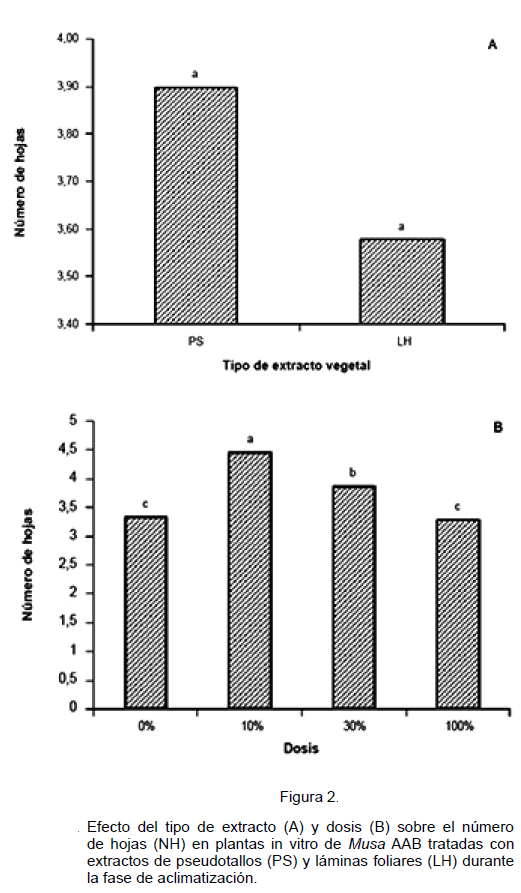
En las Figuras 1 y 2, se representan las variables altura y número de hojas, respectivamente, en función del tipo de extracto (A) y dosis aplicada (B). El análisis estadístico detectó diferencias significativas para estas variables sobre ambos factores, sin detectar diferencias para las interacciones entre los mismos.
Las plantas in vitro tratadas con extractos provenientes de PS fueron 1,23 veces más altas y con un número de hojas ligeramente superior que aquellas tratadas con extractos de LH (Figuras 1A y 2A), lo que indica una mayor efectividad de este extracto para promover el crecimiento a través del incremento de estas variables comparado con el de LH.
En cuanto al factor dosis, se observa que todas tuvieron un efecto positivo sobre el crecimiento de las plantas in vitro de plátano superando al testigo (0%); sin embargo, con la aplicación del 10% se obtuvo el mejor comportamiento de la altura de la planta y número de hojas (Figuras 1B y 2B, respectivamente), las cuales tendieron a disminuir al incrementar la concentración de los extractos. Estos resultados pudieran estar reflejando que el efecto de estos extractos vegetales tienen un comportamiento similar al mostrado por los nutrimentos, los cuales alcanzan una dosis óptima de aplicación (Espinosa y Mite, 2012).
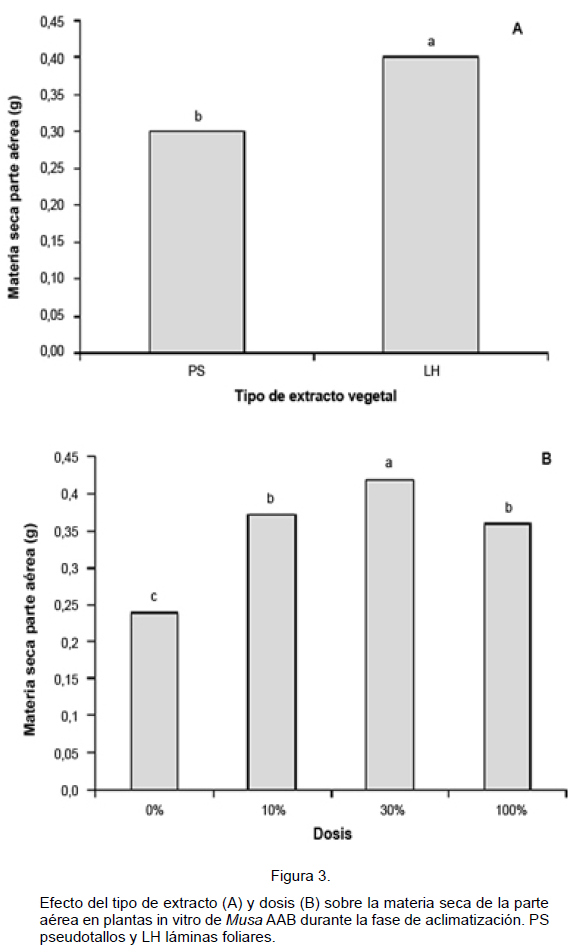
En el caso de la variable MS de la parte aérea, el análisis estadístico detectó diferencias signifi cativas para los factores: tipo de extracto y dosis. El extracto de LH produjo un incremento del 33,33% en el valor de la variable antes mencionada, comparado con el proveniente de PS (Figura 3A).
En cuanto al factor dosis, se obtuvo que en todos los casos donde se aplicó el extracto (10, 30 y 100%), los valores para esta variable fueron superiores comparados con el testigo (0%). Sin embargo, al realizar una comparación entre ellas, se observa que la dosis del 30% produjo el mayor incremento de la MS de la parte aérea (75%) en plantas tratadas, seguida de las dosis de 10 (54,17%) y del 100% (50%), con respecto al testigo (Figura 3B).
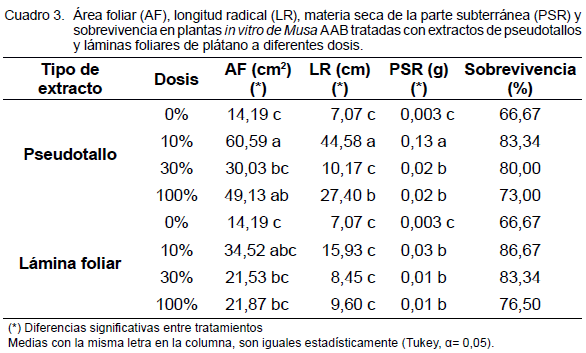
Respecto a las variables AF, LR y MS de raíces, el análisis estadístico detectó diferencias significativas para los factores tipo de extracto y dosis, al igual que para la interacción entre ambos. En el Cuadro 3 se observa que la mejor respuesta para las variables AF, LR y MS radical, se obtuvo cuando las plantas fueron tratadas con extractos provenientes de PS a la dosis de 10%, las cuales superaron al testigo en un 326,99; 530,55 y 4233,33%, respectivamente.
Sin embargo, se puede apreciar que ambos extractos aplicados en las diferentes dosis estudiadas (10, 30 y 100%), produjeron incrementos en los valores de las variables analizadas que superaron en todos los casos al tratamiento testigo (0%), lo que demuestra la efectividad de estos extractos vegetales sobre el crecimiento en plantas in vitro de plátano.
Los resultados coinciden con el estudio realizado por Russo et al. (1995), quienes reportan el efecto favorable de un bioestimulante extraído del raquis de banano (Musa AAA, grupo Cavendish, cultivar Gran enano) sobre el AF y MS radical.
En el caso de la sobrevivencia de las plantas durante la aclimatización, a pesar de que los valores alcanzados por esta variable son menores, en algunos casos, a los reportados por la literatura (Acosta-Acosta y Galindo-Menéndez, 2013), podría estar asociado a la eliminación de las raíces previo al trasplante; además se pudo observar un efecto positivo de los extractos evaluados (Cuadro 3), evidenciado en el incremento de esta variable en un 30% respecto a las plantas no tratadas; siendo las dosis de 10 y 30% las que contribuyeron a la mayor adaptabilidad de las mismas en condiciones ex vitro.
Variables fisiológicas
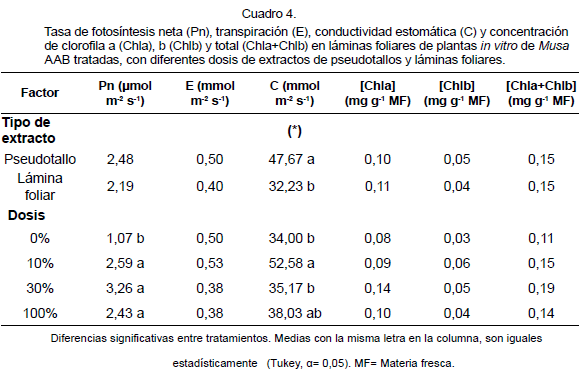
En el Cuadro 4, se presentan las variables Pn, E, C y concentración de pigmentos fotosintéticos: clorofila a (Chla), b (Chlb) y total (Chla+Chlb) en LH de plantas in vitro de Musa AAB en función de los factores: tipo de extracto y dosis.
Las dosis aplicadas provocaron diferencias altamente significativas sobre Pn, sin diferencias en cuanto al tipo de extracto utilizado. La aplicación de los extractos a cualquiera de las dosis evaluadas (10, 30 y 100%) incrementó el valor de esta variable con respecto al testigo (0%).
En el caso de E, no hubo diferencia significativa para ninguno de los factores analizados; pero sí para la variable C en relación con el tipo de extracto y dosis. Se obtuvo que plantas tratadas con extractos de PS mostraran una C mayor; es decir, mayor intercambio de gases [entre ellos, el dióxido de carbono (CO2)] que aquellas tratadas con extracto de LH.
Por otra parte, la dosis del 10% favoreció en un 54,65% el incremento de esta variable con respecto al testigo (dosis 0%). Sin embargo, al comparar los valores de esta variable con los de fotosíntesis, se observó que los valores más altos encontrados no coinciden con los valores más altos de Pn, lo que hace pensar que durante la fase de aclimatización de las plantas de plátano, la aplicación de los extractos vegetales, podría estimular otros factores que contribuyan al incremento en la fotosíntesis, entre los cuales sería interesante considerar la actividad de las enzimas fosfoenolpiruvato carboxilasa (PEP carboxilasa).
Se conoce que el plátano es una especie de mecanismo fotosintético C3; no obstante, durante la aclimatización se reportó incrementos en la actividad de la PEP carboxilasa, que pudiera estar asociada a su vez a la síntesis de almidón durante el proceso fotosintético (Aragón et al., 2010).
En la concentración de pigmentos fotosintéticos no hubo diferencias estadísticas entre los factores estudiados (tipo de extracto y dosis). Aunque, en el caso del factor dosis se observó que la en la dosis de 30%; produciendo incrementos hasta en un 75% en la concentración de Chla; de 100% en Chlb, hasta 72,73% en el caso de Chla+Chlb, comparadas con el testigo (dosis 0%).
Garcés (2010) reporta que el uso de lixiviados de banano y plátano obtenidos mediante fermentación anaeróbica de raquis, influyen positivamente sobre el contenido de clorofila en plantas in vitro de banano Williams.
El comportamiento observado en las variables fotosintéticas, donde se evidenció un incremento en Pn y de clorofilas en plantas tratadas, contribuye a la mayor adaptabilidad a las condiciones ex vitro y, por lo tanto, en el mayor porcentaje de sobrevivencia (Cuadro 3).
En términos generales, el efecto positivo de los extractos evaluados sobre el crecimiento de plantas in vitro de plátano, puede ser atribuido a sus características químicas y microbiológicas (Cuadro 2). Estos extractos contienen macro y microelementos esenciales para las plantas, donde, más que la concentración de los mismos, realza la disponibilidad de estos nutrimentos para la planta, lo que está relacionado con su pH cercano a la neutralidad.
Por otro lado, los valores de conductividad eléctrica descartan la posibilidad de problemas de salinidad con la aplicación de estos extractos al suelo con su consecuente desbalance osmótico en la planta. Estos extractos contienen también proteínas, las cuales aportan aminoácidos que pueden incorporarse directamente al metabolismo de la planta.
Los aminoácidos, además de una función nutricional, pueden actuar como reguladores del transporte de microelementos, ya que pueden formar complejos con metales en forma de quelatos. La principal ventaja del uso de aminoácidos libres en la fertilización, es que al ser absorbidos rápidamente por la planta, son utilizados inmediatamente sin requerir mayores transformaciones (Albuja et al., 2011).
Otros componentes pueden estar influyendo sobre la respuesta de crecimiento y de adaptación de las plantas in vitro, es la presencia de los grupos de metabolitos secundarios presentes en los extractos evaluados; los mismos contienen fl avonoides, alcaloides y fenoles, que parecen estar asociados a la absorción de nutrimentos, síntesis de proteínas, actividad enzimática, fotosíntesis, componentes estructurales y efectos aleloquímicos. En el caso de los flavonoides, actúan como catalizadores en la fase fotoquímica de la fotosíntesis y como reguladores de los canales de iones envueltos en la fosforilación (Stalikas, 2007).
Por otra parte, aunque los extractos evaluados (PS y LH) difieren en cuanto a la presencia de saponinas, estas reducen la tensión superficial fungiendo como surfactantes que ayudan a su absorción en la planta. Además, contienen ácidos húmicos, los cuales, también poseen auxinas y precursores de su síntesis o actividad.
Otra característica, no menos importante para las plantas, es la presencia de bacterias del género Bacillus, dado que se ha reportado que bacterias de este género ejercen una acción específica mediante la producción de metabolitos secundarios y resistencia a estrés bióticos y abióticos, facilitando la toma de nutrientes del suelo (Calvo y Zúñiga, 2010) y como promotoras del crecimiento en algunos cultivos (Idriss et al., 2002).
CONCLUSIONES
A partir de los resultados obtenidos se comprueba el efecto promotor del crecimiento que los extractos provenientes de PS y LH de plátano Hartón ejercen sobre plantas in vitro de Musa AAB, durante la fase de aclimatización y que la dosis del 10% es suficiente para desencadenar respuestas morfológicas y fisiológicas conducentes a mejorar la adaptabilidad de las plantas durante esta fase de la propagación in vitro.
Se recomienda continuar los estudios para clarificar el mecanismo de acción de estos extractos y profundizar en las respuestas morfoanatómicas, fisiológicas y bioquímicas manifestadas por esta especie durante su adaptación a las nuevas condiciones ambientales.
AGRADECIMIENTO
Al personal de la Escuela Socialista de Agricultura Tropical (ESAT), Unidad de Biotecnología Agrícola del Centro Nacional de Investigaciones Agropecuarias (CENIAP) y la sede del Instituto Nacional de Investigaciones Agrícolas (INIA), ubicada en Yaracuy. Al Fondo Nacional de Ciencia, Tecnología e Innovación (FONACIT) por el financiamiento; a la señora Juana Aguilar y demás productores de musáceas del estado Yaracuy; a los colegas Luis Castro, María Torrealba y los señores Sabino Morales y Walter Williams, por el apoyo en la realización de esta investigación.
LITERATURA CITADA
1. Acosta-Acosta, E. y L. Galindo-Menéndez. 2013. Efecto de diferentes tiempos e intensidades luminosas y dosis de BIOBRAS-16 al 0,01 mg l-1, en plantas in vitro de banano (Musa spp. cv. FHIA-18) en la fase de aclimatización. Innovación Tecnológica, (Número Especial), ISSN: 1025-6504. 19:9. [ Links ]
2. Agramonte, D., D. Ramírez, M. Pérez, O. Gutiérrez, J. Pérez y M. Núñez. 1998. Manejo integrado de plantas in vitro en la fase de aclimatización. Programa y Resúmenes. XI Seminario Científico del INCA. Cultivos Trop. La Habana. 115 p. [ Links ]
3. Albuja, R.; P. Araujo y A. López. 2011. Obtención de un biofertilizante a partir del residuo ultra fino de Spirulina platensis, mediante degradación anaerobia. Boletín Técnico del Departamento de Ciencias de la Vida, Ing. en Biotecnología, Sangolquí, Ecuador. 20 p. Disponible en línea http://repositorio.espe.edu.ec/bitstream/21000/5015/2/TESPE-033046-A.pdf. [Jun. 22, 2012]. [ Links ]
4. Aragón, C., M. Escalona, R. Rodríguez, M. Cañal, I. Capote, D. Pina and J. González-Olmedo. 2010. Effect of sucrose, light, and carbon dioxide on plantain micropropagation in temporary immersion bioreactors. In vitro Cell. Dev. Biol. Plant. 46:89-94. [ Links ]
5. Arnon, D. I. 1949. Cooper enzymes in insolated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiology. 24(1):1-15. [ Links ]
6. Belalcázar, C., J. Valencia y J. Lozada. 1991. La planta y el fruto. In: Belalcázar, S. (ed). El cultivo del plátano en el trópico. Manual de Asistencia Técnica No. 50. ICA, Armenia, Quindío, INIBAP. Feriva. Cali, Colombia. pp. 45-89. [ Links ]
7. Blanco, G. 2014. Respuesta morfofisiológica asociada al mecanismo de acción de extractos vegetales de plátano Hartón sobre el crecimiento de plantas in vitro de Musa AAB durante la aclimatización. Tesis Doctoral en Biotecnología Agrícola mención Vegetal. Maracay, Venezuela. Instituto Nacional de Investigaciones Agrícolas (INIA). Escuela Socialista de Agricultura Tropical (ESAT). 117 p. [ Links ]
8. Bradford, M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of Protein-Dye Binding. Analytical Biochemistry. 72:248-254. [ Links ]
9. Calvo, P. y D. Zúñiga. 2010. Caracterización fisiológica de cepas de Bacillus spp. aisladas de la rizósfera de papa (Solanum tuberosum). Ecología Aplicada. 9(1):31-39. [ Links ]
10. Espinosa, J. y F. Mite. 2012. Búsqueda de eficiencia en el uso de nutrientes en banano. International Plant Nutrition Institute. Disponible en línea: http://nla.ipni.net/articles/NLA0081-EN/$FILE/Eficiencianutrientes.pdf. [Jun. 22, 2012]. [ Links ]
11. Garcés, H. 2010. Comparación de la calidad y efectos de lixiviados obtenidos a partir de raquis de banano (Musa acuminata) y plátano (Musa balbisiana) mediante transformación aeróbica y anaeróbica en condiciones de invernadero. Trabajo de grado para la obtención del título de Ingeniero Agropecuario, Escuela Politécnica del Litoral, Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Guayaquil, Ecuador. 133 p. [ Links ]
12. Granda, D., A. Mejía y G. Jiménez. 2005. Utilización de residuos de plátano para la producción de metabolitos secundarios por fermentación en estado sólido con el hongo Lentinus crinitus. VITAE. 12(2):13-20. [ Links ]
13. Hernández, J. y S. Zamora. 2001. Desarrollo rural sostenible para las zonas productoras de plátano del estado Yaracuy. INIA Secretaría de Desarrollo Agrícola de la Gobernación del estado Yaracuy. 158 p. [ Links ]
14. Hernández, J., A. Cañizares, G. Blanco, I. Arrieche, A. Pérez, C. Salazar y M. González. 2009. Contenido de nitrógeno, fósforo y potasio en harinas de clones de musáceas comestibles (Musa spp.). Revista UDO Agrícola. 9(2):499-457. [ Links ]
15. Hiscox, J. y G. Israelstam. 1979. A method for the extraction of chlorophyll from leaf tissue without maceration. National Research Council of Canadá. pp. 1332-1334. [ Links ]
16. Idriss, E., O. Makarewicz, A. Farouk, K. Rosner, R. Greiner, H. Bochow, T. Richter and R. Borriss. 2002. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect. Microbiology. 148:2097-2109. [ Links ]
17. Instituto de Biotecnología de las Plantas de la Universidad Central Martha Abreu de Las Villas. 2005. Protocolo para la micropropagación de cultivares de plátano y bananos mediante organogénesis. Cuba. 31 p. [ Links ]
18. Larco, E. 2004. Desarrollo y evaluación de lixiviados de compost y lombricompost para el manejo de sigatoka negra (Mycosphaerella fijiensis Morelet), en plátano. Tesis de grado Magíster Scientiae. Escuela de Posgraduados, Programa de Educación para el Desarrollo y la Conservación del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Costa Rica. 77 p. [ Links ]
19. Lezcano, M. 2008. Micropropagación masiva de plantas: El proceso innovador de la Biofábrica. CINNTEC, revista digital de innovación tecnológica. N° 3. Disponible en línea: http://www.cinntec.misiones.gov.ar/index.php?option=com_content&task=view&id=17&Itemid=23. [Abr. 28, 2012]. [ Links ]
20. Linares, B. 2009. Informe de seguimiento técnico anual del proyecto Fortalecimiento de cadenas de valor de plátano: Innovaciones tecnológicas para reducir agroquímicos, caso Venezuela. FONTAGRO-INIA Yaracuy, Venezuela. 10 p. [ Links ]
21. Marcano, D. y M. Hasegawa. 2002. Fotoquímica orgánica. Segunda edición. Consejo de Desarrollo Científico y Humanístico. Universidad Central de Venezuela. Editorial Torino. Caracas, Venezuela. 588 p. [ Links ]
22. Mazzeo, M., L. León, L. Mejía, L. Guerrero y J. Botero. 2010. Aprovechamiento industrial de residuos de cosecha y poscosecha del plátano en el Departamento de Caldas. Revista Educación e Ingeniería. (9):128-139. [ Links ]
23.Murashige, T. and F Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum. 15(3):473-497. [ Links ]
24. Norma, Venezolana COVENIN Nº 3276-97. 1997. Alimentos. Recuento de Coliformes y de Escherichia coli. Método en placa con películas secas rehidratables (Petrifilm). 7 p. [ Links ]
25. Norma Venezolana COVENIN Nº 1291-04. 2004. Determinación de Salmonella shigella. Aislamiento e identificación de Salmonella en alimentos. (1a. Revisión). Caracas, Venezuela: Ministerio de Fomento. 35 p. [ Links ]
26. Ortiz, M. 2009. Evaluación de la actividad de los lixiviados de raquis de banano (Musa AAA), plátano (Musa AAB) y banano Orito (Musa AA) sobre el agente causal de la sigatoka negra (Mycosphaerella fijiensis Morelet) en condiciones in vitro. Trabajo de grado Ingeniera Agropecuaria. Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Escuela Politécnica del Litoral. Guayaquil, Ecuador. 110 p. [ Links ]
27. Russo, R., J. Lugo, O. Arreola y O. Arango. 1995. Efecto de un bioestimulante húmico extraído del raquis de banano (pinzote) sobre el crecimiento de plántulas de banano (Musa AAB subgrupo Cavendish clon Gran enano). Agronomía Mesoamericana. 6:130-133. [ Links ]
28. Stalikas, C. 2007. Extraction, separation and detection methods for phenolic acids and flavonoids. V. Sep. Sci. 30:3268-3295. [ Links ]
29. Walkley, A. and I. A. Black. 1934. An Examination of Degtjareff Method for Determining Soil Organic Matter and a Proposed Modification of the Chromic Acid Titration Method. Soil Sci. 37:29-37. [ Links ]