Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.57 n.1 Caracas mar. 2007
O perfil de macronutrientes influencia a termogênese induzida pela dieta e a ingestão calórica
Helen Hermana Miranda Hermsdorff , Ana Carolina Pinheiro Volp, Josefina Bressan
Universidad de Navarra, Pamplona, España. Universidade Federal de Viçosa.Viçosa, Brasil
RESUMO.
A composição da dieta pode interferir diretamente na homeostase energética. No metabolismo energético, a via de oxidação e a termogênese induzida pela dieta são diferenciadas pela proporção de macronutrientes da dieta. Neste sentido, a dieta hiperprotéica émais termogênica que as dietas hiperglicídicas e hiperlipídicas, enquanto que as dietas ricas em carboidrato parecem ser mais termogênicas que as ricas em lipídio, mas os resultados ainda são controversos. Em relação à ingestão calórica, a composição da dieta pode estimular ou inibir a mesma, de acordo com a palatabilidade dos alimentos e o grau de saciação e saciedade, relacionadas às quantidades de carboidrato, proteína e lipídio da mesma. Uma hierarquia tem sido relatada para a capacidade dos macronutrientes em induzir saciedade em que a proteína é o mais sacietógeno ao contrário dos lipidios, que são os menos sacietógenos. De modo geral, ainda há discrepâncias entre os estudos, em relação ao papel regulador dos macronutrientes em componentes do gasto energético e na ingestão calórica, devido às diferenças metodológicas como amostra, tempo de exposição à dieta, densidade calórica e conteúdo calórico total da mesma. Desta forma, o presente trabalho tem como objetivo analisar as evidências científicas mais consistentes a respeito do papel modulador da composição da dieta na termogênese induzida pela dieta e na ingestão calórica, para melhor entendimento da prevenção e controle da obesidade pela intervenção dietética.
Palavras chave: Carboidratos, proteínas, lipídios, termogênese, metabolismo energético, ingestão calórica, obesidade.
SUMMARY.
Macronutrient profile affects diet-induced thermogenesis and energy intake. The diet composition can interfere directly in the energy homeostase. In the energy metabolism, the oxidation pathway and diet-induced thermogenesis are differentiated by diet macronutrients proportion. In this respect, the high-proteindiet is the most thermogenic, compared to high-carbohydrate and high-lipid diets, while high-carbohydrate diet appears to increase the thermogenic effect more than high-lipid diet, but the studies arecontroversies. Towards energy intake, it can stimulate or inhibit the energy intake, according to the foods palatability, satiation and satiety degree, related to diet carbohydrate, protein and lipid content. A hierarchy has been observed for the satiating efficacies of the macronutrients protein, carbohydrate and fat, with protein as most satiating and fat as least satiating. In general, there are discrepancies between studies about the regulatory role of macronutrients in the components of energy expenditure and intake, due the methodological differences in the subjects, exposition time for diet, energy density, and total energy content. The present work seeks to analyze the more consistent scientific evidences toward the modulator role of diet composition on the diet induced thermogenesis and energy intake, for better understanding of obesity prevention and control by dietetic intervention.
Key words: Carbohydrates, proteins, lipids, thermogenesis, energy metabolism, energy intake, obesity.
Recibido: 29-09-2006 Aceptado: 02-04-2007
INTRODUÇÃO
O balanço energético, advindo do equilíbrio entre o gasto energético (GE) e a ingestão calórica (IC), tem um importante papel no controle do peso e da reserva de gordura corporal. Para entender como este balanço é perdido, é necessário investigar a ingestão, oxidação, termogênese e estocagem dos macronutrientes, a saber, carboidrato, proteína e lipídio, que juntos influenciam na IC, no GE e no balanço energético (1).
A oxidação da proteína e do carboidrato se ajusta espontaneamente à sua ingestão, mas isto não ocorre com o lipídio, que é principalmente estocado durante a fase pósprandial (2,3). A termogênese induzida pela dieta (TID), por sua vez, tem o conteúdo calórico e a composição da dieta como importantes moduladores (4,5). A proteína é o macronutriente mais termogênico (6-8), enquanto que o poder termogênico do carboidrato e lipídio ainda é controverso.
Alguns estudos indicam que dietas ricas em carboidrato têm maior efeito na TID que dietas hiperlipídicas (9-10), enquanto outros não encontram diferença entre seus efeitos (6,11,12). A TID parece ser também influenciada pelos estímulos sensoriais (13), de modo que o aumento da palatabilidade dos alimentos está associado ao aumento da TID (4,6). Em relação ao estado nutricional, os indivíduos obesos têm apresentado menor resposta metabólica oxidativa (14-17) e termogênica (18-21) nos estados de jejum e pós-prandiais, suportadas pela hipótese de que ação do sistema nervoso simpático (SNS) é prejudicada pela redução do número e da sensibilidade dos â- adrenorreceptores (22-23).
A ingestão alimentar, um dos componentes do balanço energético, está intimamente ligada às sensações de fome, saciação, saciedade e apetite (24-25). Por isso, a influência dos macronutrientes na IC é muito investigada, mas os resultados também são controversos. Estudos mostram que pessoas apresentam menor sensação de fome, menor IC e maior saciedade após a ingestão de uma carga de proteína, quando comparada à ingestão de cargas de carboidrato e lipídio (26-29). O lipídio parece ter menor efeito sacietógeno que o carboidrato, além de aumentar a palatabilidade dos alimentos e, apresentar maior conteúdo calórico (30-32). Entretanto, em alguns estudos, não houve diferença entre dietas hiperglicídicas e hiperlipídicas na saciedade, quando as mesmas apresentavam densidade calórica e palatabilidade similares (26,33), o que sugere a influência dessas características da dieta na IC.
Desse modo, o presente trabalho tem como objetivo analisar as evidências científicas mais consistentes a respeito do papel modulador da composição da dieta na termogênese induzida pela dieta e na ingestão calórica, para melhor entendimentoda prevenção e controle da obesidade pela intervenção dietética adequada.
METODOLOGIA
Para a presente revisão, foi realizada uma busca a partir dos principais bancos de dados nacional e internacional em saúde disponíveis na Internet: Web of Science, Pubmed, Lilacs e Scielo (1990 – Abril, 2007), com o fim de se apresentar e discutir as publicações mais relevantes sobre o tema. Foram utilizadas as palavras chaves carboidratos, proteínas e lipídios, termogênese, metabolismo energético, ingestão calórica, obesidade, em português e em sua respectiva tradução para as línguas inglesa e espanhola, quando necessário.
Termogênese induzida pela dieta e o papel dos macronutrientes
O balanço energético, fundamental para a manutenção do peso corporal dos indivíduos, se faz pelo equilíbrio entre o GE e a IC. O fato de que o balanço é mantido quando a energia ingerida é igual a que é gasta nos processos metabólicos e atividade física, sugere que alta prevalência de gordura corporal total (GCT) é, provavelmente, causada por um ou mais fatores: (a) alterações no gasto energético pela atividade física; (b) alterações na eficiência do turnorver metabólico (termogênese); (c) alterações na IC. Para entender como este balanço é perdido, faz-se necessário investigar a ingestão, oxidação e estocagem dos macronutrientes, a saber, carboidrato, proteína e lipídio, que juntos determinam a IE, o GE e o balanço energético (1).
A oxidação celular dos substratos é determinada pela necessidade do organismo em gerar adenosina trifosfato (ATP), utilizado nas diferentes funções metabólicas (manutenção de temperatura, atividades, etc.). A composição dos substratos metabólicos, destinada a fosforilação oxidativa, varia consideravelmente durante o dia (5). O quociente respiratório não protéico (QRNP), razão entre o volume de CO2 expirado e volume de O2 inspirado, indica a proporção de GE na oxidação de carboidrato e lipídio, enquanto que a oxidação de proteína é independentemente estimada pela excreção de nitrogênio urinário de 24 horas (1).
A ingestão alterada de carboidrato não causa imediatamente mudanças na sua oxidação, sendo necessário um tempo para ajustar o QRNP ao novo estado (um a três dias). Após uma semana de dieta rica em carboidrato ou em proteína, a oxidação do macronutriente está equilibrada (1). Chawalibog & Thorbek (34) obtiveram uma redução significativa da oxidação noturna de carboidrato (5-7g de carboidrato/ hora) em comparação a oxidação de carboidrato durante o dia (12-14g de carboidrato/ hora). Esta diferença pode ser explicada pela necessidade de manutenção da homeostase glicídica. Durante o dia, enquanto o carboidrato é ingerido, as reservas de glicogênio permanecem saturadas e então, a maior parte do carboidrato ingerida é oxidada. Durante a noite, período de jejum, as reservas de glicogênio precisam ser utilizadas, reduzindo o nível de oxidação do carboidrato para preservação das mesmas.
Os QRNPs após a ingestão de uma dieta rica em gordura são menores que os obtidos após a ingestão de uma dieta pobre em gordura, devido à maior oxidação de lipídio na primeira (16,35). Entretanto, estudos em modelos animais e em humanos demonstram que a alta ingestão de lipídios pode causar uma redução na expressão de genes envolvidos na cadeia transportadora de elétrons e na biogênese mitocondrial, ou seja, na capacidade de fosforilação oxidativa (36,37). O lipídio, portanto, diferentemente do carboidrato e da proteína, que ajustam sua oxidação a sua ingestão, é principalmente estocado durante a fase pós-prandial (2,3,5). Além disso, o grau de saturação, a posição do ácido graxo (AG) no glicerol e o número de carbonos da cadeia do AG podem influenciar no metabolismo pós-prandial dos lipídios. Por exemplo, em modelos animais, dietas ricas em ácidos graxos poliinsaturados levaram a um menor acúmulo de gordura corporal, reduziram o QRNP e aumentaram a TID (27). Em humanos, as dietas hiperlipídicas ricas em ácidos graxos poliinsaturados promoveram menor acúmulo de gordura corporal que dietas ricas em ácidos graxos monoinsaturados, por estimulação da TID (5). Outros estudos obtiveram menor QRNP e maior oxidação de lipídio após ingestão de diglicerídios (DG), comparados a ingestão de triglicerídios (TG). A hipótese que justifica este resultado é a diferença no metabolismo dos DG e TG nos períodos pré e pós-absortivos. O TG é hidrolisado pela 1,3 – lipase em 1,2-DG ou 2,3-DG, que por sua vez, sãohidrolisados em 2-monoacil-glicerol e AG para serem absorvidos na mucosa intestinal e transportados às células como quilomícrons. Os DG são, em sua maioria, consumidos na forma de 1,3-DG que são hidrolisados em AG e glicerol e transportados via sistema porta ao fígado, onde são preferencialmente oxidados (38). Este mecanismo também justifica as menores concentrações plasmáticas de TG em jejum (39) e em estado pós-prandial (40) e menor acúmulo de gordura no tecido adiposo abdominal (41) após ingestão de dietas ricas em DG. Os TG contendo AG de cadeia longa (TCL) e AG de cadeia média (TCM) também têm sido investigados. As dietas em que 30 a 60% do valor calórico total é consumido na forma de TCM levaram a uma maior oxidação de lipídio (42-43), maior oxidação de carboidrato (44) e maior TID (45) que as dietas em que a mesma proporção calórica é consumida na forma de TCL. O mecanismo parece ser o mesmo dos DG, em que os TCM são transportados diretamente ao fígado via sistema porta e estimulam a â-oxidação hepática. O aumento da concentração plasmática de â- hidroxibutirato, após ingestão de DGs e TCM, indica o aumento da oxidação hepática (38,42). Apesar do efeito benéfico no metabolismo do lipídio, a utilização de TCM na alimentação habitual é dificultada por suas características sensoriais, que levam a rejeição na maioria dos indivíduos, mesmo em pequenas porções.
Estes resultados mostram que a resposta oxidativa, principalmente pós-prandial, está associada à proporção de macronutrientes oferecida na dieta. Para o lipídio, é ainda importante levar em consideração as quantidades de gorduras saturadas, mono e poliinsaturadas, bem como a presença dos DG e TCM.
A TID é o gasto energético gerado pelos processos de ingestão, digestão, absorção, utilização e estocagem dos alimentos ingeridos. Ela representa 5% a 15% do gasto energético total, o que indica seu importante papel na regulação do balanço energético e do peso corporal. Em uma dieta mista, a TID pode representar um gasto energético de 10% a 15% do conteúdo calórico de uma dieta mista, mas quando os macronutrientes são ingeridos separadamente, a proteína, o carboidrato e o lipídio apresentam TID de 20% a 30%, 5% a 10% e 0% a 3% do valor calórico total ingerido, respectivamente. A TID é composta por duas fases distintas. A fase cefálica ou facultativa ocorre pela ação do sistema nervoso simpático (SNS), ativado pelas características sensoriais da dieta, enquanto a fase gastrointestinal ouobrigatória se caracteriza pelo gasto energético na fase de absorção e utilização dos nutrientes pelo consumo de ATP (45,46).
Entre os vários fatores que modulam a TID, o conteúdo calórico e a composição da dieta são os mais importantes (4,5,46).
A proteína é o macronutriente mais termogênico, levando a um gasto energético de 19% da energia ingerida para sua utilização e estocagem, enquanto que o lipídio, necessita de um gasto 3% para o mesmo metabolismo (6,7,27). Ao mesmo tempo, o efeito térmico da proteína é 50% a 100% maior que do carboidrato, geralmente atribuído ao custo metabólico da síntese de peptídeo ligante, ureogênese e gliconeogênese (29).
Os estudos sobre o efeito termogênico do carboidrato e lipídio ainda são controversos. Labayen et al (9) e Tentolourius et al (10) obtiveram maior TID após a ingestão de dieta rica em carboidrato, comparado a ingestão de dieta rica em lipídio, suportados pela hipótese de que o carboidrato é capaz de ativar o SNS pela resposta insulínica pós-prandial (10,47). Por outro lado, outros estudos em que a ingestão de dietas ricas em carboidrato e em lipídio não apresentou diferença significante na TID (6,11,12,48). Em relação ao tipo de carboidratos e lipídios, a TID é maior após ingestão de dietas ricas em carboidratos complexos, comparadas a dietas ricas em açucares (49,50) e após a ingestão de dietas ricas em TCM, comparadas a dietas ricas em TCL (42). Desse modo, não só a quantidade de carboidrato e lipídio oferecida na IC é importante no efeito térmico da dieta, mas também sua qualidade pode ser manipulada para obtenção de maior gasto energético pósprandial.
A TID é reduzida em homens alimentados diretamente no estômago, comparada a TID dos 30 a 40 minutos após umaalimentação oral (fase cefálica da TID). Este resultado sugere que a TID pode ser influenciada pelos estímulos sensoriais (aparência, aroma, textura) da dieta. Em estudo com ratos, a ingestão de dieta palatável rica levou ao aumento da IC e maior ganho de peso, comparado a ingestão de uma dieta controle. Em outro estudo, depois da ingestão de dieta palatável, a TID foi maior em magros, associada a uma maior excreção de noradrenalina (maior resposta metabólica), enquanto que em obesos a TID não apresentou diferença significativa. A deficiência nos obesos de aumentar a TID pela dieta pode estar relacionada a diferentes respostas físicas, fisiológicas e psicológicas para estimular a TID, na sua fase cefálica (51). Ao mesmo tempo, não houve efeito da palatabilidade na TID em jovens e idosos em 6 horas de leitura pós-refeição, ou, em adultos após carga lipídica com a presença ou não da estimulação oral, sugerindo que o efeito da palatabilidade na hiperfagia pode não ser atenuado pelo gasto energético e, causar efeito direto na mudança da composição corporal (52- 53). É importante notar que a composição da dieta (em açúcar e lipídio) pode influenciar os resultados sobre o efeito da palatabilidade na TID. Deste modo, as discrepâncias nos estudos da influência hedônica na TID podem estar relacionadas com as diferenças nos graus de palatabilidade das dietas e outras características como: tamanho, consistência, familiaridade, duração da estimulação sensorial e estresse psicológico induzido pela dieta. Além disso, variações individuais podem interferir na TID e na palatabilidade como resistência insulínica, composição corporal e idade, que estão negativamente associados à TID (53).
Além destes fatores, o tempo de leitura e a carga calórica oferecida interferem na capacidade de detecção das repostas da TID em relação aos macronutrientes e à palatabilidade. Geralmente, a TID necessita de uma leitura de 4 a 8 horas 36 MIRANDA HERMSDORFF et al. para ser determinada, mas o tempo do aumento do GE pósprandial que inclui a TID total e seu valor de pico varia bastante entre os estudos (4). Os valores de TID estão aumentados para dietas ricas em álcool e proteína no final de 5 horas de leitura, sugerindo que os efeitos destas refeições foram pronunciadospor período mais longo (11). Após ingestão de uma dieta mista, a TID pode ser determinada em uma leitura de 3 horas, quando o conteúdo calórico está entre 360 e 620 kcal, ou ainda, quando o mesmo é equivalente a, aproximadamente, 15% do gasto energético total. Para dietas que oferecem 35% a 45% das necessidades energéticas, seriam necessárias 8 horas de leitura (18,48). A variabilidade da TID também se deve à pequena magnitude da sua resposta num longo período de tempo, à influência do processo pós-prandial de nutrientes e a variabilidade intra-individual. Para um estudo obter efeito do tratamento ou diferença entre grupos de 10, 25 ou 50% na TID (á= 0,05; â= 0,10 ou 0,20) seria necessária uma amostra maior que 10 indivíduos por grupo (18).
A TID é modulada, portanto, por vários fatores, o que dificulta na determinação da real influência dos macronutrientes da dieta. Entretanto, o efeito destes macronutrientes na oxidação e gasto pós-prandial indicam a importância da composição da dieta na homeostase energética.
A Tabela 1 mostra os principais resultados relacionados ao efeito da composição dieta na TID.
TABELA 1
Principais resultados científicos sobre o papel dos macronutrientes da dieta na termogênese induzida pela dieta
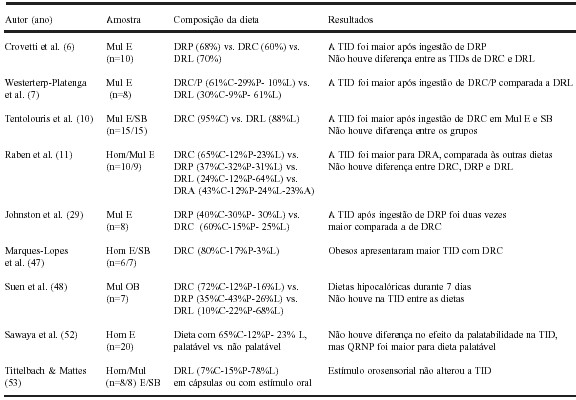
E: indivíduos eutróficos; SB: indivíduos com sobrepeso; OB: indivíduos obesos; Mul: mulheres; Hom: Homens; C: carboidrato; P: proteína; L: lipídio; A: álcool; DRC: dieta rica em carboidrato; DRP: dieta rica em proteína; DRL: dieta rica em lipídio; DRA: dieta rica em álcool; TID: termogênese induzida pela dieta; QR: quociente respiratório.
Como comentado anteriormente, o SNS tem importante papel na regulação da termogênese e utilização de lipídio. Estudos em que catecolaminas e epinefrina (ambos á- e â- adrenoreceptores) são infundidas, o gasto energético é aumentado por meio do aumentado da lipólise e da oxidação de lipídio (22). Em humanos, é proposto que a termogênese seja mediada por â1- e â2- adrenoreceptores, diferentes de outros mamíferos em que a ativação da termogênese ocorre via â3- adrenoreceptores (54). O SNS, via â- adrenoreceptores excita a resposta termogênica via ativação das proteínas desacopladoras de elétrons (uncoupling protein; UCP), que liberam a energia eletroquímica advinda da fosforilação oxidativa respiratória na forma de calor, sem geração ATP (54,56). O SNS pode ser estimulado por corticotropina (CRH) ou inibido pelo neuropeptídeo Y (NPY), sendo mediado, portanto, por peptídeos ligados a homeostase energética. Suaatividade também é aumentada em resposta à alimentação (~5 a 10%) principalmente quando o conteúdo de energia da dieta é aumentado, por exemplo, pelo consumo de alimentos palatáveis. A ingestão de carboidrato, mas não de proteína e lipídio é acompanhada de aumento na atividade do SNS em animais e humanos, enquanto que em estado de jejum os níveis de noraepinefrina e batimentos cardíacos são reduzidos em magros e obesos (efeito inibitório). A glicemia pós-prandial modulada pela ingestão de carboidratos também interfere na homeostase energética do SNS, associada às alterações da insulina, leptina e glicorticóides, via alteração da captação e utilização de glicose nos tecidos hepático, muscular e adiposo (54,55).
Além disso, indivíduos podem ser mais susceptíveis ao ganho de peso após o consumo de dietas ricas em lipídios, em presença de polimorfismos genéticos das UCPs, descritas anteriormente por sua ação termogênica. A UCP-1 se localiza no tecido adiposo marrom, adquirindo importância especial durante os primeiros anos de vida, quando este tecido se apresenta em maiores concentrações. Em estudo realizado com crianças entre 8 a 11 anos, aquelas que continham o polimorfismo resultante da substituição de adenina por guaninana posição -386 (alelo GG) da região promotora do cromossomo 4, apresentaram uma TID menor que as crianças com presença de alelo AA + AG, após consumo de dieta rica em lipídios (70% do valor calórico total) (36,37). Em relação as UCPs 2 e 3, elas são expressas no tecido adiposo branco, no músculo esquelético e em outros tecidos (fígado, timo, pulmão, coração, rins), indicando que a regulação termogênica pelas UCPS também pode ocorrer na fase adulta e é difusa pelo organismo (54-55, 57). Em ratos a expressão das UCPs 2 e 3 estão elevadas em resposta à dieta rica em lipídios no cérebro e no músculo esquelético, respectivamente (57). Com relação à interação polimorfismo genético e fenótipo, a existência de polimorfismo genético na UCP-2 em humanos, representada pela substituição de guanina por adenina na posição -866 da região promotora do cromossomo 11, tambémestá relacionada com maior risco para obesidade e hipertensão arterial. Sobre a UCP-3, as mutações existentes são de muito baixa freqüência (56).
A composição da dieta tem forte poder modulador na resposta metabólica oxidativa e termogênica nos estados de jejum e pós-prandiais, mas em obesos essa resposta pode ser reduzida. Estudos, comparando a resposta oxidativa de indivíduos magros e obesos, relatam uma maior oxidação do lipídio após dieta rica em lipídios em magros, mas não em obesos (14-17, 20). Isso porque o GE é menor nos obesos, agindo como uma força que se opõe às alterações da dieta(aumento do valor calórico em lipídios) e mantém a alta reserva de gordura corporal, por um balanço energético positivo (14, 20, 58). Em indivíduos obesos, a lipólise e a oxidação de lipídios via ação do SNS é reduzida pela redução do número e da sensibilidade dos â-adrenorreceptores (22,23). A participação de peptídeos na ativação do SNS sugere uma associação entre a composição corporal e a resposta metabólica (10,48,54). Em relação a TID, é mais significante o número de estudos em que a mesma é menor em obesos e pós-obesos. Outros estudos ainda mostram uma forte correlação negativa entre a TID e a resistência insulínica e, as concentrações plasmáticas de ácidos graxos livres, enquanto que as concentrações de leptina são positivamente associadas à TID (18-21). Estes dados suportam, portanto, a hipótese de que a TID, apesar de representar pequena proporção do GE total, tem papel relevante na patogênese da obesidade e da síndrome metabólica.
De acordo com os estudos apresentados e discutidos, a proteína é o macronutriente que proporciona maior GE, enquanto que o carboidrato parece ser o segundo macronutriente no GE, devido a sua ação no SNS e na liberação de hormônios relacionados a homeostase energética (insulina, leptina). O lipídio, portanto, tem fraco poder no GE, facilitando o acúmulo de gordura corporal, principalmente em indivíduos já obesos. Apesar disso, a modulação do tipo de lipídio a ser oferecido na intervenção dietoterápica pode ser uma alternativa interessante para minimizar o efeito deletério do lipídio.
Ingestão calórica e o papel dos macronutrientes
Sendo a ingestão alimentar um dos componentes do balanço energético, faz-se necessário destacar os vários processos que estão intimamente ligados ao ato de se alimentar como a fome, saciação, saciedade e apetite. A fome é a força que leva ao ato de se alimentar, podendo se referir à sensação ou ao desejo conscientes de obter e comer alimentos (24,25).
A saciação é o processo em que o período de alimentação é interrompido e a saciedade é o estado de inibição da alimentação que ocorre entre as refeições. O apetite, por suavez, é o desejo físico e emocional por um alimento específico (24,59).
Uma diferença em torno dos sinais responsáveis por nosso comportamento alimentar gera um padrão alimentar baseado nas refeições. Estes sinais interferem em diferentes tempos após a ingestão alimentar. A saciedade sensorial específica reflete o processo precoce da saciedade, ou seja, é o momento em que há pouca influência da digestão e absorção de nutrientes na saciedade e as propriedades sensoriais específicas inibem a alimentação, principalmente por alimentos de características semelhantes (59,60). Esta fase da saciedade é uma resposta cefálica iniciada pela visão, aroma e sabor dos alimentos, em que os sinais são a salivação, resposta gástrica, secreção pancreática e eventos intestinais (24). Uma outra etapa se inicia 20 a 30 minutos após o início da ingestão, ou seja, depende de mudanças pré-absortivas, como distensão gástrica, taxa de esvaziamento gástrico, liberação de hormônios (colecistocinina), estimulação do nutriente no trato gastrointestinal por meio de receptores fisioquímicos (24,33). A fase pós-absortiva da saciedade inclui mecanismos de ação de metabólitos após a absorção no intestino e sua entrada na corrente sanguínea como a glicose e aminoácidos, que podem agir diretamente no cérebro ou podem influenciar indiretamente, via neurônios aferentes pós-estimulação de quimoreceptores ou, ainda, via modulação hormonal (insulina, ghrelina, leptina) (24,61). Deste modo, a influência dos macronutrientes na IC, por meio de mecanismos orosensoriais, pré e pós-absortivos, tem sido muito investigada.
Em relação aos mecanismos orosensoriais de saciedade dos macronutrientes, alguns investigadores sugerem que a palatabilidade tem grande efeito sobre a saciação, e não na saciedade, ou seja, a palatabilidade poderia interferir no consumo ad libitum durante a refeição, aumentando o apetite e modificando o perfil de alimentos ingeridos, mas não na IC, horas após a refeição (18,24,62). Entretanto, alguns estudos mostram que o estímulo orosensorial exerce grande influência na manutenção da refeição e no desenvolvimento da saciedade (30,59,63,64). A palatabilidade é associada a relações complexas entre respostas sensoriais aprendidas ou não do alimento e a preferências condicionais ao sabor e ao odor. Esta preferência a alimentos específicos, em humanos, é influenciada pelo conteúdo calórico, advindo de carboidratos e lipídios e não de proteína que é considerada pouco palatável (31,61). O sabor doce, principalmente, parece ter efeito na saciedade (30,62,65). Isto poderia nos levar a pensar que o uso de adoçantes artificiais diminuiria a IC e manteria a saciedade, mas isso não é verdade. A sacarina, a sucralose e o aspartame contribuem para o sabor doce nos alimentos, e somente são associados ao aumento da saciedade, quando acompanhados de conteúdo calórico (62,65). O intervalo entre as refeições é ainda associado positivamente com a carga de açúcar (30). Deste modo, não a palatabilidade per se, mas o sabor doce dos carboidratos simples, associado ao seu conteúdo calórico estimula a saciedade. O lipídio, por sua vez, não apresenta uma relação positiva entre a palatabilidade e a saciedade (30,66), o que sugere que esse macronutriente aumenta a IC por apresentar melhor palatabilidade e não ter efeito no intervalo entre as refeições.
Além de diferentes efeitos sensoriais, a proteína, o carboidrato e lipídio têm diferentes ações nos mecanismos pré e pós-absortivos da saciedade. Estudos mostram que pessoas têm menor fome, maior saciedade e apresentam menor IC após a ingestão de proteína, quando comparada à ingestão de carboidrato e lipídio (6,26-29). Dentre os processos envolvidos no maior poder sacietógeno da proteína destacam-se: 1) Sua menor palatabilidade em relação aos outros macronutrientes e conseqüente IC reduzida; 2) A presença de quimiorreceptores no lúmen intestinal que são ativados pelos aminoácidos e promovem a saciedade por via aferente do nervo vago ao núcleo do trato solitário, localizado no hipotálamo; 3) Produção de neurotransmissores (serotonina, histamina) e de catecolaminas (dopamina, adrenalina e noradrenalina), dependente de aminoácidos precursores (histidina, triptofano, tirosina), que levam a uma redução na IC e um aumento no GE (61).
Em relação ao efeito do carboidrato e do lipídio na saciedade, alguns investigadores identificaram maior poder sacietógeno do carboidrato em relação ao lipídio (30, 32, 44). As hipóteses que justificam as diferenças entre esses macronutrientes na promoção da saciedade estão relacionadas à hierarquia dos mesmos na resposta oxidativa e termogênica. A teoria glicostática propõe, por exemplo, que a glicemia indica a quantidade de energia disponível ou necessária, em relação à utilização de glicose pelos tecidos, por meio de receptores glico-sensíveis em neurônios centrais (hipotálamo) e periféricos (nervo vagus) (44,67). Maiores taxas de utilização de glicose comparada aos seus estoques poderiam estimular a IC seguinte e, o inverso também (68), sendo a insulina sinal direto para saciedade (59). Esta teoria suporta a hipótese de que alimentos com alto índice glicêmico (IG) teriam maior efeito na saciedade que alimentos de baixo IG devido a maiores concentrações de glicose e liberação de insulina pósprandiais (62). Entretanto a relação entre IG e saciedade deve ser avaliada com cuidado, pois o IG é uma unidade de medida específica para avaliar a resposta glicêmica de 50 g de carboidrato padrão (glicose ou pão branco) e não para dietas com diferentes proporções de carboidrato, proteína e lipídio. Além disso, outros mecanismos pré e pós-absortivos do carboidrato estão envolvidos no seu poder sacietógeno (cocção, conteúdo de fibras, tipos de carboidrato) (58,69).
Uma outra hipótese é que a diferença entre os macronutrientes em relação ao efeito na saciedade está associada diretamente ao seu efeito no gasto energético e oxidação pós-prandial. A proteína é o macronutriente mais termogênico e seu aumento obrigatório no metabolismo após ingestão de aminoácidos é mais fortemente relacionado com a saciedade que na ingestão de carboidrato, que por sua vez, é maior que na ingestão de lipídios. Em um estudo, as diferenças na área abaixo da curva de saciedade foram correlacionadas com diferenças na TID, maior e menor, para dietas hiperglicídicas e hiperlipídicas, respectivamente. (7)Desta forma, a hierarquia para a saciedade produzida pelos macronutrientes seria parcialmente relacionada com a hierarquia em que os estoques são regulados para disposição oxidativa. A relação pode ser direta ou causada pelo reflexo de outros eventos neuroendócrinos presentes (6,8,61).
Por outro lado, outros estudos não obtiveram efeitos do carboidrato e do lipídio significantemente diferentes (6,11). Quando dietas ricas em de carboidrato e lipídio são oferecidas, apresentando mesma densidade calórica e palatabilidade, estas parecem não exercer uma resposta fisiológica suficiente para detecção na motivação de comer e saciedade (26,33,70). Ao mesmo tempo, em indivíduos com peso normal e em obesos, a densidade calórica e o volume das refeições oferecidas são positivamente relacionados ao retardo da saciação e à maior IC, sem causar alguma compensação na saciedade e, ou, na IC seguinte (64,71,72). Apesar do maior volume da refeição promover maior ingestão, em estudos em que o conteúdo calórico era idêntico em dieta com pequeno e grande volume, a saciedade foi maior para a última (73). Tais resultados indicam que o maior conteúdo calórico consumido em dietas com alta densidade calórica ou em refeições de grande volume pode levar ao aumento da IC, independente da composição da dieta.
Deste modo, duas características dos alimentos ricos em gordura influenciam no seu fraco efeito inibitório durante a ingestão, nas refeições seguintes e na maior captação de energia: (1) São alimentos muito palatáveis, que pode causar um feedback positivo na alimentação (maior apetite) e, conseqüentemente menor saciação; (2) Aumentam a densidade calórica, o que leva a uma menor distensão gástrica, menor estimulação de mecanoreceptores e, conseqüente redução na saciedade.
A Tabela 2 mostra os principais resultados relacionados ao efeito da composição dieta na IC.
TABELA 2
Principais resultados científicos sobre o papel dos macronutrientes da dieta na ingestão calórica
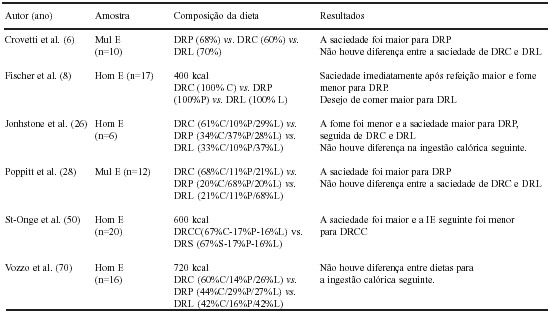
E: indivíduos eutróficos; Mul: mulheres; Hom: Homens; C: carboidrato; P: proteína; L: lipídio; A: álcool; S: Sacarose; DRC: dieta rica em carboidrato; DRP: dieta rica em proteína; DRL: dieta rica em lipídio; DRA: dieta rica em álcool; DRCC: Dieta rica em carboidrato complexo; DRS: dieta rica em sacarose.
Um dos maiores problemas na investigação da IC é a acurácia na medição da ingestão alimentar de indivíduos e população. O relato subestimado (quando ingestão calórica é menor que gasto energético calculado ou medido), de forma consciente ou inconsciente é reconhecidamente maior para indivíduos com sobrepeso ou obesos (74). Segundo Barkeling et al. (75), obesos apresentaram maiores escores para fome edesinibição para comer que indivíduos com peso normal em condições de vida livre. Por outro lado, quando avaliados em laboratório, os escores para fome, sensação de plenitude gástrica foram menores para os obesos. A explicação para este comportamento é a inabilidade social, característica presente nos obesos e que está relacionada à dificuldade em relatar com veracidade a ingestão alimentar e as sensações de fome e saciedade. A relação inversa entre IMC e IC, não é apenas resultado de registros subestimados, mas também pode representar diferenças na atividade física, TID, capacidade oxidativa e substrato oxidado, presença de hábitos restritivos, julgamentos sensoriais associados aos aspectos cognitivos (aprendizado, memória, crenças e conhecimento) (74,75). Obesos são mais responsivos a fatores externos como o horário do dia, presença do alimento e eventos situacionais e, menos sensíveis a fatores internos como os sinais fisiológicos de fome e saciedade (31).
Desta forma, vários fatores contribuem para os diferentes resultados encontrados quando se avaliam os efeitos da composição da dieta na ingestão e apetite. Dentre eles, podese citar a palatabilidade, o perfil de macronutrientes da dieta, a densidade calórica, o volume da refeição oferecida, o grau de conhecimento sobre o alimento que está sendo consumido, a interação dos efeitos da dieta com os hábitos alimentaresdas pessoas em estudo e as características dos indivíduos (idade, sexo, restrição alimentar, composição corporal).
CONSIDERAÇÕES FINAIS
O gasto energético, em especial, os seus componentes relacionados à oxidação de substratos e à TID, é importante no controle do peso corporal, e sofre influência do conteúdo calórico e dos macronutrientes ingeridos.
Por outro lado, a composição da dieta também pode interferir na ingestão calórica pelo grau de palatabilidade e poder de saciação e saciedade que proporciona aos alimentos. O conteúdo calórico total, os tipos de carboidratos e lipídios, a densidade calórica e a palatabilidade do plano alimentar também devem ser considerados.
Apesar da existência de vários estudos com o objetivo de identificar a influência da composição da dieta em componentes do metabolismo energético e na ingestão calórica, bem como a interação destas variáveis na homeostase energética, as diferenças entre os efeitos do carboidrato, proteína e lipídio e os mecanismos envolvidos não estão totalmente esclarecidos. As diferenças metodológicas (dieta, protocolo, tempo do estudo, características dos participantes) podem ser uma possível explicação para tais controvérsias. Desta forma, são necessários mais estudos para identificar os mecanismos e a magnitude dos efeitos dos macronutrientes no balanço energético para prevenção e controle da obesidade por meio de uma intervenção dietética adequada.
AGRADECIMENTOS
Nossa equipe agradece a CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) pela bolsa de mestrado e, a FAPEMIG (Fundação de Amparo a Pesquisa de Minas Gerais), pelo financiamento do projeto de pesquisa.
REFERÊNCIAS
1. Schutz Y. Macronutrient and energy balance in obesity. Metabolism 1995; 44 (9Suppl3):7-11. [ Links ]
2. Arvaniti K, Richard D, Tremblay A. Reproducibility of energy and macronutrient intake and related substrate oxidation rates in a buffet-type meal. Br J Nutr 2000; 83(5):489-95. [ Links ]
3. Maffeis C, Schutz Y, Chini L, Grezzani A, Piccoli R, Tato L. Effects of dinner composition on postprandial macronutrient oxidation in prepubertal girls. Obes Res 2004; 12(7): 1128-34. [ Links ]
4. Jonge L, Bray GA. The thermic effect of food and obesity: a critical review. Obes Res 1997; 5(6):622-31. [ Links ]
5. Labayen I, Martínez JA. Distribución de macronutrientes de la dieta y regulación del peso y composición corporal: papel de la ingesta lipídica en la obesidad. An Sist Sanit Navar 2002; 25 (Suppl.1):79-90. [ Links ]
6. Crovetti R, Porrini M, Santangelo A, Testolin G. The influence of thermic effect of food on satiety. Eur J Clin Nutr 1998; 52(7):482-8. [ Links ]
7. Westerterp-Plantenga MS, Rolland V, Wilson SAJ, Westerterp KR. Satiety related to 24 h diet-induced thermogenesis during high protein/carbohydrate vs high fat diets measured in a respiration chamber. Eur J Clin Nutr. 1999; 53(6):495-502. [ Links ]
8. Fischer K, Colombani PC, Wenk C. Metabolic and cognitive coefficients in the development of hunger sensations after pure macronutrient ingestion in the morning. Appetite 2004; 42(1):49-61. [ Links ]
9. Labayen I, Forga L, Martínez JA. Nutrient oxidation and metabolic rate as affected by meals containing different proportions of carbohydrate and fat, in healthy young women. Eur J Nutr 1999; 38(3):158-166. [ Links ]
10. Tentolouris N, Tsigos C, Perea D, Koukou E, Kyriaki D, Kitsou E, Daskas S, Daifotis Z, Makriakis K, Raptis AS, Katsilambros N. Differential effects of high-fat and high-carbohydrate isoenergetic meals on cardiac autonomic nervous system activity in lean and obese women. Metabolism 2003;52(11):1426- 32. [ Links ]
11. Raben A, Agerholm-Larsen L, Flint A, Holst JJ, Astrup A. Meals with similar energy densities but rich in protein, fat, carbohydrate, or alcohol have different effects on energy expenditure and substrate metabolism but not on appetite and energy intake. Am J Clin Nutr 2003; 77(1):91-100. [ Links ]
12. Brehm BJ, Spang SE, Lattin BL, Seeley RJ, Daniels SR, DAlessio DA. The role of energy expenditure in the differential weight loss in obese women on low-fat and low-carbohydrate diets. J Clin Endocrinol Metab 2005; 90(3):1475-82. [ Links ]
13. LeBlanc J, Labrie A. A possible role of palatability of the food in diet-induced thermogenesis. Int J Obes Relat Metab Disord 1997; 21(12):1100-3. [ Links ]
14. Weinsier RL, Nelson KM, Hensrud DD, Darnell BE, Hunter GR, Schutz Y. Metabolic Predictors of Obesity. Contribution of resting energy expenditure, thermic effect of food, and fuel utilization to four-year weight gain of post-obese and neverobese women. J Clin Invest 1995; 95(3):980-5. [ Links ]
15. Buemann B, Toubro S, Astrup A. Substrate oxidation and thyroid hormone response to the introduction of a high fat diet in formerly obese women. Int J Obes Relat Metab Disord 1998; 22(9):869-77. [ Links ]
16. Colling J, Blundell J. Differences in energy expenditure and substrate oxidation between habitual high fat and low fat consumers. Int J Obes Relat Metab Disord 1998; 22(7):612-8. [ Links ]
17. Blaak EE, Hul G, Verdich C, Stich V, Martinez A, Petersen M et al. Fat oxidation before and after a high fat load in the obese insulin-resistant state. J Clin Endocrinol Metab. 2006; 91(4):1462-9. [ Links ]
18. Weststrate JA. Resting metabolic rate and diet-induced thermogenesis: a methodological reappraisal. Am J Clin Nutr 1993; 58:592-601. [ Links ]
19. Mourão DM, Monteiro JBR, Hermsdorff HHM, Leite MCT. Alimentos modificados e suas implicações no metabolismo energético. Rev Nutr 2005; 18(1):19-28. [ Links ]
20. Blaak EE, Hul G, Verdich C, Stich V, Martinez JA, Petersen M et al. Impaired fat-induced thermogenesis in obese subjects: The NUGENOB Study. Obes. 2007; 15(3):653-63. [ Links ]
21. Marrades MP, Martinez JA, Moreno-Aliaga MJ. Differences in short-term metabolic responses to a lipid load in lean (resistant) vs. obese (susceptible) young male subjects with habitual high-fat consumption. Eur J Clin Nutr. 2007; 61(2):166-74. [ Links ]
22. Schiffelers SLH, Saris WHM, Boomsma F, van Baak MA. â1- and â2- adrenoceptor-mediated thermogenesis and lipid utilization in obese and lean men. J Clin Endocrinol Metab 2001; 86(5):2191-9. [ Links ]
23. Buijs MM, Burggraaf J, Wijbrandts C, de Kam ML, Frölich, M, Choen AF et al. Blunted lipolytic response to fasting in abdominally obese women: evidence for involvement of hyposomatotropism. Am J Clin Nutr 2003; 77(3):544-50. [ Links ]
24. Blundell JE. Appetite disturbance and the problems of overweight. Drugs 1990; 39 (Suppl 3):1-19. [ Links ]
25. Hetherington MM. The physiological-psychological dichotomy in the study of food intake. Proc Nutr Soc 2002; 61(4)497- 507. [ Links ]
26. Johnstone AM, Stubbs RJ, Harbron CG. Effects of overfeeding macronutrients on day-to-day food intake in man. Eur J Clin Nutr 1996; 50(7):418-30. [ Links ]
27. Doucet E, Tremblay A. Food intake, energy balance and body weight control. Eur J Clin Nutr 1997; 51(12):849-55. [ Links ]
28. Poppitt SD, Mccormack D, Buffenstein R. Short-term effects of macronutrient preloads on appetite and energy intake in lean women. Physiol Behav 1998; 64(3):279-85. [ Links ]
29. Johnston CS, Day CS, Swan PD. Postprandial thermogenesis is increased 100% on a high-protein, low-fat diet versus a highcarbohydrate, low-fat diet in healthy, young women. J Am Coll Nutr 2002; 21(1): 55-61. [ Links ]
30. Woodend DM, Anderson GH. Effect of sucrose and safflower oil preloads on short term appetite and food intake of young men. Appetite 2001; 37(3):185-95. [ Links ]
31. Ulijaszek SJ. Human eating behaviour in an evolutionary ecological context. Proc Nutr Soc 2002; 61(4):517-26. [ Links ]
32. Rumpler WV, Kramer M, Rhodes DG, Paul DR. The impact of the covert manipulation of macronutrient intake on energy intake and the variability in daily food intake in nonobese men. Int J Obes 2006; 30(5):774-81. [ Links ]
33. Rolls BJ, Bell EA. Intake of fat and carbohydrate: role of energy density. Eur J Clin Nutr 1999; 53(Suppl 1):S166-73. [ Links ]
34. Chwalibog A, Thorbek G. Energy expenditure and oxidation of carbohydrate and fat in humans during day and night. Thermochimica Acta 2002; 394:247-52. [ Links ]
35. Blundell JE, Cooling J, King NA. Differences in postprandial responses to fat and carbohydrate loads in habitual high and low fat consumers (phenotypes). Br J Nutr 2002; 88(2):125- 32. [ Links ]
36. Nagai N, Sakane N, Ueno LM, Hamada T, Moritani T. The – 3826 A-G variant of the uncoupling protein-1 gene diminishes postprandial thermogenesis after a high fat meal in healthy boys. J Clin Endocrinol Metab 2003; 88(12):5661-7. [ Links ]
37. Sparks LM, Xie H, Koza RA, Mynatt R, Hulver MW, Bray GA et al. A high-fat diet coordinately downregulates genes required for mitochondrial oxidative phosphorylation in skeletal muscle. Diabetes 2005; 54(7):1926-33. [ Links ]
38. Kamphuis MM, Mela DJ, Westerterp-Platenga MS. Diacylglycerols affect substrate oxidation and appetite in humans. Am J Clin Nutr 2003; 77(5):1133-9. [ Links ]
39. Taguchi H, Watanabe J, Onizawa K, Nagao T, Gotoh N, Yasukawa T et al. Double-blind controlled study on the effects of dietary diacylglycerol on postprandial serum and chylomicron triacylglycerol responses in healthy humans. J Am Coll Nutr 2000; 19(6):789-96. [ Links ]
40. Yamamoto K, Asakawa J, Tokunaga K, Watanabe H, Matsuo N, Tokimitsu I et al. Long-term ingestion of dietary diacylglycerol lowers serum triacylglycerol in type II diabetic patients with hypertriglyceridemia. J Nutr 2001; 131(12):3204- 7. [ Links ]
41. Nagao T, Watanabe H, Goto N, Onizawa K, Taguchi H, Matsuo N et al. Dietary diacylglycerol suppresses accumulation of body fat compared to triacylglycerol in men a double-blind controlled trial. J Nutr 2000; 130(4):792-7. [ Links ]
42. Bendixen H, Flint A, Raben A, Hoy Carl-Erik, Mu H, Xu Xuebing, Bartles EM, Astrup A. Effect of 3 modified fats and a conventional fat on appetite, energy intake, energy expenditure, and substrate oxidation in healthy men. Am J Clin Nutr 2002; 75(1):47-56. [ Links ]
43. St-Onge MP, Jones PJH. Greater rise in fat oxidation with medium- chain triglyceride consumption relative to long-chain triglyceride is associated with lower initial body weight and greater loss of subcutaneous adipose tissue. Int J Obes Relat Metab Disord 2003; 27(12):1565-71. [ Links ]
44. Van Wymelbeke V, Louis-Sylvestre J, Fantino M. Substrate oxidation and control of food intake in men after a fat-substitute meal compared with meal supplemented with a isoenergetic load of carbohydrate, long-chain triacylglycerols or medium-chain triacyglycerols. Am J Clin Nutr 2001; 74(5):620-30. [ Links ]
45. Tappy L. Thermic effect of food and sympathetic nervous system activity in humans. Reprod Nutr Dev 1996; 36:391-7. [ Links ]
46. Hermsdorff HHM, Monteiro JBR, Mourão DM, Leite MCT. Termogênese induzida pela dieta: uma revisão sobre seu papel no balanço energético e no controle de peso. Rev Bras Nutr Clin 2003; 18(1):37-41. [ Links ]
47. Marques-Lopes I, Forga L, Martinez JA. Thermogenesis induced by a high-carbohydrate meal in fasted lean and overweight Young men: insulin, body fat, and sympathetic nervous system involvement. Nutrition 2003; 19(1):25-29. [ Links ]
48. Suen VMM, Silva GA, Tannus AF, Unamuno MRDL, Marchini JS. Effect of hypocaloric meals with different macronutrient compositions on energy metabolism and lung function in obese women. Nutrition 2003; 19(9):703-7. [ Links ]
49. Raben A, Macdonald I, Astrup A. Replacement of dietary fat by sucrose or starch: Effects on 14d ad libitum energy intake, energy expenditure and body weight in formerly obese and never-obese subjects. Int J Obes Relat Metab Disord 1997; 21(10):846-59. [ Links ]
50. St-Onge MP, Rubiano F, DeNino WF, Jones A Jr, Greenfield D, Ferguson PW et al. Added thermogenic and satiety effects of a mixed nutrient vs a sugar-only beverage. Int J Obes Metab Disord 2004; 28(2):248-53. [ Links ]
51. Hashkes PJ, Gartside PS, Blondheim SH. Effect of food palatability on early (cephalic) phase of diet-induced thermogenesis in nonobese and obese man. Int J Obes Relat Metab Disord 1997; 21(7):608-13. [ Links ]
52. Sawaya AL, Fuss PJ, Dallal GE, Tsay R, McCrory MA, Young V, Roberts SB. Meal palatability, substrate oxidation and blood glucose in young and older men. Physiol Behav 2001; 72(1- 2):5-12. [ Links ]
53. Tittelbach TJ, Mattes RD. Effect of orosensory stimulation on postprandial thermogenesis in humans. Physiol Behav 2002; 75:71-81. [ Links ]
54. Janský P, Janský L. Sites and cellular mechanisms of human adrenergic thermogenesis- a review. J Therm Biol 2002; 27:269- 77. [ Links ]
55. Schwartz MW, Baskin DG, Kaiyala KJ, Woods SC. Model for the regulation of energy balance and adiposity by the central nervous system. Am J Clin Nutr 1999; 69(4):584-96. [ Links ]
56. Reyes JGG, Mier GM, Rivera AZ, Zúñiga AS. Genómica nutricional y obesidad. Rev Endocrinol Nutr. 2006; 14(4):247- 56. [ Links ]
57. Fisler JS, Warden CH. Uncoupling proteins, dietary fat and the metabolic syndrome. Nutr Metab. 2006; 3:38. [ Links ]
58. Hirsch J, Hudgins LC, Leibel RL, Rosebaum M. Diet composition and energy balance in humans. Am J Clin Nutr 1998; 67(3 Suppl):S551-5. [ Links ]
59. Reid M, Hetherington M. Relative effects of carbohydrates and protein on satiety- a review of methodology. Neurosci Biobehav Rev 1997; 21(3):295-308. [ Links ]
60. Snoek HM, Huntjens L, van Gemert LJ, Graaf C, Weenen H. Sensory-specific satiety in obese and normal-weight women. Am J Clin Nutr 2004; 80(4):823-31. [ Links ]
61. Tome D. Protein, amino acids and the control of food intake. Br J Nutr 2004; 92(Suppl 1): 27-30S. [ Links ]
62. Poothullil JM. Role of oral sensory signals in determining meal size in lean women. Nutriton 2002; 18(6):479-83. [ Links ]
63. Anderson GH, Woodend D. Consumption of sugars and the regulation of short-term satiety and food intake. Am J Clin Nutr 2003; 78(4):S843-9. [ Links ]
64. McCrory MA, Saltzman E, Rolls BJ, Roberts SB. A twin of the effects of energy density and palatability on energy intake of individual foods. Physiol Behav 2006; 87(3):451-9. [ Links ]
65. Mitchell CP, Flaherty CF. Differential effects of removing the glucose or saccharin components of a glucose-saccharin mixture in a successive negative contrast paradigm. Physiol Behav 2005; 84(4):579-83. [ Links ]
66. Ronbison TM, Gray RW, Yeomans MR, French SJ. Test-meal palatability alters the effects of intragastric fat but not carbohydrate preloads on intake and rated appetite in healthy volunteers. Physiol Behav 2005; 84(2):193-203. [ Links ]
67. Flatt JP. The difference in the storage capacities for carbohydrate and for fat, and its implication in the regulation of body weight. Ann NY Acad Sci 1987;499:104-23. [ Links ]
68. Mayer J. Glucostatic mechanism of regulation of food intake. New Engl J Med 1953; 249; 13-16. [ Links ]
69. Saris WH, Foster GD. Simple carbohydrates and obesity: Fact, Fiction and Future. Int J Obes. 2006; 30(Suppl 3):S1-3. [ Links ]
70. Vozzo R, Wittert G, Cocchiaro C, Tan WC, Mudge J, Fraser R, Chapman I. Similar effects of foods high in protein, carbohydrate and fat on subsequent spontaneous food intake in healthy individuals. Appetite 2003; 40(2):101-7. [ Links ]
71. Bell EA, Rolls BJ. Energy density of foods affects energy intake across multiple levels of fat content in lean and obese women. Am J Clin Nutr 2001; 73(6):1010-8. [ Links ]
72. Rolls B, Morris EL, Roe LS. Portion size of food affects energy intake in normal-weight and overweight men and women. Am J Clin Nutr 2002; 76(6):1207-13. [ Links ]
73. Mourão DM, Monteiro JBR, Hermsdorff HHM, Leite MCT. Effects of Modified Foods on Appetite of Overweight Men. Rev Bras Nutr Clin 2004; 19(2):47-53. [ Links ]
74. Bolton-Smith C, Woodward M. Dietary composition and fat to sugar ratios in relation to obesity. Int J Obes 1994; 18(12):820-8. [ Links ]
75. Barkeling B, Rössner S, Sjöberg A. Methodological studies on single meal food intake characteristics in normal weight and obese men and women. Int J Obes Relat Metab Disord 1995; 19(4):284-90. [ Links ]














