Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.57 n.2 Caracas jun. 2007
Pigmentos carotenoides: consideraciones estructurales y fisicoquímicas
Antonio J. Meléndez-Martínez, Isabel M. Vicario, Francisco J. Heredia
Laboratorio de Color y Calidad de Alimentos. Facultad de Farmacia. Universidad de Sevilla. 41012 Sevilla, España
RESUMEN.
Los pigmentos carotenoides constituyen un grupo de compuestos ubicuos en la naturaleza que realizan una serie de funciones que los hacen especiales. Así, son considerados compuestos indispensables para la vida, fundamentalmente debido a las diferentes funciones que llevan a cabo en relación con la fotosíntesis tal y como se conoce hoy en día. Durante muchos años, la importancia nutricional de los carotenoides se debió a que algunos de ellos poseen actividad provitamínica A, si bien el que el interés por estos isoprenoides se haya multiplicado en los últimos años se ha debido a una gran variedad de estudios que parecen indicar que actúan como antioxidantes y que podrían ser beneficiosos para la prevención de diversas enfermedades crónicas humanas no transmisibles, si bien existe todavía cierta controversia al respecto. En cualquier caso, las funciones y efectos debidos a estos pigmentos se deben a sus propiedades fisico-químicas y que éstas a su vez son consecuencia de su estructura química. Debido a las variadas acciones beneficiosas de las que son responsables, y sobre todo a su importancia nutricional, el objetivo fundamental de esta revisión es la descripción de dichas caracteríticas, cuyo conocimiento es indispensable para tener una visión global de los diferentes roles que desempeñan y para el diseño de nuevos estudios.
Palabras clave: Carotenoides, estructura química, espectroscopia, espectroforometría, pigmentos, propiedades fisicoquímicas.
SUMMARY.
Carotenoid pigments: structural and physicochemical considerations. Carotenoid are ubiquitous compounds serving a series of functions that make them special. Thus, they are regarded as essential compounds for life mainly due to the different roles they perform in photosynthesis as we currently know it. For many years, the nutritional relevance ot carotenoids was due to some of them exhibiting vitamin A activity, although theinterest in these pigments has expanded dramatically in the last years owing to a large variety of surveys that seem to indicate that they are antioxidant and may be beneficial for the prevention of several chronic non-transmissible human diseases, albeit there is some controversy in this regard. In any case, it is clear that the different functions and effects attributed to these isoprenoids stem from their physical and chemical properties, the latter being due to their chemical structure. Due to the diverse benefitial actions carotenoids are responsible for and, above all, to their nutritional importance, the main objective of this review is to describe such features, whose knowledge is indispensable to have a holistic view of the different roles they play and for the design of new studies.
Key words: Carotenoids, chemical structure, spectroscopy, spectrophotometry, pigments; physicochemical properties.
Recibido: 20-03-2007 Aceptado: 11-07-2007
INTRODUCCION
Los carotenoides son compuestos ubicuos en la naturaleza, cuya presencia en diversas estructuras de plantas y en gran variedad de animales, algas, hongos y bacterias se ha descrito desde hace décadas (1-4). Estos pigmentos no sólo son responsables del color de flores (colza, caléndula, diente deleón, crisantemo, etc.) (5-7) y frutos (tomates, naranjas, pimientos, albaricoque, melocotón, etc.) (8-12) para favorecer la polinización y dispersión de semillas, o de estructuras animales como las plumas y picos de algunos pájaros (13,14), el exoesqueleto de crustáceos (15) y el músculo o la piel de algunos peces (16, 17) para otros fines, en algunos casos no muy claros (3,4), sino que realizan otras funciones que los hacen pigmentos especiales. Así, son considerados compuestos indispensables para la vida, fundamentalmente debido a las funciones que llevan a cabo en relación con la fotosíntesis (captación de luz, fotoprotección, disipación de excesos de energía, desactivación de oxígeno singlete, etc.), hasta el punto de que sin ellos, la fotosíntesis, tal y como se conoce hoy en día, sería inviable (18-20). Así, se ha demostrado ampliamente que como consecuencia de la inhibición de la enzima fitoeno sintasa con herbicidas se producen fenómenos de fotooxidación que conducen a la destrucción de las moléculas de clorofila (21,22).
Durante años, la importancia nutricional de los carotenoides se debió sobre todo al hecho de que algunosposeen actividad provitamínica A, la cual sigue siendo objetode estudio en la actualidad (23,24-33). No obstante, el que el interés por estos compuestos isoprenoides se haya multiplicado no solo en Latinoamérica (34-37), sino a nivel mundial (38,39),se ha debido a estudios en los que se concluye que son compuestos antioxidantes (40-42) y beneficiosos para la prevención de diversas enfermedades, como ciertos tipos de cáncer (43-45), trastornos oculares (46,47) y vasculares (48,49), etc, si bien existe aún cierta controversia al respecto (50,51). Así, el interés actual en los pigmentos carotenoides desde un punto de vista nutricional es claro, tal que los artículos de revisión en los que se discute las propiedades antioxidantesy beneficiosas para la salud de los humanos son numerosos (52-55), así como aquellos que tratan sobre la biodisponibilidad de los mismos (56-58).
En relación con todo ello, resulta claro afirmar que las funciones y efectos de estos pigmentos se deben a sus propiedades físicas y químicas, las cuales son consecuencia de su estructura química. Debido a las acciones beneficiosas de las que son responsables, y sobre todo a su creciente importancia en el campo de la Nutrición, el objetivo de esta revisión es la descripción de dichas caracteríticas.
Estructura química
Como ocurre con cualquier compuesto químico, las funciones de los carotenoides son debidas en última instancia a su estructura química. En el caso particular de estos isoprenoides, la característica estructural más llamativa es el sistema de d.e.c. (d.e.c.) característico de sus moléculas, que es el principal responsable de su espectro de absorción, reactividad, forma, localización en estructuras subcelulares y de su papel en procesos de transferencia de energía (18). Así, el número de d.e.c. no sólo afecta a sus propiedades de absorción de luz y por tanto a su color (59,60), sino también a su reactividad frente a radicales (61,62), a la forma de la molécula (63) y a su efectividad en los procesos de transferencia de energía dentro del aparato fotosintético (64, 65).
Químicamente la mayoría de los carotenoides son tetraterpenoides, compuestos de 40 átomos de carbono formados por ocho unidades isoprenoides unidas de forma que la secuencia se invierte en el centro de la molécula. Es decir, la unión de dichas unidades es "cabeza-cola", excepto en el centro de la molécula, donde es "cabeza-cabeza". Debido a ello, los dos grupos metilo centrales de la cadena poliénica están separados por seis átomos de carbono, mientras que el resto están separados por cinco. Algunos carotenoides son acíclicos, si bien la mayoría contienen anillos a uno o ambos extremos de la molécula. Considerando los elementos químicos presentes en sus moléculas, los carotenoides pueden dividirse en dos grandes grupos: carotenos, que son hidrocarburos, y xantófilas, que contienen átomos de oxígeno. Éste puede estar presente en forma de grupo hidroxilo (zeinoxantina, lactucaxantina, etc.), metoxilo (esferoidenona, espiriloxantina, etc.), epóxido (anteraxantina, licopeno-1,2-epóxido, etc.), carbonilo (capsantina, esferoidenona, etc.) o carboxilo (norbixina, neurosporaxantina, etc.), principalmente (66,67). Otros grupos oxigenados presentes en carotenoides son acetatos (fucoxantina, dinoxantina, etc.), lactonas (peridinina, uriólido, etc.) y sulfatos (caloxantina-3-sulfato, nostoxantina- 3-sulfato, etc.) (63,68-70).
Las xantófilas hidroxílicas pueden existir en la naturaleza en estado libre o esterificadas con ácidos grasos (palmítico, linoleico, linolénico, esteárico, mirístico, láurico, oleico, etc.)en pimientos y derivados, patatas, mango, cítricos, etc (71- 75). Precisamente, la esterificación de carotenoides está suscitando gran interés recientemente, concretamente en relación a la biodisponibilidad de los pigmentos (76,77), a su efecto en las reacciones de los carotenoides con radicales libres (78) y a su papel durante la maduración de frutos (79). Existen asimismo glucósidos (crocina, zeaxantina monoramnósido, etc.) y glucosil ésteres de xantófilas (crocetina monoglucosil éster, glucosil éster del ácido diapolicopenodioico, etc.), los cuales se han descrito en estigmas de azafrán, frutos de gardenia, bacterias, etc. (63,69,70, 80-82). Los carotenoides pueden encontrarse además formando complejos hidrosolubles estables con proteínas, lipoproteínas o glucoproteínas sobre todo en animales invertebrados acuáticos como gambas, langostas y cangrejos, entre muchos otros (3,15, 83).
No todos los carotenoides constan de ocho unidades isoprenoides, ya que algunos, denominados apocarotenoides, poseen un esqueleto de menos de 40 átomos de carbono, debido probablemente a escisiones en uno (por ejemplo el âapo- 8-carotenal, pigmento presente en el níspero (84) y en cítricos (85), entre otras fuentes) o ambos extremos de la molécula(como por ejemplo la crocetina, pigmento característico del azafrán (86)) (Figura 1). Otros apocarotenoides han sido identificados en diversas fuertes, como las semillas de Bixa orellana (87), el pimiento (88), flores de Boronia megastigma (89), etc. Otros carotenoides con un número de átomos de carbono diferente de 40 son los norcarotenoides, como la peridinina, en los que uno, dos o tres átomos de carbono han sido eliminados del esqueleto hidrocarbonado, o los secocarotenoides (como la â-carotenona) en los que se ha roto un enlace entre carbonos adyacentes (excepto los carbonos 1 y 6 de anillos). Otros carotenoides poseen 45 o 50 átomos de carbono, y se forman por la adición de unidades isoprenoides a los grupos terminales, como por ejemplo la decaprenoxantina. En cuanto a los retrocarotenoides (como la rodoxantina), la posición de los dobles enlaces a lo largo de la cadena poliénica está invertida, de forma que los carbonos 15 y 15 están unidos por un enlace simple (Figura 1) (63,70, 90, 91).
FIGURA 1. Estructuras químicas de b-apo-8-carotenal, crocetina, peridinina, decaprenoxantina, semi- b-carotenona y rodoxantina

Debido a la presencia del sistema de d.e.c., podrían existir, en teoría, muchos isómeros geométricos de cadacarotenoide, si bien, debido a impedimentos estéricos, sólo algunos son estables (18,63,92). La mayoría de los carotenoides naturales son isómeros todo-trans (todo-E), aunquetambién existen isómeros cis (isómeros Z) en fuentes naturales, como es el caso de la bixina, presente como (9Z)- bixina en las semilla de Bixa orellana (93), y del fitoeno, presente comúnmente como (15Z)-fitoeno en productos vegetales y microorganismos (94,95), entre otros. El análisis por cromatografía líquida de isómeros geométricos de carotenoides se ha visto favorecido en los últimos años debido al desarrollo de columnas C30, cuyo diseño las hace muy eficientes para su separación (96, 97). Así, diferentes isómeros de carotenoides han sido objeto de estudio en una gran variedad de fuentes, como vegetales (98), zumo de zanahorias y bebidas enriquecidas en vitaminas (99), mango (100), zumo de naranja (101,102), flores (6,103), etc. El estudio de isómeros geométricos de carotenoides resulta especialmente interesante debido a que parece que presentan distintas actividades o reactividad frente a diversos agentes y que podrían absorberse en diferente medida (104, 105).
No obstante, debe tenerse en cuenta que los isómeros cis pueden ser en ocasiones artefactos, producidos durante la manipulación de las muestras o debido a tratamientos tecnológicos o culinarios (106,107). Por otra parte, muchos carotenoides naturales poseen centros quirales, por lo que pueden existir diversos isómeros ópticos de cada uno de ellos, como es el caso de la zeaxantina (Figura 2), capsantina, aloxantina, neoxantina y muchísimos otros (2,63,70).
FIGURA 2. Configuraciones de la zeaxantina

Nomenclatura
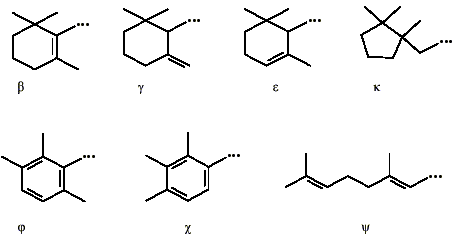
Tradicionalmente, los carotenoides se nombraron en función de la fuente de la que se aislaron por primera vez. Así, el término caroteno proviene del nombre científico de la zanahoria(Daucus carota L.), mientras que los pigmentos aislados del pensamiento (Viola tricolor L.) y algunas algas del género Fucus se denominaron violaxantina y fucoxantina, respectivamente. En la actualidad también se usa una nomenclaturasemi-sistemática que proporciona información estructural (Tabla 1). Así, se consideran las dos mitades de la molécula del carotenoide, y el compuesto se nombra como derivado del caroteno correspondiente, especificándose los grupos terminales mediante letras griegas (Figura 3). Los cambios en elnivel de hidrogenación y la presencia de sustituyentes se indican mediante el empleo de prefijos y sufijos.
TABLA 1. Nombres semi-sistemáticos de diversos carotenoides

FIGURA 3. Grupos terminales presentes en las moléculas de los pigmentos carotenoides
Propiedades físico-químicas
Los carotenoides son compuestos lipídicos, aunque existen algunas excepciones, por lo que son insolubles en agua y solubles en disolventes orgánicos como acetona, metanol, éter dietílico, hexano, cloroformo y piridina, entre muchos otros. Debido a su carácter hidrofóbico se encuentran normalmente en ambientes lipófilos, como en membranas, si bien su asociación con proteínas o reacciones de glicosilación les permiten también estar presentes en medios acuosos (4,18). En relacióncon el papel de los pigmentos carotenoides en membranas de distinta naturaleza (41,108), cabe señalar que los carotenos permanecen en el interior de las mismas, mientras que las xantófilas pueden encontrarse en otras localizaciones en las que interaccionan a través de sus grupos hidroxílicos con moléculas de fosfolípidos (18). La asociación con proteínas permite además a los carotenoides permanecer en una posición correcta con respecto a otras moléculas, siendo ejemplos claros de este hecho los complejos pigmento-proteina que mantienen a carotenoides y clorofilas en posiciones adecuadas para los procesos de transferencia de energía que tienen lugar durante la fotosíntesis (109, 110).
Los carotenoides ácidos pueden formar sales sódicas o potásicas solubles en agua por tratatamiento con álcali, como es el caso de bixina, astaceno o mitiloxantina (66,111). Lascarotenoproteínas son también solubles en agua y muy estables (4). El color de estos complejos es estable durante años a temperatura ambiente y en contacto con el aire, por lo que tienen un gran interés como posibles colorantes (83). El carácter hidrofóbico de la mayoría de los carotenoides hace que tiendan a la agregación y cristalización en medio acuoso (18), siendo un ejemplo típico los cristales de licopeno en loscromoplastos de los tomates (112,113). Los puntos de fusión son elevados, generalmente comprendidos en el rango 130- 220°C y la solubilidad de los cristales generalmente pequeña, siendo mejor en disolventes orgánicos clorados y en benceno (66,111).
El sistema de d.e.c. de las moléculas de carotenoides esresponsable de su intenso color. Para que estos pigmentostengan una coloración perceptible son necesarios al menossiete d.e.c.. Así, el æ-caroteno (7 d.e.c.) es amarillo pálido,mientras que fitoeno (3 d.e.c.) y fitoflueno (5 d.e.c.), son incoloros (60). El color se debe concretamente a la oscilación de los electrones a lo largo de la cadena hidrocarbonada insaturada. La absorción de luz produce el paso de la molécula de su estado energético basal a otro de mayor energía llamado estado excitado. En el caso de los carotenoides, la transición electrónica se produce de orbitales ð enlazantes a orbitales ð* antienlazantes. Como consecuencia de la deslocalización de los electrones a lo largo de la cadena hidrocarbonada, debido a la presencia de numerosos d.e.c. en ésta, la molécula en estado excitado no posee un alto contenido energético, de ahí que la energía de la radiación visible sea normalmente suficiente para que se produzca el salto electrónico (59). La asociación de carotenoides con proteínas estabiliza a los pigmentos además de extender el rango de colores a verde, azul y púrpura. Así, el máximo de absorción de astaxantina en acetona es 478 nm, mientras que el de la á -crustacianina es 632 nm, de ahí su coloración azulada (114). Analíticamente, el color de los carotenoides es de gran importancia, ya que un cambio de color durante el análisis es indicativo de degradación o de modificación estructural de los pigmentos. De igual forma, el color permite monitorizar su separación mediante cromatografía en columna y en capa fina (111,115).
En los últimos años, han aparecido estudios en los que se propone la medida objetiva del color como una potente herramientaen el ámbito del control de calidad para la estimación rápida del contenido en carotenoides en diversas fuentes,como tomates (8), zumo de naranja (9) y albaricoques (11), fundamentalmente debido a las ventajas que ofrecen tales medidas, como rapidez, no destrucción de las muestras, versatilidad,etc. Así, la medida objetiva del color se ha propuestorecientemente como un método apropiado para la determinación de la actividad vitamínica A de zumos de naranja de una forma más eficiente, rápida y realista en el ámbito del control de calidad (25). Aparte de estos estudios en los que el color se ha correlacionado de algún modo con el contenido en carotenoides, existen otros muchos en los que el contenido de estos pigmentos y el color de diferentes muestras se ha analizado paralelamente (116,117). En este sentido debe también tenerse en cuenta que diversas técnicas espectroscópicas se usan, aunque sin obtener parámetros cromáticos, para el análisis de estos compuestos (118,119).
El espectro de absorción UV-Vis de los carotenoides es de interés para aclarar su estructura. Normalmente aparecen tres máximos cuyas longitudes de onda (ë) dependen del número de d.e.c. y del disolvente empleado para la medida (59,111), si bien el máximo de absorción (ëmáx) de los carotenoides in vivo aparece a longitudes de onda unos 10 nm mayores en comparación con los máximos en hexano o etanol, debido a su presencia en un ambiente proteico o lipídico (4). Independientemente del disolvente, las ëmáx aumentancon la longitud del cromóforo (59), de forma que los dobles enlaces no conjugados no afectan significativamenteal espectro. No obstante, cuando existen d.e.c. en un anillo, debido a que éste no es coplanar con la cadena poliénica lineal,las ëmáx aparecen a longitudes de onda menores en comparación con los carotenoides no cíclicos con el mismo número de d.e.c. (120). Los grupos carbonílicos conjugados conla cadena poliénica también aumentan la longitud del cromóforo. Así, la presencia de uno de estos grupos en un anillo hace que los máximos se localicen a ë aproximadamente 10 nm superiores, mientras que su presencia en la cadenapoliénica hace que se desplacen a longitudes de onda en torno a 30 nm superiores (115,121). Los grupos hidroxilo y metoxilo, sin embargo, no afectan al cromóforo, de ahí que los espectros del â-caroteno y sus hidroxiderivados âcriptoxantinay zeaxantina sean prácticamente idénticos. Por otra parte, la forma del espectro y la persistencia de las bandasde absorción, lo que comúnmente se conoce como estructurafina, reflejan el grado de planaridad del cromóforo. Elsistema de d.e.c. de los carotenoides acíclicos puede adoptaruna conformación casi planar, de ahí que sus espectros presenten máximos y mínimos perfectamente definidos, aunque la persistencia de las bandas disminuye cuando existen más de nueve d.e.c.. El espectro de los carotenoides cíclicos en los que el cromóforo no se extiende a los anillos presenta también bandas de absorción persistentes (120), aunque cuando la conjugación se extiende a anillos existen impedimentos estéricos entre el grupo metilo en el carbono 5 del anillo y el átomo de hidrógeno del carbono 8 de la cadena poliénica, que hacen que los dobles enlaces de los anillos no sean coplanares con los de la cadena poliénica. Como consecuencia se produce un desplazamiento hipsocrómico (a ë menores) de las ëmáx, un efecto hipocrómico (disminución de la absorción) y una pérdida de estructura fina (115,120). Así, la primera banda de absorción de carotenoides con dos anillos â, como â-caroteno, â-criptoxantina y zeaxantina, se reduce a una mera inflexión (67). Cuando existen grupos carbonilos conjugados con la cadena poliénica, se produce un desplazamiento batocrómico (a ë mayores) de los máximos, además de una pérdida de estructura fina, de forma que el espectro de estos compuestos, como astaxantina, cantaxantina o capsorrubina, entre otros, se reduce a una curva simétrica o a una banda principal con inflexiones a uno y otro lado (59,67,115). El espectro de isómeros Z o cis presenta algunas peculiaridades con respecto a los de isómeros todo-E o todo-trans. Así, el máximo de absorción se localiza a ë entre 2 y 6 nm menores en el caso de isómeros mono-cis, la estructura fina disminuye y una nueva banda de absorción aparece en la región ultravioleta (59,92,115).
Los carotenoides en disolución, obedecen la ley de Lambert-Beer, de ahí que se cuantifiquen espectrofotométricamente, relacionando la absorbancia a una determinada λ con un valor estándar expresado como coeficiente de absorción, ya sea el coeficiente de absorción específico, ![]() , que se define como la absorbancia teórica de una disoluciónde concentración 1% (P/V) en una cubeta de 1 cm de paso de luz, o el coeficiente de absorción molar, ε, definido como la absorbancia teórica de una disolución de concentración 1 molar. Ambos coeficientes están relacionados por la fórmula ε=
, que se define como la absorbancia teórica de una disoluciónde concentración 1% (P/V) en una cubeta de 1 cm de paso de luz, o el coeficiente de absorción molar, ε, definido como la absorbancia teórica de una disolución de concentración 1 molar. Ambos coeficientes están relacionados por la fórmula ε=![]() Teoricamente, ε es caracteristico del cromóforo e independiente del peso molecular del carotenoide, por lo que podría ser considerado el mismo para carotenoides distintos con idéntico cromóforo, como por ejemplo b-caroteno y zeaxantina. En cambio, los valores de
Teoricamente, ε es caracteristico del cromóforo e independiente del peso molecular del carotenoide, por lo que podría ser considerado el mismo para carotenoides distintos con idéntico cromóforo, como por ejemplo b-caroteno y zeaxantina. En cambio, los valores de ![]() no serían los mismos para ambos compuestos, si bien están relacionados por sus pesos moleculares:
no serían los mismos para ambos compuestos, si bien están relacionados por sus pesos moleculares:
![]()
La exactitud de la cuantificación de los carotenoides depende, por tanto, de la de los coeficientes de absorción. Parala determinación de estos coeficientes se recomienda pesar con precisión entre 1 y 2 mg del pigmento puro y disolverlos completamente en un disolvente apropiado (59). Este procedimiento suele ser bastante complicado, sobre todo si los carotenoides están cristalizados, por lo que el contenido en carotenoides es frecuentemente subestimado (66). La determinación cuantitativa de los pigmentos carotenoides, implica por tanto una cierta inexactitud. En relación con este hecho, cabe señalar que los coeficientes de absorción de los isómeroscis son sensiblemente menores que los de los correspondientes isómeros todo-trans, si bien pocos han sido determinados experimentalmente (70), por lo que la cuantificación de los isómeros cis con los valores tabulados para los isómeros todotrans implica aún un mayor grado de inexactitud. En la literatura existen tablas en las que se indican los valores de los coeficientes de absorción, generalmente el específico, para distintos carotenoides en varios disolventes, especificándose asímismo la λ a la que debe llevarse a cabo la medida de absorbancia (59,67,122,123). No obstante, debido a las dificultades inherentes a la determinación experimental de los coeficientes de absorción, existen discrepancias en algunos de los valores de tabulados (66,115). Para calcular la concentración de un determinado carotenoide se aplica la fórmula x = Ay/(![]() ×100) (120), donde x es el peso del carotenoide en gramos, y es el volumen de la disolución en mililitros, A la absorbancia medida experimentalmente y
×100) (120), donde x es el peso del carotenoide en gramos, y es el volumen de la disolución en mililitros, A la absorbancia medida experimentalmente y ![]() el coeficiente de absorción específico. Cuando no se ha determinado el coeficiente de absorción específico para un carotenoide o bien se pretende estimar el contenido total de carotenoides de un extracto, se suele usar un valor arbitrario de 2500 (121).
el coeficiente de absorción específico. Cuando no se ha determinado el coeficiente de absorción específico para un carotenoide o bien se pretende estimar el contenido total de carotenoides de un extracto, se suele usar un valor arbitrario de 2500 (121).
REFERENCIAS
1. Karrer P, Jucket E. Carotenoids. Bassel, Switzerland: Birkhäuser; 1948. [ Links ]
2. Goodwin TW. The biochemistry of the carotenoids. Volume I. Plants. London, United Kingdom: Chapman and Hall; 1980. [ Links ]
3. Goodwin TW. The biochemistry of the carotenoids. Volume II. Animals. London, United Kingdom: Chapman and Hall; 1984. [ Links ]
4. Britton G. The biochemistry of natural pigments. Cambridge, United Kingdom: Cambridge University Press; 1983. [ Links ]
5. Kull D, Pfander H. Isolation and identification of carotenoids from the petals of rape (Brassica napus). J Agric Food Chem 1995; 43: 2854-2857. [ Links ]
6. Meléndez-Martínez AJ, Britton G, Vicario IM, Heredia FJ. HPLC analysis of geometrical isomers of lutein epoxide isolated from dandelion (Taraxacum officinale F. Weber ex Wiggers). Phytochem 2006; 67: 771-777. [ Links ]
7. Kishimoto S, Maoka T, Nakayama M, Ohmiya A. Carotenoid composition in petals of chrysanthemum (Dendranthema grandiflorum (Ramat.) Kitamura). Phytochem 2004; 65: 2781- 2787. [ Links ]
8. Arias R, Lee T-C, Logendra L, Janes H. Correlation of lycopene measured by HPLC with the L*, a*, b* color readings of a hydroponic tomato and the relationship of maturity with color and lycopene content. J Agric Food Chem 2000; 48: 1697-1702. [ Links ]
9. Meléndez-Martínez AJ, Vicario IM, Heredia FJ. Application of Tristimulus Colorimetry to estimate the carotenoids content in ultrafrozen orange juices. J Agric Food Chem 2003; 51(25): 7266-7270. [ Links ]
10. Hornero-Méndez D, Gómez-Ladrón de Guevara R, Mínguez- Mosquera MI. Carotenoid biosynthesis changes in five red pepper (Capsicum annuum L.) cultivars during ripening. Cultivar selection for breeding. J Agric Food Chem 2000; 48: 3857-3864. [ Links ]
11. Ruíz D, Egea J, Tomás-Barberán FA, Gil MI. Carotenoids from new apricot (Prunus armeniaca L.) varieties and their relationship with flesh and skin color. J Agric Food Chem 2005; 53: 6368-6374. [ Links ]
12. Gil MI, Tomás-Barberán FA, Hess-Prierce B, Kader AA. Antioxidant capacities, phenolic compounds, carotenoids, and vitamin C contents of nectarine, peach, and plum cultivars from California. J Agric Food Chem 2002; 50: 4976-4982. [ Links ]
13. Blanco G, Frías O, Garrido-Fernández J, Hornero-Méndez D. Environmental-induced acquisition of nuptial plumage expression: a role of denaturation of feather carotenoproteins? Proceedings of the Royal Society B Biological Sciences 2005; 272(1575): 1893-1900. [ Links ]
14. Negro JJ, Grande JM, Tella JL, Garrido J, Hornero D, Donázar JA, Sánchez-Zapata JA, Benítez JR, Barcell M. An unusual source of essential carotenoids. A yellow-faced vulture includes ungulate faeces in its diet for cosmetic purposes. Nature 2002; 416: 807-808. [ Links ]
15. Cremades O, Parrado J, Alvarez-Ossorio M-C, Jover M, Collantes de Terán L, Gutierrez JF, Bautista J. Isolation andcharacterization of carotenoproteins from crayfish (Procambarus clarkii). Food Chem 2003; 82(4): 559-566. [ Links ]
16. Ronsholdt B, McLean E. Determination of total carotenoid content in rainbow trout muscle by multivariate calibration of VIS reflectance spectra. J Food Compos Anal 2001; 14: 345- 357. [ Links ]
17. Yanar Y, Büyükcapar H, Yanar M, Göcer M. Effect of carotenoids from red pepper and marigold flower on pigmentation, sensory properties and fatty acid composition of rainbow trout. Food Chem 2007; 100: 326-330. [ Links ]
18. Britton G. Structure and properties of carotenoids in relation to function. FASEB J 1995; 9: 1551-1558. [ Links ]
19. Demmig-Adams B, Gilmore AM, Adams III WW. In vivo functions of carotenoids in higher plants. FASEB J 1996; 10: 403-412. [ Links ]
20. Frank HA, Chynwat V, Desamero RZB, Farhoosh R, Erickson J, Bautista J. On the photophysics and photochemical properties of carotenoids and their role as light-harvesting pigments in photosynthesis. Pure Appl Chem 1997; 69(10): 2177-2124. [ Links ]
21. Grumbach KH, Britton G. Distribution of carotenoids in subcellular and sub-plastidic fractions of radish seedlings (Raphanus sativus) grown in the presence of bleaching pesticides. Phytochem 1983; 22(9): 1937-1940. [ Links ]
22. Sandmann G, Mitchell G. In vitro inhibition studies of phytoene desaturase by bleaching ketomorpholine derivatives. J Agric Food Chem 2001; 49: 139-141. [ Links ]
23. Nyambaka H, Ryley J. An isocratic reversed-phase HPLC separation of the stereoisomers of the provitamin A carotenoids (a- and b-carotene) in dark green vegetables. Food Chem 2004; 55(1): 63-72. [ Links ]
24. Meléndez-Martínez AJ, Vicario IM, Heredia FJ. Provitamin A carotenoids and ascorbic acid contents of the different types of orange juices marketed in Spain. Food Chem 2007; 101: 177- 184. [ Links ]
25. Meléndez-Martínez AJ, Vicario IM, Heredia FJ. Rapid assessment of vitamin A activity through objective color measurements for the quality control of orange juices with diverse carotenoid profiles. J Agric Food Chem 2007; 55(8): 2808-2815. [ Links ]
26. González E, Montenegro MA, Nazareno MA, López de Mishima BA. Carotenoid composition and vitamin A value of an Argentinian squash (Cucurbita moschata). Arch Latinoam Nutr 2001; 51(4): 395-399. [ Links ]
27. Raju M, Varakumar S, Lakshminarayana R, Krishnakantha TP, Baskaran V. Carotenoid composition and vitamin A activity of medicinally important green leafy vegetables. Food Chem 2007; 101: 1621-1628. [ Links ]
28. Pinheiro SantAna HM, Stringheta PC, Cardoso Brandao SC, Monteiro Cordeiro de Azeredo R. Carotenoid retention and vitamin A value in carrot (Daucus carota L.) prepared by food service. Food Chem 1998; 61(1/2): 145-151. [ Links ]
29. Sánchez-Moreno C, Plaza L, De Ancos B, Cano MP. Vitamin C, provitamin A carotenoids, and other carotenoids in highpressurized orange juice during refrigerated storage. J Agric Food Chem 2003; 51: 647-653. [ Links ]
30. Burri BJ, Clifford AJ. Carotenoid and retinoid metabolism: insights from isotope studies. Arch Biochem Biophys 2004; 430: 110-119. [ Links ]
31. de Carvalho Rondó PH, Villar BS, Tomkins AM. Vitamin A status of pregnant women assessed by a biochemical indicator and a simplified food frequency questionnaire. Arch Latinoam Nutr 1999; 49(4): 322-325. [ Links ]
32. Römer S, Fraser PD, Kiano JW, Shipton CA, Misawa N, Schuch W, Bramley PM. Elevation of the provitamin A content of transgenic tomato plants. Nat Biotechnol 2000; 18: 666-669. [ Links ]
33. Beyer P, Al-Babili S, Ye X, Lucca P, Schaub P, Welsch R, Potrykus I. Golden Rice: introducing the b-carotene biosynthesis pathway into rice endosperm by genetic engineering to defeat vitamin A deficiency. J Nutr 2002; 132: 506S-510S. [ Links ]
34. Amaya-Farfan J. Panorama de la investigación sobre carotenoides en el Brasil. Perspectiva y necesidades. Arch Latinoam Nutr 1999; 49(1-S): 92-97. [ Links ]
35. Chávez Pérez JF. Prioridades de investigaciones en el campo de carotenoides en Venezuela. Arch Latinoam Nutr 1999; 49(1- S): 103-107. [ Links ]
36. López de Mishima B, Closa SJ, Samman N, de Portela MLPM. Necesidades de investigación sobre carotenoides en la República Argentina. Arch Latinoam Nutr 1999; 49(1-S): 98-102. [ Links ]
37. Muñoz de Chávez M, Chávez A, Calvo C. Necesidades de investigación en carotenoides en América Latina. Arch Latinoam Nutr 1999; 49(1-S): 85-88. [ Links ]
38. O´Neill ME, Carroll Y, Olmedilla B, Granado F, Blanco I, Van den Berg H, Hininger I, Rousell AM, Chopra M, Southon S, Thurnham DI. A European carotenoid database to assess carotenoid intakes and its use in a five-country comparative study. Br J Nutr 2001; 85: 499-507. [ Links ]
39. Dixon LB, Zimmerman TP, Kahle LL, Subar AF. Adding carotenoids to the NCI Diet History Questionnaire Database. J Food Compos Anal 2003; 16: 269-280. [ Links ]
40. Yamaguchi LF, Martinez GR, Catalani LH, Medeiros MHG, Di Mascio P. Lycopene entrapped in human albumin protects 2'-deoxyguanosine against singlet oxygen damage. Arch Latinoam Nutr 1999; 49(1-S): 12-20. [ Links ]
41. Böhm F, Tinkler JH, Truscott TG. Carotenoids protect against cell membrane damage by the nitrogen dioxide radical. Nature Med 1995; 1: 98-99. [ Links ]
42. Naguib YMA. Antioxidant activities of astaxanthin and related carotenoids. J Agric Food Chem 2000; 48: 1150-1154. [ Links ]
43. Maoka T, Mochida K, Kozuka M, Ito Y, Fujiwara Y, Hashimoto K, Enjo F, Ogata M, Nobukuni Y, Tokuda H, Nishino H. Cancer chemopreventive activity of carotenoids in the fruits of red paprika Capsicum annuum L. Cancer Lett 2001; 172: 103-109. [ Links ]
44. Russell RM. Beta-carotene and lung cancer. Pure & Applied Chemistry 2002; 74(8): 1461-1467. [ Links ]
45. Slattery M, Benson J, Curtin K, Ma K-N, Schaeffer D, Potter JD. Carotenoids and colon cancer. Am J Clin Nutr 2000; 71: 575-582. [ Links ]
46. Snodderly DM. Evidence for protection against age-related macular degeneration by carotenoids and antioxidant vitamins. Am J Clin Nutr 1995; 62: 1448S-61S. [ Links ]
47. Trumbo PR, Ellwood KC. Lutein and zeaxanthin intakes and risk of age-related macular degeneration and cataracts: an evaluation using the Food and Drug Administrations evidencebased review system for health claims. Am J Clin Nutr 2006; 84: 971-974. [ Links ]
48. Tavani A, La Vecchia C. b-carotene and risk of coronary heart disease. A review of observational and intervention studies. Biomed & Pharmacother 1999; 53: 409-416. [ Links ]
49. Rao AV. Lycopene, tomatoes, and the prevention of coronary heart disease. Exp Biol Med 2002; 227: 908-913. [ Links ]
50. Palozza P. Prooxidant actions of carotenoids in biologic systems. Nutr Rev 1998; 56: 257-265. [ Links ]
51. Paolini M, Abdel-Rahman SZ, Sapone A, Pedulli GF, Perocco P, Cantelli-Forti P, Legator MS. b-carotene: a cancer chemopreventive agent or a co-carcinogen? Mutat Res 2003; 543: 195-200. [ Links ]
52. Krinsky NI. Carotenoids as antioxidants. Nutrition 2001; 17(10): 815-817. [ Links ]
53. Stahl W, Sies H. Antioxidant activity of carotenoids. Mol Aspects Med 2003; 24: 345-351. [ Links ]
54. Olson JA. Carotenoids and human health. Arch Latinoam Nutr 1999; 49(1-S): 7-11. [ Links ]
55. Meléndez-Martínez AJ, Vicario IM, Heredia FJ. Importancia nutricional de los pigmentos carotenoides. Arch Latinoam Nutr 2004; 54(2): 149-154. [ Links ]
56. Olson JA. Bioavailability of carotenoids. Arch Latinoam Nutr 1999; 49(1-S): 21-25. [ Links ]
57. Borel P, Reboul E, Richelle M, Perrot E, Desmoulins-Malezet C, Pirisi V, Borel. Bioaccessibility of carotenoids and vitamin E from their main dietary sources. J Agric Food Chem 2006; 54: 8749-8755. [ Links ]
58. Granado-Lorencio F, Olmedilla-Alonso B, Herrero-Barbudo MC, Blanco-Navarro I, Pérez-Sacristán B, Blázquez-García S. In vitro bioaccessibility of carotenoids and tocopherols from fruits and vegetables. Food Chem 2007; 102: 641-648. [ Links ]
59. Britton G. UV/Visible Spectroscopy. En: Britton G, Liaaen-Jensen S, Pfander H, editores. Carotenoids. Volume 1B: Spectroscopy. Basel, Switzerland: Birkhäuser; 1995. p. 13-62. [ Links ]
60. Meléndez-Martínez AJ, Britton G, Vicario IM, Heredia FJ. Relationship between the colour and the chemical structure of carotenoid pigments. Food Chem 2007; 101: 1145-1150. [ Links ]
61. Woodall AA, Lee SW, Weesie RJ, Jackson MJ, Britton G. Oxidation of carotenoids by free radicals: relationship between structure and reactivity. Biochim Biophys Acta 1997; 1336: 33-42. [ Links ]
62. Woodall AA, Britton G, Jackson MJ. Carotenoids and protection of phospholipìds in solution or in liposomes against oxidation by peroxyl radicals: Relationship between carotenoid structure and protective ability. Biochimica et Biophysica Acta 1997; 1336: 575-586. [ Links ]
63. Weedon BCL, Moss GP. Structure and nomenclature. En: Britton G, Liaaen-Jensen S, Pfander H, editores. Carotenoids. Volume 1A: Isolation and analysis. Basel, Switzerland: Birkhäuser; 1995. p. 27-70. [ Links ]
64. Cogdell RJ, Gillbro T, Andersson PO, Liu RSH, Asato AE. Carotenoids as accessory light-harvesting pigments. Pure & Applied Chemistry 1994; 66(5): 1041-1046. [ Links ]
65. Young AJ, Phillip D, Ruban AV, Horton P, Frank HA. The xanthophyll cycle and carotenoid-mediated dissipation of excess excitation energy in photosynthesis. Pure & Applied Chemistry 1997; 69(10): 2125-2130. [ Links ]
66. Britton G. Carotenoids. En: Hendry GAF, Houghton JD, editores. Natural food colorants. Glasgow and London: Blackie; 1992. p. 141-182. [ Links ]
67. Mínguez-Mosquera MI. Clorofilas y carotenoides en Tecnología de los Alimentos. Sevilla, Spain: Secretariado de publicaciones de la Universidad de Sevilla; 1997. [ Links ]
68. Mercadante AZ, Steck A, Pfander H. Isolation and structure elucidation of minor carotenoids from annatto (Bixa orellana L.) seeds. Phytochem 1997; 46(8): 1379-1383. [ Links ]
69. Mercadante AZ. New carotenoids: Recent progress. Pure Appl Chem 1999; 71(12): 2263-2272. [ Links ]
70. Britton G, Liaaen-Jensen S, Pfander H. Carotenoids. Handbook. Basel, Switzerland: Birkhäuser; 2004. [ Links ]
71. Breithaupt DE, Bamedi A. Carotenoid esters in vegetables and fruits: a screening with emphasis on b-cryptoxanthin esters. J Agric Food Chem 2001; 49(4): 2064-2070. [ Links ]
72. Ishida BK, Turner C, Chapman MH, McKeon TA. Fatty acid and carotenoid composition of gac (Momordica cochinchinensis Spreng) fruit. J Agric Food Chem 2004; 52: 274-279. [ Links ]
73. Breithaupt DE, Bamedi A. Carotenoids and carotenoid esters in potatoes (Solanum tuberosum L.): new insights into an ancient vegetable. J Agric Food Chem 2002; 50: 7175-7181. [ Links ]
74. Pott I, Breithaupt DE, Carle R. Detection of unusual carotenoid esters in fresh mango (Mangifera indica L. cv. Kent). Phytochem 2003; 64: 825-829. [ Links ]
75. Philip T. The nature of carotenoid esterification in citrus fruits. J Agric Food Chem 1973; 21(6): 964-966. [ Links ]
76. Wingerath T, Stahl W, Sies H. b-Cryptoxanthin selectively increases in human chylomicrons upon ingestion of tangerine concentrate rich in b-Cryptoxanthin esters. Arch Biochem Biophys 1995; 324(2): 385-390. [ Links ]
77. Pintea A, Diehl HA, Momeu C, Aberle L, Socaciu C. Incorporation of carotenoid esters into liposomes. Biophys Chem 2005; 118: 7-14. [ Links ]
78. Pérez-Gálvez A, Mínguez-Mosquera MI. Degradation of nonesterified and esterified xanthophylls by free radicals. Biochimica et Biophysica Acta 2002; 1569: 31-34. [ Links ]
79. Hornero-Méndez D, Mínguez-Mosquera MI. Xanthophyll esterification accompanying carotenoid overaccumulation in chromoplast of Capsicum annuum ripening fruits is a constitutive process and useful for ripeness index. J Agric Food Chem 2000; 48: 1617-1622. [ Links ]
80. Van Calsteren M-R, Bissonnette MC, Cornier F, Dufresne C, Ichi T, Yves LeBlanc JC, Perreault D, Roewer I. Spectroscopic characterization of crocetin derivatives from Crocus sativus and Gardenia jasminoides. J Agric Food Chem 1997; 45: 1055- 1061. [ Links ]
81. Selim K, Tsimidou M, Biliaderis CG. Kinetic studies of degradation of saffron carotenoids encapsulated in amorphous polymer matrices. Food Chem 2000; 71: 199-206. [ Links ]
82. Pfister S, Meyer P, Steck A, Pfander H. Isolation and structure elucidation of carotenoid-glycosyl esters in gardenia fruits (Gardenia jasminoides Ellis) and Saffron (Crocus sativus Linne). J Agric Food Chem 1996; 44: 2612-2615. [ Links ]
83. Armenta-López R, Guerrero I, Huerta S. Astaxanthin extraction from shrimp waste by lactic fermentation and enzymatic hydrolysis of the carotenoprotein complex. J Food Sci 2004; 67(3): 1002-1006. [ Links ]
84. Gross J, Gabai M, Lifshitz A, Sklarz B. Carotenoids of Eriobotrya japonica. Phytochem 1973; 12: 1775-1782. [ Links ]
85. Farin D, Ikan R, Gross J. The carotenoid pigments in the juice and flavedo of a mandarin hybrid (Citrus reticulata) cv Michal during ripening. Phytochem 1983; 22(2): 403-408. [ Links ]
86. Carmona M, Zalacain A, Sánchez AM, Novella JL, Alonso GL. Crocetin esters, picrocrocin and its related compounds present in Crocus sativus stigmas and Gardenia jasminoides fruits. Tentative identification of seven new compounds by LCESI- MS. J Agric Food Chem 2006; 54: 973-979. [ Links ]
87. Mercadante AZ, Steck A, Pfander H. Isolation and identification of new apocarotenoids from annatto (Bixa orellana) seeds. J Agric Food Chem 1997; 45: 1050-1054. [ Links ]
88. Maoka T, Fujiwara Y, Hashimoto K, Akimoto N. Isolation of a series of apocarotenoids from the fruits of the red paprika Capsicum annuum L. J Agric Food Chem 2001; 49: 1601- 1606. [ Links ]
89. Cooper CM, Davies NW, Menary RC. C-27 apocarotenoids in the flowers of Boronia megastigma (Nees). J Agric Food Chem 2003; 51: 2384-2389. [ Links ]
90. Lóránd T, Molnár P, Deli J, Tóth G. FT-IR study of some secoand apocarotenoids. J Biochem Biophys Methods 2002; 53: 251-258. [ Links ]
91. Wang F, Jiang JG, Chen Q. Progress on molecular breeding and metabolic engineering of biosynthesis pathways of C30, C35, C40, C45, C50 carotenoids. Biotechnology Advances 2007; 25: 211-222. [ Links ]
92. Zechmeister L. Cis-trans isomeric carotenoids, vitamins A and arylpolyenes. Vienna, Austria: Springer Verlag; 1962. [ Links ]
93. Mercadante AZ, Pfander H. Carotenoids from annatto: a review. Recent Res Dev Agric Food Chem 1998; 2: 79-91. [ Links ]
94. Khachik F, Beecher GR, Lusby WR. Separation, identification, and quantification of the major carotenoids in extracts of apricots, peaches, cantaloupe, and pink grapefruit by liquid chromatography. J Agric Food Chem 1989; 37: 1465-1473. [ Links ]
95. Britton G, Powls R. Phytoene, phytofluene and z-carotene isomers from a Scenedesmus obliquus mutant. Phytochem 1977; 16: 1253-1255. [ Links ]
96. Sander LC, Epler-Sharpless K, Craft NE, Wise SA. Development of engineered stationary phases for the separation of carotenoid isomers. Anal Chem 1994; 66: 1667-1674. [ Links ]
97. Emenhiser C, Simunovic N, Sander LC, Schwartz SJ. Separation of geometrical carotenoid isomers in biological extracts using a polymeric C30 column in reversed-phase liquid chromatography. J Agric Food Chem 1996; 44: 3887-3893. [ Links ]
98. Lessin WJ, Catignani GL, Schwartz SJ. Quantification of cistrans isomers of provitamin A carotenoids in fresh and processed fruits and vegetables. J Agric Food Chem 1997; 45(10): 3728-3732. [ Links ]
99. Marx M, Schieber A, Carle R. Quantitative determination of carotene stereoisomers in carrot juices and vitamin supplemented (ATBC) drinks. Food Chem 2000; 70: 403-408. [ Links ]
100. Pott I, Marx M, Neidhart S, Mühlbauer W, Carle R. Quantitative determination of b-carotene stereoisomers in fresh, dried, and solar-dried mangoes (Mangifera indica L.). J Agric Food Chem 2003; 51: 4527-4531. [ Links ]
101. Meléndez-Martínez AJ, Britton G, Vicario IM, Heredia FJ. Identification of isolutein (lutein epoxide) as cis-antheraxanthin in orange juice. J Agric Food Chem 2005; 53(24): 9369-9373. [ Links ]
102. Meléndez-Martínez AJ, Vicario IM, Heredia FJ. Carotenoids, color and ascorbic acid content of a novel frozen-marketed orange juice. J Agric Food Chem 2007; 55(4): 1347-1355. [ Links ]
103. Leigh Hadden W, Watkins RH, Levy LW, Regalado E, Rivadeneira DM, Van Breemen RB, Schwartz SJ. Carotenoid composition of marigold (Tagetes erecta) flower extract used as nutritional supplement. J Agric Food Chem 1999; 47: 4189- 4194. [ Links ]
104. Boileau TWM, Boileau AC, Erdman Jr. JW. Bioavailability of all-trans and cis-isomers of lycopene. Exp Biol Med 2002; 227: 914-919. [ Links ]
105. Böhm V, Puspitasari-Nienaber NL, Ferruzzi MG, Schwartz SJ. Trolox equivalent antioxidant capacity of different geometrical isomers of a-carotene, b-carotene, lycopene, and zeaxanthin. J Agric Food Chem 2002; 50: 221-226. [ Links ]
106. Meléndez-Martínez AJ, Vicario IM, Heredia FJ. Estabilidad de los pigmentos carotenoides en los alimentos. Arch Latinoam Nutr 2004; 54(2): 209-215. [ Links ]
107. Schieber A, Carle R. Occurrence of carotenoid cis-isomers in food: Technological, analytical and nutritional implications. Trends in Food Science and Technology 2005; 16: 416-422. [ Links ]
108. Socaciu C, Jessel R, Diehl HA. Carotenoid incorporation into microsomes: yields, stability and membrane dynamics. Spectrochimica Acta Part A 2000; 56: 2799-2809. [ Links ]
109. Frank H, Cogdell RJ. Photochemistry and function of carotenoids in photosynthesis. En: Young A, Britton G, editores. Carotenoids in photosynthesis. London: Chapman & Hall; 1993. p. 253-326. [ Links ]
110. Gruszecki WI, Grudzinski W, Banaszek-Glos A, Matula M, Kernen P, Krupa Z, Sielewiesiuk J. Xanthophyll pigments in light-harvesting complex II in monomolecular layers: localisation, energy transfer and orientation. Biochimica et Biophysica Acta 1999; 1412: 173-183. [ Links ]
111. Schiedt K, Liaaen-Jensen S. Isolation and analysis. En: Britton G, Liaaen-Jensen S, Pfander H, editores. Carotenoids. Volume 1A: Isolation and analysis. Basel, Switzerland: Birkhäuser; 1995. p. 81-108. [ Links ]
112. Nguyen M, Francis D, Schwartz S. Thermal isomerisation susceptibility of carotenoids in different tomato varieties. J Sci Food Agric 2001; 81: 910-917. [ Links ]
113. Seybold C, Fröhlich K, Bitsch R, Otto K, Böhm V. Changes in contents of carotenoids and vitamin E during tomato processing. J Agric Food Chem 2004; 52(23): 7005-7010. [ Links ]
114. Hoischen D, Colmenares LU, Liu J, Simmons CJ, Britton G, Liu RSH. Fluorinated analogs of the carotenoprotein acrustacyanin. Bioorg Chem 1998; 26(6): 365-374. [ Links ]
115. Rodriguez-Amaya DB. A guide to carotenoid analysis in foods. Washington, D.C.: ILSI Press; 2001. [ Links ]
116. Chen BH, Peng HY, Chen HE. Changes of carotenoids, color and vitamin A content during processing of carrot juice. J Agric Food Chem 1995; 43: 1912-1918. [ Links ]
117. Meléndez-Martínez AJ, Britton G, Vicario IM, Heredia FJ. Color and carotenoid profile of Spanish Valencia late ultrafrozen orange juices. Food Res Int 2005; 38: 931-936. [ Links ]
118. Zandomeneghi M, Festa C, Carbonaro L. Front-surface absorbance spectra of wheat flour: determination of carotenoids. J Agric Food Chem 2000; 48: 2216-2221. [ Links ]
119. Hornero-Méndez D, Mínguez-Mosquera MI. Rapid spectrophotometric determination of red and wellow isochromic carotenoid fractions in paprika and red pepper oleoresins. J Agric Food Chem 2001; 49: 3584-3588. [ Links ]
120. Britton G. Carotenoids. En: Dey PM, Harborne JB, editores. Methods in plant Biochemistry. London: Academic Press; 1991. p. 473-518. [ Links ]
121. Britton G, Young A. Methods for isolation and analysis of carotenoids. En: Young A, Britton G, editores. Carotenoids in photosynthesis. London: Chapman & Hall; 1993. p. 409-458. [ Links ]
122. Davies BH. Carotenoids. En: Goodwin TW, editores. Chemistry and Biochemistry of plant pigments. London, New York, San Francisco: Academic Press; 1976. p. 38-165. [ Links ]
123. De Ritter E, Purcell AE. Carotenoid analytical methods. En: Bavernfeind JC, editores. Carotenoids as colorants and vitamin A precursors. New York: Academic Press; 1981. p. 815-883. [ Links ]














