Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Latinoamericanos de Nutrición
versión impresa ISSN 0004-0622versión On-line ISSN 2309-5806
ALAN v.59 n.4 Caracas dic. 2009
Revisión del papel de los oligosacáridos prebióticos en la prevención de infecciones gastrointestinales
Ana María Domínguez-Vergara, Luz Vázquez-Moreno, Gabriela Ramos-Clamont Montfort
Centro de Investigaciones en Alimentación y Desarrollo A.C. Hermosillo, Sonora, México
RESUMEN
Las enfermedades gastrointestinales siguen siendo un problema de salud pública mundial. El avance de la ciencia muestra que cambios en el balance adecuado de la microflora intestinal (MI) juegan un papel crucial en la patogénesis. La evidencia apunta a que una manera de modular esta MI es a través del uso de oligosacáridos prebióticos, que estimulan el crecimiento de bacterias benéficas y que a la vez aumentan la resistencia a la invasión por patógenos. Estudios con animales indican que el consumo de carbohidratos prebióticos podría estar implicado en la prevención y tratamiento de diarreas. En infantes humanos sanos, los estudios revelan que el consumo de mezclas de prebióticas (galactooligosacáridos/fructooligosacáridos, inulina/galactooligosacáridos) disminuyen la incidencia de fiebre, de infecciones y de patógenos gastrointestinales. Lo anterior representa un gran potencial para los alimentos funcionales que los contienen, principalmente las fórmulas infantiles. Sin embargo, los estudios de prevención de diarreas mediante el suministro de prebióticos en personas con una microflora intestinal alterada no son concluyentes, sobre todo aquellos practicados en ancianos, personas con problemas crónicos de inflamación intestinal y personas con diarreas asociadas a la toma de antibióticos. Lo anterior nos indica la necesidad de estudios bioquímicos y microbiológicos más profundos en humanos de diferentes edades y condiciones de salud intestinal, a fin de determinar en que condiciones, los prebióticos tienen algún efecto sobre las infecciones.
Palabras clave: Oligosacáridos prebióticos, inulina, fructooligosacáridos, galactooligosacáridos, infecciones.
Role of prebiotic oligosaccharides in prevention of gastrointestinal infections: a review.
SUMMARY
Gastrointestinal disorders are still a main world public health problem. Scientific progress shows that and inadequate balance in intestinal microbiota (IM) plays a crucial role in its pathogenesis. Evidence indicates that one way to modulate the IM is through the use of prebiotics. These oligosaccharides stimulate the growth of benefic bacteria and increase the resistance to invading pathogens. Research using animals show that the consumption of prebiotics could be implicated in prevention and treatment of diarrhea. Studies in healthy infants also indicate that the consumption of prebiotic mixtures (galactooligosaccharides/ fructooligosaccharides, inulin/ galactooligosaccharides) decreases the incidence of fever, infections and pathogens. These results represent a great potential for functional foods that contain prebiotics, mainly the infant formulas. However, results of other clinical studies for prebiotics effects on diarrhea are not conclusive. Specially those studies that include patients with an altered IM (like the elderly), patients with chronic intestinal inflammation and with diarrhea associated to antibiotic treatments. There is a need for more biochemical and microbiological studies in humans at different ages and intestinal health conditions, in order to determine when prebiotics may effectively function on infections.
Key words: Prebiotic oligosaccharides, insulin, fructooli-gosaccharides, galactooligosaccharides, infections.
Recibido: 07/05/2009
Aceptado: 27/08/2009
INTRODUCCION
Las infecciones gastrointestinales siguen siendo un problema importante de salud a pesar de los avances de la medicina. La incidencia mundial de decesos causados por este tipo de enfermedades supera a las 3 millones de muertes/año. Aunque el problema se agudiza en los países en desarrollo, también se presenta en países industrializados, donde la incidencia de infecciones intestinales afecta aproximadamente al 10% de la población. Las bacterias enteropatógenas son las principales causantes de estas infecciones. En la mayoría de las personas, estos microorganismos provocan una gastroenteritis que puede curarse con los medicamentos y la rehidratación adecuada. Sin embargo, en poblaciones desprotegidas, como ancianos, niños, personas con inflamación crónica intestinal y personas inmuno-comprometidas, el problema puede agravarse, pudiendo derivar hasta en una septicemia que conduzca a la muerte.
El descubrimiento y la aplicación de los antibióticos para el control de las infecciones intestinales ha sido uno de los grandes avances médicos del siglo XX. Sin embargo, el mal uso y el abuso de éstos, ha provocado el aumento de la resistencia bacteriana. De allí la importancia de buscar alternativas para prevenir y/o tratar las infecciones. Una opción prometedora se basa en la modulación de la microflora intestinal (MI) a través de la dieta. En esta revisión se analizará el efecto de los carbohidratos prebióticos en la modulación de la MI con el fin de prevenir y/o tratar infecciones gastrointestinales.
Microflora intestinal y salud
El intestino humano es el hábitat natural de una población diversa y dinámica de microorganismos que, a través de la evolución, se han adaptado para vivir y colonizar las mucosas y el lumen intestinal. Esta microflora intestinal, está compuesta por más de 400 especies diferentes (1,2). Además, difiere cuali y cuantitativamente en los distintos segmentos del tracto gastrointestinal. En el estómago y el duodeno la concentración bacteriana llega hasta 103 UFC/mL; en el yeyuno e ileon habitan en promedio de 104 a 108 UFC/mL, mientras que en el colon se encuentra la mayor cantidad de microorganismos, que va desde 109 hasta 1012 UFC/mL (3). La mayor cantidad de anaerobias se localiza en el colon, estratificada a su vez horizontalmente, por lo que se distingue entre la MI adherida a las mucinas, a las criptas y a los colonocitos (3,4).
En los humanos, la forma de nacer influye en la composición de la microflora. Los recién nacidos por cesárea presentan conteos menores de lactobacilos y bifidobacterias (L y B) y mayores de coliformes y estreptococos, que los nacidos por vía vaginal (3,5). Otro factor que influye en la composición de la MI es la alimentación del neonato. Las bifidobacterias y lactobacilos predominan en los niños que han sido alimentados con leche materna, mientras que en bebés alimentados con fórmula prevalecen coliformes, enterococos y bacteroides (1,6) El avance de la ciencia nos ha indicado la conveniencia de que nuestro intestino se colonice con bacterias L y B. Es por ello que en la actualidad se investiga la incorporación de estimuladores de su crecimiento (prebióticos), en las fórmulas infantiles. Entre los prebióticos más importantes se encuentran algunos oligosacáridos no digeribles.
La interacción entre las L y B y su hospedador, es una relación simbiótica en la que el humano provee al microorganismo de un hábitat rico en nutrientes, mientras que las L y B le confieren importantes beneficios (5,7). Entre estos últimos destacan aspectos de nutrición (producción de ácidos grasos de cadena corta, promoción de la absorción de iones, producción de aminoácidos y vitaminas), protección (barrera que impide la invasión de patógenos) e importantes efectos tróficos sobre el epitelio intestinal y el sistema inmune mucosal (7,8). Por ello, la microflora intestinal es considerada actualmente como un órgano con funciones comparables en importancia a las del hígado (1,9,10).
En el momento en que se rompe la relación del hospedador con su microflora benéfica, como sucede por ejemplo, ante una infección gastrointestinal o después del uso prolongado de antibióticos, se afecta el equilibrio del organismo (10). Ello produce cambios patológicos importantes que se relacionan con procesos inflamatorios, autoinmunes e infecciosos, entre otros (1,4). Debido a lo anterior, es importante conservar la homeostasis intestinal, a través del balance microbiano. Una alternativa es a través del uso de oligosacáridos prebióticos (6,7).
Oligosacáridos prebióticos
Un oligosacáridos prebiótico es un carbohidrato que permite cambios específicos en la composición y/o actividad de la microflora intestinal responsable del bienestar y de la salud de su hospedador (11-13). Estos compuestos no son digeridos por el humano y por tanto llegan intactos hasta el colon donde sirven de alimento para aquellas bacterias que expresan enzimas como la b-fructofuranosidasa, la a- y b- galactosidasas, la xylanasa y otras carbohidrasas. Este efecto se conoce como bifidogénico específicamente para bifidobacterias (12,14,15). Además de estas características, los prebióticos deben inducir indirectamente cambios benéficos sistémicos o luminales en el hospedador (12,13).
La fermentación de los prebióticos en el colon da lugar a la producción de ácidos grasos de cadena corta (AGCC) como el butírico, el acético, el láctico y el propiónico (7,10). También se producen H2, CO2 y una disminución del pH intestinal a <5.0. Esto último, previene el crecimiento de patógenos (i.e. clostridios, coliformes etc.) y promueve la proliferación de L y B (16). Los AGCC se absorben en el intestino, contribuyendo a la homeostasis de la sal y del agua en el colon (7). Posteriormente pasan a la vena porta para ser metabolizados en el hígado. El propionato es un precursor gluconeogénico, y el acetato pasa a tejidos periféricos y es metabolizado en el músculo. En el colon el butirato es metabolizado y utilizado selectivamente como combustible, y regula el metabolismo de los ácidos nucleicos de algunas bacterias del colon (17). El butirato también promueve el mantenimiento de la barrera intestinal y ha sido implicado en la prevención del cáncer de colon (18). También se adjudica a los AGCC la regulación del metabolismo de los lípidos (19, 20).
De acuerdo a lo anterior, la funcionalidad o el efecto de un prebiótico se evalúa en base a la promoción del crecimiento intestinal de L y B, a la disminución de clostridios y coliformes, y al aumento en los AGCC (7,12,18).
La principal ventaja del uso de prebióticos es que estimulan el crecimiento de las L y B nativas del colon, sin necesidad de introducir una especie microbiana en un alimento (como es el caso de los probióticos). Una ventaja adicional es que los oligosacáridos son más fáciles de introducir en la formulación de un alimento, que los microorganismos, ya que estos últimos pueden perder su viabilidad durante el procesamiento y almacenamiento. En consecuencia los prebióticos pueden ser una estrategia más práctica y eficiente para modular la flora intestinal, que los probióticos (7).
Oligosacáridos de la leche humana
Los primeros oligosacáridos reconocidos como prebióticos fueron los de la leche humana (OLH). Esto ocurrió al demostrarse su efecto bifidogénico en el intestino de los infantes (20,21). La leche humana contiene entre 7.0 y 12.0 g/L de oligosacáridos complejos; sus estructuras se componen principalmente por D-galactosa, N-acetilglucosamina, L-fucosa y ácido siálico (22-24). Los OLH constituyen el tercer componente de mayor concentración en la leche, después de la lactosa y los lípidos, pudiendo encontrarse como oligosacáridos libres o formando parte de algunos glicoconjugados unidos a lípidos, o a proteínas (22).
El efecto prebiótico de los OLH quedó establecido después de una serie de estudios científicos. (25) Algunos de éstos demostraron que los OLH resisten la digestión del humano (26,27) y estimulan el crecimiento de las bifidobacterias (28). Esto se confirma con las grandes diferencias observadas en la microflora de los niños de acuerdo a su alimentación de bebés. El intestino de niños alimentados con leche de fórmula contiene menos bifidobacterias y más coliformes, enterococos y bacteroides, mientras que en los niños alimentados con la leche de la madre se encuentran mayores poblaciones de L y B (22-24). Por otro lado, Coppa y colaboradores (29) encontraron una relación directa entre la concentración de oligosacáridos en la leche materna correlaciona y la diversidad de especies de Bifidobacterium.
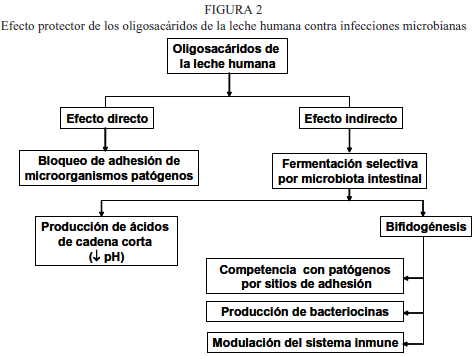
Existe evidencia de que los OLH pueden absorberse parcialmente, permaneciendo en el torrente sanguíneo pudiendo inducir algunos efectos sistémicos (26,27). Un ejemplo son los OLH que contienen las estructuras 3 ´sialil lactosa y 3´sialil 3 fucosil lactosa, los cuales pueden ser reconocidos por selectinas relacionadas con procesos inflamatorios. Los estudios de Bode (30, 31) y Kannagi (32), muestran que mediante este reconocimiento del tipo lectina-carbohidrato, los OLH son capaces de modular la adhesión de leucocitos, monocitos, linfocitos y neutrófilos, ejerciendo un efecto anti-inflamatorio que posiblemente contribuya a la disminución de la incidencia de enfermedades inflamatorias en el infante (23). Otro efecto benéfico de los OHL que se discutirá más adelante es su capacidad de inhibir la adhesión de patógenos intestinales, protegiendo al infante contra las infecciones (24).
Los efectos benéficos que los OHL ejercen en el infante y su baja disponibilidad, han despertado un gran interés por la búsqueda de posibles sustitutos que puedan añadirse a las fórmulas infantiles (25) La búsqueda de prebióticos, también está dirigida hacia otras poblaciones en las que la microflora intestinal se encuentra alterada. Algunos factores que influyen en el desbalance de la microflora son el tratamiento prolongado con antibióticos, la dieta, el estrés, la edad y la enfermedad (33-35). Por ejemplo, la microflora de las personas de la tercera edad muestra una disminución en el contenido de L y B relacionada con un aumento en la susceptibilidad a las infecciones (20,25,35), mientras que los tratamientos prolongados con antibióticos disminuyen drásticamente a las poblaciones de L y B y aumentan la presencia de Clostridium difficile (33,34). En personas que sufren de enfermedades relacionadas con la inflamación crónica del intestino, la MI presenta un desbalance en el contenido de bifidobacterias (4). En todos estos casos, la administración de prebióticos bifidogénicos puede contribuir a mejorar el estado de salud del paciente (36-38).
Oligosacáridos con potencial prebiótico
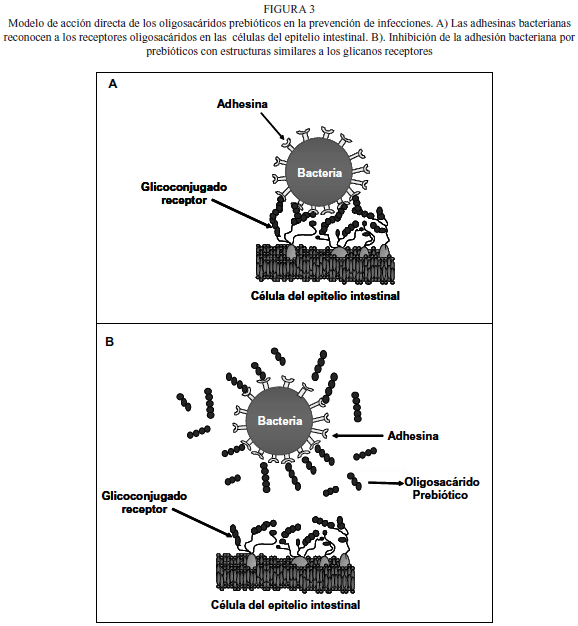
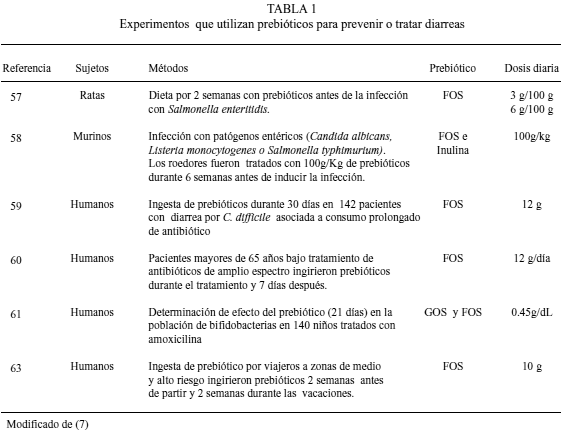
Los oligosacáridos con potencial prebiótico, que pudieran sustituir a los OLH, se clasifican de acuerdo a su composición química y grado de polimerización (GP). Entre ellos se encuentran la lactulosa, los galacto o transgalacto-oligosacáridos, la inulina y los fructuoligosacáridos o FOS (39). Todos ellos han demostrado su efecto bifidogénico tanto in vitro, como en humanos y animales (40-42). En la Figura 1 se muestran algunas de sus estructuras.
Los galactooligosacáridos o trans-galactoligosacáridos (GOS/TOS) se obtienen de la transgalactosilación de la lactosa del suero de queso, con b-galactosidasa (43). Dependiendo de las enzimas utilizadas y las condiciones de la reacción se consiguen mezclas de tri, tetra o pentasacáridos con enlaces b 1-3, 1-6 y 1-4 (44). Por otro lado, la inulina, formada principalmente por cadenas lineales de aD-glucopiranosil-(b-D-fructofuranosil)n-1-b-D-fructofuranosido, se obtiene principalmente de la chicoria (Cichorium intybus). La inulina está compuesta por una mezcla de oligómeros y polímeros con un grado de polimerización (GP) que varia de 2 hasta 60 unidades (30). Cerca del 10 % de las cadenas de fructanos tienen un GP entre 2 y 5. Éstos se conocen como oligofructanos o FOS pudiéndose obtener en mayores cantidades mediante la hidrólisis parcial de la inulina, utilizando endoinulinasa (E.C. 3.2.1.7) Cada prebiótico varía no solo en grado de polimerización, sino en sus propiedades funcionales (41, 45). Al momento, la principal fuente de inulina es la chicoria sin embargo existen otras fuentes, como los agaves, cuyo potencial no ha sido completamente evaluado. Los mano-oligosacáridos, isomalto-oligosacaridos, xilo-oligosacaridos y los oligosacáridos de la soya, se utilizan como prebióticos en Japón. Actualmente se encuentran en vías de investigación (7). Los oligosacáridos obtenidos del suero de soya, presentan estructuras galactosiladas unidas mediante enlaces a1-6 a una molécula de sacarosa. En los xilo-oligosacáridos, predominan los enlaces de tipo b1-4. Los a1-6 iso-malto-oligosacáridos pueden ser digeridos por el humano, pero tan lentamente, que alcanzan a llegar al colon donde son fermentados por las L y B. Por esta razón se consideran como parcialmente prebióticos (46). Diversos estudios comprueban que la inulina, los FOS y los GOS presentan un efecto prebiótico en el intestino. Además, existe evidencia de que con mezclas de FOS y GOS se obtiene un efecto sinérgico (7,15,47,48). Un hallazgo interesante es que la ingestión de prebióticos disminuye significativamente la presencia de patógenos de los géneros Clostridia, Enterobacter y Staphilococcus aureus (49). Lo anterior ha despertado el interés por conocer más sobre el efecto de los prebióticos en las infecciones intestinales. Prebióticos e infecciones gastrointestinales Las diarreas provocadas por infecciones gastrointestinales son causa importante de morbilidad y mortalidad en todo el mundo. En particular, este padecimiento es el causante del 22% de las muertes que se presentan anualmente en los países en vías de desarrollo (50,51). También son la causa más común de muerte en recién nacidos (51,52). Las infecciones gastrointestinales pueden controlarse suministrando antibióticos; sin embargo, los problemas de resistencia bacteriana o la baja disponibilidad de estos medicamentos para poblaciones de escasos recursos, hacen cada vez más apremiante la búsqueda de alternativas profilácticas. La ingestión de prebióticos, pudiera ser una alternativa. La evidencia más importante de esta afirmación se encuentra en los estudios con oligosacáridos de la leche humana (53,54). La alimentación del recién nacido con leche humana (LH) ha sido identificada como la forma más efectiva para proteger a los niños menores de 5 años de las infecciones gastrointestinales (55,56). La LH es el modelo natural de protección, entender los mecanismos de defensa de las moléculas que la componen, servirá de base para el diseño de intervenciones profilácticas efectivas contra diferentes infecciones (57). Esta leche contiene una extensa variedad de factores de defensa provenientes de los sistemas inmunes innato y adquirido de la madre (i.e inmunoglobulinas, lactoferrina, lisozima, etc.). Los niños alimentados con leche de fórmula carecen de la protección de los factores de defensa de la leche materna humana. Por ello, son más propensos a las infecciones (58). Los efectos anti-infecciosos de los OLH (Figura 2), se relacionan con su acción sobre la MI benéfica del hospedador. Es decir, con el soporte en el crecimiento de las L y B, que permite excluir a los patógenos del tracto gastrointestinal a través de a) la competencia por los sitios de adhesión en la mucosa, b) la disminución del pH, debida a la producción de los AGCC y c), la producción de sustancias inhibidoras como las bacteriocinas (57,59). Por otro lado, hay evidencia de que las L y B pueden modular el sistema inmune de su hospedador, desencadenando una respuesta de defensa contra la infección (60). Una acción más específica y directa de los OLH, para prevenir la infección, es su capacidad de actuar como análogos solubles de los receptores del tracto gastrointestinal, a los que se unen, varios Gram negativos (57). Para algunos investigadores este es el elemento principal de la protección de los oligosacáridos contra la infección (53,57). El principio se basa en el reconocimiento proteína-carbohidrato que se establece entre las lectinas microbianas y los glicoconjugados de la superficie celular. Lo anterior permite a la bacteria adherirse y posteriormente colonizar e invadir al epitelio intestinal (61). Este es el mecanismo que siguen, por ejemplo, Escherichia coli, Helicobacter jejuni, y algunas especies de Salmonella y cepas de Shigella (62,63). La Figura 3 indica como el oligosacárido sería capaz de prevenir la adhesión bacteriana y por tanto la infección. Martín-Sosa et al. (64), estudiaron el efecto de los OLH en la inhibición de la adhesión de cepas de Escherichia coli enterotoxigénica (ETEC) y de E. coli uropatogénica (UPEC) a tejidos celulares. Las adhesinas de estos microorganismos reconocieron oligosacaridos que contienen galactosa y ácido siálico (62,63). Por otro lado, Crane et al. (65), demostraron que las fucosas presentes en los OLH inhiben la adhesión de la toxina termoestable de E. coli (STa) a sus receptores intestinales. En un estudio más reciente Morrow y Rangel (57) también demostraron la importancia de los OLH fucosilados, en la prevención de diarrea por Campilobacter jejuni, calicivirus y ETEC, en infantes neonatos alimentados con leche materna. Los estudios anteriores dejan en claro la importancia de los OLH en la prevención de la infección, durante las primeras etapas de la vida. Sin embargo, la disponibilidad de OLH es extremadamente limitada ya que únicamente se sintetizan en la leche de la madre durante la etapa de lactación (56). Es por ello que la búsqueda de alternativas prebióticas es constante. Debido a que los oligosacáridos presentes en la leche de otros mamíferos no son tan abundantes como los de la leche humana, su obtención industrial es limitada (66). Efectos de GOS y FOS sobre infecciones diarreicas Una alternativa industrialmente factible para la prevención y tratamiento de diarreas es el uso de oligosacáridos prebióticos de origen vegetal o industrial. Sin embargo, los estudios experimentales desarrollados son escasos y se limitan casi exclusivamente a probar inulina y FOS (Tabla 1). Los patógenos estudiados han sido Salmonella enteritidis, Candida albicans, Listeria monocytogenes y Salmonella tiphymurium, entre otros. En infecciones por Salmonella enteritidis inducidas en ratas el grupo de Ten-Bruggencate et al. (67), encontraron que el efecto protector del prebiótico contra Salmonella, dependió del suplemento adecuado de calcio. Por otro lado, en infecciones provocadas en ratones, el grupo de Buddington et al. (68), probaron que la inulina y los FOS son efectivos en reducir el número de C. albicans viable en el intestino. Además, observaron que el tratamiento previo con prebióticos redujo significativamente la mortalidad de los ratones infectados con L. monocytogenes. Lo mismo ocurrió con aquellos infectados con S. typhimurium, en los que también se obtuvieron indicios de una disminución de la adhesión de Salmonella en el intestino (68). A pesar de los resultados prometedores con modelos animales, no existen reportes que asocien a los prebióticos con el tratamiento exitoso en pacientes con diarrea. Esto es particularmente cierto para aquellas poblaciones con diarrea asociada a la administración de antibióticos o a la inflamación intestinal crónica. En diarreas por Clostridium difficile asociadas a tratamiento de antibióticos, la administración de FOS (12 g/día), no disminuyó la incidencia de diarreas, pero si el índice de recaídas (8% vs 34%, p < 0.001), en los pacientes que consumieron este tipo de carbohidratos. Sin embargo, esta misma dosis no fue efectiva en ancianos con el mismo tipo de diarrea (69-71). En pacientes con diarrea por inflamación intestinal crónica, se observaron efectos adversos (flatulencia, dolor abdominal) después del suministro de prebióticos. Los resultados anteriores pueden estar relacionados con la alteración de la MI que generalmente se presenta en este tipo de pacientes (bajas cuentas de L y B) y con la dosis de prebiótico suministrada (72). En lo que se refiere a la prevención de diarreas, Cummings et al. (73) llevaron a cabo un estudio controlado al azar con 244 personas para relacionar el consumo de 10 g/ día de prebióticos, con la prevención de la diarrea del viajero. Los resultados indican que los individuos que consumieron inulina-FOS, experimentaron ataques de diarrea menos frecuentes y menos severos que los individuos que consumieron el placebo. Estos resultados pudieran estar indicando que el consumo del prebiótico requiere de un cierto plazo para ejercer un efecto positivo sobre la diarrea. En el año 2000, se introdujeron en la Unión Europea fórmulas infantiles que contienen una combinación prebiótica (0.8 g/100 mL) de 10% inulina (o FOS), 90% GOS. No se han observado efectos adversos de estas fórmulas después de varios estudios realizados en fechas posteriores a la introducción en el mercado de estos productos. Por el contrario, los resultados indican un considerable aumento en la bifidogénesis y en la producción de AGCC de los bebés, después de 28 días de consumo de la fórmula. Este comportamiento fue similar al de los niños alimentados con leche materna (47,74-77). Con el consumo de estas fórmulas se reporta en el lactante una reducción de las alergias y de la incidencia de infecciones intestinales y respiratorias (78). En otras investigaciones se demostró además, una disminución en el contenido de patógenos, del pH intestinal y un mayor nivel de IgA secretora (79-81). También se observaron efectos moderadamente laxantes, adecuado balance de agua y mejoras en la barrera intestinal (77, 82-84). En un estudio prospectivo controlado al azar, realizado durante el primer año de vida, se observó que, en aquellos niños que recibieron fórmula con la mezcla inulina: GOS durante el primer año de vida, la incidencia de infecciones gastrointestinales y respiratorias fue estadísticamente menor a la de aquellos que recibieron un placebo. En niños destetados se ha observado que el consumo de FOS (3g/día o 2g/día, ambos durante 3 semanas) tuvo un efecto directo en la disminución de episodios de fiebre y diarrea (80,85-87). Sin embargo, otros estudios no muestran una reducción significativa de diarrea en niños, ya sea infecciosa o asociada al tratamiento de antibióticos (71, 86). En general los estudios realizados hasta el momento, tanto en animales como en humanos, requieren de más elementos para probar la efectividad de inulina, FOS y GOS, sobre las infecciones enterobacterianas. Es importante enfocarlos también hacia 1) conocer los posibles mecanismos bioquímicos por los cuales se lleva a cabo la acción preventiva; 2) saber el tipo, la dosis y el grado de polimerización de oligosacáridos necesarios para provocar una respuesta positiva; 3) estudiar la posible acción de los prebióticos como inmunomoduladores a nivel luminal y sistémico, y 4) y su efecto sobre diferentes grupos inmunocomprometidos donde la MI se encuentra alterada. Otro aspecto muy importante y que ha sido descuidado, es el estudio de la capacidad de los FOS y GOS para mimetizar a los receptores naturales de los patógenos. Como se mencionó anteriormente, varios enteropatógenos poseen adhesinas en su superficie las cuales reconocen a los oligosacáridos de las células intestinales (62,63). Este reconocimiento permite que el patógeno pueda adherirse al intestino para posteriormente infectar a la célula (57). Si el prebiótico mimetiza a los oligosacáridos de las células intestinales, podrá ser reconocido por las adhesinas, evitando la unión patógeno-intestino y previniendo subsecuentemente, la infección (Figura 2). Un oligosacárido puede mimetizar a otro cuando existe similitud en sus estructuras químicas (57,61,88,89). Lo anterior debido a que las interacciones proteína carbohidrato son altamente específicas (88). Los oligosacáridos de la leche humana presentan dicha similitud y por ello evitan la adhesión de los patógenos al intestino del infante (63-65). Al respecto hay que considerar que las estructuras de los OLH son mucho más complejas que las de los FOS y GOS (57). Además, estos últimos carecen de fucosa y de ácido siálico necesarios, en muchos casos, para que los enteropatógenos reconozcan a las células del intestino. Sin embargo, la galactosa también es importante en este tipo de uniones (Tabla 2). Varias adhesinas microbianas son específicas para galactosa, aunque la afinidad de la interacción aumenta, al estar presente un ácido siálico (61,62). Al momento, existe solo un estudio que revela que los GOS (prebióticos galactosilados) son capaces de inhibir in vitro, la adhesión de E. coli enteropatogénica a células HEp-2 y Caco-2 (90). Esto indica que al menos estos oligosacáridos pueden tener propiedades antiadhesivas contra los patógenos intestinales. Entonces, la combinación de GOS (análogo que puede mimetizar a oligosacáridos de la célula intestinal) con inulina y/o FOS (prebióticos con mayor efecto bifidogénico), puede lograr un efecto sinérgico que sea más efectivo contra enteropatógenos importantes (91). Lo anterior concuerda con los resultados de las investigaciones mencionadas. El interés por obtener una leche con factores de protección similares a los de la leche humana, ha promovido la adición de diferentes componentes a las leches de fórmula, entre ellos, las mezclas de GOS:FOS. Los resultados en el campo de la prevención de diarreas son prometedores. Sin embargo, deben tenerse cuidados especiales durante la fabricación y reconstitución de las fórmulas infantiles, para evitar contaminaciones que puedan afectar seriamente a la salud del infante. Se ha demostrado de manera convincente que las fórmulas infantiles son, tanto desde el punto de vista epidemiológico como microbiológico, el vehículo y la fuente de infecciones en los lactantes, provocadas por Salmonella y Enterobacter sakazakii (92-95). Ambas son causantes de enfermedades en los lactantes, por ejemplo, infecciones sistémicas, enterocolitis necrotizante y diarrea grave (96-99). La presencia de estos microorganismos se puede producir como consecuencia de: a) contaminación por medio de ingredientes no sometidos a tratamiento térmico durante el proceso de fabricación (procesos de mezcla en seco y combinado) y b) contaminación a partir del entorno de elaboración durante las fases secas del proceso, posteriores al tratamiento (93, 96). Para evitar este tipo de contaminaciones y otras de origen químico en las fórmulas infantiles que contengan GOS: FOS, es necesario seguir las buenas prácticas de manufactura y las recomendaciones de los Organismos de las Naciones Unidas relacionados con la salud y la alimentación (100). Estas mismas recomendaciones deben de seguirse para todos los alimentos que contengan oligosacaridos prebióticos, tanto los diseñados para poblaciones con riesgo de enfermedades in testinales (ancianos, infantes, personas con inflamación intestinal crónica, etc), como adultos y jóvenes sanos. Éste es uno de los requisitos para garantizar el fin de la adición de los prebióticos a los alimentos: mantener y/o mejorar la salud del consumidor (57). Se requiere también de investigaciones más profundas, para determinar las dosis, frecuencia y condiciones de salud en las que los oligosacáridos prebióticos de origen vegetal o industrial puedan actuar efectivamente en la prevención de las diarreas de origen infeccioso. CONCLUSIONES Las diarreas provocadas por infecciones gastrointestinales son causa importante de morbilidad y mortalidad en todo el mundo. Una estrategia para reducir su incidencia o para acortar sus periodos de duración puede ser la modulación de la microflora intestinal a través del consumo de prebióticos. Al respecto existen resultados prometedores en la experimentación con animales. En humanos sanos se ha demostrados además, que estos prebióticos disminuyen la incidencia de infecciones intestinales de manera dosis y tiempo de consumo dependiente. Sin embargo, existe controversia en estudios en personas con una microflora intestinal alterada, como ancianos, personas con problemas crónicos de inflamación intestinal y personas con diarreas asociadas a antibióticos, donde los resultados en prevención de diarreas no son concluyentes. AGRADECIMIENTO Al Consejo Nacional de Ciencia y Tecnología (CONACYT) de México por sus apoyos a la beca del primer autor y al proyecto CB-2007 82985. REFERENCIAS 1. Fric P. Probiotics and prebiotics renaissance of a therapeutic principle. Cen Eur J Med 2007; 2(3):237-270. [ Links ] 2. Berg RD. The indigenous gastrointestinal microflora. Trends in Microbiol 1996; 4:430-435. [ Links ] 3. Blaut M, Clavel T. Metabolic diversity of the intestinal microbiota: implications for health and disease J Nutr 2007; 137: S751-S755. [ Links ] 4. Swidsinski A, Ladhoff A, Pemthaler A, Swidsinski S, Loening-Baucke V, Ortner M, et al. Mucosal flora in inflammatory bowel disease. Gastroenterology 2002; 122:44-54. [ Links ] 5. Collins MD, Gibson GR. Probiotics, prebiotics, and symbiotics: approaches for modulating the microbial ecology of the gut. Am J Clin Nutr 1999; 69:S1052-S1057. [ Links ] 6. Gibson GR. Dietary modulation of the human gut microflora using the prebiotics oligofructose and inulin. J Nutr 1999; 129(7):S1438-S1441. [ Links ] 7. Macfarlane GT, Steed H, Macfarlane S. Bacterial metabolism and health-related effects of galacto-oligosaccharides and other prebiotics. J Appl Microbiol 2007; 1:40-47. [ Links ] 8. Guarner F. Studies with inulin-type fructans on intestinal infections, permeability, and inflammation. J Nutr 2007; 137:S2568-S2571. [ Links ] 9. Wilks M. Bacteria and early human development. Early Hum Dev 2007; 83:165-170. [ Links ] 10. Nicholson JK, Holmes E, Wilson ID. Gut microorganisms, mammalian metabolism and personalized health care. Nature Rev Microbiol 2005; 3: 1-8. [ Links ] 11. Cummings JH, Stephen AM. Carbohydrate terminology and classification. Eur J Clin Nutr 2007; 61:S5-S18. [ Links ] 12. Gibson GR, Probert HM, van Loo J, Rastall RA, Roberfroid M. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev 2004; 17:259-275. [ Links ] 13. Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr 1995; 125:1401-1412. [ Links ] 14. Bouhnik Y, Raskine L, Simoneau G, Vicaut E, Neut C, Flourie, et al. The capacity of nondigestible carbohydrates to stimulate fecal bifidobacteria in healthy humans: a double-blind, randomized, placebo-controlled, parallel-group, dose-response relation study. Am J Clin Nutr 2004; 80:1658-1664. [ Links ] 15. Gibson GR, Beatty ER, Wang X, Cummings JH. Selective stimulation of bifidobacteria in the human colon by oligofructose and inulin. Gastroenterol 1995; 108:975-982. [ Links ] 16. Forchielli ML., Walker WA. The effect of protective nutrients on mucosal defense in the immature intestine. Acta Paediatr 2005; 94:74-83. [ Links ] 17. Cummings JH, Englyst H. Fermentation in the human large intestine and the available substrates. Am J Clin Nutr. 1987; 45:1243-1255. [ Links ] 18. Marcil V, Delvin E, Seidman E, Poitras L, Zoltowska M, Garofalo C, et al. Modulation of lipid synthesis, apolipoprotein biogenesis and lipoprotein assembly by butyrate. Am J Physiol Gastrointest Liver Physiol. 2002; 283:G340-G346. [ Links ] 19. Emenaker NJ, Calaf GM, Cox D, Basson MD, Qureshi N. Short-chain fatty acids inhibit invasive human colon cancer by modulating uPA, TIMP-1, TIMP-2, Mutant p53, Bcl-2, Bax, p21 and PCNA protein expression in an in Vitro cell culture model. J Nutr 2001; 131:S3041-S3046. [ Links ] 20. Isolauri E, Salminen S, Ouwehand AC. Microbial-gut interactions in health and disease. Probiotics. Best Pract Res Clin Gastroenterol 2004; 18(2): 299-313. [ Links ] 21. Stahl B, Thurl S, Zeng J, Karas M, Hillenkamp F, Steup M, et al. Oligosaccharides from milk as revealed by matrix-assisted laser desorption/ionization mass spectrometry. Anal Biochem 1994; 223:218-226. [ Links ] 22. Boehm G, Stahl B. Oligosaccharides from milk. J Nutr 2007; 3:S847-S849. [ Links ] 23. Kunz C, Rudloff S, Baier W, Klein N, Strobel, S. Oligosaccharides in human milk: structural, functional, and metabolic aspects. Ann Rev Nutr 2000; 20:699-722. [ Links ] 24. Dai D, Walker WA. Protective nutrients and bacterial colonization in the immature human gut. Adv Pediatr 1999; 46:353-382. [ Links ] 25. Manning TS, Gibson R. Prebiotics. Best Pract Res Clin Gastroenterol 2004; 18(2):287-98. [ Links ] 26. Engfer MB, Stahl B, Finke B, Sawatzki G, Daniel H. Human milk oligosaccharides are resistant to enzymatic hydrolysis in the upper gastrointestinal tract. Am J Clin Nutr 2000;71:1589–1596. [ Links ] 27. Gnoth MJ, Kunz C, Kinne-Saffran E, Rudloff S. Human milk oligosaccharides are minimally digested in vitro. Jf Nutr 2000; 130:3014–3020. [ Links ] 29. Petschow BW, Talbott RD. Growth promotion of Bifidobacterium species by whey and casein fractions from human and bovine milk. J Clin Microbiol 1990; 28:287-292. [ Links ] 29. Coppa GV, Bruni S, Morelli L, Soldi S, Gabrielli O. The first prebiotics in humans: Human milk oligosaccharides. J Clin Gastroenterol 2004; 38(6 Suppl):S80-83. [ Links ] 30. Bode L, Kunz C, Muhly-Reinholz M, Mayer K, Seeger W, Rudloff S. Inhibition of monocyte, lymphocyte, and neutrophil adhesion to endothelial cells by human milk oligosaccharides. Thromb Haemost 2004; 92:1402–1410. [ Links ] 31. Bode L, Rudloff S, Kunz C, Strobel S, Klein N. Human milk oligosaccharides reduce platelet–neutrophil complex formation leading to a decrease in neutrophil X2 integrin expression. J Leukocyte Biol 2004; 76:1–7. [ Links ] 32. Kannagi R. Regulatory roles of carbohydrate ligands for selectins in the homing of lymphocytes. Curr Opin Struc Biol 2002; 12:599–608. [ Links ] 33. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118(2):511-521. [ Links ] 34. Dicksved J, Floistrup H, Bergstrom A, et al. Molecular fingerprinting of the fecal microbiota of children raised according to different lifestyles. Appl Environ Microbiol 2007; 73(7):2284-2289. [ Links ] 35. Mitsuoka T. Intestinal flora and aging. Nutr Rev 1992; 50(12):438-446. [ Links ] 36. Sartor R, Muehlbauer M. Microbial host interactions in IBD: implications for pathogenesis and therapy. Curr Gastroenterol Rep 2007; 9:497-507. [ Links ] 37. Lindsay JO, Whelan K, Stagg AJ, Gobin P, Al-Hassi HO, Rayment N, et al. Clinical, microbiological, and immunological effects of fructo-oligosaccharides in patients with Crohns disease. Gut 2006; 55:348-355. [ Links ] 38. Moreau NM, Martin LJ, Toquet CS, Laboisse CL, Nguyen PG, Siliart BS, et al. Restoration of the integrity of rat caeco-colonic mucosa by resistant starch, but not by fructo-oligosaccharides, in dextran sulphate sodium-induced experimental colitis. British J Nutri. 2003; 90:75-85. [ Links ] 39. Delzenne NM. Oligosaccharides: state of the art. Proc Nutr Soc 2003; 62:177-182. [ Links ] 40. Roberfroid M. Prebiotic: the concept revisited. J Nutr 2007; 137:S830-S837. [ Links ] 41. Macfarlane S, Macfarlane GT, Cummings JH. Prebiotics in the gastrointestinal tract. Alim Pharm Ther 2006; 24:701-714. [ Links ] 42. Tuohy KM, Ziemer CJ, Klinder A, Knobel Y, Pool-Zobel BL, Gibson GR. A human volunteer study to determine the prebiotic effects of lactulose powder on human colonic microbiota. Microb Ecol Health Dis 2002; 14: 165-173. [ Links ] 43. Playne MJ, Crittenden RG. Commercially available oligosaccharides. Bull Int Dairy Fed 1996; 313:10-22. [ Links ] 44. Crittenden RG, Playne MJ. Production, properties and applications of food grade oligosaccharides. Trends Food Sci Technol 1994; 7:353-361. [ Links ] 45. Biedrzycka E, Bielecka M. Effectiveness of fructans of different degrees of polymerization. Trends Food Sci Technol 2004; 15:170-175. [ Links ] 46. Gibson GR. Prebiotics as gut microflora management tools. J Clin Gastroenterol. 2008; 42:S75-S79. [ Links ] 47. Haarman M, Knol J. Quantitative real-time PCR assays to identify and quantify fecal Bifidobacterium species in infants receiving a prebiotic infant formula. Appl Enviro Microbio. 2005; 71(5):2318-24. [ Links ] 48. Rycroft CE, Jones MR, Gibson GR, Rastall RA. A comparative in vitro evaluation of the fermentation properties of prebiotic oligosaccharides. J Appl Microbiol 2001; 91(5):878-887. [ Links ] 49. Boehm G, Jelinek J, Stahl B, van Laere K, Knol J, Fanaro S. Prebiotics in infant formulas. J Clin Gastroenterol 2004; 38:S76-S79. [ Links ] 50. Casburn-Jones AC, Farthing MJ. Management of infectious diarrhea. Gut 2004; 53:296-305. [ Links ] 51. Black RE, Morris SS, Bryce J. Where and why are 10 million children dying every year? Lancet 2003; 361:2226-2234. [ Links ] 52. Vandenplas Y, Salvatore S, Viera M, Devreker T, Hauser B. Probiotics in infectious diarrhea in children: are they indicated. Eur J Pediatr 2007; 166:211-1218. [ Links ] 53. Kunz C, Rudloff, S. Potential anti-inflammatory and anti-infectious effects of human milk oligosaccharides. Adv Exp Med Biol 2008; 606:455-465. [ Links ] 54. Kunz C, Rudloff S. Health promoting aspects of milk oligosaccharides. Int Dairy J 2006; 16(11):1341-1346. [ Links ] 55. Jones G, Steketee RW, Black RE, Bhutta Z, Morris S. How many child deaths can we prevent this year? Lancet 2003; 362:65-71. [ Links ] 56. Hamosh M. Bioactive factors in human milk. Pediatr Clin North Am 2001; 48:69-86. [ Links ] 57. Morrow AL, Rangel JM. Human milk protection against infectious diarrhea: implications for prevention and clinical care seminars in pediatric infectious diseases. Sem Pediatr Infect Dis. 2004; 15:221-228. [ Links ] 58. Cleary TG. Human milk protective mechanisms. Adv Exp Med Biol 2004; 554:145-154. [ Links ] 59. Wang B, Brand-Miller J. The role and potential of sialic acid in human nutrition. Eur J Clin Nutr 2003; 57:1351-1369. [ Links ] 60. Fanaro S, Vigi V. Which role for prebiotics at weaning? J Clin Gastroenterol 2008; 42:S209-S213. [ Links ] 61. Heithoff DM, Conner CP, Mahan MJ. Dissecting the biology of a pathogen during infection. Trends Microbiol 1997; 12:509-513. [ Links ] 62. Sharon N. Carbohydrates as future anti-adhesion drugs for infectious diseases. Bioch Bioph Acta 2006; 1760(4):527-537. [ Links ] 63. Ofek I, Sharon N. Adhesins as lectins: specificity and role in infection. Curr Top Microbiol Immunol 1990; 151:91-113. [ Links ] 64. Martin-Sosa S, Martin MJ, Hueso P. The sialylated fraction of milk oligosaccharides is partially responsible for binding to enterotoxigenic and uropathogenic Escherichia coli human strains. J Nutr. 2002; 132(10): 3067-3072. [ Links ] 65. Crane JK, Azar S, Stam A, Newburg D. Oligosaccharides from human milk block binding and activity of the Escherichia coli heat-stable enterotoxin (STa) in T84 intestinal cells. J Nutr 1994; 12:2358-2364. [ Links ] 66. Bode L. Recent advances on structure, metabolism and function of human milk oligosaccharides. J Nutr 2006; 136:2127-30. [ Links ] 67. Ten Bruggencate SJ, Bovee-Oudenhoven IM, Lettink-Wissink M, Van der Meer R. Dietary fructo-oligosaccharides dose-dependently increase translocation of salmonella in rats. J Nutr 2003; 133(7):2313-2318. [ Links ] 68. Buddington KK, Donahoo JB, Buddington RK. Dietary oligofructose and inulin protect mice from enteric and systemic pathogens and tumor inducers. J Nutr 2002; 132:472-477. [ Links ] 69. Lewis S, Burmeister S, Brazier J. Effect of the prebiotic oligofructose on relapse of Clostridium difficile associated diarrhoea: a randomized, controlled study. Clin Gastroenterol Hepatol 2005; 3:442-448. [ Links ] 70. Lewis S, Burmeister S, Cohen S, Brazier J, Awathi A. Failure of dietary oligofructose to prevent antibiotic-associated diarrhoea. Alim Pharm Ther 2005; 21:469-477. [ Links ] 71. Brunser O, Gotteland M, Cruchet S, Figueroa G, Garrido D, Steenhout P. Effect of milk formula with prebiotics on the intestinal microbiota of infants after an antibiotic treatment. Pediatr Res 2006; 59:451-456. [ Links ] 72. Vrese M, Marteau P. Probiotics and prebiotics: effects on diarrhea. J Nutr 2007; 137:S803–S811. [ Links ] 73. Cummings JH, Christie S, Cole TJ. A study of fructo-oligosaccharides in the prevention of travellers diarrhoea. Alimen Pharmacol Ther 2001; 8: 1139-1145. [ Links ] 74. Haarman M, Knol J. Quantitative real-time PCR analysis of fecal Lactobacillus species in infants receiving a prebiotic infant formula. Appl Environ Microbiol 2006; 72:2359–65. [ Links ] 75. Knol J, Boehm G, Lidestri M, Negretti F, Jelinek J, Agosti M, et al. Increase of faecal bifidobacteria due to dietary oligosaccharides induces a reduction of clinically relevant pathogen germs in the faeces of formula-fed preterm infants. Acta Paediatr 2005; 94:S31–S33. [ Links ] 76. Knol J, Scholtens P, Kafka C, Wells J. Colon microflora in infants fed formula with galacto- and fructo-oligosaccharides: more like breast-fed infants. J Pediatr Gastroenterol Nutr 2005; 40:36–42. [ Links ] 77. Moro G, Minoli I, Mosca M, Fanaro S, Jelinek J, Stahl B, et al. Dosage-related bifidogenic effects of galacto- and fructooligosaccharides in formula-fed term infants. J Pediatric Gastroenterol Nutr 2002; 34:291–295. [ Links ] 78. ESPGHAN Committee on Nutrition. Prebiotic oligosaccharides in dietetic products for infants: a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr 2004; 39:465-473. [ Links ] 79. Bakker-Zierikzee AM, Tol E, Kroes H, Alles MS, Kok FJ, Bindels JG. 2006. Faecal SIgA secretion in infants fed on prebiotic infant formula. Pediatr Allergy Immunol 2006; 17:134-140. [ Links ] 80. Moore N, Chão C, Yang LP, Storm H, Oliva-Hemker M, Saavedra JM. Effects of fructo-oligosaccharide-supplemented infant cereal: a doubleblind, randomized trial. British J Nutr 2003; 90:581–587. [ Links ] 81. Oli MW, Petschow BW, Buddington RK. Evaluation of fructooligosaccharide supplementation of oral electrolyte solutions for treatment of diarrhoea (recovery of the intestinal bacteria). Dig Dis Sci 1998; 43:138-47. [ Links ] 82. Francavilla R, Castellaneta S, Masciale A, Straziuso S, Polimeno L, Gagliardi F, Boehm G, Miniello V. Intestinal permeability and faecal flora of infants fed with prebiotic supplemented formula: a double blind placebo controlled study. J Pediatric Gastroenterol Nutr 2006; 42:PN2–PN21. [ Links ] 83. Mihatsch WA, Hoegel J, Pohlandt F. Prebiotic oligosaccharides reduce stool viscosity and accelerate gastrointestinal transport in preterm infants. Acta Paediatr 2006; 95:843-848. [ Links ] 84. Schmelzle H, Wirth S, Skopnik H, Radke M, Knol J, et al. Randomized double-blind study of the nutritional efficacy and bifidogenicity of a new infant formula containing partially hydrolyzed protein, a high beta-palmitic acid level, and nondigestible oligosaccharides. J Pediatr Gastroenterol Nutr 2003; 36:343–351. [ Links ] 85. Waligora-Dupriet AJ, Campeotto F, Nicolis I, Bonet A, Soulaines P, Dupont C, et al. Effect of oligofructose supplementation on gut microflora and well-being in young children attending a day care centre. Int J Food Microbiol 2007; 113:108–113. [ Links ] 86. Duggan C, Penny ME, Hibberd P, Gil A, Huapaya A, Cooper A, et al. Oligofructose-supplemented infant cereal: 2 randomized, blinded, community-based trials in Peruvian infants. Am J Clin Nutr 2003; 77: 937-942. [ Links ] 87. Saavedra J.M, Tschernia A. Human studies with probiotics and prebiotics: clinical implications. British J Nutr 2002; 87:S241–S246. [ Links ] 88. Shoaf K, Mulvey JL, Armstrong GL, Hutkins RW. Prebiotic galactooligosaccharides reduce adherence of enteropathogenic Escherichia coli to tissue culture cells. Infec Immun 2006; 74:6920-6928. [ Links ] 89. Sharon N, Lis H. The structural basis for carbohydrate recognition by lectins. Adv Exp Med Biol 2001; 491:1-16. [ Links ] 90. Ofek I, Hasty DL, Sharon N. Anti-adhesion therapy of bacterial diseases: prospects and problems. FEMS Immunol Med Microbiol 2003;38(3):181-191. [ Links ] 91. Fooks L, Gibson GR. In Vitro investigations of the effect of probiotics and prebiotics on selected human intestinal pathogens. FEMS Microbiol Ecology 2002; 1:67-75. [ Links ] 92. Usera MA, Rodriguez A, Echeita A, Cano R. Multiple analysis of a foodborne outbreak caused by infant formula contaminated by an atypical Salmonella virchow strain. Eur J Clin Microbiol Infect Dis 1998; 17(8):551-555. [ Links ] 93. OBrien S, Healy B, Negredo C, Anderson W, Fanning S, Iversen C. Prevalence of Cronobacter species (Enterobacter sakazakii) in follow-on infant formulae and infant drinks. Lett Appl Microbiol. 2009; 48(5):536-541. [ Links ] 94. Fiore A, Casale M, Aureli P. Enterobacter sakazakii: epidemiology, clinical presentation, prevention and control. Ann Ist Super Sanita 2008; 44(3):275-280. [ Links ] 95. Hunter CJ, Petrosyan M, Ford HR, Prasadarao NV. Enterobacter sakazakii: an emerging pathogen in infants and neonates. Surg Infect (Larchmt) 2008; 9(5):533-539. [ Links ] 96. OBrien S, Healy B, Negredo C, Anderson W, Fanning S, Iversen C. Prevalence of Cronobacter species (Enterobacter sakazakii) in follow-on infant formulae and infant drinks. Lett Appl Microbiol. 2009; 48(5):536-541. [ Links ] 97. Cahill SM, Wachsmuth IK, Costarrica Mde L, Ben Embarek PK. Powdered infant formula as a source of Salmonella infection in infants. Clin Infect Dis. 2008 Jan 15; 46(2):268-273. [ Links ] 98. Jones TF, Ingram LA, Fullerton KE, Marcus R, Anderson BJ, McCarthy PV, et al. A case-control study of the epidemiology of sporadic Salmonella infection in infants. Pediatrics. 2006; 118(6):2380-2387. [ Links ] 99. Lai KK. Enterobacter sakazakii infections among neonates, infants, children, and adults. Medicine 2001;80: 113-122.