Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Puericultura y Pediatría
versión impresa ISSN 0004-0649
Arch Venez Puer Ped v.73 n.4 Caracas dic. 2010
APROXIMACIÓN AL DIAGNÓSTICO Y TRATAMIENTO DE MENINGITIS POR MICROORGANISMOS POCO FRECUENTES
Luigina Siciliano Sabatela (1), Ivelisse Natera Alvizu (2), Lourdes Morillo Gimón (3), Roque Antonio Aouad Tórrez (4)
(1) Infectólogo Pediatra . Servicio de Infectología. Hospital de Niños JM de los Ríos. Caracas, Venezuela. Profesora de Pediatría. Escuela de Medicina JM Vargas. Universidad Central de Venezuela luigina.siciliano@gmail.com
(2) Infectólogo Pediatra. Profesora de Pediatría. Escuela de Medicina Luis Razetti. Universidad Central de Venezuela urdanetanatera@cantv.net
(3) Infectólogo Pediatra. Servicio de Medicina II. Hospital de Niños JM de los Ríos. Caracas, Venezuela lourdes_morillo@hotmail.com
(4) Infectólogo Pediatra. Clínica Lugo, Maracay. Estado Aragua, Venezuela atra1962@gmail.com Autor corresponsal: Luigina Siciliano Sabatela luigina.siciliano@gmail.com
RESUMEN
La adecuada evaluación de pacientes pediátricos con meningitis debe considerar la posibilidad de infección por microorganismos poco frecuentes, principalmente virus Herpes simplex, que causa enfermedad aguda, y otros patógenos con evolución clínica prolongada, tales como Mycobacterium tuberculosis, Candida spp y Cryptococcus spp. Aunque la mayoría de estas infecciones son más comunes en pacientes con inmunosupresión, también se producen en personas previamente sanas. La dificultad para el diagnóstico diferencial inicial está relacionada con la similitud en los hallazgos clínicos y los parámetros básicos de líquido cefalorraquídeo. En consecuencia, la aproximación al diagnóstico etiológico requiere de un alto índice de sospecha y un análisis minucioso de síntomas y signos, datos epidemiológicos y antecedentes médicos. La terapia antimicrobiana precoz disminuye el riesgo de secuelas neurológicas y muerte, por lo tanto, debe comenzarse tan pronto aparezcan evidencias sugestivas de la infección, aun sin tener los resultados de las pruebas específicas para confirmación del diagnóstico.
Palabras clave: meningoencefalitis herpética, tuberculosis meníngea, candidiasis meníngea, criptococosis meníngea.
SUMMARY
Appropriate assessment of pediatric patients with meningitis should consider the possibility of infection with uncommon microorganisms, mainly herpes simplex virus, which causes acute disease and other pathogens with prolonged clinical course, such as Mycobacterium tuberculosis, Candida spp and Cryptococcus spp. Although most of these infections are more common in immunosuppressed patients, they also may occur in previously healthy individuals. The difficulty for the initial differential diagnosis is related to the similarity in clinical findings and basic parameters of cerebrospinal fluid. Consequently, the approach to etiologic diagnosis requires a high index of suspicion and a careful analysis of signs and symptoms, epidemiological data and medical history. Early antimicrobial therapy reduces the risk of neurological sequelae and death, therefore, it should be initiated as soon as evidence suggestive of infection appears, even without the results of specific tests to confirm the diagnosis.
Keywords: Herpetic meningoencephalitis, meningeal tuberculosis, meningeal candidiasis, meningeal cryptococcosis
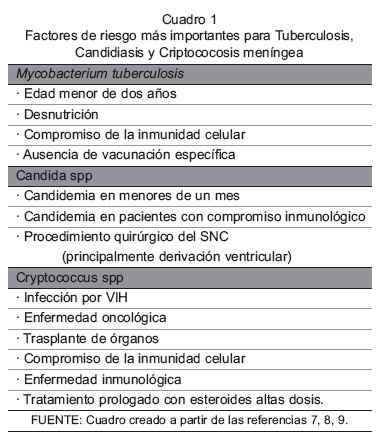
La identificación precoz de la infección meníngea y la aproximación temprana al diagnóstico etiológico (1,3) constituyen la clave para la indicación oportuna de la terapia antimicrobiana específica, la cual influye favorablemente sobre el pronóstico del paciente (4,5). En la mayoría de los casos pediátricos se requiere diferenciar entre infección bacteriana por Streptococcus pneumoniae, Neisseria meningitidis y Haemophilus influenzae tipo b (1,2) o infección viral, principalmente por enterovirus (3). La dificultad para el diagnóstico diferencial entre ambos escenarios se relaciona a diferentes factores entre los cuales se debe señalar la variabilidad de las alteraciones del Líquido Cefalorraquídeo (LCR) -bien sea por infección incipiente, tratamiento antibiótico previo o punción lumbar traumática-; al inadecuado procesamiento de cultivos bacteriológicos y a la limitada disponibilidad de pruebas para identificación de virus por técnicas de biología molecular (1-3). La complejidad en la interpretación de los hallazgos se profundiza aún más, cuando se consideran otros microorganismos menos frecuentes, entre ellos el virus Herpes simplex, que causa enfermedad aguda (4) y otros patógenos, que usualmente presentan un curso clínico prolongado o crónico, tales como Mycobacterium tuberculosis, Candida spp y Cryptococcus spp (5). El compromiso del Sistema Nervioso Central (SNC) por estos microorganismos ocurre con mayor frecuencia en pacientes inmunocomprometidos (ver Cuadro 1), no obstante, también se presenta en pacientes previamente sanos y sin ninguna condición predisponente (6-9).
MENINGOENCEFALITIS HERPÉTICA
El virus Herpes simplex, al igual que otros virus de la familia Herpesviridae, tiene un especial tropismo por el SNC y ha sido relacionado con diferentes manifestaciones neurológicas, entre las que se encuentran meningitis, cuya evolución es benigna, y meningoencefalitis, que constituye la forma de presentación más grave de la enfermedad (6,10-14). Aunque la infección herpética ocurre con gran frecuencia, la complicación meníngea es considerada un evento poco común, en el cual no se han identificado factores predisponentes (6,10-12). Por lo general, la meningoencefalitis en pacientes con más de un mes de vida se debe al virus tipo 1, mientras que en los neonatos es más frecuente el tipo 2 (15,16).
El compromiso del SNC después del período neonatal generalmente se produce por vía hematógena (en infección primaria), pero también puede ocurrir por vía neuronal retrógrada, por lo general, en las recidivas (16,17). En los recién nacidos se produce por diseminación sistémica del virus, el cual es adquirido con mayor frecuencia durante el trabajo de parto (85%) por contacto con secreciones genitales de la madre. Sin embargo, también se ha descrito transmisión viral en el posparto (10%) de contactos en el hogar con lesiones activas de piel o mucosas (6,15). Cerca de un tercio de los casos de meningoencefalitis ocurre en pacientes menores de 20 años de edad, principalmente entre 6 meses y 3 años (11,13-15). La mayoría de los casos pediátricos se produce por infección primaria; en contraste, la enfermedad en adultos ocurre con gran frecuencia por reactivación del virus (10). El período de incubación de la infección herpética adquirida después del nacimiento varía entre 2 días y 2 semanas (6,16,17), mientras que en los neonatos con infección transmitida durante el nacimiento, es usual que los síntomas aparezcan en la segunda semana de vida (15,16).
Las manifestaciones clínicas no son específicas, por cuanto pueden encontrarse en meningoencefalitis por otros microorganismos (5,18-26). Los pacientes usualmente tienen historia de alteraciones de conciencia (97-100%), fiebre (90- 100%), cefalea (74-81%) y vómitos (57%); además, al momento del ingreso pueden presentar cambios de conducta (85- 87%), meningismo (65%), afasia (36-76%), ataxia (40%), hemiparesia (38-40%), convulsiones (38-62%), déficit de pares craneales (32%) y coma (31%) (10,11,14,17,19,20). Los episodios convulsivos pueden ser focales (65%), generalizados (23%) o de ambos tipos (12%) (10). Como pródromo de los hallazgos neurológicos, el 48% de los pacientes presenta síntomas respiratorios inespecíficos y en algunos casos también cursa con gingivoestomatitis (6). En el neonato, la asociación con lesiones de piel y mucosas o la presencia de afectación sistémica, solo ocurre en menos del 50% de los casos. Por tanto, cuando la meningoencefalitis se presenta con hepatitis, neumonitis u otras manifestaciones extrameníngeas, sin compromiso dermatológico, los hallazgos pueden confundirse con sepsis asociada a meningitis bacteriana (15,16).
Al igual que las manifestaciones clínicas, los hallazgos del LCR son muy similares a los encontrados en otras infecciones virales del SNC (3,4,6). El perfil característico incluye presión del LCR inicial normal o ligeramente alta, pleocitosis linfocitaria (<500 células/ml), proteínas normales o un poco elevadas y glucosa normal (6,15,27,28). También se ha reportado xantocromía o hematíes (26). No obstante, en el 5% de los pacientes con infección herpética los hallazgos licuorales pueden ser normales, principalmente en etapas tempranas de la enfermedad (12,15-20).
La detección del virus en el LCR mediante la técnica de Reacción en Cadena de Polimerasa (PCR -siglas en inglés-) constituye la prueba de elección para confirmar el diagnóstico; debido a su elevada sensibilidad (96-98%) y especificidad (94-99%), ha reemplazado a las pruebas diagnósticas utilizadas clásicamente, como el cultivo viral y la biopsia cerebral (20,27-29). Para la interpretación de los resultados obtenidos con esa técnica se requiere cautela, ya que pueden ocurrir falsos negativos, fundamentalmente cuando la muestra se obtiene en etapa temprana (primeras 24-48 horas) o tardía (después de 10-14 días) del curso de la enfermedad (26). Tales resultados también ha sido reportados en pacientes que cursan con alteraciones discretas del LCR (específicamente pleocitosis leve con <10 células/ml) (21) y en aquéllos que reciben terapia antiviral al momento de la toma de la muestra (15). Con la disponibilidad reciente de la PCR en tiempo real, mediante la cual es posible la cuantificación del virus, se han logrado algunas ventajas adicionales, tales como la obtención de resultados con mayor facilidad y rapidez, mayor precisión en el diagnóstico, incluso en los primeros días de evolución de la enfermedad, y la evaluación de la respuesta al tratamiento indicado (10,26,28). Aunque la medición de los anticuerpos específicos sintetizados en el espacio intratecal contribuye a la confirmación de la infección, su sensibilidad y especificidad son considerablemente más bajas cuando se compara con la PCR, por tanto, su valor diagnóstico es limitado (10).
Entre los estudios neurológicos por imágenes, como primera opción se recomienda la resonancia magnética cerebral, por cuanto tiene mayor sensibilidad y permite la identificación precoz de alteraciones (30). Cuando solo sea posible la realización de la tomografía computarizada de cráneo, debe considerarse que en los primeros días de evolución, el resultado puede ser normal (10,17,18,30). Entre los hallazgos más frecuentes destacan signos de edema focalizado con efecto de masa y signos de hemorragia, ambos ubicados en el lóbulo temporal o lóbulo frontal. En algunos casos, en especial, en neonatos y lactantes, pueden ocurrir alteraciones difusas, con compromiso de otras áreas, tales como lóbulo parietal, lóbulo occipital, zona periventricular y sistema límbico (10).
Aunque las alteraciones usualmente son asimétricas, en el 38% de los casos puede haber compromiso bilateral (30). El electroencefalograma reporta alteración en la mayoría de los pacientes (75-81%) (10,14,26). Entre los hallazgos más frecuentes, se señala actividad difusa lenta con descargas epileptiformes periódicas en lóbulos temporal y frontal. Aunque las alteraciones electroencefalográficas no son específicas, la focalización con compromiso unilateral de las áreas señaladas, debe sugerir el diagnóstico de infección herpética (10,14, 26).
El pronóstico de la enfermedad depende del momento en el cual se indica el tratamiento específico y de la edad del paciente (6,10,15,16,26,31-33). En este sentido, el riesgo de secuelas o de mortalidad es casi nulo, si la terapia antiviral se inicia en los primeros 4 días de enfermedad (31,32), mientras que es muy elevado cuando el paciente presenta trastornos significativos del sensorio cuando se inicia la terapéutica (6,25). El tratamiento con aciclovir intravenoso debe mantenerse por un tiempo mínimo de 21 días (ver tabla), por cuanto los esquemas más cortos han demostrado riesgo de recaídas (6,24,26,31-33). No obstante, independientemente del momento de inicio o la duración de la terapia, la evolución de la enfermedad en neonatos, es mucho más desfavorable y el riesgo de recurrencias es mayor (15, 16,32). La efectividad de la terapia supresiva con aciclovir oral para prevenir la reactivación del virus en estos pacientes constituye un aspecto controversial, y por tanto continúa siendo evaluado (6,15,16).
TUBERCULOSIS MENÍNGEA
La meningitis por Mycobacterium tuberculosis representa aproximadamente el 1% de las formas clínicas de la enfermedad (34). A pesar de su baja frecuencia, constituye la forma más grave, que aun con tratamiento específico, cursa con elevado riesgo de complicaciones (34). Al igual que otras formas de tuberculosis extrapulmonar, la meningitis se produce por diseminación hematógena, la cual puede ocurrir entre 2 y 6 meses después de la primoinfección (sobre todo en pacientes menores de 4 años de edad) o por reactivación después de varios años en pacientes que adquieren alguna condición inmunosupresora (35,36). Además de la meningitis o meningoencefalitis, el compromiso del SNC puede manifestarse como una lesión de ocupación de espacio, específicamente tuberculoma, el cual ocurre en forma aislada o concomitante con la afectación meníngea (37).
Entre los factores de riesgo descritos para la meningitis se encuentran: edad menor de 2 años, desnutrición, ausencia de vacunación específica e inmunosupresión celular, en particular infección por el VIH (ver cuadro) (7,38,39). Para el diagnóstico de meningitis tuberculosa se requiere la inclusión del mayor número de criterios posibles, entre los cuales se encuentran los datos epidemiológicos, las manifestaciones clínicas, la respuesta inmunológica del paciente, la identificación bacteriológica del microorganismo, los estudios por imágenes y en ocasiones los hallazgos de anatomía patológica (40).
La presencia del antecedente de contacto epidemiológico con un paciente con tuberculosis pulmonar activa (usualmente un adulto cercano) es un dato de enorme importancia que puede ser clave para dirigir el diagnóstico. No obstante, solo se logra en el 30-50% de los casos, y en muchas ocasiones se obtiene después de insistir reiteradamente en su búsqueda (41). Aunque la vacuna disminuye el riesgo de diseminación extrapulmonar del microorganismo, su efectividad máxima no supera el 80% (7).
La mayoría de los pacientes tiene manifestaciones de comienzo gradual que son muy similares a las encontradas en meningoencefalitis micóticas y en meningitis bacteriana parcialmente tratada (1-4). Por lo general, la evolución clínica progresa en tres estadios evolutivos (40). En el primero, que clásicamente dura entre 2 o 3 semanas, puede ocurrir malestar general, febrícula, cefalea intermitente, cambios del carácter o de conducta y alteraciones de la escolaridad. En el transcurso de las siguientes 2 semanas correspondientes al segundo estadio, aparecen algunos trastornos de conciencia (como confusión o somnolencia) y signos de afectación neurológica, tales como irritación meníngea o hipertensión intracraneana, la cual es reflejada por la presencia de cefalea más intensa, vómitos persistentes y parálisis de pares craneales. Por último, en el tercer estadio aparecen las manifestaciones neurológicas más graves como convulsiones o hemiparesia y se profundizan los cambios en el nivel de conciencia, que pueden llegar al estupor o coma, además de convulsiones y signos de focalización neurológica. Aunque en general la evolución es subaguda o crónica, en algunos pacientes, en especial, en los primeros años de la vida, la enfermedad puede presentarse también en forma aguda con deterioro abrupto y sin la presencia de los estadios clínicos definidos (35, 36). En estos casos, la rápida evolución de la enfermedad podría sugerir infección por bacterias piogénicas y por tanto, se dificultaría o retardaría el diagnóstico (1,2).
La respuesta inmune del paciente determinada mediante la prueba intradérmica, solo se logra evidenciar entre el 30% y 50% de los casos (42, 43). En este sentido, independientemente del antecedente de inmunización, cuando la prueba intradérmica sea positiva en un paciente con manifestaciones clínicas, el resultado debe ser atribuido a enfermedad y no a respuesta vacunal (35, 36). En los últimos años, se ha incorporado al diagnóstico de tuberculosis la cuantificación in vitro de la liberación de interferón gamma en respuesta a los antígenos del microorganismo. La ventaja de esta prueba radica básicamente en la mayor especificidad en relación a la intradermorreacción, sin los falsos positivos debidos a la vacuna (44).
Las alteraciones más frecuentes y características del LCR incluyen presión inicial elevada, pleocitosis moderada, usualmente ≤1000 células/ml con predominio de linfocitos, además de hipoglucorraquia e hiperproteinorraquia (34-36, 40- 43). En relación a la celularidad, también se ha descrito un predominio inicial de polimorfonucleares con conversión posterior a mononucleares en días o semanas (45). Igualmente, se ha señalado una respuesta paradójica durante la terapia, en la cual se presenta un viraje transitorio de predominio linfocitario a polimorfonuclear y, en forma muy ocasional al inicio de la enfermedad también se podría observar normalidad de los parámetros (45, 46). La presencia de hipoclorurorraquia no constituye un hallazgo significativo en la infección meníngea, por tanto no se incluye dentro de las alteraciones descritas en revisiones recientes (34-36, 39, 40- 43). La determinación de la actividad de la enzima Adenosina Deaminasa (ADA) con valores ≥10,5 UI/L puede tener gran utilidad para el diagnóstico, no obstante, su sensibilidad y especificidad no superan el 81% y 86% respectivamente. Por tanto, cualquier resultado requiere ser interpretado en conjunto con los demás hallazgos (47).
Debido a la baja carga bacilar de las formas extrapulmonares, las pruebas diagnósticas bacteriológicas del LCR poseen baja sensibilidad, por tanto su negatividad no puede excluir el diagnóstico. En este sentido es importante señalar que por tinción de Zielh Neelsen es posible detectar 100 bacilos por ml o más. Como consecuencia, la sensibilidad no supera el 20%, la cual puede mejorarse con el análisis de una muestra de 5 ml o más y con la visualización minuciosa por un tiempo mayor a 30 minutos (48). Aunque el aislamiento del bacilo mediante cultivo es la prueba que confirma el diagnóstico, su sensibilidad es relativamente baja (entre 25% y 70%); no obstante, podría mejorarse con el análisis de muestras cisternales o ventriculares (49). La detección del microorganismo por PCR permite un diagnóstico más rápido, con especificidad elevada cercana al 100%, aunque la sensibilidad es del 50% (40, 49).
En la valoración del paciente mediante estudios por imágenes, la radiografía simple del tórax puede mostrar patrones alterados hasta en el 50% de los casos (41, 50). La presencia de un infiltrado intersticial pulmonar micronodular (patrón miliar) traduce la existencia de tuberculosis diseminada y, por tanto, el riesgo de siembra hematógena a múltiples órganos (41, 50). Por otro lado, la tomografía axial computarizada de cráneo y la resonancia magnética nuclear cerebral, como métodos en la evaluación del SNC permiten evidenciar alteraciones como hidrocefalia, disminución del espacio subaracnoideo, obliteración de las cisternas basales, hiperdensidad basal y tuberculomas (37). La resonancia tiene la ventaja de detectar otras alteraciones como la presencia de vasculitis y precisar el tipo de hidrocefalia, este último hallazgo reportado en el 70% de los casos (51). La identificación de hidrocefalia no comunicante permite evaluar el riesgo de herniación que puede existir al realizar la punción lumbar (37, 51). En cuanto a la tomografía, la administración de contraste es un requisito para visualizar la mayoría de las alteraciones; sin embargo, se ha demostrado que el estudio simple también puede ser de utilidad para detectar la hiperdensidad basal, con una sensibilidad del 46% y especificidad del 100% (52).
La indicación de tratamiento específico precoz contribuye a mejorar el pronóstico de la enfermedad (35). En este sentido, se requiere inicio inmediato de la terapéutica cuando exista exposición reciente al microorganismo y hallazgos sugestivos de la enfermedad, aun sin tener la confirmación bacteriológica (7, 35). El inicio de la terapia también debería considerarse en pacientes que reúnan hallazgos clínicos, radiológicos y factores de riesgo para la adquisición o para la diseminación del microorganismo, aun cuando no se haya logrado definir el contacto epidemiológico o no se haya obtenido la identificación microbiológica del bacilo (7, 35).
El tratamiento antimicrobiano (Cuadro 2) requiere la administración de esquemas combinados que permitan la esterilización del LCR e impidan el desarrollo de resistencia antimicrobiana durante la terapia (7, 53-58). Aunque existen diferentes opciones terapéuticas, todas coinciden en dos fases de tratamiento. La recomendación para la primera fase incluye la administración diaria y por dos meses de isoniacida, rifampicina y pirazinamida en asociación de una droga adicional que puede ser etionamida, etambutol o estreptomicina (7, 53-58). La selección de la cuarta droga depende de la edad del paciente, de la penetración al SNC, los posibles efectos adversos, la disponibilidad del medicamento y de los patrones locales de resistencia (7, 57, 58). A pesar que etionamida y etambutol alcanzan mejores concentraciones en LCR, cuando exista dificultad para la terapia por vía oral, la estreptomicina sería la opción recomendada (7, 53-58). Por otro lado, cuando no se pueda realizar una adecuada evaluación oftalmólogica (tal como ocurre en pacientes menores de 4 años de edad) o cuando exista lesión del nervio óptico se recomienda etionamida o estreptomicina (58).
Para la segunda fase terapéutica, el esquema seleccionado debería basarse en la sensibilidad in vitro del microorganismo aislado (7,53,55-58), no obstante, como primera opción se recomienda continuar con isoniacida y rifampicina administradas dos o tres veces por semana y durante 7-10 meses, de manera de completar un mínimo de 9 a 12 meses de terapia total (53-58). La recomendación de esquemas más cortos que incluyan solo cuatro meses para la segunda etapa, únicamente se podrían justificar en pacientes inmunocompetentes, en quienes no exista evidencia de resistencia a los medicamentos, la evolución clínica haya sido favorable y se haya demostrado normalidad de los parámetros del LCR, particularmente la proteinorraquia (56). Como parte del seguimiento de los pacientes, también se debe mantener la monitorización de las eventuales reacciones no deseadas de los medicamentos indicados (7, 55-58).
A la par del tratamiento específico se requiere lograr el control de las complicaciones, en particular la hipertensión intracraneana, secundaria a edema cerebral o a hidrocefalia. Es fundamental el tratamiento con corticoesteroides (prednisona 1-2 mg/kg/día -máximo 60 mg/día- o dexametasona 0,6 mg/kg/día cada 6 horas -máximo 8 mg/día en pacientes con menos de 25 kg y 12 mg/día en pacientes con 25 kg o más-) durante 3 a 4 semanas, y en algunos casos, la indicación de acetazolamida o furosemida o incluso el tratamiento quirúrgico para el drenaje ventricular (7,57,59).
CANDIDIASIS MENÍNGEA
La candidiasis meníngea constituye la infección micótica más frecuente del SNC; el microorganismo se adquiere tanto por vía hematógena de un foco distante como por implantación directa durante una cirugía (60, 61). Cuando la enfermedad es debida a diseminación sistémica, usualmente se manifiesta como meningoencefalitis, mientras que cuando existe inoculación, la manifestación más frecuente es meningitis (62). Entre las formas de presentación de la infección en el SNC se incluyen abscesos y microabscesos cerebrales, estos últimos asociados a compromiso encefálico (60). Aunque la candidiasis meníngea ocurre con poca frecuencia, su incidencia en las últimas décadas ha mostrado una tendencia creciente, probablemente relacionada a la mayor expectativa de vida de los pacientes con enfermedad grave y, a la mayor frecuencia del diagnóstico de la enfermedad (60). Su pronóstico es muy desfavorable, en particular en pacientes inmunocomprometidos y neonatos prematuros, o en aquéllos con tratamiento antifúngico tardío (61,63).
Por lo general, la candidemia se origina desde el tracto digestivo, la piel o las membranas mucosas, por cuanto el microorganismo forma parte de la flora normal del humano (64). Entre los factores de mayor riesgo para originar candidiasis invasiva se encuentran el tratamiento antibiótico de amplio espectro, la nutrición parenteral total, la presencia de catéteres vasculares de larga permanencia, las quemaduras graves, la cirugía abdominal y las enfermedades o condiciones que predisponen a inmunosupresión, incluso el bajo peso al nacer (8,60,62). Los pacientes inmunocomprometidos con candidemia tienen riesgo elevado de presentar infección meníngea (ver cuadro) (8, 60). Aunque la inoculación directa ocurre principalmente durante la colocación de catéteres de derivación ventricular, también es posible durante otros procedimientos quirúrgicos más rutinarios, como la punción lumbar (65). Independientemente de la forma de ingreso del microorganismo, la candidiasis meníngea es considerada una infección de adquisición intrahospitalaria (61).
La evolución de la infección suele ser insidiosa y los hallazgos clínicos son inespecíficos (60). La forma de presentación típica incluye fiebre, dolor leve de cabeza o cuello y alteraciones del estado de conciencia que progresan en días o semanas (60,61). En ocasiones, la enfermedad también puede tener un comienzo agudo y evolución rápida con manifestaciones sugestivas de compromiso del SNC, tales como meningismo y fotofobia (60). Los hallazgos neurológicos focales ocurren con muy baja frecuencia y a veces puede presentarse solo fiebre, en especial en pacientes con escasa respuesta inflamatoria, como los inmunocomprometidos (60).
Cuando existe derivación ventricular, las manifestaciones de infección podrían ser básicamente signos de disfunción u obstrucción valvular (65-68). Aunque en neonatos la evolución clínica también es variable, los hallazgos son muy similares a los encontrados en otras infecciones sistémicas y, a veces, la dificultad respiratoria es relevante (60).
La punción lumbar puede evidenciar presión de inicio normal o ligeramente elevada, y en la celularidad se encuentra un recuento promedio de 500-600 células/ml con predomino de linfocitos, aunque a veces también predominan los neutrófilos (62-69). Además de la alteración citológica, también es frecuente observar hipoglucorraquia e hiperproteinorraquia (62,63,69). La dificultad del diagnóstico no solo radica en la baja especificidad de estas alteraciones, sino en su poca sensibilidad, por lo cual en algunos casos estos parámetros podrían encontrarse dentro de límites normales (62, 65). La visualización de levaduras en el frotis directo y el aislamiento microbiológico con mucha frecuencia son negativos (67), por tanto los resultados deben ser interpretados con cautela.
En muchos casos la confirmación de la infección se realiza mediante estudios de anatomía patológica posterior al deceso del paciente (65,68,69). Aunque el microorganismo puede recuperarse en medios de cultivos usuales para identificar bacterias, se recomienda un medio específico para hongos (68,69). Tomando en consideración que no siempre se encuentran alterados los parámetros citológicos o bioquímicos, la identificación del microorganismo en el LCR en ningún caso debería considerarse colonización (5). En los pacientes que presentan candidemia, principalmente los inmunocomprometidos y los neonatos, se requiere investigar el compromiso meníngeo, aun sin manifestaciones clínicas sugestivas de afectación neurológica (5,70).
En los estudios por imágenes del SNC, tanto la tomografía como la resonancia magnética nuclear, pueden mostrar hidrocefalia en el 20% de los pacientes con enfermedad sistémica y en el 36% de los pacientes con dispositivos de derivación ventricular (71). Entre las alteraciones que se pueden observar, principalmente después de la administración de contraste, se incluyen edema, lesión de ocupación de espacio y pequeñas áreas de necrosis o hemorragias, las cuales corresponden a microabscesos. Aunque estos hallazgos se podrían evidenciar con ambos estudios, la resonancia ha mostrado mayor sensibilidad para su visualización (5,72).
La primera opción para el tratamiento antifúngico es anfotericina B deoxicolato intravenosa (o en cualquiera de sus presentaciones) preferiblemente en asociación con flucitosina oral (ver tabla) (66-68,71,73). En algunas situaciones también podría asociarse anfotericina B intratecal (67). Cuando ocurra mejoría del paciente (tanto en las manifestaciones clínicas, como en las alteraciones del LCR) y después de un mínimo de dos semanas del inicio de la terapia, se podría continuar con fluconazol intravenoso a dosis altas (66, 68). Esta opción también podría indicarse desde el comienzo en pacientes que no toleren la anfotericina B deoxicolato y no se disponga de otras formulaciones del antifúngico, aunque existe mayor posibilidad de recaídas (66). La selección del mejor esquema para cada paciente también depende de la especie de Candida aislada, y en caso de estar disponible, del patrón de sensibilidad in vitro del microorganismo (66). En este sentido, se debe señalar que entre las cepas que se consideran resistentes al fluconazol se encuentran C. krusei y C. glabrata (73).
A diferencia de itraconazol y posaconazol, voriconazol alcanza concentraciones elevadas en el LCR (66). Aun cuando no existe información sobre su uso en infecciones del SNC, en casos de resistencia al fluconazol se podría considerar la indicación como terapia de continuación por vía intravenosa después de la anfotericina B (66, 67). Las equinocandinas, en particular la caspofungina, deben reservarse para los casos de imposibilidad o contraindicación del uso de anfotericina o fluconazol o cuando existe falla terapéutica (66).
La duración total de la terapia antifúngica no está bien definida, no obstante se recomienda mantenerla por un mínimo de 3-4 semanas después de la resolución completa de los síntomas y signos clínicos de la enfermedad (66,71). Además, antes de la suspensión se debe documentar la normalización de los parámetros del LCR y la resolución de los microabscesos cerebrales en la resonancia (71,73). Junto a la terapia antifúngica, los pacientes que desarrollan la infección relacionada a la presencia de catéter de derivación ventricular requieren su remoción, por cuanto sería muy difícil la erradicación del microorganismo (66).
CRIPTOCOCOSIS MENÍNGEA
La infección del SNC por el Cryptococcus ocurre por diseminación hematógena desde los pulmones, órganos que constituyen el sitio primario de infección (9, 60). La afectación del SNC se considera la manifestación más severa de la infección (74, 75). Aunque la forma de presentación neurológica más frecuente es meningitis o meningoencefalitis (9,75,76), también ocurre como lesión de ocupación de espacio o criptococoma (60,68,75). El compromiso extrapulmonar se presenta con mayor frecuencia en pacientes con déficit inmunológico, en especial, de la inmunidad celular (ver cuadro), no obstante, también ocurre en pacientes sin evidencia de inmunosupresión (9, 76). Entre las especies del hongo descritas en la actualidad se considera que C. neoformans afecta principalmente a huéspedes inmunocomprometidos, mientras que C. gattii es el responsable de la enfermedad en pacientes inmunocompetentes (9,75).
El Cryptococcus es un microorganismo ubicuo en la naturaleza que se encuentra en el suelo y en el excremento de pájaros, sobre todo palomas (9,75). La especie C. gattii también se ha relacionado con varias especies de árboles, particularmente de eucalipto, y es más frecuente en zonas tropicales o subtropicales (9, 74). De cualquier manera, el ingreso al organismo se produce por inhalación desde el ambiente, por cuanto no se ha demostrado transmisión de persona a persona (9, 60). Por lo general, el compromiso pulmonar es asintomático o leve y, por tanto, con frecuencia ocurre en forma inadvertida (73-75). Aunque las manifestaciones neurológicas tienen evolución subaguda o crónica, también se ha descrito la progresión rápida de los síntomas en pocos días (60,75). Como resultado de la diseminación extrapulmonar del microorganismo, la afectación del SNC podría estar acompañada de manifestaciones en otros órganos tales como piel, huesos, ojos, riñones y próstata (9,74,75). A diferencia de los pacientes con deterioro inmune, la infección en pacientes inmunocompetentes tiene progresión más lenta y de localización básicamente neurológica (60, 75).
Entre los hallazgos clínicos (60,74,75), la cefalea es el síntoma más constante de la infección meníngea. Aunque es leve y progresa en forma lenta durante semanas o meses, en algunos casos puede ser intensa, al punto de interferir con las actividades usuales. La mayoría de los pacientes tiene fiebre, no obstante, no es un hallazgo universal (79%). En ocasiones ocurren vómitos intermitentes. Con frecuencia no se encuentran signos notorios en el examen físico. La rigidez de nuca es un hallazgo poco frecuente (30%). Cuando la enfermedad progresa y ocurre hipertensión endocraneana, se evidencia edema de papila (33%) y paresia de pares craneales. Otros hallazgos focales son raros y se atribuyen a la presencia de criptococoma. También se ha descrito alteración del sensorio (20%), convulsiones (8-25%) ceguera, confusión, letargo o cambios de conducta (60, 75).
Las alteraciones características incluyen presión de inicio ligeramente elevada, pleocitosis linfocitaria leve (<200 células/ ml), hiperproteinorraquia e hipoglucorraquia (60, 69, 73, 75). En contraposición, algunos pacientes, sobre todo inmunocomprometidos, pueden mostrar hallazgos completamente normales en el perfil básico del líquido (5,69,75). La prueba más utilizada para el diagnóstico presuntivo es la visualización microscópica directa de las levaduras mediante la coloración con tinta china (u otras tinciones). A pesar de su facilidad, rapidez y bajo costo, tiene la desventaja de algunos falsos negativos y falsos positivos. Una de las causas más frecuente de falsos negativos es la escasa cantidad de microorganismos, por tanto para aumentar la sensibilidad de la prueba se recomienda utilizar el sedimento después de la centrifugación del líquido (60, 75). Por otro lado, los falsos positivos pueden deberse a la presencia de otras levaduras, fundamentalmente del género Candida o también por artefactos relacionados con la técnica (60,74,75).
Para la confirmación del diagnóstico, se requiere la detección del antígeno capsular específicamente en el LCR, lo cual se realiza más frecuentemente mediante la técnica de aglutinación con látex (74,75). Aunque esta prueba tiene elevada sensibilidad y especificidad (>90%), se han descrito algunos falsos negativos, en especial, cuando se realizan en los primeros días de evolución de la enfermedad (60,69,75). La identificación del antígeno capsular también se puede realizar mediante inmunoensayo enzimático, prueba que tiene elevada sensibilidad (85-99%) y especificidad (97%) (60,69,75). Entre sus ventajas se encuentra la posibilidad de cuantificar el antígeno, con lo cual se puede monitorizar la respuesta al tratamiento. Para la confirmación de la infección también se podría usar el cultivo del LCR, para lo que se requiere un mínimo de 72 horas (69,75).
En el inicio de los síntomas de la infección meníngea, el estudio neurológico por imágenes mediante tomografía o resonancia magnética puede no mostrar anormalidades, por tanto, la interpretación de los resultados debe hacerse considerando el tiempo de evolución de la enfermedad. También se debe considerar que para la mejor apreciación de los hallazgos se requiere el uso de contraste endovenoso (60, 70, 73).
Ninguno de los hallazgos encontrados en estos casos son específicos e incluyen fundamentalmente engrosamiento de meninges, con disminución de los surcos, hidrocefalia (9-58%) y criptococomas (10-30%). En ocasiones se pueden observar múltiples lesiones quísticas en la base del cerebro (70). Se debe iniciar el tratamiento antifúngico (ver Cuadro 2) en cuanto se tenga el diagnóstico presuntivo mediante la visualización directa del hongo, aun cuando no se cuente con la detección del antígeno capsular o el resultado del cultivo (75). La terapia específica incluye una fase inicial, una fase de consolidación y una fase supresiva o de mantenimiento (76,77). Como primera opción en el tratamiento inicial se recomienda anfotericina B deoxicolato intravenosa (o en cualquiera de sus presentaciones) asociada a flucitosina por un mínimo de 2 semanas (71-77). Cuando no se pueda asociar flucitosina, la anfotericina B debe continuarse al menos por 6 semanas. Entre las alternativas para esta primera fase, se ha señalado la combinación de anfotericina B con fluconazol o la terapia única con fluconazol; no obstante, estos últimos esquemas solo se deben indicar cuando no sea posible el tratamiento recomendado como primera línea (77).
Para el seguimiento del paciente se requiere la reevaluación del LCR a las 2 semanas del inicio de la terapia. Cuando aún persistan evidencias de infección activa, el tratamiento debe prolongarse por 6 a 10 semanas, según el tipo de esquema terapéutico seleccionado. Por otro lado, cuando la evolución sea satisfactoria, se podrá pasar a la fase de consolidación, con fluconazol oral a dosis altas por un mínimo de 8-10 semanas, y posteriormente seguir con la fase de mantenimiento con fluconazol a dosis estándar por al menos 6 meses. Los pacientes que tengan compromiso inmunológico deben recibir este tratamiento supresor por más tiempo, cuya duración dependerá de la condición inmunosupresora de base (77).
CONCLUSIONES
El diagnóstico de meningitis o meningoencefalitis herpética, tuberculosa o micótica requiere un alto índice de sospecha y un análisis minucioso de toda la información obtenida en el interrogatorio, la exploración física, la evaluación del LCR y los estudios por imágenes. No obstante, la identificación definitiva del microorganismo involucrado requiere la realización de exámenes específicos, los cuales deben ser interpretados según la especificidad y la sensibilidad de cada prueba. El tratamiento antimicrobiano precoz es fundamental para mejorar el pronóstico de la enfermedad, y por tanto, ante la evidencia razonable de la presencia de un determinado microorganismo debe iniciarse la terapia específica de inmediato, aun sin los resultados de los exámenes para la confirmación microbiológica. Esta decisión, que en ocasiones podría ser controversial, requiere la ponderación entre los beneficios de la terapéutica y los efectos adversos eventuales de los medicamentos.
REFERENCIAS
1. Chávez-Bueno S, McCracken GH Jr. Bacterial meningitis in children. Pediatr Clin North Am. 2005 Jun;52(3):795-810 [ Links ]
2. Mace SE. Acute bacterial meningitis. Emerg Med Clin North Am. 2008 May;26(2):281-317 [ Links ] 3. Irani DN. Aseptic meningitis and viral myelitis. Neurol Clin. 2008;26(3):635-655. [ Links ]
4. Rotbart HA. Viral meningitis. Semin Neurol 2000;20(3):277-292. [ Links ]
5. Cohen BA. Chronic meningitis. Curr Neurol Neurosci Rep. 2005;5(6):429-439. [ Links ]
6. American Academy of Pediatrics. Herpes simplex. In: Pickering LK. Red book: Report of the committee on infectious diseases. 28ª ed. 2009. pp. 363-373.
7. American Academy of Pediatrics. Tuberculosis. In: Pickering LK. Red book: Report of the Committee on Infectious Diseases. 28ª ed. 2009. pp. 680-701.
8. American Academy of Pediatrics. Candidiasis. In: Pickering LK. Red book: Report of the Committee on Infectious Diseases. 28ª ed. 2009. pp. 245-249.
9. American Academy of Pediatrics. Cryptococcus neoformans infections (Cryptococcosis). In: Pickering LK. Red book: Report of the committee on infectious diseases. 28ª ed. 2009. pp. 270-272.
10. Tyler KL. Update on herpes simplex encephalitis. Rev Neurol Dis. 2004;1(4):169-178. [ Links ]
11. Elbers JM, Bitnun A, Richardson SE, Ford-Jones EL, Tellier R, Wald RM, et al. A 12-year prospective study of childhood herpes simplex encephalitis: is there a broader spectrum of disease? Pediatrics. 2007;119(2):e399-407. [ Links ]
12. Glaser CA, Gilliam S, Schnurr D, Forghani B, Honarmand S, Khetsuriani N, et al. In search of encephalitis etiologies: diagnostic challenges in the California Encephalitis Project, 1998-2000. Clin Infect Dis. 2003;36(6):731-742. Epub 2003 Mar 3. [ Links ]
13. Davison KL, Crowcroft NS, Ramsay ME, Brown DW, Andrews NJ. Viral encephalitis in England, 1989-1998: what did we miss? Emerg Infect Dis. 2003;9(2):234-240. [ Links ]
14. Fica A, Pérez C, Reyes P, Gallardo S, Calvo X, Salinas AM. Encefalitis herpética. Serie clínica de 15 casos confirmados por reacción de polimerasa. Rev Chil Infect. 2005;22:38-46. [ Links ]
15. Kimberlin D. Herpes simplex virus, meningitis and encephalitis in neonates. Herpes. 2004;11 Suppl 2:65A- 76A. [ Links ]
16. Frenkel LM. Challenges in the diagnosis and management of neonatal herpes simplex virus encephalitis. Pediatrics. 2005;115(3):795-797. [ Links ]
17. De Tiège X, Rozenberg F, Héron B. The spectrum of herpes simplex encephalitis in children. Eur J Paediatr Neurol. 2008;12(2):72-81. [ Links ] Epub 2007 Sep 17.
18. Vial C, Pozzetto B, Essid A, Stéphan JL, Chabrier S. Acute encephalitis: report on 32 consecutive pediatric cases observed in one hospital. Med Mal Infect. 2007;37(4):208-214. [ Links ] Epub 2007 Mar 26.
19. Kleinschmidt-DeMasters BK, Gilden DH. The expanding spectrum of herpesvirus infections of the nervous system. Brain Pathol. 2001;11(4):440-451. [ Links ]
20. Santos E, Moralejo L, de Dios S, Fuertes A. Encefalitis por virus del herpes simple con líquido cefalorraquideo normal. Med Clin (Barc). 2004;122(9):357-358. [ Links ]
21. De Tiège X, Héron B, Lebon P, Ponsot G, Rozenberg F. Limits of early diagnosis of herpes simplex encephalitis in children: a retrospective study of 38 cases. Clin Infect Dis. 2003;36(10):1335-1339. [ Links ] Epub 2003 May 1.
22. Kennedy PG. Viral encephalitis: causes, differential diagnosis and management. J Neurol Neurosurg Psychiatry. 2004;75 Suppl 1:i10-i15. [ Links ]
23. Tyler KL. Herpes simplex virus infections of the central nervous system: encephalitis and meningitis, including Mollarets Herpes. 2004;11 Suppl 2:57A-67A. [ Links ]
24. Steiner I, Budka H, Chaudhuri A, Koskiniemi M, Sainio K, Salonen O, et al. Viral encephalitis: a review of diagnostic methods and guidelines for management. Eur J Neurol. 2005;12(5):331-343. [ Links ]
25. Whitley RJ, Gnann JW. Viral encephalitis: familiar infections and emerging pathogens. Lancet. 2002;359(9305):507-513. [ Links ]
26. Kennedy PG, Chaudhuri A. Herpes simplex encephalitis. J Neurol Neurosurg Psychiatry. 2002;73(3):237-238. [ Links ]
27. Ito Y, Ando Y, Kimura H, Kuzushima K, Morishima T. Polymerase chain reaction-proved herpes simplex encephalitis in children. Pediatr Infect Dis J. 1998;17(1):29-32. [ Links ]
28. Muñoz-Almagro C, Jordan I, Cambra FJ, Esteban E, Urrea M, Garcia-Garcia JJ, et al. Quantitative real-time PCR in paediatric patients with herpes simplex infections of the central nervous system. J Virol Methods. 2008 (2):297-300. [ Links ] Epub 2007 Nov 5.
29. García-Bardeci D, Pena M, Suárez-Bordón P, Aladro Y, Pérez-González C, Lafarga B. Utilidad de la reacción en cadena de la polimerasa en el diagnóstico de las infecciones herpéticas del sistema nervioso. Enferm Infecc Microbiol Clin. 2004;22(3):150-155. [ Links ]
30. Leonard JR, Moran CJ, Cross DT 3rd, Wippold FJ 2nd, Schlesinger Y, Storch GA. MR imaging of herpes simplex type 1 encephalitis in infants and young children: a separate pattern of findings. AJR Am J Roentgenol. 2000; 174(6):1651-1655.
31. Aoki FY, Hayden H, Dolin R. Antiviral drugs (other than antiretrovirals). In: Mandell GL, Bennett JE, Dolin R. Principles and Practice of Infectious Diseases. 7ª ed. Amsterdam, Netherlands: Elsevier; 2010. pp: 573-576.
32. McGrath N, Anderson NE, Croxson MC, Powell KF. Herpes simplex encephalitis treated with acyclovir: diagnosis and long-term outcome. J Neurol Neurosurg Psychiatry. 1997;63(3):321-326. [ Links ]
33. American Academy of Pediatrics. Antiviral drugs. In: Pickering LK. Red book: Report of the committee on infectious diseases. 28ª ed. Elk Grove Village (IL): American Academy of Pediatrics; 2009. pp. 777-782.
35. Rock RB, Olin M, Baker CA, Molitor TW, Peterson PK. Central nervous system tuberculosis: pathogenesis and clinical aspects. Clin Microbiol Rev. 2008;21(2):243- 261, [ Links ]
36. Newton SM, Brent AJ, Anderson S, Whittaker E, Kampmann B. Paediatric tuberculosis. Lancet Infect Dis. 2008;8(8):498-510. [ Links ]
37. Donald PR, Schoeman JF. Tuberculous meningitis. N Engl J Med. 2004;351(17):1719-1720. [ Links ]
38. Ravenscroft A, Schoeman JF, Donald PR. Tuberculous granulomas in childhood tuberculous meningitis: radiological features and course. J Trop Pediatr. 2001;47(1):5-12. [ Links ]
39. Guwatudde D, Nakakeeto M, Jones-Lopez EC, Maganda A, Chiunda A, Mugerwa RD, et al. Tuberculosis in household contacts of infectious cases in Kampala, Uganda. Am J Epidemiol. 2003;158(9):887-898. [ Links ]
40. Cegielski JP, McMurray DN. The relationship between malnutrition and tuberculosis: evidence from studies in humans and experimental animals. Int J Tuberc Lung Dis. 2004;8(3):286-298. [ Links ]
40. Thwaites GE, Tran TH. Tuberculous meningitis: many questions, too few answers. Lancet Neurol. 2005;4(3):160-170. [ Links ]
41. Farinha NJ, Razali KA, Holzel H, Morgan G, Novelli VM. Tuberculosis of the central nervous system in children: a 20-year survey. J Infect. 2000;41(1):61-68. [ Links ]
42. Yaramis A, Gurkan F, Elevli M, Söker M, Haspolat K, Kirbas G, et al. Central nervous system tuberculosis in children: a review of 214 cases. Pediatrics. 1998;102(5):E49. [ Links ]
43. Katti MK. Pathogenesis, diagnosis, treatment, and outcome aspects of cerebral tuberculosis. Med Sci Monit. 2004 Sep;10(9):RA215-RA229. [ Links ] Epub 2004
44. Pai M, Riley LW, Colford JM Jr. Interferon-gamma assays in the immunodiagnosis of tuberculosis: a systematic review. Lancet Infect Dis. 2004;4(12):761-776. [ Links ]
45. Daif A, Obeid T, Yaqub B, AbdulJabbar M. Unusual presentation of tuberculous meningitis. Clin Neurol Neurosurg. 1992;94(1):1-5. [ Links ]
46. Sutlas PN, Unal A, Forta H, Senol S, Kirbas D. Tuberculous meningitis in adults: review of 61 cases. Infection. 2003;31(6):387-391. [ Links ]
47. Moghtaderi A, Niazi A, Alavi-Naini R, Yaghoobi S, Narouie B. Comparative analysis of cerebrospinal fluid adenosine deaminase en tuberculous and non-tuberculous meningitis. Clin Neurol Neurosurg. 2010;112(6):459-462. [ Links ]
48. Thwaites GE, Chau TT, Farrar JJ. Improving the bacteriological diagnosis of tuberculous meningitis. J Clin Microbiol. 2004;42(1):378-379. [ Links ]
49. Pai M, Flores LL, Pai N, Hubbard A, Riley LW, Colford JM Jr. Diagnostic accuracy of nucleic acid amplification test for tuberculous meningitis: a systematic review and meta-analysis. Lancet Infect Dis. 2003;3(10):633-643. [ Links ]
50. Girgis NI, Sultan Y, Farid Z, Mansour MM, Erian MW, Hanna LS, et al. Tuberculosis meningitis, Abbassia Fever Hospital-Naval Medical Research Unit No. 3- Cairo, Egypt, from 1976 to 1996. Am J Trop Med Hyg. 1998;58(1):28-34. [ Links ]
51. van Well GT, Paes BF, Terwee CB, Springer P, Roord JJ, Donald PR, et al. Twenty years of pediatric tuberculous meningitis: a retrospective cohort study in the western cape of South Africa. Pediatrics. 2009;123(1):e1-e8. [ Links ]
52. Andronikou S, Smith B, Hatherhill M, Douis H, Wilmshurst J. Definitive neuroradiological diagnostic features of tuberculous meningitis in children. Pediatr Radiol. 2004;34(11):876-885. [ Links ] Epub 2004 Sep 17.
53. Woodfield J, Argent A. Evidence behind the WHO guidelines: hospital care for children: what is the most appropriate anti-microbial treatment for tuberculous meningitis? J Trop Pediatr. 2008;54(4):220-224. [ Links ]
54. Guilarte A, España M, Méndez R, Vásquez A. Norma Oficial Venezolana del Programa Nacional Integrado de Control de la Tuberculosis. MPPS. Caracas, 2006.
55. Joint Tuberculosis Committee of the British Thoracic Society. Chemotherapy and management of tuberculosis in the United Kingdom: Recommendations 1998. Thorax. 1998;7:578-582. [ Links ]
56. World Health Organization. Treatment of tuberculosis: guidelines for national programmes. 3ª ed. Geneva; 2003.
57. American Thoracic Society, CDC, Infectious Diseases Society of America. Treatment of tuberculosis. MMWR. 2003;52:1-77.
58. Grupo de Trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica (SEIP). Documento de consenso sobre el tratamiento de tuberculosis extrapulmonar y formas complicadas de tuberculosis pulmonar. An Pediatr. 2008;69(3):271-278.
59. Thwaites GE, Nguyen DB, Nguyen HD, Hoang TQ, Do TT, Nguyen TC, et al. Dexamethasone for the treatment of tuberculous meningitis in adolescents and adults. N Engl J Med. 2004;351(17):1741-1751. [ Links ]
60. Rauchway A, Husain S, Selhorst JB. Neurologic presentations of fungal infections. Neurol Clin. 2010;28(1):293-309. [ Links ]
61. Odio CM. Antifungal therapy for infants, children and adolescentes with suspected or documented invasive fungal infection. Drugs Today (Barc). 2010;46 Suppl C:33-46. [ Links ]
62. Chen TL, Tsai CA, Fung CP, Lin MY, Yu KW, Liu CY. Clinical significance of Candida species isolated from cerebroespinal fluid. J Microbiol Inmunol Infect. 2002;35(4):249-254. [ Links ]
63. Ostrosky-Zeichner L, Rex JH, Bennett J, Kullberg BJ. Deeply Invasive candidiasis. Infect Dis Clin North Am. 2002;16(4):821-835. [ Links ]
64. Cohen-Wolkowiez M, Smith PB, Mangum B, Steinbach WJ, Alexander BD, Cotten CM, et al. Neonatal Candida meningitis: significance of cerebrospinal fluid parameters and blood cultures. J Perinatol. 2007;27(2):97-100. Epub 2006 Nov 2.
65. Baradkar V, Taklikar S. Meningitis caused by Candida albicans in a premature neonate. J Pediatr Neurosci. 2007;2:90-91. [ Links ]
66. Pappas PG, Kauffman CA, Andes D, Benjamin DK Jr, Calandra TF, Edwards JE Jr, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis. 2009;48(5):503-535. [ Links ]
67. De Rosa FG, Garazzino S, Pasero D, Di Perri G, Ranieri VM. Invasive candidiasis and candidemia: new guidelines. Minerva Anestesiol. 2009;75(7-8):453-458. [ Links ] Epub 2008 Han 24.
68. Murthy JM. Fungal infections of the central nervous system: the clinical syndromes. Neurol India. 2007;55(3):221-225. [ Links ]
69. Davis JA, Costello DJ, Venna N. Laboratory investigation of fungal infections of the central nervous system. Neurol India. 2007;55(3):233-240. [ Links ]
70. Jain KK, Mittal SK, Kumar S, Gupta RK. Imaging features of central nervous system fungal infections. Neurol India. 2007;55(3):241-250. [ Links ]
71. Black KE, Baden LR. Fungal infections of the CNS. Treatment strategies for the immunocompromised patient. CNS Drugs. 2007;21(4):293-318. [ Links ]
72. Redmond A, Dancer C, Woods ML. Fungal infections of the central nervous system: A review of fungal pathogens and treatment. Neurol India. 2007;55(3):251-259. [ Links ]
73. Scully EP, Baden LR, Katz JT. Fungal brain infections. Curr Opin Neurol. 2008;21(3):347-352. [ Links ]
74. Chayakulkeeree M, Perfect JR. Cryptococcosis. Infect Dis Clin North Am. 2006;20(3):507-544 [ Links ]
75. Satishchandra P, Mathew T, Gadre G, Nagarathna S, Chandramukhi A, Mahadevan A, et al. Cryptococcal meningitis: clinical, diagnostic and therapeutic overviews. Neurol India. 2007;55(3):226-232. [ Links ]
76. Pukkila-Worley R, Mylonakis E. Epidemiology and management of cryptococcal meningitis: developments and challenges. Expert Opin Pharmacother. 2008 Mar;9(4):551-560. [ Links ]
77. Perfect JR, Dismukes WE, Dromer F, Goldman DL, Graybill JR, Hamill RJ, et al. Clinical practice guidelines for the management of cryptococcal disease: 2010 update by the infectious diseases society of america. Clin Infect Dis. 2010;50(3):291-322. [ Links ]
78. American Academy of Pediatrics. Antifungal drugs for systemic fungal infections In: Pickering LK. Red book: Report of the committee on infectious diseases. 28ª ed. 2009. p. 765-776. [ Links ]














