Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gen
versión On-line ISSN 2477-975X
Gen vol.71 no.2 Caracas jun. 2017
Bioequivalencia clínica de dos marcas de esomeprazol administradas en pacientes con ulcus gastroduodenal
Marco Sarabia,1 Carmen Zuramay,2 Jairo Ruiz,3 María González,4 David Rincon4
1 Médico Gastroenterólogo- Clínica Vista Alegre. Caracas. Venezuela. 2 Medico Gastroenterólogo. Clínica Venezuela. Caracas-Venezuela. 3 Medico Gastroenterólogo. Centro de Especialistas. Caracas-Venezuela. 4 Farmacólogo-Laboratorios Leti S.A.V. Guatire. Estado Miranda-Venezuela.
Autor correspondiente: David Rincón.Laboratorios Leti S.A.V. Zona Industrial del este, Avenida 2, Manzana J, Parcela 3, Edificio Leti. Guarenas, Estado Miranda. Centro Médico San Martín de Porres. Villa Heroica, Edificio Cruma, Piso PB, Sector La Palmera. Guatire, Estado Miranda. darinconm@gmail.com
Correos Autores: marcosarabia@gmail.com; gioconda.yoko.rodriguez@gmail.com; jairojruizr@gmail.com; mgonzalez@leti.com.ve; darinconm@gmail.com
Resumen
Los inhibidores de bomba de protones son usados en el tratamiento de la gastropatía ácido-péptica. Objetivo: comparar la eficacia de dos marcas de esomeprazol en el tratamiento de gastropatía ácido-péptica, la evolución de síntomas y su tolerancia. Materiales y Métodos: Se incluyeron pacientes de ambos sexos, con edades entre 18-60 años, con o sin Helicobacter pylori, que en la gastroscopia presentaron una o más erosiones o úlceras ≥ 5 mm y < 25 mm en su diámetro mayor. Se distribuyeron aleatoriamente a recibir una de las marcas, 40 mg/día, oral, durante 4 semanas. Al final fueron evaluados con endoscopia, interrogatorio de efectos adversos y laboratorio, comparando tasa de curación y evolución de la endoscopia. Se evaluó la tasa de respondedores por disminución del score de síntomas y la tolerancia mediante interrogatorio de efectos adversos y pruebas de laboratorio. Resultados: Ingresaron 34 pacientes, analizando los resultados de 30. En ambos grupos observamos mejoría en la endoscopia (curación y/o mejoría). El score de síntomas mejoró en ambos grupos, con significancia intragrupo pero no intergrupal. Los efectos adversos no fueron significativos. Conclusiones: Observamos mejoría en los criterios de endoscopia, y en el score de síntomas, en ambos grupos.
Palabras Clave: Esomeprazol, Bioequivalencia, Gastropatía Erosiva, Score de Lanza.
Clinical bioequivalence of 2 brands of esomeprazol administered in patients with gastroduodenal ulcus
Summary
Introduction: Proton pump inhibitors are used in the treatment of acid-peptic gastropathy. Objective: to compare the efficacy of two brands of esomeprazole in the treatment of acid-peptic gastropathy, the evolution of symptoms and their tolerance. Materials and methods: Patients of both sexes, aged 18-60 years, with or without Helicobacter pylori, who had one or more erosions or ulcers ≥ 5 mm and <25 mm in their largest diameter, in gastroscopy, were included. They were randomized to receive one of the brands, 40 mg / day, orally, for 4 weeks. At the end, they were evaluated with endoscopy, adverse event questioning and laboratory tests, comparing cure rate and evolution of endoscopy. We evaluated the rate of responders according to decreased symptom score, and tolerance through questioning of adverse effects and laboratory tests. Results: Thirty-four patients were enrolled, analyzing the results of 30 patients. In both groups we observed improvement in endoscopy (healing and / or improvement). The score of symptoms improved in both groups, with intragroup but not intergroup significance. Adverse events were not significant. Conclusions: Thirty-four patients were enrolled, analyzing the results of 30 patients. In both groups we observed improvement in endoscopy (healing and / or improvement). The score of symptoms improved in both groups, with intragroup but not intergroup significance. Adverse events were not significant.
Key words: Esomeprazole, Bioequivalence, Erosive Gastropathy, Lanza Score.
Fecha de recepción: 22 de mayo de 2017. Fecha de revisión: 24 de mayo de 2017. Fecha de Aprobación: 27 de mayo de 2017.
Introducción
Más de un 60% de los fármacos incluidos en la Farmacopea son racematos constituidos por mezclas equimoleculares de dos enantiómeros. Los enantiómeros son entidades químicas que presentan propiedades farmacológicas independientes, no sólo entre sí, sino también con respecto al racemato. Esta ha sido la razón que llevó en 1992 a la Food and Drug Administration a recomendar a las industrias farmacéuticas que comercializaban racematos a que desarrollasen el enantiómero más activo. El desarrollo de un enantiómero es un proceso tan complejo como el del racemato, en el que se exige: a) conocer el mecanismo de acción del enantiómero, b) determinar su efectividad clínica y su perfil de seguridad en comparación con la del racemato, y c) demostrar que no existe en el organismo interconversión de un enantiómero en otro.
El omeprazol fue el primer inhibidor de la bomba de protones (IBP) comercializado y, hasta fechas recientes, todos los IBP han sido comercializados como racematos. Sin embargo, el omeprazol racémico presenta dos enantiómeros, el R- (H199/19) y el S-omeprazol (esomeprazol). Pronto se pudo demostrar que el esomeprazol era más potente que el omeprazol y el H199/19 para inhibir la secreción gástrica estimulada por gastrina durante 24 horas y mantener el pH gástrico por encima de 4. Ello condujo al desarrollo de esomeprazol con el objetivo de aumentar la tasa de éxito del tratamiento supresor de la producción de ácido con respecto a la conseguida con otros IBP ya comercializados. Por tanto, esomeprazol (S-omeprazol) es el primer IBP desarrollado como enantiómero1.
Esomeprazol es un enantiómero del omeprazol (S-omeprazol), más potente que omeprazol para inhibir la secreción gástrica, y produce un aumento más rápido del pH, manteniéndolo durante más tiempo por encima de cuatro (4)2. Actúa bloqueando la ATPasa-H+/Na+ de la membrana de las células parietales gástricas. Se absorbe rápidamente en intestino delgado, y en hígado se transforma por acción de las isoformas del citocromo P450, CYP2C19 y en menor grado CYP3A4 -que actúan de forma distinta a como lo hacen con omeprazol-, lo que da lugar a una mayor biodisponibilidad de esomeprazol y una mayor área bajo la curva de la concentración plasmática. Es bien tolerado, y está disponible para su administración por vía oral, así como en presentación para administrar por vía intravenosa, en inyección o en infusión.
Esomeprazol bloquea la ATPasa-H+/Na+ presente en la superficie de la membrana de las células parietales de la mucosa gástrica, que representa la vía final común de la secreción ácida, independientemente de cuál sea el agente secretagogo (acetilcolina, gastrina o histamina). La función fisiológica de la ATPasa-H+/Na+ (114 KDa) es intercambiar H+ por Na+ en una proporción 1:1, siendo capaz de promover la secreción de protones incluso contra gradientes (pH = 1) un millón de veces superiores a las concentraciones de H+ existentes en la célula parietal en condiciones fisiológicas (pH = 7,4)2- 4.
Como otros IBP, esomeprazol es una base débil muy liposoluble, que tras absorberse en el intestino delgado, atraviesa con facilidad las membranas celulares y alcanza la célula parietal gástrica (pH = 7,4), desde aquí, difunde a los espacios canaliculares, donde el pH ácido (2,0-3,0) favorece la protonación del esomeprazol y lo convierte en un derivado sulfonamido muy hidrofílico, que ya no es capaz de atravesar la membrana de la célula parietal y que, por tanto, se acumula en la luz del canalículo parietal. A este nivel, forma puentes disulfuro con los residuos de cisteína localizados en las posiciones 321, 813 y 892 de la cadena A de la ATPasa-H+/Na+, formándose así un complejo que inhibe de forma irreversible, no competitiva y dosis-dependiente, la actividad de la enzima.
Una vez inhibida la ATPasa-H+/Na+ de la célula parietal, la recuperación de la actividad enzimática implica la síntesis de nuevas moléculas de la enzima por la célula parietal. Este proceso requiere más de 18 horas, lo que explicaría por qué esomeprazol, al igual que otros IBP, mantienen el pH gástrico por encima de 4 más tiempo a lo largo del día que otros fármacos utilizados en el control de la secreción gástrica ácida (p.ej. antihistamínicos H2, anticolinérgicos). De hecho, los efectos del esomeprazol pueden llegar a durar hasta 4 días tras la administración de una dosis única.
En ensayos clínicos comparativos, esomeprazol (20 y 40 mg/día) mantiene el pH intragástrico > 4 durante 12,7 y 16,8 horas, respectivamente, mientras que 20 mg de omeprazol lo hacen durante 10,5 horas (P < 0,001). Estas diferencias explican por qué el esomeprazol produce un mayor porcentaje de cicatrizaciones que omeprazol (5). En estudios comparativos con otros IBP, esomeprazol (40 mg/día) mantiene el pH gástrico > 4 durante más tiempo que omeprazol (20 mg/día), lansoprazol (30 mg/día), pantoprazol (40 mg/día) o rabeprazol (20 mg/día)6, 7.
El esomeprazol es un profármaco que a pH ácido se activa dando lugar a un derivado sulfonamido hidrófilo que no se absorbe; por este motivo se administra por vía oral con recubrimiento entérico. El esomeprazol se absorbe intensa y rápidamente en el intestino delgado y pasa al torrente sanguíneo, siendo su biodisponibilidad por esta vía (65%) superior a la de omeprazol (53%); además, su biodisponibilidad aumenta tras administración repetida, siendo del 85% luego de 5 días de tratamiento. Su acción aparece al cabo de 1 hora y alcanza concentraciones plasmáticas máximas entre 1-2 horas. Se une a proteínas plasmáticas en un 97%, presenta un pobre volumen de distribución (0,22 L/Kg) y una semivida de 0,8 horas. El esomeprazol se biotransforma en el hígado a través de las isoformas del citocromo P450 CYP2C19 (dando lugar a derivados hidroxi y desmetilados) y, en menor grado, del CYP3A4 (que produce una sulfona de esomeprazol), eliminándose casi el 80% de la dosis administrada en forma de metabolitos inactivos por la orina (sólo el 1% sin biotransformar) y el 20% restante por bilis. El 95% del fármaco administrado se recupera del organismo a las 48 horas de su administración, lo que indica que no existe el peligro de que esomeprazol se acumule tras su administración repetida una vez al día. No se ha demostrado que esomeprazol se interconvierta en R-omeprazol en el organismo.
Esomeprazol presenta una biotransformación más lenta que omeprazol8. Esomeprazol, omeprazol y R-omeprazol se biotransforman por diversas isoformas del citocromo P450, pero la participación de las isoformas CYP2C19 y CYP3A4 es bien distinta. Así, el esomeprazol se biotransforma en un 73% a través del CYP2C19 y el 27% restante a través del CYP3A4, mientras que el 98% del R-omeprazol se biotransforma a través del CYP2C19. Esta diferencia explica porque el esomeprazol presenta un aclaramiento hepático 3 veces más lento (15 L/min/mg de proteína) que el de R-omeprazol (43 L/min/mg de proteína) u omeprazol.
Esta biotransformación más lenta explicaría la mayor biodisponibilidad oral del esomeprazol y lo que es más importante, por qué el área bajo la curva de las concentraciones plasmáticas a lo largo del tiempo (AUC) de esomeprazol es significativamente mayor que la de omeprazol (P < 0,05) a todas las dosis ensayadas. Este hallazgo es muy importante, ya que el grado de inhibición de la secreción gástrica ácida producida por los IBP se correlaciona mejor con el AUC que con las concentraciones plasmáticas del fármaco. Es decir, que cuanto mayor sea el AUC, mayor será la cantidad de fármaco que alcance los canalículos de la célula parietal e inhiba la ATPasa-H+/Na+ y mayor también el control de la secreción gástrica ácida producida. Dado que acabamos de ver que el esomeprazol presenta un AUC mayor que la de omeprazol, es evidente que alcanza mayores concentraciones a nivel de la ATPasa-H+/Na+.
Además, en pacientes con Enfermedad por Reflujo Gastroesofágico (ERGE), la administración de esomeprazol durante 5-7 días se acompaña de una reducción en el efecto de primer paso y en la velocidad del aclaramiento sistémico del fármaco (desde 17 L/hora tras la primera dosis hasta 9 L/hora tras administración repetida). El resultado es que tras administración repetida de esomeprazol, aumenta su biodisponibilidad oral (hasta un 85%), su semivida (1,3 horas) y su AUC2, 8.
La seguridad de esomeprazol ha sido analizada en ensayos clínicos controlados frente a placebo o frente a otros IBP en más de 10.000 pacientes y de estos, 3.000 habían sido tratados con esomeprazol durante al menos 12 meses. Estos estudios demostraron que esomeprazol es bien tolerado, siendo la incidencia de reacciones adversas y de abandonos muy similar a la previamente descrita con omeprazol. En general, las reacciones adversas son ligeras y transitorias y no guardan relación con la dosis de esomeprazol administrada. Aquéllas que aparecen en > 1% de los pacientes son: cefaleas, diarrea, flatulencia, náuseas, estreñimiento y dolor abdominal. Más raramente (<1%) aparecen dermatitis, prurito, urticaria, sequedad de boca y mareos6, 7, 9-13.
No se han observado cambios en los niveles de vitamina B12, hierro, paratohormona, cortisol, testosterona, estradiol, prolactina, colecistocinina o secretina. La administración crónica de esomeprazol aumenta el pH gástrico y estimula la secreción de gastrina por las células antrales, pero no produce cambios en la citología de la mucosa gástrica o en las células enterocromafines.
Como otros IBP, esomeprazol aumenta el pH gástrico y puede reducir la absorción de fármacos (p. ej. ketoconazol, itraconazol, sales de hierro) en los que este proceso está regulado por la acidez gástrica. Esomeprazol inhibe el CYP2C19, pudiendo aumentar los niveles plasmáticos de algunos fármacos que se biotransforman por esta isoenzima (p. ej. diazepam, citalopram, imipramina, clormipramina o fenitoína); ello puede obligar a reducir la dosis de estos fármacos, cuando se prescribe esomeprazol a demanda. La asociación de esomeprazol y claritromicina en la erradicación del H. pylori duplica el AUC de esomeprazol y de 14-hidroxiclaritromicina, lo que facilita un mejor control de la acidez gástrica, pero no es necesario ajustar la dosis de ambos fármacos. Esomeprazol no interactúa con alimentos, quinidina, cafeína, anticonceptivos orales o amoxicilina. En pacientes tratados con warfarina, el esomeprazol aumenta el tiempo de protrombina, por lo que en pacientes tratados con anticoagulantes orales es necesario monitorizar el tiempo de protrombina al iniciar o suspender la administración de esomeprazol4.
Del 1-3% de la población blanca (y hasta un 20% de la asiática) carece de la enzima CYP2C19 funcional14 por lo que van a metabolizar lentamente al esomeprazol; en este caso, el fármaco se biotransforma más lentamente a través del CYP3A4. Aunque en estos pacientes aumentan las concentraciones plasmáticas de esomeprazol en un 60%, ello no conlleva un aumento en la incidencia de reacciones adversas, por lo que no es necesario reajustar la dosificación15. Se ha aprobado una formulación I.V. de esomeprazol que se administra en inyección (durante 3 minutos) o en infusión (durante 10-30 minutos) a la dosis de 40 mg en el caso de esofagitis por reflujo y de 20 mg en el caso de ERGE16.
Materiales y métodos
El objetivo principal del estudio fue evaluar la eficacia de esomeprazol de dos diferentes marcas comerciales, esomeprazol de Laboratorios Leti, S.A.V., ULGARIN® 40 mg cápsulas (EL), producto test, vs. esomeprazol de AstraZeneca, NEXIUM® 40 mg comprimidos (ER), producto de referencia, en la curación de erosiones (gastropatía erosiva) y úlceras gástricas y duodenales después de 4 semanas de tratamiento.
Se realizó un estudio fase III, prospectivo, doble ciego, doble falso, de grupos paralelos, de bioequivalencia, aleatorizado.
Las evaluaciones se realizaron mediante examen físico y endoscopia superior al inicio y al mes de tratamiento.

Las erosiones se definen como rupturas planas de la mucosa, con base blanquecina, de cualquier tamaño; las úlceras se definen como rupturas de la mucosa de al menos 3 mm o más17-19.
Se evaluó la efectividad, mediante:
Tasa de curación a las 4 semanas (score de Lanza 0).
Evolución de los síntomas (acidez, dolor, pirosis): se consideraron respondedores aquellos pacientes que presentaron un descenso en los escores de síntomas de ≥ 15. Escala de graduación de síntomas: 0 = asintomático (libres de síntomas); 1 = Leve (no interfiere con las actividades cotidianas); 2 = Moderado (interfiere con las actividades normales); 3 = severo (incapacitante, con incapacidad para realizar las actividades normales).
Uso de medicación de rescate: antiácidos.
Condición de respondedor.
Se evaluaron los efectos adversos mediante: registro de efectos adversos interrogados y exámenes de laboratorio: hematología, urea, glicemia, creatinina, transaminasas y orina.
Se incluyeron pacientes de ambos sexos, con edades comprendidas entre 18-60 años con o sin Helicobacter pylori, que a la endoscopia tuviesen una o más lesiones ulcerosas ≥ 5 mm y < 25 mm en un diámetro mayor o una gastropatía erosiva de acuerdo a los criterios de Lanza y que hubiesen firmado un consentimiento informado escrito en el que el paciente manifestó que fue suficientemente informado y aceptó participar en el estudio. El protocolo fue aprobado por un Comité de Ética Institucional y aprobado por las autoridades sanitarias venezolanas.
No se incluyeron pacientes con historia actual de evidencia de enfermedad esofágica, Síndrome de Zollinger-Ellison, uso continuo de inhibidores de la bomba de protones un mes antes de ingresar al estudio, uso de los inhibidores de histamina dos semanas previas al estudio. Pacientes que necesitasen medicación concomitante con anticolinérgicos o drogas que afectaran la motilidad intestinal, antecedentes de Enfermedad Inflamatoria del Intestino, antecedentes de síndrome de malabsorción intestinal, pancreatitis, enfermedad hepática severa (transaminasas 3 veces el valor considerado como normal), insuficiencia renal (creatinina sérica > 1.50 mg/dl.), neoplasias, diabetes no controlada (glicemia en ayuna ≥ 126 mg/dl), enfermedad isquémica coronaria aguda tres meses antes del estudio, enfermedad vascular cerebral, trastornos de la coagulación, asma bronquial, embarazo, lactancia, cirugía intestinal previa, historia de alergia al esomeprazol o cualquier otro medicamento utilizado en el estudio.
A todos los pacientes se les realizó: hematología completa, glicemia, urea, creatinina, transaminasas y examen de orina antes y después del tratamiento.
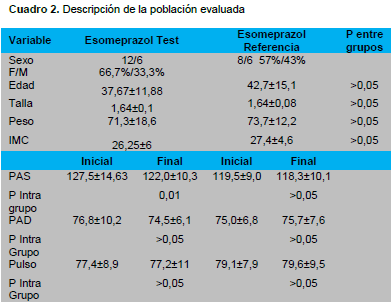
Las variables: edad, peso, IMC, PAS, PAD, pulso y pruebas de laboratorio fueron evaluadas mediante T de Student apareada intra grupo y no apareada entre grupos. Las variables Score de Lanza mediante Chi2, el escore de síntomas mediante test de Wilcoxon (intragrupo), y U de Mann-Whitney entre grupos.
Resultados
Ingresaron al estudio 34 pacientes que cumplieron los criterios de inclusión y exclusión, de los cuales se analizaron por ITT 30 pacientes, o sea, aquellos pacientes que recibieron los medicamentos de prueba y tuvieron una evaluación posterior a la administración del mismo.

Conclusiones
La selección de un medicamento está basada en efectividad, seguridad, calidad y costo.
En general, los ensayos clínicos se realizan con el objetivo de demostrar la superioridad del medicamento estudiado respecto al de referencia. Esta superioridad puede ser de eficacia o de seguridad.
Pero cada vez es más frecuente que el objetivo del ensayo sea demostrar que el fármaco de estudio es igual de eficaz que el de referencia o, al menos, no inferior, bien porque el tratamiento control tenga una eficacia difícil de superar o porque el tratamiento experimental presente otras ventajas, como una administración más cómoda o una menor duración del tratamiento, o mayor accesibilidad al producto.
Desde el punto de vista de la compañía farmacéutica y de las expectativas de los investigadores que han llevado a cabo el estudio, lo deseable es encontrar evidencias de superioridad del nuevo medicamento. También desde el punto de vista del médico y de los que trabajamos para la salud, las esperanzas están en que el nuevo producto sea superior y permita un avance en la terapia de los pacientes.
En cuanto a la selección de medicamentos, lo que nos interesa es determinar cuándo un medicamento puede ser clasificado como superior al de referencia y cuándo como equivalente terapéutico, bien porque se haya demostrado equivalencia terapéutica o porque las diferencias encontradas no sean importantes clínicamente20.
Este estudio de equivalencia terapéutica fue diseñado para un tamaño de muestra que pudiera evaluar alguna diferencia entre dos marcas de Esomeprazol comercializadas en el país, en la curación y mejoría de los síntomas. Sin embargo no fue posible alcanzar el número de pacientes para tener una potencia del 90% para determinar una diferencia entre los grupos debido a que un criterio de exclusión, no haber tomado bloqueantes de la bomba de protones durante las últimas semanas, impidió la inclusión de una gran cantidad de pacientes.
En un estudio realizado durante un periodo de 4 años que incluyó 63.878 admisiones a hospitales en los EEUU, se observó que la terapia de supresión de ácido fue indicada en un 52% de los pacientes (83% inhibidores de la bomba de protones, 23% Bloqueantes-H221. Y si a esto añadimos la inmensa automedicación ante cualquier síntoma digestivo podemos encontrar la explicación a que no se pudiesen incluir más pacientes.
En cuanto a las características demográficas de los pacientes incluidos no había diferencias estadísticas entre los dos grupos de pacientes, tanto de los que recibían el esomeprazol de referencia como el evaluado, eso nos permite concluir que nuestra muestra fue homogénea y comparable.
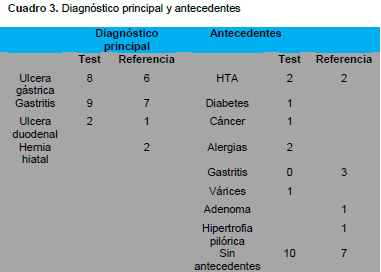
De igual forma los diagnósticos endoscópicos iniciales de ambos grupos fueron similares por lo que no existió diferencia estadísticamente significativa en cuanto al diagnóstico inicial.
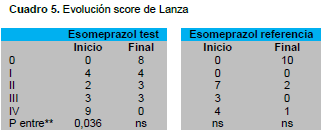
En cuanto a la mejoría endoscópica se utilizó el score de Lanza y podemos evidenciar que en el esomeprazol evaluado (ULGARIN®) presentó diferencias en cuanto al diagnóstico inicial y post tratamiento, con mejoría del score utilizado en el estudio, siendo esto estadísticamente significativo. Por lo contrario en el grupo de referencia no hubo diferencias significativas del score inicial y post tratamiento e inclusive, en la afectación más severa donde el score de lanza fue IV se evidenció que el medicamento a evaluar mejoró en un 100% el score, no así en el medicamento de referencia donde de 4 casos con score de IV, 3 pacientes presentaron mejoría post-tratamiento pero uno persistió con iguales hallazgos; podríamos decir que a pesar de una muestra pequeña, el esomeprazol evaluado es superior al de referencia en cuanto a la mejoría endoscópica evaluado por el score de Lanza.
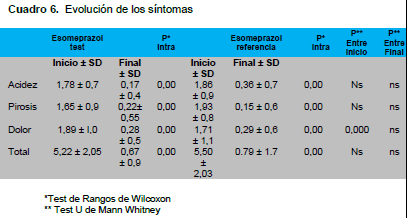
En cuanto a la mejoría clínica, ambos grupos mejoraron los síntomas luego de la administración de los medicamentos, tanto el evaluado como el de referencia, y no hubo diferencias estadísticamente significativas. En cuanto a la presencia de Helicobacter Pylori podemos observar que en el grupo test respondieron al tratamiento para erradicación en un 86% aproximadamente, no así en el esomeprazol de referencia donde el 100% erradicó la bacteria sin embargo esto no fue estadísticamente significativo.
Clasificación del trabajo
AREA: Gastroenterología.
TIPO: Clínico.
TEMA: Equivalencia terapéutica.
PATROCINIO: Laboratorios Leti S.A.V. (aprobado por el Ministerio del Poder Popular para la Salud). Conflictos de interés: Los Dres. Maria Gonzalez Yibirin y David Rincón Matute, pertenecen al departamento de investigación clínica de Laboratorios LETI S.A.V. 2.
Referencias Bibliográficas
1. Scott LJ, Dunn CJ, Mallarkey G, Sharpe M. Esomeprazole: a review of its use in the management of acid-related disorders. Drugs. 2002;62:1503-1538. [ Links ]
2. Spencer CM, Faulds D. Esomeprazole. Drugs. 2000;60:321-329. [ Links ]
3. Barone JA, Horn JR. Comparative pharmacology of proton pump inhibitors. Manag Care. 2001;10(suppl):11-16. [ Links ]
4. Robinson M, Horn J. Clinical pharmacology of proton pump inhibitors: what the practising physician needs to know. Drugs 2003;63(24):2739-2754. [ Links ]
5. Röhss K, Hasselgren G, Hedenström H. Effect of esomeprazole 40 mg vs omeprazole 40 mg on 24 hour intragastric pH in patients with symptoms of gastroesophageal reflux disease. Dig Dis Sci. 2002;47(5):954-958. [ Links ]
6. Howden CW, Ballard ED, Robieson W. Evidence for therapeutic equivalence of lansopazole 30 mg and esomeprazole in the treatment of erosive esophagitis. Clin Drug Invest 2002;22:99-109. [ Links ]
7. Castell DO, Kahrilas PJ, Rchter JE, et al. Esomeprazole (mg) compared with lansoprazole (30 mg) in the treatment of erosive esophagitis. Am J Gastroenterol. 2002;97:575-583. [ Links ]
8. Andersson T, Hassan-Alin M, Hasselgren G, Röhss K, Weidolf L. Pharmacokinetic studies with esomeprazole, the (S)-isomer of omeprazole. Clin Pharmacokinet. 2001;40(6):411-426. [ Links ]
9. Rai A, Orlando R. Gastroesophageal reflux disease. Curr Opin Gastroenterol. 1998;14:326-333. [ Links ]
10. Dent J, Brun J, Fendrick AM, et al. An evidence-based appraisal of reflux disease management – the Genval Workshop. Gut. 1999;44(2):S1-S16. [ Links ]
11. Richter JE, Kahrilas PJ, Johanson J, et al. Esomeprazole Study Investigators. Efficacy and safety of esomeprazole compared with omeprazole in GERD patients with erosive esophagitis: a randomized controlled trial. Am J Gastroenterol. 2001;96(3):656-665. [ Links ]
12. Kahrilas PJ, Falk GW, Johnson DA, et al. Esomeprazol improves healing and symptom resolution as compared with omeprazole in reflux oesophagitis patients: a randomized controlled trial. The Esomeprazole Study Investigators. Aliment Pharmacol Ther. 2000;14(10):1249-1258. [ Links ]
13. Talley N, Lauritsen K, Tunturi-Hihnala H, et al. Esomeprazole 20 mg maintains symptom control in endoscopy-negative gastro-oesophageal reflux disease: a controlled trial of "on demand" therapy for 6 months. Aliment Pharmacol Ther. 2001;15(3):347-354. [ Links ]
14. Touw DJ. Clinical implications of genetic polymorphisms and drugs interactions mediated by cytochrome P-450 enzymes. Drug Metabol Drug Interact. 1997;14:55-82. [ Links ]
15. Tybring G, Böttiger Y, Widén J, Bertilsson L. Enantioselective hydroxylation of omeprazole catalysed by CYP2C19 in Swedish white subjets. Clin Pharmacol Ther. 1997;62(2):129-137. [ Links ]
16. Keating GM, Figgitt DP. Intravenous Esomeprazole. Drugs. 2004;64(8):875-882. [ Links ]
17. Lanza FL. Endoscopic studies of gastric and duodenal injury after the use of ibuprofen, aspirin, and other nonsteroidal anti-inflammatory agents. Am J Med 1984;77(1A):19-24. [ Links ]
18. Lanza FL, Royer GL Jr, Nelson RS, Rack MF, Seckman CC. Ethanol, aspirin, ibuprofen, and the gastroduodenal mucosa: an endoscopic assessment. Am J Gastroenterol. 1985;80(10):767-769. [ Links ]
19. Soylu A, Dolapcioglu C, Dolay K, et al. Endoscopic and histopathological evaluation of acute gastric injury in high-dose acetaminophen and nonsteroidal anti-inflammatory drug ingestion with suicidal intent. World J Gastroenterol. 2008;14(43):6704–6710. [ Links ]
20. González M.; Casamayor LB.; García del Valle R.; Arroyo V.; De la Hija Díaz MB.; García Díaz-Guerra R. Equivalencia terapéutica. Importancia en la práctica clínica. Boletín Farmacoterapéutico de Castilla de La Mancha. 2012; XII(4). [ Links ]
21. Pérez Hoyer G, Pérez Machado L. Inhibidores de bomba, posibles consecuencias de su uso a largo plazo. GEN. 2011;65(4):376-379. [ Links ]













