Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.73 no.1 Caracas mar. 2013
Placentación, hormona gonadotrópica coriónica y cáncer
Drs. Nelson Velásquez*, Gerardo Fernández**, José Oberto Leal*
* Profesor Titular de la Universidad del Zulia. Departamento de Obstetricia y Ginecología. Hospital Chiquinquirá de Maracaibo.
**Profesor Emérito y Doctor Honoris Causa de la Universidad del Zulia. Departamento de Obstetricia y Ginecología. Hospital Chiquinquirá de Maracaibo.
INTRODUCCIÓN
Las células normales crecen, se dividen y tienen un mecanismo para dejar de hacerlo conocido como apoptosis o muerte celular programada (1); es decir mueren con el tiempo. Las células cancerosas a diferencia de las normales continúan creciendo y dividiéndose descontroladamente, y no porque exista una lesión en el ADN (2). Se supone que la transformación maligna es un proceso que engloba múltiples aspectos: pérdida progresiva del control por la célula normal, falla en el proceso de reparación del DNA, o menoscabo de los factores de apoyo que previenen el crecimiento anómalo (3,4).
Existen miles de millones de células en el cuerpo humano en diferentes etapas de desarrollo o diferenciación. Cuando las células crecen y se extienden rápidamente, con pérdida de control del crecimiento normal, aparece el cáncer (5). Las células cancerosas suelen agruparse y formar tumores. Un tumor maligno es un bulto o grupo de células cancerosas que destruyen a las células normales que lo rodean y dañan los tejidos sanos del cuerpo. A veces, las células cancerosas se separan del tumor original y se dirigen hacia otras partes del cuerpo; cuando esto ocurre, recibe el nombre de metástasis, la extensión puede ser local, hemática, linfática o por embolización.
En su aparición se han señalado agentes intrínsecos, tales como la herencia, dieta u hormonas y a elementos extrínsecos, que algunos los han denominado factores epigenéticos, avalados casi todos por estudios científicos, como son: contacto, ingestión o inhalación de sustancias químicas, conocidas son por ejemplo, las asociadas al hábito tabáquico, las radiaciones ionizantes, obesidad, virus y bacterias, solos o algunos en asociación, contribuyendo a la activación de cambios en los genes de las células. Muchos de los factores extrínsecos actúan dañando los genes; en el caso de las afecciones virales se ha determinado que introducen sus propios genes dentro de las células, mientras que la herencia transmite alteraciones estructurales en los genes, permitiendo que el hospedero sea más susceptible al desarrollo del cáncer. Puede ocurrir en el feto durante su gestación, en niños y adolescentes; pero son más comunes en los adultos y durante el envejecimiento. Un origen multifactorial no puede descartarse y por considerarlo un grave problema de salud pública nunca ha cesado la búsqueda de su etiología.
En esta publicación se muestra una breve reseña de algunos avances que han tratado de relacionar el origen de la vida de algunos mamíferos, la evolución de la hormona gonadotropina coriónica (hGC) o sus variantes, y la forma de su placentación. ¿Queda poco tiempo para encontrar el origen de las enfermedades malignas o aún hay que hacer una larga espera para lograrlo?
FECUNDACIÓN, PLACENTACIÓN Y HORMONA CORIÓNICA
La fecundación normal del óvulo permite la unión de 2 células haploides, óvulo y espermatozoide, con la finalidad de constituir un huevo o cigoto diploide; ocurre en el tercio externo de la trompa de Falopio, 24 a 48 horas posteriores a la ovulación. Después de 10 horas los 2 pronúcleos se van aproximando y sus cromosomas se condensan; más tarde ocurre la organización y formación de la primera mitosis que dará origen a 2 células o blastómeras y sucesivamente la división celular para formar el embrión que se implantará durante la fase de blastocisto en el endometrio preparado, aproximadamente 7 a 8 días luego de la fertilización. La receptividad endometrial está condicionada por factores endocrinos, paracrinos y autocrinos que modulan todos los pasos bioquímicos y moleculares para llevar adelante este proceso. Este fenómeno incluye 3 estadios: aposición, adhesión e invasión.
La sincronización entre el desarrollo del trofoblasto y la preparación endometrial requiere de múltiples señales. El trofoblasto penetra en el epitelio uterino, reemplaza parcialmente el endotelio de los vasos miometriales (invasión endovascular) y se establece la circulación útero placentaria, colocando al trofoblasto en contacto directo con la sangre materna constituyéndose una placentación del tipo hemocorial, característica de los humanos. La placentación es el proceso en el cual las células trofoblásticas darán origen a la placenta, órgano único autónomo y transitorio. Tiene como fin generar un medio de unión e intercambio de oxígeno y nutrientes entre las estructuras fetales y maternas, gracias al establecimiento de la circulación sanguínea; actúa como un órgano endocrino transitorio, puede ser fuente de numerosas hormonas y mediadores químicos indispensables para el mantenimiento del embarazo y colabora en la adaptación maternal al nuevo estado de gravidez. En los animales existen varios tipos, dependiendo de la relación entre los tejidos maternos y fetales, es decir, de la cantidad de tejido que separa la sangre materna de la fetal.
La placentación endoteliocorial, es aquella en las que los vasos maternos en el endotelio están desnudos y en contacto con el corion de la membrana fetal; se observa en la mayoría de los carnívoros zorros, perros y gatos. La epiteliocorial, en la cual el epitelio uterino y el corion están en contacto y no lo invaden; es característica de vacas, yeguas y ballenas, se llama también placenta adeciduata. En la hemocorial, presente en la especie humana, la sangre materna conecta directamente con el trofoblasto (corion). Su desarrollo se lleva en un medio relativamente pobre de oxígeno -hipoxia relativa- y se estima que puede estar regulada por varios factores como el oxígeno mismo, la matriz extracelular y ciertas sustancias químicas como las citoquinas, factores de crecimiento y hormonas (6,7).
Casi inmediatamente después de la fertilización en la mujer, las células trofoblásticas inician la producción de hormona coriónica o gonadotropina coriónica humana (hCG), que puede ser detectada en sangre a los 9 días posteriores al pico ovulatorio de la LH, que generalmente ocurre 8 días pos-ovulación y uno después de la implantación; es decir, puede detectar embarazo en todas las pacientes 11 días después de la fertilización. Sus concentraciones se elevan exponencialmente hasta 9-10 semanas del embarazo, doblando su cantidad entre 1,3-2 días. Tiene un peso molecular de 36 000-40 000 Da. Está compuesta de 2 subunidades la α y la β, la primera es común a otras hormonas. La β le confiere la especificidad (8).
Las concentraciones de hCG en suero y orina varían sustancialmente durante el embarazo y entre los individuos. Los métodos para su detección son múltiples y los laboratorios o equipos para ello presentan variaciones en sus concentraciones de acuerdo al número de semanas de la gestación. Por estos motivos, su uso para fechar un embarazo a partir del último día del período menstrual ha sido cuestionado y considerado por algunos como de poca utilidad. Sus variaciones se han estimado como las más grandes de cualquier otra hormona o de sus metabolitos entre individuos y embarazos saludables, los valores oscilan desde 0,21 ng/mL a 173 ng/mL en la 4ª semana de gestación y de 1,86 ng/mL a 1 308 ng/mL en la 5ª semana. Se han conseguido concentraciones tan bajas como de 20 mIU/mL o tan altas como 8 900 mIU/mL en la 5ª. semana de embarazo que han conducido a partos normales de término (9). En orina, las variaciones han sido reportadas como más grandes; en la 5a. semana, han sido encontrado valores desde 22,8 mIU/mL a 41,950 mIU/mL. Dentro de las explicaciones para estas amplias oscilaciones está la que establece que cuando una pequeña cantidad de receptor es activada, puede producirse una respuesta similar a cuando se activan todos los receptores celulares, debido a limitaciones en las respuestas de la adenosina monofosfato cíclico, proteína kinasa o proteína G celular; teoría conocida como fenómeno del receptor ahorrador o ahorradora del receptor de LH/hCG (10).
Por primera vez se demostró que la fuente de la variabilidad en las concentraciones de hCG durante el embarazo es atribuible a diferencias individuales existentes en su producción para cada uno de los embarazos (9). Laurence A Cole, (9) de la Universidad de New Mexico en EE.UU, realizó un interesante estudio, en el cual colectó orina del primer vaciado en 220 mujeres que deseaban embarazarse y en quienes se determinó la presencia de LH usando un kit de uso en el hogar; 98 de los embarazos clínicos llegaron a término normalmente. La muestras de orina fueron tomadas en ciclos menstruales no gestacionales, gestacionales y después de haberse logrado embarazo, se continuó hasta la 7ª semana. Ochenta y dos de 98 voluntarias recolectaron exitosamente las muestras de orina. Demostró que el verdadero embarazo ocurre en el momento de la implantación, que varía entre 16 a 32 días después del último período menstrual; señaló además que la mayor variación en sus niveles es causado por las diferencias placentarias y la tasa de producción con el tiempo. Hubo 120 embarazos clínicos y 390 bioquímicos, 20 de los primeros terminaron en abortos espontáneos en el 1º y 2º trimestre y 2 finalizaron en embarazos ectópicos. Concluyó, que no por el hecho de producir concentraciones altas o bajas en la semana previa a la implantación, ese embarazo va producir altas o bajas concentraciones de la hormona. Se utilizaron muestras de orina por la dificultad de obtener sangre diariamente, por tan largo tiempo, hasta que se alcanzara un embarazo y más allá de el (11).
GONADOTRÓPINA CORIÓNICA, FORMAS MOLECULARES Y CÁNCER
Hoy se conoce que la hormona coriónica gonadotrópica está formada por un grupo de 5 moléculas, cada una compartiendo una secuencia común de aminoácidos, pero que difieren en la estructura mérica y la cadena de aminoácidos; se producen en células separadas y cada una posee funciones biológicas distintas. Por ejemplo, la hCG y la forma hCG sulfatada, son elaboradas por las células del sincitiotrofoblasto placentario y las células gonadotrópicas de la hipófisis; en cambio la hCG hiperglicosilada se origina en las células del citotrofoblasto placentario de manera autocrina; esta forma hiperglicosilada impulsa y estimula la malignidad de los cánceres placentarios, testiculares y de las células germinales del ovario. La hCG-β y la forma hiperglicosilada de la hCG-β son producidas también de manera autocrina por gran parte de los cánceres avanzados, como son la mayoría de los tumores epiteliales malignos o carcinomas, adenocarcinomas, sarcomas, teratomas, blastomas, leucemias y linfomas (12).
Ha sido demostrado que el coriocarcinoma y los tumores malignos de las células germinales ováricas producen una variante diméricas larga de hCG, una forma hiperglicosilada hCG (hCG-H), con una larga cadena lateral de carbohidratos donde los oligosacáridos son notablemente diferentes entre los del embarazo y los del coriocarcinoma (13). Alfthan y col. (14) la encontraron en malignidades pancreáticas y de las vías biliares. Butler y col. (15) la hallaron en cánceres de vejiga urinaria, tumores epiteliales y sarcoma de Kapossi y lograron la reducción del crecimiento de las células cancerosas en respuesta al uso de vacunas anti-hCG (15-17). Hussa y col. la hallaron en células de carcinomas del cuello uterino. Algunos investigadores han utilizado la determinación de la hiperglicosilada-hCG como marcador tumoral en el diagnóstico de cánceres donde no se ha encontrado el origen primario del tumor (19). Otros, como Regelson en 1995 (20) se preguntaba si ya se había encontrado un biomarcador definitivo del cáncer.
SITIOS DE PRODUCCIÓN/ACCIÓN DE HORMONA CORIÓNICA
La función principal de la hCG durante el embarazo es impulsar el desarrollo de la placenta hemocorial para que sea eficiente en transferir nutrientes al feto y la más conocida de todas es la que se refiere al mantenimiento y función del embarazo en las 3-4 primeras semanas, conduciendo la esteroidogénesis en el cuerpo amarillo y la producción de progesterona. Hoy se conoce que esta hormona está relacionada a una gran cantidad de funciones y que las otras fracciones o moléculas de hCG tienen críticos papeles durante la gestación. Ella podría controlar el crecimiento uterino, fetal y placentario durante el embarazo, protegerlo de la contracción miometrial, del rechazo inmunológico o de los macrófagos, esto último actuando como un factor inhibitorio anti-macrófagos o sobre el factor inhibidor de la migración de ellos. También reduce su actividad fagocitaria en la interfase útero-placentaria previniendo la destrucción del tejido fetoplacentario por los sistemas de macrófagos maternos (21,22).
Se han encontrado receptores de hCG/LH en cerebro humano adulto, en áreas como el hipocampo, hipotálamo y tallo cerebral, que podría explicar las náuseas, vómitos e hiperémesis durante el embarazo. Han sido localizados en hígado, pulmón, riñones, bazo, intestino grueso y delgado de fetos, pero están ausentes en estos órganos adultos; parece como si decrecieran al nacimiento. Han sido detectados en semen, pero su papel no es claro (23).
La forma hiperglicosilada de hCG impulsa la invasión e implantación de las células placentarias muy profundamente en el miometrio, conduce el crecimiento de las células del citotrofoblasto, promueve la fusión y diferenciación de las células periféricas del citotrofoblasto a células sinciciales o sincitiotrofoblasto. Ambas moléculas, la hCG y la hiperglicosilada conducen a la implantación del tejido placentario dentro del útero y la formación del tejido trofoblástico velloso. Paralelamente promueven el crecimiento y desarrollo de las arterias espiralazas y la formación del cordón umbilical y de la circulación umbilical en las vellosidades coriales El mecanismo intrínseco de cómo ocurre esta función permanece sin elucidarse (24-26).
Esta molécula, Maravilla de la Ciencia de hoy (23) es la glicoproteína más ácida y la que posee más alto contenido de azucares, y, aunque entre sus múltiples funciones está la más estudiada y antigua como lo fue la del soporte a la producción de progesterona durantes las tres primeras semanas que siguen a la implantación, ahora se sabe que puede controlar el cáncer en los seres humanos.
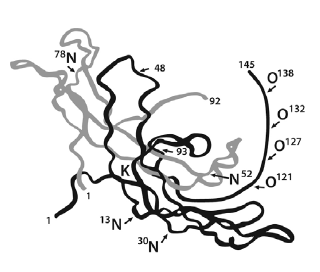
Es muy importante conocer que la subunidad β tiene una secuencia común con el Factor Transformador del Crecimiento β (TGF-β) y cuando se examinó la configuración de su molécula cristalizada, se descubrió la presencia de una estructura vinculada a la cistina, que también es común al TGF-β B y a otras citoquinas (27) (Figura 1). La hCG, en ocasiones no pone de manifiesto esta secuencia o estructura común a TGF-β, pero sus variantes si lo hacen y como consecuencia, la hCG hiperglicosilada, hCG-β y la hCG-β hiperglicosilada pueden antagonizar al receptor de TGF-β, de esta manera autocrina son promotoras de cáncer, aparentemente antagonizando al receptor del TGF-β. Las 2 formas diméricas; la hCG y la hCG hiperglicosilada, funcionan diferentemente, la primera sobre el receptor hCG/LH, la segunda, producida por el citotrofoblasto, es en forma autocrina un antagonista de del TGF-β, pero ambas controlan la implantación, placentación y función del cuerpo amarillo del embarazo. La hiperglicosilada hCG es una variante muy glicosilada que principalmente se produce en las primeras tres semanas del embarazo para controlar la implantación, el crecimiento de las células del citotrofoblasto y su invasión; ya se sabe que antagonizando el receptor del TGF en estas células se producen procesos similares a los del cáncer: bloqueo de la apoptosis y secreción de enzimas invasivas metaloproteinasas y colagenasas que conducen a crecimiento e invasión proteolítica. En la Figura 2 se observa la comparación entre la LH y las estructuras moleculares de GC de algunos mamíferos.
Figura 1. Estructura cristalina de la hCG regular desglicosilada. Sububnidad
a (gris) y b (negro).Figura 2. Estructura de gonadotrofina coriónica (GC) en algunos mamíferos comparada con la LH.
La hCG genera la fusión de las células citotrofoblásticas para formar el sincitiotrofoblasto; también promueve la angiogénesis y formación de la circulación umbilical, sistemas que en su conjunto participan en la formación de las placentas hemocoriales (28,29).
Algunos estudios han demostrado que la gonadotrofina coriónica además de estimular la angiogénesis y la vasculogénesis durante la placentación también lo hace a nivel del pericito, estimulando su reclutamiento (24) y como a nivel de las arterias uterinas existen receptores para hCG/ LH, pueden regular la formación de eicosanoides y al disminuir el índice de resistencia en ellas cuando se indica hCG para inducir la ovulación, no sería difícil pensar que pudiera estar relacionada a la regulación fisiológica del flujo sanguíneo, algunas hemorragias obstétricas y abortos (30,31).
Del mismo modo se ha demostrado su participación en la proliferación de las células del músculo liso uterino y que esta proliferación es mucho más pronunciada en células de los leiomiomas uterinos (33).
EVOLUCIÓN Y HORMONA CORIÓNICA
Otro aspecto interesante es la relación que se ha querido establecer entre los procesos de placentación, desarrollo de la masa encefálica, la gonadotropina coriónica (GC) y una de sus variantes; la hiperglicosilada GC, en mamíferos. En este contexto se ha estudiado la evolución del desarrollo de la placentación hemocorial desde los simios primates menos a más evolucionados sugiriéndose que los sistemas ultraeficientes de la placentación hemocorial en primates avanzados son necesarias para el desarrollo de la masa encefálica. También se ha conocido que la GC aparece en los primates al mismo tiempo que la placentación hemocorial. Laurence Cole (34) del Servicio de Referencia de hCG de EE.UU y del Departamento de Obstetricia y Ginecología y Centro de las Ciencias de la Salud de la Universidad de New Mexico, en Alburquerque, EE.UU ha examinado la progresión de la placentación hemocorial, todas las formas de la GC, y su papel en la evolución nutricional del cerebro.
En los primates prosimios como el lémur no hay invasión placentaria al útero, es de tipo epiteliocorial, en la cual simplemente existe un vínculo a la decidua y la nutrición es realizada por simple difusión desde las arterias maternas a la placenta. Estos animales son primates estrepsirrinos de la Isla de Madagascar a veces son confundidos con primates ancestrales, los antropoides: monos, homoides y seres humanos porque comparten algunos rasgos morfológicos y de comportamiento con los primates basales, solo tienen 0,07 % de cerebro, en relación con su masa corporal. En simios primates de especies mas bajas, tales como el tití y monos cebus, ya ocurre invasión placentaria, extendiéndose a la decidua endometrial lo que permite que su cerebro sea un 0,17 % de la masa corporal. En simios más avanzados como los mandriles y orangutanes, la invasión se extiende una décima del miometrio, alcanzándose 0,74 % de cerebro, constituyendo una forma avanzada de placentación hemocorial.
En los humanos la placentación es única y el blastocisto llega a estar completamente embebido dentro del endometrio materno, la extensión de la invasión ocurre hasta un tercio de la anchura del endometrio y es la más eficiente de las placentas hemoriales, permitiendo una masa cerebral que ocupa el 2,4 % de la corporal.
Hechos relacionados con la mutación y/o evolución de las formas moleculares de HC, que involucran la aparición de varias subfracciones cada vez con más oligosacáridos y acido siálico, la mayor invasión placentaria para mejorar la nutrición fetal y el desarrollo de su masa cerebral y la aparente vinculación de estos procesos con algunas malignidades, han permitido que investigadores como Cole, establezcan entre ellos paralelismos estrechos.
COLOFÓN
No existe duda que desde que surge el cáncer como entidad clínica, que aparece en cualquier parte de la economía y que es causa muy común de mortalidad en la especie humana, se ha tratado de establecer su origen, de obtener diagnóstico temprano y el tratamiento más adecuado. A pesar de las investigaciones que día a día se realizan no ha podido encontrarse ni el origen ni el tratamiento efectivo para la mayoría de ellos. Seguirán las indagaciones.
Agradecimiento
Agradecemos al Lic. Nelson G-S Velásquez E. por el diseño de los gráficos que aparecen en la revisión.
REFERENCIAS
1. DiSaia PJ, Creasman WT. Genes and cancer. En: Clinical Gynecologic Oncology. 6a. edición. St. Louis Missouri: Editorial Mosby; 2002.p.572-573. [ Links ]
2. Ross DW. Introduction to molecular medicine. 2a edición. Nueva York: Springer-Verlag; 1997. [ Links ]
3. Parshad R, Price FM, Bohr VA, Cowans KH, Zujewski JA, Sanford KK. Deficient DNA repair capacity, a predisposing factor in breast cancer. Br J Cancer. 1996;74: 1-5. [ Links ]
4. Mutch DG, Williams S. Biology of ephitelial ovarian cancer. Clin Obstet Gynecol. 1994;37:406-422. [ Links ]
5. González-Merlo J. Ginecología Oncológica. 2ª edición. Barcelona, España: Editorial Masson; 2000. [ Links ]
6. Chakraborty C, Gleeson LM, McKinnon T, Lala PK. Regulation of human trofoblast migration and invasiveness. Can J Physiol Pharmacol. 2002;80:116- 124. [ Links ]
7. Malassine A, Cronier L. Hormones an human trophoblast differentiation: A review. Endocrine. 2002;19:3-11. [ Links ]
8. Knuppel RA. Maternal-placental-fetal unit; fetal & early neonatal physiology. En: De Cherney AH, Goodwin TM Nathan L, Lufer N, editores. Current Diagnosis & treatment Obstetrics & Gynecology. 10ª edición. Nueva York: McGraw- Hill; 2007.p.159-186. [ Links ]
9. Cole LA. Individual deviations in human chorionic gonadotropin concentrations during pregnancy. Am J Obstet Gynecol. 2011;204:349-350. [ Links ]
10. Madsen BW. Spare receptors. Clin Exp Pharm Phys 1979; 6: 713-714. [ Links ]
11. Cole LA, Ladner DG, Byrn FW. The normal variabilities of the menstrual cycle. Fertil Steril. 2009;91:522-527. [ Links ]
12. Cole LA, Butler S. Hyperglicosylated hCG, hCGβ and hyperglicosylated hCG-β: Interchangeable cancer promoters. Mol Cell Endocrinol. 2012;349:232-238. [ Links ]
13. Cole A. The O-linked oligosaccharides are strikingly different on pregnancy and choriocarcionoma hCG. J Clin Endocrinol Metab. 1987;65:811-813. [ Links ]
14. Alfthan H, Haglund C, Roberts P, Stenman UH. Evaluation of free β-subunit of human choriogonadotropin and core β-fragment of human choriogonadotropin in the serum an urine of patiens with malignant pancreatic and biliary disease. Cancer Res. 1992;53:4628-4633. [ Links ]
15. Butler SA, Ikram MS, Mathieu S, ILES RK. The increase in bladder carcinoma cell population induced by the free beta subunit of hCG is a result of an antiapoptosis effect and not cell proliferation. Brit J Cancer. 2000;82:1553-1556. [ Links ]
16. Butler SA, Staite EM, Iles RK. Reduction of bladder cancer cell growth in response to hCGβ vaccinated mouse serum. Oncol Res Anti Cancer Drug Des. 2003;14:93-100. [ Links ]
17. Butler SA, Iles RK. Ectopic human chorionic gonadotropin B secretion by epitelial tumors and human chorionic gonadotropin β-induced apoptosis in Kapossi´s sarcoma, is there a conection? Clin Cancer Res. 2003;9:4666-4673. [ Links ]
18. Hussa RO, Fein HG, Pattillo RA, Nagelberg SB, Rosen SW, Weintraub BD, et al. A distinctive form of human chorionic gonadotropina B- subunit-like material produced by cervical carcinoma cell. Cancer Res. 1986;46:1948-1954. [ Links ]
19. Ruddon RW, Norton SE. Use of biological markers in the diagnosis of cancers of unknown primary tumor. Semin Oncol. 1993;20:251-260. [ Links ]
20. Regelson W. Have we found the definitive cancer biomarker? The diagnostic and therapeitic implicacions of human chorionic gonadotropina-beta statemente as a key to malignancy. Cancer 1995; 76: 1299-1301. [ Links ]
21. Akoum A, Metz CN, Morin M. Marked increase in macrophage mygration inhitory factor síntesis and secretion in human endometrial cell in response to human chorionic gonadotropina hormone. J Clin Endocrinol Metab. 2005;90:2904-2910. [ Links ]
22. Wan H, Marjan A, Cheung VW, Leenen PJM, Khan NA, Benner R, et al. Chorionic gonadotroppun can enhance innte inmunity by stimulating macrophage function. J Leukoc Biol. 2007;82:926-933. [ Links ]
23. Cole LA. hCG, the wonder of today´s science. Reprod Biol Endocrinol. 2012;10: 24 doi:10.1186/1477-7827- 10-24. [ Links ]
24. Berndt S, Blacher S, Perrier d´Hauterive S, Thiry M, Tsampalas M, Cruz A, et al. Chorionic gonadotropin stimulation of angiogenesis and pericyte recruitment. J Clin Endocrinol Metab. 2009;94:4567-4574. [ Links ]
25. Burton GJ, Jauniaux E, Watson A. Maternal arterial connections to the placental intervillous space diring the first trimester of human pregnancy: The Boyd collection revisited. Am J Obstet Gynecol. 1999;181:718-724. [ Links ]
26. Rao CV, Lei ZM. The past, present and future of nongonadal LH/hCG actions in reproductive biology and medicine. Mol Cell Endocrinol. 2007;269:2-8. [ Links ]
27. Lapthorn AJ, Harris DC, Littlejohn A, Lusbader JW, Canfield RE, Machin KJ. Crystal structure of hCG. Nature. 1994;369:455-461. [ Links ]
28. Khoo NK, Bechberger JF, Shepherd T, Bond SL, McCrae KR, Hamilton GS, et al. L SV40 Tag transformation of the normal invasive trophoblast results in a premalignant phenotype I. Mechanisms responsaible for hyperinvasiveness and resistance to anti-invasive action of the TGF-β. Intl J Cancer. 1998;77 429-439. [ Links ]
29. Wasowicz G, Derecka K, Stepien A, Pelliniemi L, Doboszynsk T, Gawronska B, et al. Evidence for the presence of the luteinizing hormone hormonechorionic gonadotrophin receptors in the pig umbilical cord. J Reprod Fertil. 1999;117:1-9. [ Links ]
30. Toht P, Li X, Rao CV, Lincoln SR, Sanfilipo JS, Spinnato JA, et al. Expression of functional human chorionic gonadotropin/human luteinizing hormone receptor gene in human uterine arteries. J Clin Endocrinol Metab. 1994;79:307-315. [ Links ]
31. Zygmunt M, Herr F, Keller-Shoenwetter S, Kunzi- Rapp K, Munstedt K, Rao CV, et al. Characterization of human chorionic gonadotropin as a novel angiogenic factor. J Clin Endocrinol Metab. 2002;87:5290-5296. [ Links ]
32. Zygmunt M, Herr F, Munstedt K, Lang U, Liang OD. Angiogenesis and vasculogenesis in pregnancy. Eur J Obstet Gynecol Reprod Biol. 2003;110(Suppl):1018. [ Links ]
33. Horiuchi A, Nikaido T, Yoshizawa T, Itoh K, Kobayashi Y, Toki T, et al. HCG promotes proliferation of uterine leiomyomal cells more strongly than that of myometrial smooth muscle cells in vitro. Mol Hum Reprod. 2000;6:523-528. [ Links ]
34. Cole LA. hCG and hyperglycosylated hCG in the establishment and evolution of hemochorial placentation. J Reprod Immunol. 2009;82(2):112- 118. [ Links ]