Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.73 no.1 Caracas mar. 2013
Leucemia mieloide aguda durante el embarazo. Reporte de un caso
Msc. José Urdaneta Machado,
Betty Benítez 1, Drs. Nasser Baabel Zambrano, Gustavo Valbuena 21 Universidad del Zulia. Facultad de Medicina. Escuela de Bioanálisis. Departamento de Morfofisiopatología.
2 Universidad del Zulia. Facultad de Medicina. Escuela de Medicina. Departamento de Ginecología y Obstetricia.
Correspondencia: José Ramón Urdaneta Machado. Móvil: 0414-6173150 Correo electrónico: doctorjrum@hotmail.com
RESUMENSe trata de primigesta de 18 años, etnia wayuu, con amenorrea de 30,5 semanas, quien acude en condiciones clínicas de cuidado por presentar disnea acentuada desde hace una semana. El examen físico demostraba palidez cutánea marcada, hiperplasia gingival, soplo holosistólico grado I, taquisfigmia, murmullo vesicular abolido en ambas bases pulmonares con crepitantes bilaterales, abdomen globoso, útero grávido, AU: 27 cm, feto cefálico activo, tacto sin modificaciones. Presenta anemia, marcada leucocitosis, hipoproteinemia, elevación de LDH, y patrón de consolidación bibasal en radiografía pulmonar. Ingresa con diagnóstico de embarazo simple pretérmino, neumonía bilateral, enfermedad linfoproliferativa, y sepsis (?); durante su evolución presenta alteración en el perfil biofísico fetal y hemodinámico, practicándose cesárea segmentaria debido a oligoamnios y sufrimiento fetal agudo. Se obtiene neonato pretérmino, el cual ingresa por prematuridad, sepsis neonatal y enfermedad de membrana hialina. Frotis de sangre periférica revela leucopenia con predominio de monocitos, trombocitopenia, anisocitosis, hipocromia, y macroplaquetas; mientras que el aspirado de médula ósea presentaba 80 % de infiltración de mieloblastos y alteraciones en la citometría de flujo. Recibe quimioterapia según protocolo BMS y manejo médico de las complicaciones presentadas, fallece durante el puerperio tardío.
Palabras clave: Leucemia mieloide aguda. Embarazo. Neoplasias hematológicas.
SUMMARY
Primigravida 18 years, ethnicity Wayuu, with 30.5 weeks of amenorrhea, who went into clinical conditions of care for presenting accentuated dyspnea since a week ago. Physical examination showed marked skin pallor, gingival hyperplasia, holosystolic blow, palpitations, vesicular murmur abolished in lungs bases with bilateral crackles. Abdomen with graves uterus, height 27cm, and cephalic active fetus; vaginal touch unchanged. Presents anemia, marked leukocytosis, hypoproteinaemia, elevated LDH, and pattern of consolidation at lungs radiographers. She is admitting with diagnosed of preterm pregnancy, bilateral pneumonia, lymphoproliferative disease, and sepsis (?); during its evolution presents impaired fetal biophysical profile and hemodynamic, practised caesarean operation due to oligoamnios and acute fetal distress. Obtained preterm infant, who was admitted because of prematurity, neonatal sepsis and hyaline membrane disease. Peripheral blood smear reveals predominantly monocytes leukopenia, thrombocytopenia, anisocitosis, hipocromia and macroplaquets. While the bone marrow aspirate showed 80 % of infiltration mieloblasts cells and alterations in the cytometry of flow. Receives chemotherapy by protocol BMS and medical management of complications presented, dies during the late puerperium
Key words: Acute myeloid leukemia. Pregnancy. Hematologic malignancy.
INTRODUCCIÓN
El cáncer complica aproximadamente 1 de cada 1 000 embarazos (1), representando las neoplasias hematológicas como grupo el 18 % - 25 % de las malignidades que complican el embarazo, después de los carcinomas de mama (26 %) y el cáncer de cuello uterino (26 %) (1,2); siendo la malignidad más frecuente el linfoma de Hodgkin, seguido de linfoma no Hodgkin y la leucemia aguda; viéndose el diagnóstico de estos cánceres hematológicos desafiado tanto por una superposición de la sintomatología de la enfermedad y los síntomas relacionados con la gestación, como por las limitaciones de los estudios de imagen en el embarazo (3).
Las leucemias son un grupo heterogéneo de neoplasias que surgen de las células progenitoras linfoides o mieloides, genéticamente alteradas, situadas en la médula ósea; esta anomalía genética da lugar a su crecimiento desordenado y su expansión clonal (2). Aunque la leucemia mieloide aguda (LMA) se produce sobre todo en pacientes de edad avanzada, también puede verse en mujeres en edad fértil; no siendo sorprendente que, en algunas pacientes, su manejo se complique por coexistencia de un embarazo; sin embargo, la asociación de la leucemia y la gestación es poco frecuente (4).
La incidencia de LMA durante el embarazo se estima que es similar al de la población en general, sin embargo, se han reportado tasas de 1 por cada 75.000 a 1 por cada 100 000 embarazos (2,4-7); esta baja incidencia puede explicarse por la elevada incidencia de infertilidad en las pacientes con leucemia (7). La LMA representa más de dos tercios de las leucemias que se presentan durante el embarazo, y menos del 10 % de estos casos involucran pacientes con leucemia mieloide crónica (LMC) (4,5). Aunque en las últimas dos décadas ha aumentado la frecuencia de comunicaciones sobre LMC en pacientes embarazadas, lo cual probablemente se relacione con el aumento de edad promedio de la población gestante o con una menor edad de presentación de la enfermedad (6).
Las leucemias agudas son de difícil manejo en la gravidez y su tratamiento debe iniciarse inmediatamente para no perjudicar el pronóstico materno (9); este tipo de neoplasias en una paciente embarazada supone un aumento del riesgo de aborto, mortalidad fetal y perinatal, además de restricción del crecimiento fetal y parto pretérmino espontáneo en un 40 %-50 % de las pacientes (4,10). De igual manera, también ha sido reportada la presencia tanto de mielosupresión materna y fetal en los casos tratados con quimioterapia en el segundo o tercer trimestre (11), como casos de pacientes en las cuales la neoplasia fue trasplantada de la madre al niño, presumiblemente a través de la placenta (4); aunque hasta la fecha solo ha sido reportado un caso de trasmisión materno fetal en una paciente con leucemia mieloide aguda y dos casos en pacientes con leucemia linfocítica aguda (5).
El abordaje de la leucemia aguda durante el embarazo presenta el desafío de favorecer una remisión prolongada y una curación de la madre mientras se minimiza la toxicidad para el feto; por tanto el diagnóstico de este tipo de neoplasias hematológicas durante el embarazo constituye un problema terapéutico, dada la gravedad del pronóstico tanto para la madre como para el producto, así como a los aspectos éticos al momento de considerar alguna opción terapéutica, lo cual plantea situaciones donde las resoluciones nunca son sencillas. Por otro lado, la interpretación de la literatura médica que soporte estas decisiones actualmente es imposible ya que los datos disponibles provienen de series pequeñas y retrospectivas o de reportes de casos (12); por lo que la verdadera incidencia y curso del embarazo y la leucemia son desconocidos (7).
Por tanto, se propone presentar caso clínico de LMA por la importancia para la comunidad médica debido a la rara asociación entre esta patología y la gestación; y a las dificultades en cuanto a su manejo.
CASO CLÍNICO
Adolescente embarazada de 18 años de edad, de la etnia wayuu, procedente del medio rural, área de difícil penetración (Alta Guajira, Colombia), primigesta, con amenorrea de 30,5 semanas según fecha de la última regla (FUR), quien acude en muy malas condiciones clínicas por presentar desde hace una semana dificultad para respirar acentuada, que imposibilitaba el decúbito dorsal, acompañándose de debilidad generalizada, mareos y aumento de temperatura corporal no cuantificada.
En cuanto a sus antecedentes se trataba de un embarazo mal controlado (dos consultas), con antecedentes familiares de trastornos mentales no especificado (padre), menarquía a los 13 años de edad, inicio de actividad sexual a los 17 años, única pareja y asma bronquial durante la infancia.
Al examen físico se encontraba en condiciones clínicas de cuidado, febril (temperatura axilar 38 oC), disneica (frecuencia respiratoria 28 por minuto), taquisfigmica (pulso 102 por minuto), normotensa, con palidez cutánea marcada, piel seca e hiperplasia gingival. La evaluación cardio-pulmonar revelaba la presencia de ruidos cardíacos rítmicos con soplo holosistólico grado I, murmullo vesicular abolido en bases pulmonares con crepitantes bilaterales y matidez a la percusión, expansibilidad respiratoria disminuida, con fremito vocal normal. Asimismo, las mamas se encontraban turgentes con secreción de calostro.
El abdomen era globoso, a expensas de útero grávido, con una altura uterina de 27 cm, y en su interior feto único en situación longitudinal, presentación cefálica, con movimientos fetales activos y frecuencia cardíaca fetal de 148 latidos por minutos.
Al tacto vaginal no se encontraron modificaciones cervicales. Las extremidades eran simétricas con masas musculares hipotróficas, sin edemas ni varices.
Los exámenes complementarios realizados durante su admisión mostraban anemia severa (HB 5,9 g/dL), leucocitosis (26 000 x mm3), fórmula leucocitaria con 45 % de segmentados, 30 % de linfocitos y 25.% de monocitos, hipoproteinemia, elevación de la enzima lactato deshidrogenasa sérica, y patrón de consolidación bibasal en radiografía pulmonar.
Basándose en las manifestaciones clínicas manifestadas por la paciente, los signos encontrados durante su evaluación y los hallazgos en los exámenes paraclínicos se decide su ingreso con los diagnósticos de: 1) Embarazo simple pretérmino (30,5 semanas x FUR), 2) neumonía bilateral. 3) enfermedad linfoproliferativa a estudiar y 4) sepsis (?)
Durante su estancia hospitalaria recibe antibioticoterapia (ceftriaxona), hemoderivados (2 unidades de concentrado de glóbulos rojos), mucolíticos, multivitamínicos, terapia respiratoria, antipiréticos, medidas paliativas y de vigilancia materno-fetal. Es manejada por un equipo multidisciplinario, conformado por especialistas en obstetricia, medicina interna, cardiología, neumonología, hematología y oncología. Se toman muestras séricas para frotis de sangre periférica y se realiza aspirado de médula ósea para estudio histológico.
Al quinto día de evolución, durante el monitoreo materno-fetal se realizó perfil biofísico fetal y hemodinámico, en el cual se visualizaba feto único activo de 28,2 semanas de gestación por biometría fetal, con un peso fetal estimado de 1 250 g, sin alteraciones estructurales, y con disminución en sus movimientos; asimismo, se visualizaba placenta grado III y disminución del líquido amniótico. La puntuación del perfil biofísico fetal fue de 6/10 puntos y el perfil hemodinámico demostró disminución del índice de resistencia a nivel de la arteria cerebral media.
Por tanto, se practica cesárea segmentaria debido a oligoamnios y sufrimiento fetal agudo; obteniéndose neonato pretérmino de 1 100 g y 34 cm con puntuación de Apgar de 7 puntos al nacer y 8 puntos a los 5 minutos, el cual es ingresado al Servicio de Neonatología por prematuridad, sepsis neonatal y enfermedad de membrana hialina.
El informe del frotis de sangre periférica revelaba leucopenia con predominio de monocitos, trombocitopenia, anisocitosis, hipocromia, y macroplaquetas; mientras que el aspirado de médula ósea mostró un 80 % de infiltración de mieloblastos y alteraciones en la citometría de flujo (CD15/CD13: 47.%, DR/C117: 32 %, MPO: 28 %, CD20: 16 %, DR/ CD34: 29 %). Por tanto, se concluye en el diagnóstico de leucemia mieloide aguda mieloblástica (LMA M4).
Durante el puerperio, presenta hepatoesplenomegalia, trombocitopenia, ascitis, infección urinaria baja con litiasis renal, neutropenia febril, dehiscencia e infección de herida operatoria por enterococo fecal según resultado de cultivo de la secreción. Recibe quimioterapia según protocolo BMS con metotrexate, ASA C y dexametasona intratecal; asimismo, las complicaciones presentadas son manejadas médicamente. Finalmente, la paciente fallece durante el puerperio tardío, tres semanas después de la culminación del embarazo.
En cuanto a la recién nacida, presenta durante su estancia en el servicio de neonatología: leucocitosis, hipoglucemia, hiperbilirrubinemia con ictericia, y hipoproteinemia. Recibiendo cefotaxima más amikacina, fototerapia y medidas generales, egresando al día 26 de vida extrauterina en buenas condiciones generales.
DISCUSIÓN
Desde la primera publicación en 1845 por Virchow, se ha comunicado un incremento del número de pacientes con leucemia aguda durante el embarazo. La LMA representa más de dos tercios de las leucemias que se presentan durante el embarazo, siendo generalmente diagnosticada durante el segundo y tercer trimestre (4).
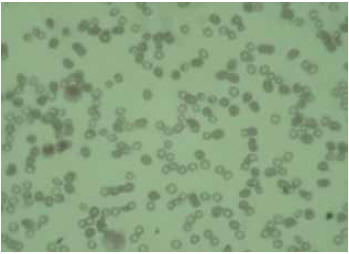
Figura 1. Frotis de sangre periférica en una embarazada con una leucemia mieloide aguda. Nótese la presencia de mieloblastos y la predominancia de monocitos. (Tinción de Wright, magnificación original X 40).
Debido a que la leucocitosis y la anemia son hallazgos comunes durante la gestación, alteraciones patológicas en la hematopoyesis como las leucemias muchas veces pueden pasar desapercibidas (13). Asimismo, por lo general no existe un síntoma específico de leucemia (14), siendo los síntomas más frecuentes, la fatiga, la debilidad, la disnea y la falta de energía, comunes en los embarazos normales; sin embargo, en las leucemias agudas, esta sintomatología representa las manifestaciones clínicas de la infiltración de la médula ósea por las células clonales leucémicas con el resultado de la supresión de la hemopoyesis normal, pero a medida que progresa la pancitopenia, los síntomas de epistaxis, fácil desarrollo de hematomas y las infecciones a repetición deberían sugerir una etiología de más entidad (2).
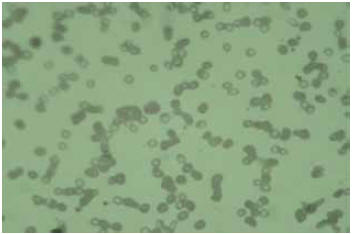
Figura 2. Frotis de sangre periférica en una embarazada con una leucemia mieloide aguda. Nótese la presencia de mieloblastos. (Tinción de Wright, magnificación original X 40).
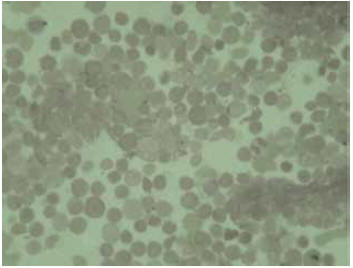
Figura 3. Aspirado de médula ósea en una paciente con leucemia mieloide aguda. Nótese la predominante infiltración de mieloblastos (Tinción de Wright, magnificación original X 40).
Muchos de estos síntomas estuvieron presentes en este caso, sin embargo, dado a lo inespecífico de la sintomatología y a las condiciones socioculturales de la paciente, además de la ausencia del control prenatal; estos no pudieron identificarse más tempranamente. Asimismo, en la literatura se ha reportado que estas pacientes al examen físico, suelen presentar palidez, petequias y equimosis, siendo poco frecuentes las adenopatías y la hepatoesplenomegalia; mientras que las neuropatías craneales y la hiperplasia gingival, ocasionada por la infiltración de las células leucémicas pueden estar presentes ocasionalmente (2).
Aunque algunos autores creen que el embarazo puede acelerar el curso de la leucemia, pero autores no encuentran ningún apoyo a esta hipótesis y han concluido que la gestación por sí misma no parece afectar el pronóstico de la enfermedad (4,8); pese al hallazgo de receptores estrogénicos en líneas celulares leucémicas (15). Más bien, las demoras o modificaciones en la terapia para garantizar el nacimiento de un bebé sano pueden afectar adversamente el pronóstico materno (11).
Los resultados en términos de porcentaje de remisión completa (92 %) y sobrevida libre de enfermedad (54 %) son similares a los de la población no gestante en todas las series comunicadas y no hay diferencias significativas con los resultados del tratamiento obtenidos en la población general ajustados según edad (6). En otras pacientes, se ha producido la remisión espontánea de la enfermedad después de la terminación de la gestación; sin embargo, en estas pacientes, la leucemia por lo general vuelve a aparecer rápidamente, conllevando posteriormente a la muerte (4).
Los estudios para el diagnóstico se pueden realizar de forma segura en la mujer embarazada, y solo se encuentran como contraindicadas de forma unánime la realización de tomografía computarizada o de estudios con radionúclidos (16). La cuestión en estas pacientes es si se puede demorar el tratamiento o iniciarlo de forma inmediata, sobre todo si se encuentran en el primer trimestre, ya que los quimioterápicos aumentan el riesgo de malformaciones mayores, aborto y muerte fetal.
El manejo de la leucemia en embarazadas y el efecto de los agentes antineoplásicos durante la concepción y el embarazo aún no han sido claramente investigados. Existen dos consideraciones importantes para el manejo de las gestantes que presentan leucemia, por un lado está la madre que requiere una terapia antineoplásica óptima y por el otro, el desarrollo fetal que puede ser potencialmente afectado por la enfermedad o por la teratogenicidad de los agentes citotóxicos (8,13): sin embargo, independientemente de la edad gestacional, la inmediata inducción de la remisión sigue siendo el primer objetivo del tratamiento, al igual que en la población no embarazada (2).
Los efectos de drogas citostáticas en el feto pueden ser estudiados desde dos perspectivas: efectos inmediatos, que son bien conocidas en términos del aborto o teratogenicidad, y efectos tardíos, que son menos conocidos con potencial gonadal y otros trastornos endocrinos, problemas en el crecimiento y desarrollo, y trastornos genéticos y teratogénicos que afectan a las generaciones futuras (4). Aunque la quimioterapia al parecer presenta algunos riesgos durante el primer trimestre, se ha alegado que puede ser administrada con seguridad durante el segundo y tercer trimestre (2,15).
Cuando la quimioterapia es usada durante la embriogénesis se han reportado una incidencia mayor de abortos espontáneos y malformaciones congénitas fetales productos de madres leucémicas (10). La ocurrencia de teratogenicidad cuando se administra la quimioterapia durante el primer trimestre ha sido reportada en 10 %-20 % (4). Asimismo, se conoce que la combinación de drogas citostáticas genera un mayor riesgo de teratogenicidad que la terapia con un agente único. Citarabina y las antraciclinas, a excepción de idarubicina, no han estado asociadas con teratogenicidad (4).
Por otra parte, respecto al manejo de la leucemia promielocítica aguda (LPA) durante el embarazo, esta representa un problema importante, ya que por lo general está asociada con coagulopatías, aunado al potencial efecto teratogénico de la quimioterapia y del ácido trans-retinoico (ATRA) (4); este último administrado terapéuticamente induce el paso de promielocito a mielocito, ocasionando un gran número de remisiones (17). Aunque algunos estudios han reportado, que el ATRA se puede utilizar con razonable seguridad para la madre y el feto durante el segundo o tercer trimestre del embarazo (13).
En relación con la leucemia crónica, se sabe que el embarazo no parece afectar su curso natural y se han empleado varias modalidades terapéuticas como la plasmaferesis, antineoplásicos (Imanitib), esteroides e interferón para su tratamiento durante la gravidez. Con la plasmaferesis se presenta la ventaja de que se evita la exposición a posibles agentes teratogénicos, mientras que el alfa-interferón parece ser también una alternativa segura ya que no se conoce que tengan efectos sobre el ADN y no parece atravesar la barrera placentaria (7,18). En los casos de pacientes con leucemia crónica que reciban agentes citotóxicos como imatinib, tomando en cuentan el potencial riesgo tanto para el feto como para la madre aun cuando han sido reportado casos de embarazos exitosos cuyas madres lo recibieron, está recomendado la prescripción de algún método anticonceptivo mientras reciban el fármaco o la inmediata descontinuación de la terapia si se produce el embarazo; sin embargo, las implicaciones de la interrupción de la terapia sobre el pronóstico de la enfermedad no son del todo claras (8,19).
En cuanto a la dosificación de los agentes antineoplásicos, las mujeres grávidas pueden recibir dosis basadas en su peso similares a aquellas recomendadas para las que no están embarazadas, ajustándose continuamente según la ganancia de peso (11). El riesgo de daño fetal inducido por la administración de quimioterapia citotóxica durante el primer trimestre del embarazo es real pero en realidad ocurre en una minoría de pacientes; no obstante, se ha sugerido que el aborto terapéutico se debe ofrecer a todos los pacientes que desarrollen leucemia aguda durante el primer semestre; mientras que después del primer trimestre la decisión de terminar con la gestación debe ser discutida con la paciente (4,11).
La dilatación y curetaje es usualmente considerada como la primera opción para la culminación de embarazos de hasta 63 días de amenorrea aquellos casos detectados durante el primer trimestre. Asimismo, la combinación del anti-progestágeno Mifepristone en combinación con un análogo prostaglandínico como misoprostol constituye una excelente opción como método no quirúrgico (11).
Si bien el embarazo no parece afectar la historia natural de la leucemia, esta puede complicar el abordaje obstétrico, puesto que la trombocitopenia que la acompaña puede ser peligrosa para la realización de una cesárea o un parto vaginal si no se mantiene un apoyo de plaquetas; asimismo, la anemia grave puede deteriorar el aporte de oxígeno al feto y las infecciones obstétricas pueden ser fatales en caso de una neutropenia (7).
Cuando la leucemia coincide con el embarazo hay un aumento de la incidencia de aborto espontáneo, muerte fetal intrauterina, retardo del crecimiento intrauterino, trabajo de parto prematuro, nacimiento prematuro y lactantes de bajo peso al nacer (7,15); algunas de las cuales se observaron en el caso presentado. De igual forma, durante el puerperio de las pacientes con leucemia se han reportado complicaciones como neutropenia febril e infección de la herida quirúrgica en un gran porcentaje de las mismas (9); las cuales también estuvieron presentes en la paciente, con un deterioro progresivo de su estado de salud causándole la muerte antes de terminado el período del puerperio.
Como puede verse, la asociación de cáncer y embarazo es una situación compleja, por lo que la oferta terapéutica es algo que no debe retrasarse; por tanto si se requiere urgentemente la quimioterapia, por lo general se debe culminar la gestación (20). Algunos autores han manifestado que su utilización durante cualquier trimestre de la gestación ocasiona un riesgo significativo para un pronóstico desfavorable (21); mientras otros han reportado que la mayoría de las muertes en embarazadas con LMA suceden en pacientes refractarias o que no fueron tratadas oportunamente (2,15,17), en las cuales la supervivencia media es inferior a 2-3 meses (7), tal como ocurrió en el caso presentado, cuyo desenlace fue una muerte materna indirecta.
La leucemia aguda durante el embarazo como puede verse es una neoplasia infrecuente, representando una situación compleja, con un pronóstico desfavorable (13,22-24); en general, se debe prestar atención a los fármacos utilizados y la edad del embarazo; debiendo ser cada paciente examinada individualmente, teniendo en cuenta tanto la agresividad de la leucemia y de la etapa del embarazo cuando se aplica el tratamiento (4). Asimismo, ha sido reportado que el embarazo por si solo conlleva una protección a corto plazo contra la LMA (25).
Al igual que en otros países, en Venezuela, son pocos los casos publicados de asociación de embarazo y leucemia, encontrándose en la revisión efectuada solo un caso publicado en el año 2000 por Jairo y col. (14), donde se presentó una paciente con un embarazo de 14 semanas e infiltración leucémica de glándulas mamarias con diagnóstico de LMA M5, a la cual se le practicó aborto terapéutico y legrado uterino con posterior quimioterapia de inducción con mejoría clínica y respuesta al tratamiento médico; sin embargo, en este caso la paciente presentaba síntomas inespecíficos desde hace un año y los autores consideraron que el embarazo aceleró la actividad proliferante de las células leucémicas.
De igual manera, debido a la alta tasa de recaída de LMA en los tres primeros años y que en algunas circunstancias puede requerirse tratamiento de mantenimiento, debe asegurarse el uso de un método anticonceptivo confiable después del parto (13,26). Finalmente, solo queda recordar una vez más la necesidad de mejorar la cobertura de los programas de atención materna, de modo de garantizar una adecuada atención médica durante la gestación, para así garantizar la salud materno-fetal y detectar oportunamente patologías como la presentada en esta comunicación, pudiendo tomar medidas a tiempo para su control y tratamiento.
REFERENCIAS
1. Cohen JB, Blum KA. Evaluation and management of lymphoma and leukemia in pregnancy. Clin Obstet Gynecol. 2011;54(4):556-566. [ Links ]
2. Hurley TJ, McKinnell JV, Irani MS. Neoplasias hematológicas durante el embarazo. Obstet Gynecol Clin N Am. 2005;32:595-614. [ Links ]
3. Brenner B, Avivi I, Lishner M. Haematological cancers in pregnancy. Lancet. 2012;379:580-587. [ Links ]
4. Chelghoum Y, Vey N, Raffoux E, Huguet F, Pigneux A, Witz B, et al. Acute leukemia during pregnancy a report on 37 patients and a review of the literature. CANCER. 2005;104(1):110-117. [ Links ]
5. Corredor E, Castillo M. Cáncer en mujeres embarazadas y su extensión a la unidad fetoplacentaria. Rev Colomb Obstet Ginecol. 2007;58(3):232-236. [ Links ]
6. Tartas NE, Foncuberta MC, Sánchez JC. Tratamiento de las neoplasias hematológicas en el embarazo. Medicina (Buenos Aires) 2007;67(6/2):729-736. [ Links ]
7. Fernández C, Pérez B, Argüelles S, García C, González C. Leucemia aguda mieloblástica en gestante de 28 semanas. Clin Invest Gin Obst. 2008;35(5):184-186. [ Links ]
8. Ault P, Kantarjian H, OBrien S, Faderl S, Beran M, Rios MB. Pregnancy among patients with chronic myeloid leukemia treated with imatinib. J Clin Oncol. 2006;24(1):1204-1208. [ Links ]
9. Nomura RM, Igai AM, Faciroli NC, Aguiar IN, Zugaib M. Maternal and perinatal outcomes in pregnant women with leukemia. Rev Bras Ginecol Obstet. 2011;33(8):174-181. [ Links ]
10. Urdaneta L. Complicaciones más frecuentes en fetos de madres leucémicas. Trabajo de Grado en Obstetricia y Ginecología. La Universidad del Zulia, Facultad de Medicina, 2001. [ Links ]
11. Molkenboer JFM, Vos AH, Schouten AC, Vos MC. Acute lymphoblastic leukaemia in pregnancy. Neth J Med. 2005;63(9):361-363. [ Links ]
12. Abadi U, Koren G; Lishner M. Leukemia and lymphoma in pregnancy. Hematol Oncol Clin North Am. 2011;25(2):277-291, vii. [ Links ]
13. Su WL, Liu JY, Kao WY. Management of pregnancy - associated acute leukemia. Eur J Gynaecol Oncol. 2003;24(3-4):251-254. [ Links ]
14. Jairo E, Bettiol A, Zambrano V, Ramírez JB, Ramírez P. Infiltración leucémica de glándulas mamarias. Med Intern. 2000;16(3):182-186. [ Links ]
15. Brell J, Kalaycio M. Leukemia in pregnancy. Semin Oncol. 2000;27:667-677. [ Links ]
16. León R, Georgeta T, Timermans E, Soldevilla S, Holgado A, Burgos PJ, et al. Gestación en paciente con leucemia linfoide crónica B. Clin Invest Gin Obst. 2008;35(6):225-227. [ Links ]
17. López JM, Fernández E, Contreras M, Bautista A. Manifestación de leucemia promielocítica aguda en el embarazo. Prog Obstet Ginecol. 2011;54(8):428- 430. [ Links ]
18. Klaasen R, de Jong P, Wijermans PW. Successful management of chronic myeloid leukaemia with leucapheresis during a twin pregnancy. Neth J Med. 2007;65(4):147-149. [ Links ]
19. Garderet L, Santacruz R, Barbu V, van den Akker J, Carbonne B, Gorin NC. Two successful pregnancies in a chronic myeloid leukemia patient treated with imatinib. Haematologica. 2007;92(1):e9-e10 [ Links ]
20. Heartin E, Walkinshaw S, Clark RE. Successful outcome of pregnancy in chronic myeloid leukemia treated with imatinib. Leuk Lymphoma. 2004;45:1307- 1308. [ Links ]
21. Dilek I, Topcu N, Demir C, Bay A, Uzun K, Gul A, et al. Hematological malignancy and pregnancy: A single-institution experience of 21 cases. Clin Lab Haematol. 2006;28(3):170-176. [ Links ]
22. Aboujaoude R, Álvarez J, Álvarez M, Al Khan A. Acute myelogenous leukemia mimicking a hemolysis, elevated liver enzymes, and low platelets syndrome during pregnancy: Case report and review of the literature. Am J Perinatol. 2007;24(1):1-4. [ Links ]
23. Yucebilgin MS, Cagirgan S, Donmez A, Ozkinay E, Akercan F, Mgoyi L, et al. Acute myeloblastic leukemia in pregnancy: A case report and review of the literature. Eur J Gynaecol Oncol. 2004;25(1):126- 128. [ Links ]
24. Ali R, Ozkalemkaş F, Ozçelik T, Ozkocaman V, Ozan U, Kimya Y, et al. Maternal and fetal outcomes in pregnancy complicated with acute leukemia: A single institutional experience with 10 pregnancies at 16 years. Leuk Res. 2003;27(5):381-385. [ Links ]
25. Larfors G, Höglund M, Cnattingius S. Pregnancy and risk of acute myeloid leukaemia--a case-control study. Eur J Haematol. 2011;87(2):169-171. [ Links ]
26. Niedermeier DM, Frei–Larh DA, Hall PD. Treatment of acute myeloid leukemia during the second and third trimesters of pregnancy. Pharmacotherapy. 2005;25:134-140. [ Links ]













