Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.75 no.2 Caracas jun. 2015
Clítoris: aspectos anatomofisiológicos y patológicos
Drs. Nelson Velásquez*, Roxana Delgado**, Noramaika Briñez**
* Médico Especialista II. Hospital Chiquinquirá de Maracaibo. Profesor Titular de La Universidad del Zulia. Jefe de la Cátedra de Obstetricia y Ginecología, LUZ. Maracaibo, Venezuela.
** Especialista en Obstetricia y Ginecología. Maracaibo, Venezuela.
La palabra clítoris deriva del griego kleitorís, k´eitoridos que al igual que la expresión kleíoo significa cerrar, mientras que el término kleís expresa: llave o cerrojo. Para algunos esta expresión griega denota pequeña colina (1). Para referirse a algo relacionado con esta estructura se han utilizado indistintamente los vocablos clitorídeo, clitorideo, clitoridio, clitoroideo y clitoridiano, términos que no fue posible encontrarlo en Diccionarios Médicos o de la Real Academia de la lengua.
Consideraciones anatómicas y fisiológicas
Los genitales externos derivan de un primordio común formado en la parte anterior por el tubérculo genital, lateralmente por los pliegues uretrales, flanqueados por las prominencias labioescrotales. El surco uretral termina en el seno urogenital. El tubérculo genital, los pliegues y las prominencias están formadas de tejido mesenquimal indiferenciado y formaran el falo o clítoris; los pliegues uretrales formarán la uretra y en el varón la parte ventral del pene, mientras que en la mujer formarán los labios menores. El pene se forma tras el crecimiento y fusión del surco y pliegues uretrales. Las prominencias parauretrales crearán el escroto en el varón y a los labios mayores en la mujer. El pene tiene el mismo tamaño del clítoris hasta las 16 semanas de desarrollo, pero completa su formación a los 80 días (2).
El clítoris es un órgano eréctil femenino que se corresponde a los cuerpos cavernosos del pene del hombre, de quien se considera su homólogo. Aparece como un saliente submucoso, arriba del vestíbulo, en cercanía subyacente a la sínfisis del pubis; está localizado en el extremo anterior de los labios menores y del vestíbulo. El órgano está constituido por las raíces del clítoris, estructuras afiladas en forma de cono, envainadas parcialmente por los músculos isquiocavernosos, fijado en la parte posterior a las ramas isquiopubianas por sus raíces y en la parte anterior al ángulo por el ligamento suspensorio. Las raíces convergen una hacia la otra y forman delante de la extremidad inferior de la sínfisis una estructura cilíndrica que es el cuerpo del clítoris. Este sigue la dirección de sus raíces, pero un poco antes de la sínfisis describe un ángulo agudo, el codo o rodilla del clítoris; después se dirige hacia abajo y atrás terminando en una extremidad libre, dilatada, de vértice romo que es el glande clitorídeo.
Comporta, pues, una porción oculta profundamente debajo de los labios mayores, en estrecha relación con el esqueleto y una libre, formada por el codo, el cuerpo y el glande, recubierto por un manguito cutáneo, el capuchón o prepucio del clítoris que cubre al glande sin fijarse a este y delimita la cavidad prepucial. Las raíces y el cuerpo del clítoris están constituidos por tejido eréctil rodeado de una cubierta fibroelástica, la aponeurosis o fascia clitorídea o albugínea.
El glande, en el cual confluyen los cuerpos cavernosos, está formado por un núcleo central de naturaleza conjuntiva, recubierto por una mucosa dermopapilar; difiere así de los cuerpos cavernosos que pertenecen al sistema eréctil y del glande peniano, igualmente eréctil, por estar provisto de cuerpo cavernosos. Se origina, al igual que el pene, del tubérculo genital y junto a los bulbos vestibulares forma parte del aparato eréctil de los genitales femeninos. En definitiva, el glande del clítoris que cubre la porción unida de los cuerpos cavernosos, está compuesto de tejido eréctil, conectado a los bulbos vestibulares por la pars intermedia, cubierto por el prepucio en la porción anterior y fijado en la posterior por el frenillo, representan la continuación de los labios menores.
Los bulbos vestibulares son otras dos formaciones que corresponden a los cuerpos esponjosos del varón, situados debajo del borde adherente de los labios menores, a uno y otro lado de la uretra y del orificio vaginal. Son de forma ovoide y sus extremos posteriores que aumentan de volumen están en contacto con la glándulas de Bartholin, mientras que los anteriores afilados, se reúnen debajo del codo del clítoris, unidos por la importante red venosa intermediaria de Kobelt. Los bulbos vestibulares descansan en el fondo en el piso del vestíbulo a cada lado del orificio vaginal y por debajo cubren los músculos bulbocavernosos. Las estructuras denominada crura clitoridis se refieren a dos formaciones o pliegues constituidas por trabéculas de fibras musculares lisas vasculares, sinusoides lacunares y capas de tejido colágeno colocadas a manera de V invertida, con el vértice conectado al cuerpo del clítoris, envueltas por la túnica albugínea y el músculo bulbocavernoso, muy cercano a los bulbos vestibulares. Se encuentran a la derecha y a la izquierda de la uretra y se extienden hacia atrás hasta el pubis; ambas se fusionan en la línea media formando con el glande clitorídeo los cuerpos cavernosos o cuerpo del clítoris, que es el segmento palpable suspendido entre el ángulo y el glande. Existen algunas fibras musculares denominadas músculos perineales transversales superficiales con origen común al músculo isquiocavernoso, que se ubican dentro del cuerpo perineal (3-6).
Las envolturas del clítoris están formadas por la piel, tapizada por una capa fibroelástica que se adelgaza alrededor del glande, al que le forma un prepucio dependiente de los labios menores. El prepucio del clítoris es una simple hoja de piel que cubre al glande, está compuesto de una capa externa queratinizada y una interna o mucosa y al igual que ocurre en el glande de los hombres, cuando las células de la cara interna del prepucio se descaman y hacen la degeneración grasa que les caracteriza, se forma el esmegma. Existe evidencia de que el prepucio produce lisozimas y citoquinas que poseen funciones inmunológicas (7). La higiene habitual impide la acumulación de esta sustancia; y si lo hace, se produce irritación y adherencias como en casos de fimosis del clítoris y del pene. No hay pruebas fehacientes de unas bandas rugosas que se encuentran debajo del prepucio peniano puedan servir como sitios de estimulación erógena (8). Los cuerpos cavernosos están constituidos por tejido eréctil de grandes mallas vasculares, el glande es de tejido conjuntivo con un revestimiento mucocutáneo de gran sensibilidad (Figura 1).
Recibe inervación de los plexos sacros e hipogástricos y del nervio pudendo, quienes proveen fibras simpáticas y parasimpáticas; de allí su gran sensibilidad. La somática-sensorial de los dos tercios proximales de la vagina se origina en la piel y está constituida por los corpúsculos de Pacini y de Meissner, los discos táctiles de Merque y terminaciones nerviosas libres. Estas fibras sensoriales ascienden por el nervio dorsal del clítoris a los nervios pudendos y de allí al cordón sacro espinal.
Su irrigación está dada por los vasos del mismo nombre, estructuras que transcurren paralelos entre sí. El nervio pudendo se origina del plexo sacro (S2-S4) en la división anterior de la arteria ilíaca interna, abandona la pelvis a través de la escotadura ciática mayor, formando un rodillo o rulo alrededor de ella y del ligamento sacro espinoso para luego ingresar en el canal pudendo de Alcock a través de la escotadura ciática menor. Tanto los vasos arteriales como los nervios dan a su vez tres ramas: la del clítoris, la perineal y la hemorroidal inferior. Las ramas clitoroideas inervan e irrigan al clítoris y transcurren sobre la membrana perineal. Las ramas perineales que son las más grandes, ingresan a los tejidos subcutáneos de la vulva por detrás de la misma membrana para irrigar e inervar a los músculos isquiocavernosos, bulbocavernosos y perineales transversos. La arteria además, irriga la piel de las porciones internas de los labios mayores y menores y al vestíbulo. La porción vasculonerviosa hemorroidal inferior se dirige al esfínter externo del ano y a la piel. El sistema del retorno venoso del clítoris es un sistema comparable con la vena dorsal del pene, que llega a los plexos retropúbicos de Santorini. Debido a que existen muchas terminaciones nerviosas en la región del clítoris se presume participe en el placer sexual y orgasmo femenino (3-5).
El clítoris en su conjunto en la mujer adulta posee una longitud de 2,5 cm aproximadamente. Otros estiman que su longitud, al igual que su diámetro transverso es mayor y la han encontrado en la época prepuberal en 3 cm (9).
Modificaciones del clítoris con la edad
El clítoris de la recién nacida, aún bajo influencia de los estrógenos maternos está edematoso y luce grande a expensa de la piel que lo cubre, pero mantiene el índice clitorideo normal: menor de 6 mm. El índice clitorídeo es el producto de multiplicar la anchura del glande por la longitud y es considerado normal 18,5 mm (10). En la primera infancia, entre 8 semanas y 7 años de edad el clítoris es relativamente pequeño pero mantiene su índice en 6 mm (6). El glande del clítoris normal es de 2-4 mm de ancho, se considera normal hasta de 5 mm y un índice de más de 10 mm es considerado como virilización significante. Verkauf y col. (10) reportaron que el diámetro transverso del glande debe ser de 3,4± 1,0 mm, con diámetro longitudinal de 5,1 ± 1,4 mm, y una longitud total, incluyendo glande y cuerpo de 16,0 ± 4,3 mm.
En niñas prepuberales normales el glande clitorídeo mide 3 mm de diámetro, si es mayor de 5 mm o el índice (longitud x ancho) es mayor de 35 mm, sugiere exposición a andrógenos (11). Por lo tanto, el médico debe recordar que todo recién nacido aparentemente masculino, pero criptórquido, resulta sospechoso de seudohermafroditismo femenino (Figura 2) y que el clítoris que mida más de un centímetro antes de la pubertad, se halla agrandado y requiere la investigación de un factor androgenizante.
Asignación del sexo
La identidad sexual de una persona, es decir, la identificación de un sujeto como varón o mujer viene a estar condicionada por varias determinantes entre las cuales se consideran: el sexo genético y gonadal, los genitales internos y externos, las características sexuales secundarias de la pubertad y el rol asignado por la sociedad, de tal suerte que constituye el evento final de factores genéticos, hormonales o morfológicos, sometidos al entorno social en el cual se desempeña la persona. La expresión como homo o heterosexual es el resultado de influencias pre y posnatales y comprende cualquier comportamiento sexual como las actitudes, la forma de hablar, preferencias recreativas, gestos corporales y hasta el contenido de sus sueños.
Es más fácil designar un sexo a infantes con cariotipos 46, XX que ha sido virilizados por elevadas concentraciones de andrógenos como consecuencia de hiperplasia suprarrenal congénita o de fuentes anormales de andrógenos, porque ellos generalmente presentan útero, ovarios y trompas normales con potencial capacidad reproductora, a quienes se les puede colocar un nombre de mujer; en cambio asignarlo a un individuo 46, XY es más complejo, ya que tienen poca capacidad reproductora con excepción de los hipospadias o el síndrome hernia-útero que la conservan.
La ambigüedad sexual en la actualidad es considerada una emergencia social y médica (12) y como el médico de atención primaria es el primer contacto familiar debe valerse de procedimientos diagnósticos que no retrasen la asignación del sexo después del nacimiento, aunque se considera que ese retraso puede ser preferible en ocasiones, a tener que modificar posteriormente un sexo mal asignado. Para esto el médico de cabecera debe obtener la colaboración de un equipo constituido por expertos en endocrinología, genética, neonatología, psicología, cirugía, urología y orientadores.
Un aspecto de recordar ante un recién nacido con genitales ambiguos o un aparente varón con criptorquidia bilateral, es que casi siempre se trata de una hiperplasia suprarrenal congénita, único trastorno que pone en peligro la vida del niño o niña y se debe estar prevenido en caso de náuseas, vómitos, diarrea, deshidratación y shock. La otra particularidad, es que la mayoría de estos enfermos son mujeres virilizadas por la misma condición, en tal sentido los antecedentes de un familiar afectado pueden ayudar en su diagnóstico y en el de insensibilidad a los andrógenos en cualquiera de sus variedades. Un hermano con muerte neonatal y ambigüedad sexual apuntan a hiperplasia suprarrenal congénita (HSC); es menester establecer la ingestión de drogas androgenizantes durante el embarazo.
Una guía clínica de importancia, aunque no definitiva es la exploración cuidadosa de la región inguinal ya que las gónadas que se encuentren en esta región o en pliegues escrotales deben con casi cereza corresponder a testículos. Los ovarios no llegan nunca a pliegues escrotales ni a la región inguinal. En muchas ocasiones los testículos son intrabdominales y no se palpan; aun así debe seguir considerándose una HSC.
El tamaño del falo, medido con ecografía, desde la rama púbica hasta la punta del glande también es importante, mide 1,5 cm en la semana 32 y 2,0 cm en la 36, alcanzando una longitud de 2,8 a 4,2 cm, en recién nacidos varones de pesos adecuados. El clítoris normal, generalmente mide menos de 1 cm.
La posición del meato uretral es importante ya que puede variar desde una abertura en el área perineal en un seno urogenital hasta leves hipospadias. Casi siempre se asocia a lo que se ha llamado encordamiento encorvamiento, que es una curvatura ventral del falo como consecuencia de una uretra corta.
Los labios pueden estar fusionados de grados que varían desde una pequeña fusión posterior, escroto bífido, hasta un escroto normal totalmente fusionado y labios mayores no fusionados normales. Las medidas desde el ano al borde de la vagina, dividida entre la que existe desde la base del clítoris al ano es inferior a 0,5 cm en mujeres normales. Si es superior a 0,5 cm está indicando cierto grado de fusión labioescrotal, mientras que la exploración rectal puede identificar una estructura central en línea media, el útero, que se palpa mejor inmediatamente después del nacimiento por el crecimiento que ocurre por la influencia hormonal intrauterina materna. La hiperpigmentación del área genital está asociada a estimulación melanocítica y elevadas concentraciones de ACTH en la HSC.
Se puede lograr establecer con cierta firmeza si se trata de un pene o clítoris si se toma en cuenta que el pene tiene un frenillo ventral en la línea media, mientras que el clítoris tiene 2 pliegues (cruras) que se extienden desde sus partes laterales hasta los labios mayores.
En casos de ambigüedad sexual es mandatario realizar ecografía pélvica que puede detectar, ovarios, útero o testículos no descendidos y la exploración radiológica contrastada por el orificio urogenital delimita la uretra, la vagina, y la presencia del cuello uterino. En la actualidad la resonancia magnética nuclear ha reemplazado con mucho, a la exploración ecográfica.
Fisiología de la respuesta sexual
La respuesta sexual se describe como un proceso lineal en el que se producen cambios neurológicos y vasculares, caracterizado por 4 etapas seguidas una de la otra, que se identifican como fase de excitación, meseta, orgasmo y resolución, seguidas por un período refractario que se marca muy bien en el varón, en el cual hay que esperar minutos u horas para poder tener una nueva relación sexual. Esta forma de respuesta sexual fue descrita en 1966 y se conoce como Modelo de Master y Johnson (13).
En el primer período o de excitación se producen cambios en el sistema nervioso central que producen vasodilatación y aumento del flujo sanguíneo en la región genital, que impactan la lubricación, ciñen los labios, expanden la vagina y abren el introito. La lubricación vaginal se aumenta por el incremento en la secreción de moco producido por el útero y el cérvix. Se producen modificaciones que permiten la elongación de la vagina ocasionado por la rugosidad de sus pliegues que proporcionan, además de su elongación, aumento de la fricción durante el coito; el clítoris aumenta en longitud y diámetro y el útero se eleva sobre el músculo elevador. Los cambios así producidos se conocen como plataforma orgásmica. La duración de esta fase es de pocos minutos a varias horas y se inicia con el comienzo de la estimulación sexual.
Le sigue la fase de meseta o plateau en la que se produce tumefacción de los labios y retracción del clítoris, secreción de las glándulas de Bartholin y congestión del tercio inferior de la vagina, que a su vez produce reducción del tamaño del introito. Esta etapa es de menor duración que la de excitación.
El estado de orgasmo es la conclusión del de meseta, dura 3 a 10 segundos, se produce una relajación masiva de la tensión muscular. Por la estimulación sensorial del clítoris, labios, vagina y glándulas periuretrales, los estímulos viajan a las estructuras de la médula espinal y se produce liberación central de neurotransmisores, cuya información pasa a centros de placer corticales. El piso pélvico, la vagina y el útero rápidamente sufren contracciones musculares y puede ocurrir alteración en el estado de conciencia.
La fase final es la de resolución en la cual disminuyen gradualmente la tensión sexual, la relajación muscular y la presión sanguínea. Este período tiene una duración que es proporcional a la de excitación. Puede retornarse a la fase de meseta si se adquiere nueva estimulación sexual, produciéndose orgasmos múltiples. Las mujeres que no experimentan orgasmos, tienen fases de resolución que producen frustración y en algunas la estimulación continua en esta fase puede ser dolorosa (13).
En 1974 Kaplan (citado por Purinton y col. (14) redujo las etapas de la respuesta fisiológica sexual a tres: deseo, excitación y orgasmo; sin contemplar los aspectos psicosociales, que son de gran importancia.
Recientemente, Basson (15) introdujo nuevos conceptos en la estimulación sexual y cree que el deseo es debido a una respuesta, más que a una manifestación espontánea y hace énfasis en la contribución física y emocional en la respuesta sexual. Lo han llamado modelo biopsicosocial y es diferente al descrito por Masters y Johnson (13-16). Según este autor, una mujer que esté íntimamente conectada con su pareja es receptora de estimulación sexual o sensual y causará la excitación que motivará el deseo; esta
sensación la hará buscar más estímulos sexuales. Para que una mujer responda a estímulos sexuales se requiere privacidad, la insinuación, la contigüidad o la entrega; el compartir y la ternura también son importantes. Para este autor, la meta de experiencia sexual no es el orgasmo.
Los labios menores que están compuestos de tejido esponjoso y contienen vasos sanguíneos y glándulas, cuya porción más interna está en continuación con la mucosa vaginal tienen terminaciones nerviosas sensitivas, interviene activamente en el placer sexual. Los músculos del piso pélvico también, todos son adyacentes a los bulbos vestibulares y al clítoris, se contraen involuntariamente durante el orgasmo y si lo hacen voluntariamente pueden intensificar la respuesta orgásmica tanto en la mujer como en el hombre, además que permiten la receptividad vaginal, cuando se relajan. Si hay hipertonicidad muscular pélvica puede ocurrir vulvodinia disestésica y vestibulitis vulvar y si hay hipotonía y laxitud puede disminuir las sensaciones, causar anorgasmia e incontinencia durante el coito.
La respuesta sexual femenina es mediada por una serie de eventos congestivos y neuromusculares que conducen al aumento del lumen e ingurgitación vaginal con aumento de su longitud y lubricación e incremento de la longitud y diámetro del clítoris. Durante la fase de excitabilidad se produce un flujo sanguíneo hacia los bulbos con incremento del doble o triple del tamaño de los labios menores que se evierten exponiendo su superficie interna. La congestión de la vagina y del clítoris ocurre por relajación muscular con incremento sanguíneo pélvico al lecho de la arteria pudenda, flujo que también aumenta en las arterias cavernosas con incremento de la presión intracavernosa. Estos fenómenos causan tumescencia y extrusión del glande del clítoris sin ocasionar rigidez, como en el pene que lo hace a expensas de impedirse el retorno venoso, debido a que en él existe un plexo venoso subalbugíneo entre la túnica albugínea y el tejido eréctil. En esta fase de excitación se infiltran los vasos sanguíneos musculares, las fibras de colágenos y elastinas constituyéndose una red alrededor de la vagina al tiempo que el flujo de sangre aumentado incrementa la presión capilar y se forma un trasudado en el lecho subepitelial vascular que es transportado pasivamente a través del espacio intraepitelial a la mucosa vaginal y coalesce para formar una película lubricante vaginal, que es incrementada por las secreciones del cuello y glándulas de Bartholin.
Un aumento de la sensación durante la actividad sexual se produce por la estimulación de los nervios somáticos-sensoriales, especialmente en clítoris, labios menores y vagina; mientras que la regulación del sistema nervioso central se inicia en el área preóptica medial, región anterior hipotalámica y estructuras límbicas del hipocampo, pasos que son además regulados por centros nerviosos superiores, responsables de los aspectos psicoconductuales, intelectuales y emocionales, señales que son transmitidas periféricamente por vías de simpático y parasimpático; aunque el papel de los neurotransmisores y las hormonas se conoce poco. Entre estos neurotransmisores se han propuesto el péptido vasoactivo intestinal y el óxido nítrico que pueden intervenir en la relajación muscular que ocurre durante la respuesta sexual femenina (14).
Es interesante reconocer algunos otros cambios como consecuencia de respuesta sexual; en el período de excitación se produce erección de los pezones y sonrojo como respuesta a la estimulación sexual que ocasiona engrosamiento de las paredes vaginales con expansión y lubricación de su interior, tumescencia del clítoris y elevación del cuerpo y cuello uterinos. Durante la fase de meseta o plateau, ocurre expansión del interior de la vagina, aparece la plataforma orgásmica en la parte más externa de la vagina, secreción de las glándulas de Bartholin y retirada del clítoris, mientras que la respuesta corporal se manifiesta por rubor, espasmo carpopedal, hiperventilación, taquicardia y tensión de músculos esqueléticos. En la fase orgásmica se produce contracciones del músculo esquelético, hiperventilación y taquicardia, mientras que el útero se contrae desde el fondo a la región inferior, hay contracción de la plataforma orgásmica y del esfínter externo del recto a intervalos de 0,8 por segundo; el esfínter uretral lo hace a intervalos irregulares. En la fase de resolución la plataforma orgásmica regresa a su color normal, retorna la vasocongestión del piso pélvico, hay pérdida de la tumescencia del clítoris que vuelve a su posición anatómica, mientras que la reacción corporal se manifiesta por sudoración, taquicardia e hiperventilación.
Disfunción sexual en la mujer
La Organización Mundial de la Salud define la disfunción sexual femenina (DSF) como varias formas en la que un individuo es incapaz de participar en una relación sexual tal como él o ella lo desea caracterizado por problemas con el deseo sexual, el despertar sexual, orgasmo o dispareunia que causa distress personal (17). Marthol y col. (18) la definen como disturbio en el deseo sexual y cambios psicofisiológicos que caracteriza la respuesta sexual cíclica, causa marcado distress y dificultades interpersonales. La frecuencia es variable, algunos la reportan en el 43 % de las mujeres, aunque solo un porcentaje bajo de ellas buscan ayuda médica (19). En un período de 2 años, Mercer y col. (20) reportaron que en Gran Bretaña, el 53 % de las mujeres tuvieron un problema sexual mensual.
Causas de disfunción sexual femenina
Los factores que intervienen en las disfunciones sexuales de la mujer, son complejos y generalmente múltiples; se han descrito hormonales, vasculares, neurológicos, farmacológicos y psicogénicos. Solo nos referiremos a algunos de ellos. Los hormonales incluyen a estrógenos, andrógenos, oxitocina y agonistas dopaminérgicos, que están relacionados con la promoción de la respuesta sexual, mientras que la progesterona o progestágenos (acetato de medroxiprogesterona, implantes de levonorgestrel, píldoras combinadas con progestágenos potentes, minipíldoras. Lo mismo suele ocurrir con los medicamentos que disminuyen o se oponen farmacológicamente a los estrógenos tales como los análogos agonista-antagonistas de hormona liberadora de gonadotrofina (GnRH), la progesterona y el período de lactancia; la prolactina y la serotonina tendrán papel inhibitorio. Los estrógenos son vitales para mantener los tejidos que tienen relación con la salud sexual. Su déficit prolongado como ocurre en la menopausia y que alcanza su máxima expresión unos 6 meses después de iniciarla, se expresa por atrofia vaginal y genital, reducción del tamaño del clítoris con la consecuente disminución de las sensaciones, aparición de dispareunia, estrechez, sequedad e irritación vaginal, sensación de quemazón con el coito y sangrado en manchas poscoitivas.
Se cree que una reducción plasmática de 50 pg/ mL de estradiol se correlaciona con disminución del deseo, respuesta sexual, orgasmos y de la sensación genital con aumento de la dispareunia, síntomas que son ocasionados como consecuencia de la disminución vaginal del óxido nítrico (NO), procesos que se revierten al administrar terapia estrogénica con mejoría del trofismo vaginal y disminución de la apoptosis de las células de la mucosa que además mantienen la lubricación, impiden el adelgazamiento y la sequedad de las paredes vaginales y son esenciales para preservar la función sensorial, el despertar y el orgasmo, previenen aterosclerosis del sistema arterial conservando una adecuada estimulación inicial, buen flujo sanguíneo en uretra, vagina y clítoris, además de que son vasodilatadores.
Los andrógenos poseen influencias poco estudiadas en la función sexual femenina. Se acepta que estados hipoandrogénicos, como en la menopausia natural o inducida disminuyen el deseo sexual, la sensación genital, la libido, orgasmo y el sentido de bienestar de las mujeres. La mayoría de estos síntomas son revertidos con el remplazo de los andrógenos.
Los andrógenos han sido implicados en la preservación de la actividad sexual (21) y jugar papel de independiente predictor del deseo sexual; se ha demostrado que una pobre función sexual se relaciona con bajos niveles de sulfato de dehidroepiandrosterona (22), sin embargo, no hay estudios que avalen que la determinación plasmática de testosterona (T), DHEA y androstenodiona sirva de selección para evaluar disfunción sexual femenina.
El uso de anticonceptivos orales combinados se ha asociado a pobre respuesta en el inicio de la actividad sexual ocasionada como consecuencia de la disminución de andrógenos libres como consecuencia de aumento de la SHBG.
La DSF pueden ser consecuencia de lesiones vasculares causadas por arteriosclerosis, diabetes, hipertensión y el cigarrillo y alteraciones nerviosas ocasionas por lesiones quirúrgicas en la esfera genital, en las zonas que corresponden a la inervación autonómica del clítoris, vulva y vagina.
Los antidepresivos, en particular los inhibidores selectivos del recambio de serotonina y varios psicofármacos, causan disfunción sexual femenina en todos los componentes de la respuesta sexual en un 60 % de las mujeres, probablemente debido a un incremento de los efectos de la serotonina con disminución de los de la dopamina en el SNC. El sildenafil ha sido eficaz para mejorar los efectos indeseables de los inhibidores del recambio de serotonina y el clorhidrato de bupropion, que es un antidepresivo con actividad dopaminérgica puede ser sustitutivo de los que actúan sobre la serotonina.
Se ha sugerido que algunas enfermedades médicas o elevadas cifras de cirugías en mujeres como histerectomías, mastectomías y vulvectomías, tienen efectos negativos en la conducta sexual; sin embargo, la mayoría de las publicaciones sugieren que la histerectomía tiene poca o ninguna influencia sobre el deseo sexual (23), aunque otras establecen que lo estimulan (24).
Una pobre imagen corporal, baja autoestima, problemas emocionales, depresión, ansiedad, trastornos obsesivos-compulsivos y experiencias sexuales negativas previas están relacionados con la disfunción sexual masculina y femenina. Fenómenos psíquicos deben ser evaluados conjuntamente con especialistas terapistas sexuales, psicólogos y psiquiatras.
La gran frecuencia de impotencia masculina después de los 60 años (cifras que alcanzan hasta el 35 %) o el alto porcentaje de diabetes mellitus, enfermedades cardiovasculares y uso frecuente de sedantes en el hombre pueden contribuir a la DSF.
Patología genital asociada al tubérculo genital
La presencia anormalmente grande, pequeño o ausencia del tubérculo genital, llama la atención de pediatras, gineco-obstetras y endocrinólogos. Casi nunca es realmente patología del clítoris o ponen en peligro la vida del infante; más bien corresponden a trastornos de la diferenciación sexual que cursan con genitales ambiguos haciéndose difícil asignar un sexo al momento del nacimiento.
En el año 1921, dos médicos franceses, Achard y Thiers (25) representaron la asociación de trastornos en el metabolismo de los carbohidratos e hiperandrogenismo, en la pintura llamada la mujer diabética barbuda (le diabet des femmes a barber). Desde entonces se han reportado un número grande de pacientes que además de la diabetes cursan con masculinización; más tarde se descubrió en algunos pacientes la acantosis nigricans y la resistencia a la insulina. En 1974 se sugirió que algunos de estos cuadros tuvieran etiología genética (26), y Colle y col. (27) en 1979 describieron gemelos idénticos con rasgos acromegálicos, sugiriendo la etiología pituitárica.
Existen muchos cuadros clínicos que cursan con resistencia a la insulina y crecimiento del tubérculo genital, entre los cuales se encuentran: el síndrome tipo A que corresponde a adolescentes con grave resistencia a los carbohidratos, acantosis nigricans e hiperandrogenismo que causa clitoromegalia y virilización; el síndrome tipo B que es una enfermedad autoinmune de aparición en la vida adulta; el síndrome de Rabson-Mendenhall, una condición congénita en la que los individuos afectados además de la clitoromegalia presentan precocidad dental y engrosamiento de las uñas. Clitoromegalia y resistencia insulínica se observa en algunas lipoatrofias congénitas de la vida adulta y adolescente
Micropene y condiciones relacionadas
El micropene se define como un pene pequeño de configuración normal. El micropene es considerado como aquel que mide 2,5 desviaciones standard por debajo de la media de longitud del falo. Para recién nacidos el límite inferior del falo es 1,9 cm, que corresponde a la longitud del pene extendido desde la rama púbica al tope del glande (28,29). Algunos consideran que la longitud normal del pene al nacimiento es de 3,5 ± 0,4 cm (media ± DE) y si en el recién nacido mide menos de 2,5 cm se trata de un micropene. En un adulto es aquel que mide menos de 7 cm en erección y pene pequeño el que mide entre 7 y 11 en erección. Debe explorarse en estado de flacidez y de erección, revisar escrotos, testículos y zonas inguinales. Puede ser medido con el pene erecto, apretando con los dedos la base del cuerpo peniano para provocar el llenado venoso. En realidad la condición es de varones con falo pequeño, no de mujeres y no debe existir ambigüedad genital (30) (Figura 3).
En tales circunstancias se ha considerado que los sujetos portadores de esta patología natural o quirúrgica no pueden establecer actividad sexual cónsona con condición de varón y muchos consideran reasignar el sexo femenino y realizar intervenciones quirúrgicas para su transformación al sexo femenino, orquiectomía, vaginoplastia o creación de una vagina, con sus labios, reposición del orificio uretral a una localización femenina y la obtención de clítoris cosmético. Algunos consideran que la plastia vaginal debe realizarse después de los 17 años. Jones ha obtenido un porcentaje significativo grande de vaginas funcionales en estos individuos después de realizar la plastia con un colgajo plano del periné (31).
Como factores etiológicos se han propuesto el hipogonadismo hipogonadotrópico (24 %), 7 % en insensibilidad androgénica, 2 % de hipogonadismo primario y la etiología no precisada (idiopática) en el 36 % (28). Un tipo de micropene producido por ablación total del pene después de una circuncisión con electrocauterio fue reportado en 1989 por Gearhart y Rock (32). Se ha utilizado tratamiento local y sistémico para intentar el crecimiento del pene; así se ha logrado obtener crecimiento superior al 60 % con la aplicación tópica de testosterona y uso de gonadotropinas exógenas (33).
Pseudohermafroditismo femenino o masculinización femenina. (Cuadro 1)
Los genitales ambiguos se pueden presentar como consecuencia de bloqueos enzimaticos congenitos, como el de la 21 hidroxilasa que es la forma mas usual de hiperplasia suprarrenal congenita (HSC) y de ambiguedad sexual. Es la causa mas frecuente de muerte neonatal endocrina, distinguiendose tres formas: la perdedora de sal, la virilizante simple con produccion suficiente de aldosterona y la no clasica que ha sido conocida desde hace mucho tiempo como de inicio tardio o atenuada o adquirida. La otra forma de defecto suprarrenal es la ausencia de 11ß- hidroxilasa (P450c11).
Las ausencias enzimaticas suprarrenales y ovaricas incluyen la de 3ß- hidroxiesteroide-deshidrogenasa y de la 17 ß-hidroxilasa (P450c17). En el primer caso las mujeres pueden presentarse con leve virilizacion y los varones con masculinizacion incompleta y grados variables de hipospadia; en el segundo caso es caracteristica la hipertension arterial, hipernatremia, hipervolemia e hipopotasemia.
Los sindromes de insensibilidad a los androgenos incluyen espectros en fenotipo que van desde la feminizacion testicular completa hasta el varon infertil. En el primer caso no hay clitoromegalia, pero existen algunos incompletos que pueden presentarla como en el sindrome de Reifenstein.
Una forma particular de pseudohermafroditismo masculino familiar incompleto (46, XY) es la que aparece como consecuencia de la carencia de 5ß- reductasa o inestabilidad de ella. Es autosomica recesiva que se caracteriza por hipospadia perineal grave e hipodesarrollo de la vagina, conocida anteriormente como hipospadia pseudovaginalperineoescrotal. En la ausencia de la enzima, las vesiculas seminales, conductos eyaculadores, epididimo y vasos deferentes que dependen de testosterona estan presentes. Mientras que las estructuras que dependen de dehidrotestosterona como los genitales externos, la uretra y prostata no se desarrollan siguiendo el patron masculino.
Las carencias de la enzimas que son necesarias para la produccion de testosterona a partir del colesterol, entidades heredadas en forma autosomicas recesivas producen fenotipos variables, desde el pseudohermafroditismo masculino parcial hasta la forma completa. El que ocurre por deficiente actividad de 17ß-hidroxiesteroide-deshidrogenasa testicular, por mutacion del gen que codifica a la enzima presenta genitales externos masculinos con ausencia de estructuras de Müller. Son criados como mujeres y pueden virilizarse en la pubertad.
En la resistencia testicular a las gonadotropinas, LH (hormona luteinizante) y/o hCG (gonadotrofina coriónica humana), los genitales son ambiguos pero femeninos, con testículos criptorquídicos; son individuos 46, XY.
En las disgenesias gonadales pueden presentarse virilización por la transformación neoplasia como ocurre en algunos casos del síndrome de Swyer, individuos 46 XY con estrías gonadales y genitales externos e internos femeninos (12).
La clitoromegalia de origen ovárica por producción excesiva de andrógenos ocurre en tumores benignos o malignos masculinizantes como arrenoblastomas, tumor de células lipídicas, algunos tecaluteínicos. Es infrecuente en la hiperluteinización, tecosis o tecomatosis y no se presenta en el así llamado síndrome de ovario poliquístico.
Causas ováricas de masculinización
El síndrome de ovario poliquístico (SOP) fue considerado por Morris y Scully (34) hace más de 50 años como una de las anormalidades no neoplásicas del ovario con efecto endocrino que pueden asociarse además de metropatías hemorrágicas, amenorrea y esterilidad, con virilización. La realidad es que el cuadro descrito por Stein y Leventhal en 1935 no reportaba clitoromegalia; pero algunos casos con virilismo franco presentan como característica una gran hiperplasia de las células de la teca interna que tapiza los quistes y a los folículos atrésicos circundantes, y/o se encontró hiperplasia del estroma, con nódulos dispersos de células redondas y grandes que contienen lípidos, con focos de hialinización del estroma. Casos que más tarde han recibido diferentes denominaciones como: luteinización difusa del estroma ovárico, hipertecosis, hiperplasia tecal y luteínica difusa y tecomatosis.
Frankel en 1943 (35) usó el término hipertecosis para describir ovarios en los que se encuentran nidos de células tecales luteinizadas dentro del estroma y luego Culiner y Shippel en 1949 (36) describieron pacientes con rasgos clínicos del SOP que eran severamente hirsutas y muy a menudo virilizadas en cuyos ovarios se hallaron la descripción histológica de Frankel. Estas pacientes no mejoran con el uso de anticonceptivos orales, tienen elevadas concentraciones de andrógenos en sangre con LH baja o normal y aunque la resección en cuña de ambos ovarios produce regresión de los síntomas en muchos casos, no se recomienda como primera línea (38).
En ocasiones una mujer puede perder su figura femenina y sus caracteres sexuales secundarios, hecho que generalmente va precedida de oligomenorrea y amenorrea con atrofia endometrial y genital, disminución del tamaño de las mamas y del útero, que pudiera estar relacionada a un exceso en la producción de andrógenos, fenómeno descrito como desfeminización. La masculinización corresponde a una mujer desfeminizada con aparición de acné e hirsutismo, hipertrofia del clítoris, regresión de la línea de implantación del pelo, calvicie, crecimiento laríngeo, voz grave y la configuración de un aspecto masculino, sintomatología que generalmente aparece en ese orden y que al recibir tratamiento de la causa originaria, tienden en desaparecer en el mismo orden. En pocas oportunidades, la mujer puede seguir presentando sangrado genital cíclico.
En los ovarios normales, existen tres tipos de células productoras de esteroides y todas tienen capacidad para producir andrógenos: teca, granulosa y células intersticiales o estromales. La granulosa tienen más habilidad para producir estradiol y progesterona, mientras que la teca y el intersticio producen los siguientes andrógenos: testosterona, androstenodiona, dehidroepiandrostenodiona y delta 5-androstenodiol y aunque poseen la capacidad de producir 11B hidroxiandrostenodiona y el sulfato de dehidroepiandrosterona, lo hacen en concentraciones muy bajas. Las células mesenquimales del estroma, productoras de andrógenos, son un grupo heterogéneo de 4 categorías intersticiales primarias y secundarias, teca-intersticiales e hiliares-intersticiales; las primarias desaparecen a las 20 semanas de gestación y las teca-intersticiales se visualizan en la teca interna de todos los folículos antrales y en la mayoría de los que están en desarrollo. Las células intersticiales secundarias se desarrollan a medida que se produce la atresia y degeneración de las células de la granulosa y del oocito. Las células intersticiales del hilio poseen inervación de nervios simpáticos amielínico al igual que las intersticiales secundarias. Las hiliares son idénticas a las de Leydig del testículo y tiene función parecida, contienen cristaloides de Reinke y producen testosterona en respuesta a la LH y a la hCG. Otras sustancias también estimulan la producción de andrógenos ováricos como la insulina, prostaglandina E2 y norepinefrina, mientras que prolactina, factor de crecimiento epidérmico, Gn-RH y estradiol la inhiben.
Los tumores de ovarios pueden producir andrógenos perse o como consecuencia de metástasis cercanas a las células de la teca y del estroma gonadal; generalmente pertenecen a los cordones sexuales o las de células productores de esteroides. El gonadoblastoma se asocia también con virilización y derivan usualmente de gónadas disgenéticas con cromosoma Y.
Las manifestaciones de hiperandrogenismo con crecimiento del clítoris, como se señaló, no corresponden al llamado síndrome de ovarios poliquísticos de Stein-Leventhal; sus ovarios pueden tener apariencia poli o multiquística, pero clitoromegalia existe cuando hay hipertecosis, hiperplasia de células hiliares, tumores de células de Leydig, de Sertoli o lipoideas, aunque se han reportado como consecuencia de tumores de la granulosa y tecales o la mezcla de ellos. El exceso de cortisol que aparece en síndrome de Cushing también causa clitoromegalias (34).
Se ha reportado clitoromegalia asociado a un aborto espontáneo en el caso de una mujer de 24 años que presentó hirsutismo progresivo y crecimiento del clítoris y normal excreción urinaria de 17 cetoesteroides; tres meses después del aborto espontáneo la voz se hizo grave y el ovario derecho se palpó crecido y duro, de 3,5 cm de diámetro, fue extirpado quirúrgicamente y al corte era amarillo brillante. Se trató de un tumor de Brenner, el estroma contenía grasas en un grupo de células voluminosas que en parte se parecían a un tumor de células luteínicas o de células de Leydig (34).
Los tumores seudomucinosos, especialmente a los asociados a virilismo, pueden poseer solo pequeñas áreas de neoplasia con franco tejido similar a las células de Sertoli-Leydig (39), sin embargo, pareciera que no existe una correlación semejante entre los tumores de células granuloso-tecales y los seudomucinosos.
En algunos casos el tumor de Brenner se origina de la Rete ovarii, estructura derivada de los cordones sexuales, son en realidad tumores de los cordones y del mesenquima sexual de tipo masculino (34).
Hiperandrogenismos de origen suprarrenal
Hiperplasia suprarrenal congenita (Figura 4) Entre las causas mas comunes de hiperandrogenismo de origen suprarrenal se encuentran: deficiencias de 21- hidroxilasa, de 3ß-hidroxiesterode-deshidrogena y de 11 hidroxilasa. Las HSC pueden aparecer tardíamente, en etapas puberales que algunos la definen como de expresión o de aparición tardía y estará representada por hiperandrogenismo y franca virilización.
La hipersecreción de andrógenos por las suprarrenales puede provocar síntomas dependientes del sexo y del momento de aparición; si lo hace antes de la pubertad el varón se tornará con alargamiento del pene y de los otros caracteres sexuales secundarios, es la llamada pubertad precoz isosexual; pero si es una niña, se manifestará por acné, hirsutismo y clitoromegalia, entonces corresponde a una pubertad precoz heterosexual. En ambos sexos hay incremento rápido de la talla, pero luego las epífisis se fusionan y el resultado final, si no se trata apropiadamente será una talla baja. De existir hipercortisolismo puede ocurrir retardo del crecimiento. Las jóvenes tendrán virilización con amenorrea y aceleración de la maduración ósea, si concurre con aumento del cortisol la talla será baja con síntomas de supresión de la función gonadal.
Hiperplasia suprarrenal adquirida
Los tumores de suprarrenal pueden ser benignos como los adenomas que producen testosterona o todos los andrógenos, cuyas concentraciones no son inhibidas por la dexametasona. Son de tamaño pequeño por lo que muchas veces no son visualizados por ultrasonido o resonancia magnética. Los malignos suelen producir las sustancias esteroideas intermedias, andrógenos totales o solo testosterona, con o sin actividad gluco y mineralocorticoide. Estos tumores pueden crecer, ser palpables y aparecen en ecosonografía y resonancia magnética (MRI), pueden invadir la cápsula y órganos vecinos.
Otras entidades que cursan con hiperplasias suprarrenales pueden ser el síndrome y la enfermedad de Cushing, las hiperprolactinemias que cursan con elevación de DHEA y su sulfato (DHEAS), la administración exógena de algunos medicamentos y un raro síndrome de resistencia a glucocorticoides (40).
Virilización durante el embarazo
En algunas ocasiones aparecen signos de virilización durante el embarazo; 2 de estos raros eventos son la luteinización del embarazo y la llamada hiperrreacción luteinalis o quiste teca-luteínico ovárico gestacional, que puede estar asociada a diabetes mellitus e isoinmunización (41). Virilización puede ocurrir en caso de ingestión de drogas y en patologías tumorales ováricas o suprarrenales productoras de andrógenos.
El hiperandrogenismo durante el embarazo ocurre con menos frecuencia en ciertos tumores de ovario: arrenoblastomas (tumor de Sertoli-Leydig), tumores de Krukenberg, tumor de Brenner, de células lipoídicas, de células teca-luteínicas, quistes dermoides, muscinosos y cistoadenocarcinomas serosos. Muy pocos casos de deficiencias de aromatasas han sido reportadas acompañando a embarazadas virilizadas y también ha ocurrido en casos de ingesta de drogas y en patología tumoral de las glándulas suprarrenales.
El tumor masculinizante asociado más frecuentemente a la gestación es el luteoma, corresponde a una masa sólida carnosa, gris amarillento o amarillo-marrón o muy amarillo, a menudo con áreas obscuras de hemorragia y congestión, no son encapsulados y son de tamaño variable, generalmente bilaterales. Puede acompañarse de virilización de los fetos hembras, son benignos y desaparecen después del embarazo. Se ha asociado a embarazos normales; pero son más frecuentes acompañando a embarazos múltiples y aún más en la enfermedad gestacional del trofoblasto, benigna o maligna.
Patología clitoridiana propiamente dicha
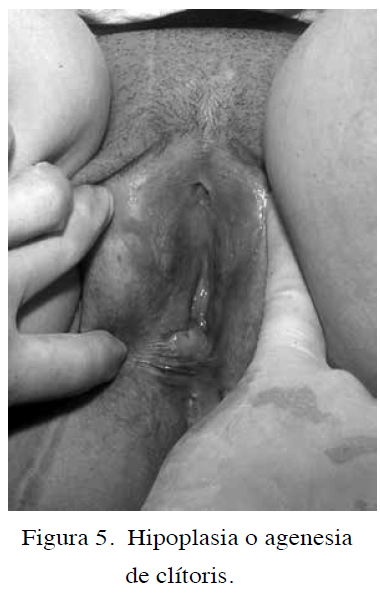
La agenesia del clítoris es sumamente rara y hasta 1989, solo se conocían cuatro casos de ausencia congénita y aislada de clítoris (5); aunque hay reportes esporádicos. En el año 2000 se reportó el caso de una niña que presentó agenesias de clítoris y labios menores al mismo tiempo (42). En el año 2005 se presentó un caso de aparente ausencia del clítoris y de las implicaciones que esta patología puede ocasionar a la salud en una joven de 13 años que fue abusada sexualmente (43). Más reciente es la publicación Brasileña de un niña de 11 años con agenesia aislada de clítoris, donde los autores no lograron palpar tejido o espesamiento que pudiese corresponder al clítoris y reconocen la dificultad en diferenciarlo de la hipoplasia clitoridea (44). En Venezuela se conoce de una presentación oral de Vila y col., en la cual describieron dos casos, madre e hija que acudieron al Hospital Chiquinquirá de Maracaibo (45) (Figura 5).
La causa de la falta congénita del clítoris probablemente sea debido a la ausencia de formación del tubérculo genital, proveniente de la fusión de los segmentos anteriores de los pliegues cloacales, que normalmente lo hacen a la sexta semana de vida intrauterina, o por que haya ocurrido la atresia del mismo. Hay reportes de ausencia de clítoris postraumáticas y como consecuencia de atrofia acentuada en casos de liquen escleroso vulvar (44).
Las malformaciones del clítoris son rarísimas, excepto su hipertrofia en los estados intersexuales. En las raras circunstancias en las que no se produce la fusión, se origina el clítoris bífido (Figura 6), que también puede ser ocasionado por la restricción de la unificación en la porción anterior de los pliegues, tal como ocurre en la extrofia vesical o cloacal. El clítoris bífido acompaña al epispadias y a la extrofia vesical.. El meato uretral anormalmente alto, se halla entre dos hemiclítoris en el epispadias anterior o clitorídeo y requiere uretroplastia, seguido de la unión de los 2 hemiclítoris. Además de la asociación con la extrofia vesical, se puede observar en prolapsos vaginales congénitos y duplicaciones vaginales, urinarias e intestinales (4).
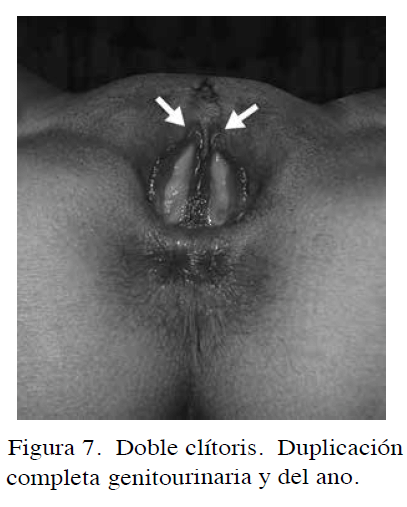
Una rara patología es el clítoris hendido, causado como consecuencia de defectos de fusión en la línea media y se asocia a la misma patología del bífido y a raros casos de ausencia o clivaje de la sínfisis del pubis; los labios mayores están muy separados y los menores lo están en la porción anterior y unidos en la posterior, hay defectos de fusión del útero, la vagina es estrecha, corta y rotada anteriormente; el piso pélvico es incompleto y existe prolapso del útero (46). La duplicación del clítoris es también muy rara y ocurre como consecuencia de la duplicación del tubérculo genital (Figura 7).
El capuchón del clítoris puede desarrollar infecciones con edema y eritema extenso, ocasionado generalmente por estafilococo y si hay formación de abscesos se presentan en forma de masas rojizas tensa y muy dolorosa que deben drenarse. El absceso clitoroideo puro es raro si se descartan los que ocurren como consecuencias de traumatismo o de las mutilaciones (circuncisión femenina) (47).
Las enfermedades de transmisión sexual pueden envolver toda el área perineal y vulvar y por lo tanto el clítoris; algunas de ellas se han incriminado en la aparición de tumores malignos de la región vulvar. El condiloma acuminado ocasionado por virus del papiloma humano (Figura 8) ha sido asociado a cáncer del clítoris (48). En 1991 se reportó un caso de un condiloma gigante de vulva y clítoris tumor de Buschke-Lowestein en el que se detectó DNA de VPH en núcleos celulares del epitelio escamoso con cambios coilocíticos (49). Hampl y col. (50) en el año 2006, reportaron el caso de una joven de 18 años con infección micótica a quien se le diagnosticó pocos meses después un carcinoma localizado entre la uretra y el clítoris.
El priapismo del clítoris es raro; se presenta como una hinchazón del órgano, irritación local e intenso dolor. Se ha propuesto como causa etiológica el uso de drogas erectógenas para inducir deseo sexual u orgasmos, las discrasias sanguíneas, tumores pélvicos, obstrucciones venosas y linfáticas de la pelvis y después de cirugía radical de la vejiga urinaria (51). Monllor y col. (52), de Tenerife, España, en 1996 reportaron priapismo clitorídeo en una paciente que había sido operada de carcinoma de vejiga (Pt3-GIII) con cirugía radical que tuvo recurrencia en la pelvis y que murió 6 meses después de la recurrencia por cáncer metastático del pulmón, y DiGorgi y col. (53) informaron un caso de una paciente que presentó priapismo prolongado, que tenía un carcinoma de vejiga a células transicionales con componente escamoso papilar.
Se ha reportado un caso de priapismo local del clítoris que ha sido causado por un tumor raro de células granulares microscópico, muy agresivo. La caverna adyacente al tumor presentó telangectasias, éxtasis y necrosis del músculo liso de la pared trabecular que condujo a una especie de telescopage, colapso y compresión de los espacios cavernosos que pudo llevar posteriormente a fibrosis en la zona (54).
El término clitorismo le fue aplicado a una erección persistente dolorosa del clítoris que se presentó en una niña de 11 años con leucemia no linfocítica aguda y extremadamente elevada cuenta de glóbulos blancos. 196 000/ mm3 (55).
Se ha informado una causa rara de clitoromegalia en una paciente de 16 años que presentó un quiste epidérmico en el clítoris que fue removido por escisión local. Estos tumores quísticos son raros, intradérmicos o subcutáneos, de crecimiento lento que aparecen en la pared de la epidermis (56) (Figura 9)
Se ha descrito el síndrome del torniquete clitorideo que corresponde a vellos pubianos que se enrollan alrededor del clítoris, resultando en una circunstancia intensamente dolorosa y edematosa (57). Es similar a lo que ocurre cuando los pelos estrangulan otras partes del cuerpo como los dedos, o el pene. El estrangulamiento e isquemia clitoroidea es de difícil diagnóstico, además de la tumefacción se producen signos irritativos y celulitis y al remover el pelo el clítoris retorna su tamaño normal (58).
Como consecuencia de circuncisiones e infibulaciones se han reportados quistes de inclusión clitorideos, infección local y sinequias de labios. Un neuroma que causaba intenso dolor con el coito de una africana de 27 años con antecedente de circuncisión fue reportado en 2003 (59).
En pacientes jóvenes con liquen escleroso puede ocurrir sangrado alrededor del clítoris, equimosis ocurren con los traumatismos y edema en los casos de hipoproteinemia o cuadros de síndrome nefrótico. Las hipertrofias del capuchón del clítoris y el mismo clítoris pueden ser vistas en la neurofibromatosis (Figura 10), hemangiopericitomas o rabdomiosarcomas.
En 1984, Schiller (60) en un estudio que incluyó 246 mujeres con tumor de vulva, 5 presentaron tumores en el clítoris: 2 tenían cáncer, y las otras 3 fueron: 1 hidroadenoma, 1 quiste retención y 1 myxofibroma.
El cáncer primario del clítoris parece ser bastante raro, al igual que el de glándula de Bartholin, y en las publicaciones aparece como cáncer de la vulva, con frecuencia de 1 por 10 otros tumores malignos de la región. En el 2007 apareció una publicación de una lesión clitorídea como consecuencia de una metástasis, probablemente hematógena, de un adenocarcinoma endometrial, en una mujer de 72 años, con múltiples afecciones y piometra, en la cual había una lesión de iguales características histológicas en otras regiones de la vulva, sin neoplasia intraepitelial asociada (61).
El clítoris puede ser asiento de una lesión del tejido celular subcutáneo, rara benigna llamada pilomatrixoma o pilomatrisoma (y de su variedad maligna el pilomatrixoma epiteliode calcificamente de Malherbe) que aparece en niños y adolescentes, dura, formada por tejido epitelial momificado y calcificado con células parecidas a las de la matriz del pelo, son de forma redondeada, o irregular y con cierta movilidad (62,63). En el Cuadro 2 podemos observar otras raras condiciones patológicas que se han descrito a nivel del tubérculo genital.
Mutilaciones
Una variedad de intervenciones que causan mutilaciones del aparato sexual femenino se han realizado y continúan efectuandose en algunos países, dentro de las cuales se deben mencionar: la circuncisión femenina o Sunna (tradición árabe) que es común en Malasia e Indonesia, en el que solo se realiza la resección del capuchón del clítoris; la excisión o clitoroidectomía en la que se extirpa una parte más o menos importante de labios menores y del clítoris que es común en el África Negra; la infibulación o circuncisión faraónica de África, se practica en Mali, Sudán y Somalia, incluye clitoreidectomía, extirpación total de labios menores y sutura, después de avivamiento de labios mayores empleando espinas de acacia. En estos casos se deja un pequeño paso en la comisura posterior, insertando un pedazo de madera en la sutura, para que exista la evacuación de la orina y la sangre menstrual. Después se atan juntos los miembros inferiores y la iniciada quedará inmóvil hasta que haya cicatrizado la herida. Después del casamiento, la mujer es descosida con puñal o navaja, lo necesario para la introducción del pene y
esta desinfabulación va seguida de coitos repetidos para que la cicatriz no se vuelva a cerrar. En Sudan realizan una intervención con sutura parcial de labios mayores ya que la infibulación está prohibida. Ciertos aborígenes de Australia practican como especie de episiotomía en la pubertad, para agrandar el orificio vaginal, desgarrando manualmente el periné o practicándole una hendidura con una piedra afilada.
Este tipo de rituales que se practican en 27 países del África es inexistente en Estados Unidos de América; pero la afluencia de refugiados africanos va en aumento en ese país y pudiera haber traido mujeres a quienes se les haya realizado tales procedimientos, que pueden cursar con algunas complicaciones como son las cicatrices fibróticas y quistes en el clítoris, que pueden alcanzar hasta 12 cm de diámetro (64). Este tipo de rituales fue considerado en 1997 en EE.UU como un crimen federal (65).
Debido a la cercanía de la uretra al clítoris, pueden ocasionar complicaciones inmediatas y mediatas ocasionando estenosis uretrales y obstrucción del meato. Se ha reportado disfunciones sexuales e infertilidad, dolor pelviano crónico, cicatrices y fibrosis hipertróficas en las cercanías al clítoris y en raras ocasiones problemas durante el parto, parto obstruido causando sufrimiento fetal (66). En forma similar a las complicaciones de la circuncisión en hombres, se han reportado, además de la hemorragia e infección que son las más comunes otras que son muy raras como la aparición de quistes, fístulas, meatitis y lesiones del glande (67,68). Una complicación más rara aún, que se observa en el mediano plazo es la aparición de neuromas del nervio dorsal del clítoris que producen cicatrices sumamente dolorosas y la llamada coalescencia de labios menores.
Correspondencia: Dr. Nelson Velásquez
Calle 73. Entre av. 3G y 3H.
Residencias Vistana, Apartamento Nº 3.
Sector La Lago. Maracaibo Venezuela.
Teléfonos: CANTV. 0261- 7910527.
CELULAR: 0414-3603471
REFERENCIAS
1. Diccionario Pschyrembel de Ginecología y Obstetricia. Walter de Gruyter. Berlin 1988. [ Links ]
2. Kushwaha Koures A, Santolaya Forgas J. Diferenciación sexual humana: mecanismos genéticos y embriológicos. En: Sánchez de La Cruz, editora. Ginecología Infanto Juvenil. Caracas: Editorial Ateproca; 1997.p.1-22.
3. Jones III HW, Wentz A C, Burnet LS. Novak´s Textbook of gynecology. 11ª edición. Baltimore: Williams & Wilkins; 1988.
4. Benson RC, Pernoll ML. Handbook of Obstetrics & Gynecology. 9ª edición. New York: McGraw-Hill, Inc; 1994.
5. Hewitt J, Pelisse M, Paniel B. Enfermedades de la vulva. Madrid: McGraw-Hill, Interamericana de España; 1989.
6. Sánchez de la Cruz B, Pérez MM. Anatomía de los genitales en la niña. En: Sánchez de La Cruz B, editora. Ginecología Infanto-Juvenil. Caracas: Editorial Ateproca; 1997.p.23-29.
7. Fleiss PM, Hodges FM, Van Howe RS. Inmunological function of the human prepuce. Sex Transm Infect. 1998;74:364-367.
8. Cold CJ, Taylor JR. The prepuce. BJU Int. 1999;83(Suppl 1):34-44. [ Links ]
9. Huffman JW, Dewhurst CJ, Capraro BJ. The gynecology of childhood and adolescente. Filadelfia: WB Saunders; 1981.
10. Verkauf BS, Von Thron J, O´ Brien WF. Clitoral size in normal women. Obstet Gynecol. 1992;80:41-44. [ Links ]
11. Sane K, Pescovitz OH. The clitoral index: A determination of clitoral size in normal girls and girl with abnormal sexual development. J Pediatr. 1992;120:264-266. [ Links ]
12. Speroff L, Fritz MA. Endocrinología ginecológica clínica y esterilidad. 2ª edición en español. Barcelona, España: Lippincott Williams & Wilkins; Segunda reimpresión 2008.
13. Masters WH, Johnson VE. The human females: Anatomy of sexual response. Minn Med. 1960:31-36.
14. Finkenzeller DA, Loveles MB. The Johns Hopkins manual of gynecology and obstetrics. 3ª edición. Filadelfia: Walters Kluwer/Lippincott Williams & Wilkins; 2007.
15. Basson R. Recent advances in womens sexual function and dysfunction. Menopause. 2004;6:714- 725. [ Links ]
16. Masters EH, Johnson VE. Human sexual response. Boston: Little, Brown; 1966.
17. Basson R, Berman J, Burnett A, Derogatis L, Fergunson D, Fourcroy J et al. Report of the International consensus development conference on female sexual dysfunction: Definitions and classifications. J Urol. 2000;183:888-893. [ Links ]
18. Marthol H, Hilz MJ. Female sexual dysfunction: A systematic overview of classification, pathophysiology, diagnosis and treatment. Fortschr Neurol Psychiatr. 2004;72:121-135. [ Links ]
19. Pauls RN, Kleeman SD, Karram MM. Female sexual dysfunction: Principles of diagnosis and therapy. Obstet Gynecol Survey. 2005;60:196-205. [ Links ]
20. Mercer CH, Fenton KA, Johnson AM, Welling K, MacDowal W, McManus S, et al. Sexual function problems and help seeking behavior in Britain: nacional probability sample survey. BMJ 2003;327:426-427. [ Links ]
21. Myers LS, Dixen J. Morrissette D, Carmichael M, Davidson JM. Effects of estrogen, androgen, and progestin on sexual psycophysiology and behavior in postmenopausal women. J Clin Endocrinol Metab. 1990;70:1124-1131. [ Links ]
22. Davis SR, Davison SL, Donath S, Bell RJ. Circulating androgen levels and self-reported sexual function in women. JAMA. 2005;294:91-96. [ Links ]
23. Thakar R, Ayers S, Clarkson P, Stanton S, ManyondaI. Outcomes after total versus subtotal hysterectomy. N Engl J Med. 2002;347:1318-1325. [ Links ]
24. Rhodes JC, Kjerulff KH, Langenberg PW, Guzinki GM. Hysterectomy and sexual functioning. JAMA. 1999;282:1934-1941. [ Links ]
25. Achard C, Thiers J. Le virilisme pilaire et son association a l´insuffisance glycolytique (diabetes des femme a barb). Bull Acad Natl Med. 1921;86:51-64. [ Links ]
26. Barnes ND, Palumbo PJ, Hyles AM, Folgar H. Insulin resistance, skin changes and virilization: A recessively inherited syndrome possibly due to pineal gland disfunction. Diabetología. 1974;10:284-289. [ Links ]
27. Colle M, Doyard P, Chaussain JL, Battin J, Job JC. Acanthosis nigricans, hirsutisme et diabetes insulinresistant. Arch Franc Pediatr. 1979;36:518-523.
28. Lee PA, Mazur T, Danish R,Amerhein J, Blitzard RM, Money J Migeon CJ. Micropenis. I. Criteria, etiologies and classifications. Johns Hopkins Med J. 1980;146:156-163. [ Links ]
29. Adashi E Y, Rock JA, Rosenwaks Z. Reproductive endocrinology, surgery and technology. Volumen 1. Filadelfia: Lippincott-Raven Publishers; 1996. [ Links ]
30. Guzman Esquivel J. Micropene. (Editorial) Rev Mex Urol. 2008;68:1-2. [ Links ]
31. Jones HW, Park IJ, Rock JA. Technique of surgical sex reassignment: Micropenis and allied conditions. Am J Obstet Gynecol. 1978;132:870-877. [ Links ]
32. Gearhart JP, Rock JA. Total ablation of the penis alter circumcision with electrocautery: A method of management and long-term followup. J Urol. 1989;142:799-801. [ Links ]
33. Klugo RC, Cerney JC. Response of micropenis to topical testosterone and gonadotropina. J Urol. 1978;119:667-668. [ Links ]
34. Morris JM, Scully RE. Patología endocrina del ovario. La Prensa Médica Mexicana, México DF, 1960.
35. Frankel L. Thecoma and hipertecosis of the ovary. J Clin Endocrinol. 1943;3:557-559. [ Links ]
36. Culiner A, Shippel S. Virilism and theca hyperplasia of the ovary: A syndrome. J Obstet Gynecol Br Emp. 1949;56:439-445. [ Links ]
37. Shippel S. The ovarian thecal cell: part IV. The hiperthecosis syndrome. J Obstet Gynecol Br Emp. 1955;62:321-353. [ Links ]
38. Nagamani M. Polycystic ovary syndrome variants: Hipertecosis. En: Adashi EY, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery, and technology. Volumen 2. Filadelfia: Lippincott-Raven Publish; 1996.p.1257-1269.
39. Hughesdon PE, Fraser IT. Arrhenoblastoma of the ovary. Case report and histological review. Acta Obstet Gynecol Scandinav Supl. 1953;32(4):1-78. [ Links ]
40. MatorakosG, ChrousosGP. Adrenalhyperandrogenism. En: Adashi EY, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery, and technology. Volumen 2. Filadelfia: Lippincott-Raven Publish; 1996.p.1540-1553.
41. McClamrock HD, Adashi EY. Gestational hiperandrogenism. En: Adashi EY, Rock JA, Rosenwaks Z, editores. Reproductive endocrinology, surgery, and technology. Volumen 2. Filadelfia: Lippincott-Raven Publish; 1996.p.1599-1616.
42. Martinón-Torres F, Martinón-Sánchez M, J Martinón- Sánchez F. Clitoris and labia minor agenesis- an undescribed malformation. Clinical Genetis. 2000;58:336-338. [ Links ]
43. Bellemare S, Dibden L. Absence of the clítoris in a 13-years-old adolescent: Medical implications for child and adolescente. J Pediatric Adolesc. 2005;18:415-418. [ Links ]
44. Macedo Almeida JA, Galvez Laghai ER. Agenesia congénita do clitóris em crianza de 11 meses de idade. Rev SOGIA-BR. 2010;11:19-20. [ Links ]
45. Vila N, Barboza R, Higuera B. Agenesia de clítoris: presentación de 2 casos. XIII Jornada Nacional de, Obstetricia y Ginecología, Sociedad de Obstetricia y Ginecología de Venezuela, Barquisimeto, marzo 1997.
46. Muram D. Pediatric & Adolescent gynecology. En: DeCherney A H, Murphy Goodwin T, Nathan L, Laufer N., editores. Current diagnosis & treatment. Obstetrics & gynecology. 10ª edición. New York: Mc Graw Hill; 2007.p.540-569.
47. López-Olmos J. Abscesos del clítoris. Clin Invest Ginecol Obstet. 2008;35:218-220. [ Links ]
48. Nachev AN, Vasilev S, Ivanov S, Meziad S. The CO2 laser treatment of extensive skin changes to the vulva caused by human papillomavirus (HPV) and refractory to others types of therapy. Akush Gineckol (Soffia) 1996;35:55-56. [ Links ]
49. Shimano S, Fukushima M, Yamakawa Y, Nishikawa A, Sato F, Honma K, et al. A case report of Buschke- Lowenstein tumor (giant condyloma). Rinsho Byori. 1991;39:97-101. [ Links ]
50. Hampl M, Ramp H, Bender G, Kueppers V. A case of a pT3, HPV- 52-positive vulvar carcinoma in a 18 years-old women. Gynecol Oncol. 2006;109:340- 345. [ Links ]
51. Mashael Al-Shebaily M, Quoreshi VQ. Malignancies in clitoris: A review of literature etiology, diagnosis, pathology and treatment strategies. Internat J Cancer Res. 2008;4:110-126. [ Links ]
52. Monllor J, Taño F, Arteaga PR, Galbis F. Priapismo of the clítoris Eur Urol. 1996;30:521-522.
53. DiGiorgi S, Schnatz PF, Mandavilli S, Greene JF, Curry SL. Transcitional cell carcinoma presentig as clitoral priapism. Gynecol Oncol. 2004;93:540-542. [ Links ]
54. Slavin RE, Christie JD, Swedo J, Powell LC jr. Locally aggresive granular cell tumor causing priapism of the crus of the clitoris. A light and ultrastructural study, with observations concerning the pathogenesis of fibrosis of the corpus cavernosum in priapism. Am J Surg Pathol. 1986;10:497-507. [ Links ]
55. Williams DL, Bell BA, Ragab AH. Clitorism at presentation of acute nonlymphocytic leucemia. J Pediatr. 1985;107:754-755. [ Links ] 56. Schmidt A, Lang U, Kiess W. Epidermal cyst of the clitoris: A rare cause of clitoromegaly. Eur J Obstet Gynecol Reprod Biol. 1999;87:163-165. [ Links ]
57. Press S, Schachner L, Paul P. Clitoris tourniquet syndrome. Pediatrics. 1980;66:781-782. [ Links ]
58. Finkenzeller DA, Loveles MB. Pediatric gynecology. En: Fortner KB, Szymanski LM, Fox HE, Wallach EE, editores. The Johns Hopkins manual of gynecology and obstetrics. 3ª edición. Filadelfia: Walters Kluwer/ Lippincott Williams & Wilkins, 2007.p.363-377.
59. Fernández-Aguilar S, Noel JC. Neuroma of the clitoris after female genital cutting. Obstet Gynecol. 2003;1010:1053-1054. [ Links ]
60. Schiller S, Donat H. Clinical significance of clitoral tumors. Zentralb Gynakol. 1984;106:1018-1021. [ Links ]
61. Mandal S, Lowe J, George M. Clitoral metastasis in poorly differentiated endometrial adenocacrcinoma. Internet J Gynecol Obstet. 2007;7: DOI 105580/ 1bac. [ Links ]
62 . Grimalt R. Tumores cutáneos: En: Moraga Loop FA, editor. Protocolos diagnósticos y terapéuticos en dermatología pediátrica. Vol. IV. Mallorca, Barcelona: Editorial Esmon Publicidad SA; 2001.p.295-303.
63 . James W D, Berger T G, Dirk M E. Andrew´s disease of the skin: Clinical Dermatology. 10ª edición. Filadelfia: W. B Saunders Publishers Editores; 2006. [ Links ]
64. Versin J. Sequelae of female circumcision. Trp Doct. 1975;5:163-169. [ Links ]
65. Federal prohibition of female genital mutilation act. Public Law 104=140, 110 Stat.1327; 1996.
66. Nour NM. Females genital cutting: Clinical and cultural guidelines. Obstet Gynecol Survey. 2004;59:272-279. [ Links ]
67. Kaplan GW. Complications of circumcision. Urol Clin North Am. 1983;10:543-549. [ Links ]
68. Alanis MC, Lucidi RS. Neonatal circumcision: A review of the world´s oldest and most controversial operation. Obstet Gynecol Survey. 2004;59:379-395. [ Links ]