Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Obstetricia y Ginecología de Venezuela
versión impresa ISSN 0048-7732
Rev Obstet Ginecol Venez vol.77 no.1 Caracas mar. 2017
Angiosarcoma cutáneo mamario radioinducido tras cirugía conservadora por carcinoma de mama.
Zoraida Frías Sánchez1 , Manuel Pantoja Garrido2 , Álvaro Gutiérrez Domingo3 , María Eugenia Calvo Cotado4 , Cecilia Jiménez Sánchez5, Juan Novo Cabrera 1.
1 Unidad de Gestión Clínica de Obstetricia y Ginecología del Hospital Universitario Virgen Macarena de Sevilla, España. 2 Unidad de Gestión Clínica de Obstetricia y Ginecología del Hospital Universitario de Jerez de la Frontera (Cádiz), España. 3 Servicio de Anatomía Patológica, Hospital Universitario Virgen Macarena, Sevilla, España. 4 Servicio de Cirugía Plástica y Reparadora, Hospital Universitario Virgen Macarena, Sevilla, España). 5 Departamento de Farmacología de la Facultad de Medicina. Universidad de Granada.
RESUMEN
El angiosarcoma de mama es una entidad extremadamente infrecuente y de pronóstico infausto, que puede darse de forma primaria, o secundaria a radioterapia tras cirugía conservadora de mama. Puede presentarse como una masa palpable, o bien, como lesiones cutáneas violáceas que pueden simular cambios benignos derivados de la radioterapia. El diagnóstico precoz es esencial, tomando muestras para biopsia de dichas lesiones, y prestando especial interés a la inmunohistoquímica. El tratamiento de este tipo de neoplasias es un tema controvertido ya que, dada la rareza de su aparición, no existen protocolos definidos sobre la actitud a seguir, siendo de vital importancia las terapias asociadas a cirugía radical. Aquí se presenta un caso de una paciente de 62 años que desarrolla un angiosarcoma cutáneo de mama, secundario a radioterapia, clínicamente observado como lesiones papulares violáceas sobre la zona irradiada previamente, tras un carcinoma de mama tratado con cirugía conservadora, con una supervivencia de aproximadamente 12 meses entre el diagnóstico y el éxitus de la paciente.
Palabras clave: Angiosarcoma de mama, Cáncer, Radiación, Cirugía conservadora, Angiosarcoma cutáneo.
SUMMARY
Breast angiosarcomas are very rare malignancies with an unfortunate prognosis, which can occur in a primary form, or secondary to radiotherapy after conservative breast surgery. It can present as a palpable mass, or as violaceous cutaneous lesions that can mimic benign changes derived from radiotherapy. Early diagnosis is essential, biopsying such lesions, and paying particular attention to immunohistochemistry. The treatment of this type of neoplasias is a controversial issue since, given the rarity of its appearance, there are no defined protocols to be followed, being the therapies associated with radical surgery of vital importance. Here we present a case of a 62-year-old female patient who develops cutaneous angiosarcoma of the breast secondary to radiotherapy, clinically observed as violaceous papular lesions on the previously irradiated area, after a breast cancer treated with conservative surgery, and with a survival of approximately 12 months between the diagnosis and the patients success.
Key words: Breast angiosarcoma, Cancer, Radiation, Breast-conserving surgery, Cutaneous angiosarcoma.
INTRODUCCIÓN
El angiosarcoma mamario es una rara enfermedad que supone el 0,04 % de todas las neoplasias malignas de la mama (1), descrito por primera vez por Body y col. (2) en 1987. Es un tumor maligno muy agresivo derivado del endotelio vascular, caracterizado por una rápida proliferación celular y un crecimiento infiltrante, que puede desarrollarse en cualquier órgano del cuerpo, siendo las zonas más usuales la piel y los tejidos blandos (3). Existen dos formas clínicas de dicha enfermedad: el angiosarcoma primario y el angiosarcoma secundario, del que trata este caso clínico. El angiosarcoma secundario puede darse tras radiación local o en el contexto de un linfedema crónico, conocido como Síndrome de Stewart-Treves (2 – 5). Es una patología importante ya que, aunque la incidencia es baja, alcanzando una cifra acumulada de 0,9 por cada 1000 personas, a los 15 años (6), el número de casos está aumentando con el auge de la cirugía conservadora de mama. La presentación clínica de esta patología tiene diversas variedades, siendo algunas de las más frecuentes las alteraciones cutáneas, como lesiones papulares, eritemas eccematosos o coloraciones violáceas similares a hematomas (2).
En cuanto al diagnóstico, es esencial, la premura en este aspecto, porque la importancia de identificar dichos casos va a poder adelantar el tratamiento y posiblemente mejorar el pronóstico. Se basa en la biopsia en sacabocado de piel o en la biopsia escisional, ya que las pruebas de imagen como la mamografía o la resonancia magnética nuclear no presentan hallazgos patognomónicos asociados a esta patología (2). La resección quirúrgica mediante mastectomía, sin linfadenectomía axilar, es el tratamiento habitual, aunque no existe consenso en cuanto a los tratamientos adyuvantes. El pronóstico es extremadamente malo, teniendo una media de supervivencia de 15 - 20 meses desde el momento del diagnóstico (7).
Por tanto, aquí se expone el caso de una mujer de 62 años intervenida mediante tumorectomía por cáncer de mama, recibiendo posteriormente radioterapia adyuvante. Ocho años más tarde, debuta con lesiones cutáneas en el lecho de la tumorectomía, con la biopsia fueron diagnosticadas como angiosarcoma secundario, es reintervenida en numerosas ocasiones con mastectomía radical, escisión radical de las lesiones sobre el lecho de mastectomía y reconstrucción con colgajo libre, acabando finalmente con el exitus de la paciente.
HISTORIA CLÍNICA
Se expone el caso de una mujer de 62 años que padeció un carcinoma ductal infiltrante de mama izquierda en el año 2006, tratado con cirugía conservadora, linfadenectomía axilar y radioterapia adyuvante. Entre los antecedentes personales, destaca una hipertensión crónica, obesidad, síndrome metabólico y ataxia cerebelosa.
En seguimiento por la Unidad de Mama desde entonces, ocho años tras la intervención, consulta por una lesión dérmica de color violácea en la mama izquierda, de reciente aparición. Como primera sospecha diagnóstica y, ante la ausencia de clínica de la paciente, se piensa que puede corresponder a cambios dérmicos benignos secundarios a la radioterapia, sin descartar la posibilidad de recidiva tumoral. No obstante, se solicita una mamografía y se decide extirpar la lesión bajo anestesia local. Los hallazgos mamográficos no demuestran patología mamaria, con cambios postquirúrgicos normales, se categoriza finalmente como BIRADS 2. La biopsia escisional es analizada por el Servicio de Anatomía Patológica, informándose como angiosarcoma dérmico en piel con cambios atribuibles a radioterapia. La lesión es totalmente extirpada, midiendo 1 cm de dimensión máxima y con los bordes quirúrgicos libres. El estudio inmunohistoquímico demuestra fuerte expresión de CD31, CD34, ausencia de expresión de HHV8 y un altísimo índice de proliferación (Ki67 del 80 %).
Se plantea el caso en el Comité de Tumores Ginecológicos, barajando la opción de mastectomía radical izquierda, pese al riesgo quirúrgico que presenta la paciente. Entre los estudios solicitados, se incluye el estudio de extensión con una tomografía axial computarizada (TAC) tóraco-abdominal, que descarta enfermedad metastásica. Finalmente, y tras consensuarlo con la paciente, se decide realizar una mastectomía radical izquierda y una mastectomía derecha profiláctica ante la insistencia de la misma. En espera de dicha intervención, aparecen nuevas lesiones dérmicas en la misma zona, siendo de nuevo diagnosticadas como angiosarcoma dérmico.
La paciente es intervenida quirúrgicamente sin complicaciones intraoperatorias ni en el postoperatorio precoz, teniendo una recuperación excelente y recibiendo el alta domiciliaria a los dos días del procedimiento. Posteriormente, se revisa a la paciente en la consulta, donde se le informa de los resultados histológicos de la pieza quirúrgica: mama derecha con ausencia de neoplasia y mama izquierda con un foco de angiosarcoma a nivel de dermis profunda y tejido subcutáneo, posiblemente radioinducido. El estudio inmunohistoquímico es positivo para CD31, CD34, FLI1, con un Ki67 muy elevado.
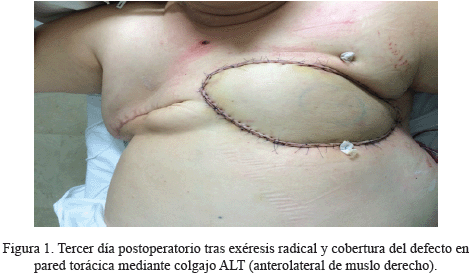
Así pues, una vez operada, se remite al Servicio de Oncología Médica para continuar con el tratamiento quimioterápico adyuvante. A los 2 meses de la intervención, la mujer vuelve a consultar por varias lesiones nodulares a lo largo de toda la cicatriz de la mastectomía izquierda, que se extirpan bajo anestesia local. Todas ellas vienen informadas como focos de angiosarcoma con márgenes afectos, con el mismo estudio inmunohistoquímico descrito anteriormente, por lo que se decide en el Comité de Tumores, que la paciente sea valorada por el Servicio de Cirugía Plástica y Reparadora General. Se estudia el caso, se valora a la paciente y se solicita una resonancia magnética nuclear (RMN), para descartar infiltración de planos profundos. Los hallazgos radiológicos indican que existen alteraciones que afectan a dermis, tejido subcutáneo y porción inferior de musculatura pectoral a nivel del lecho quirúrgico. Finalmente, se realiza una exéresis radical hasta plano costal, incluyendo musculatura pectoral, y cobertura del defecto mediante colgajo fasciocutáneo libre anterolateral de muslo derecho, suturado a vasos mamarios internos, sin incidencias en el postoperatorio (Figura 1).
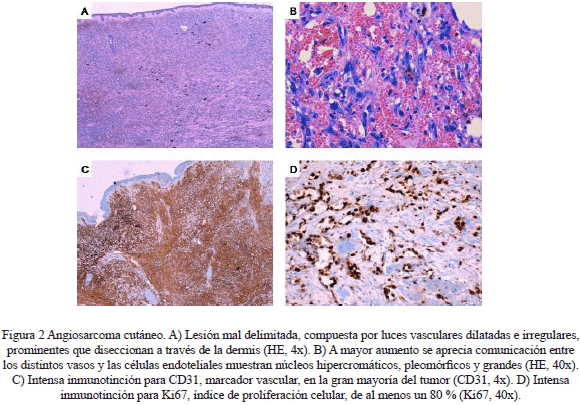
La paciente evoluciona de manera favorable, siendo dada de alta domiciliaria a los 14 días de la intervención quirúrgica. El diagnóstico definitivo fue histológico, informado por el Servicio de Anatomía patológica. En el análisis macroscópico de la pieza se observó, externamente, una lesión cicatricial irregular oblicua de 17 cm de longitud. Además, se objetivaron cuatro lesiones de aspecto papuloso de entre 0,9 y 0,5 cm de diámetro principal que, macroscópicamente, no parecían ulcerar la superficie cutánea. El borde de resección profundo mostraba abundantes asas musculares y en relación con la cicatriz se observó un área anfractuosa de 10 cm que macroscópicamente afectaba el plano muscular y que a los cortes seriados se relacionaba con un área estrellada blanquecina y firme de 6 x 3 cm que macroscópicamente contactaba con la superficie cutánea, retrayéndola (Figura 2).
El seguimiento se realiza por parte del Servicio de Cirugía Plástica, pendiente de tratamiento quimioterápico adyuvante una vez recuperada de la cirugía. La paciente fallece en su domicilio a los 20 días de la intervención, de forma súbita, sin realizarse autopsia, por deseo de los familiares.
DISCUSIÓN
El angiosarcoma de mama es una entidad rara, que supone entre el 0,5 % y el 1 % de los tumores de tejidos blandos de mama (2). Se trata de un subtipo de sarcomas de tejidos blandos de origen endotelial o vascular (2, 4, 8). Es un tumor maligno muy agresivo, caracterizado por una rápida proliferación celular y un crecimiento infiltrante. Puede desarrollarse en cualquier órgano del cuerpo, siendo las zonas más comunes, la piel y los tejidos blandos. Aproximadamente entre el 1 % y el 2 % de todos los sarcomas de tejidos blandos son angiosarcomas, observándose casi un 8 % a nivel mamario (3). Se estima que, en Europa, la incidencia de angiosarcoma de mama es de 5/100 000/ año (9). Existen dos formas clínicas de dicha enfermedad: el angiosarcoma primario y el angiosarcoma secundario. El angiosarcoma secundario puede darse tras radiación local o en el contexto de un linfedema crónico, conocido como Síndrome de Stewart-Treves (2 – 5).
El angiosarcoma secundario a radioterapia pertenece a un gran grupo de neoplasias asociados a radioterapia (RAS), definidos por tres características: que aparezca en el campo de radiación previa, un periodo de latencia de al menos 3 años y una distinción histológica de la forma primaria (10). El presente caso clínico trata de una paciente con cirugía conservadora de mama ocho años antes, por lo que la discusión se centra en el angiosarcoma secundario a radioterapia.
Se suele presentar en mujeres mayores, con una edad media entre 67 y 71 años, y con un periodo de latencia entre la radioterapia y su aparición de unos 5 a 10 años (2). La etiología de esta entidad se relaciona con el uso de la radioterapia, por lo que se podría considerar un tumor maligno iatrogénico. Existen numerosos estudios que pretenden valorar la relación entre la dosis usada en los tratamientos radioterápicos y su efecto final sobre los campos irradiados. Karlsson y col. (11), reportaron un efecto dosis-respuesta directo, en el que el riesgo de sarcoma se incrementa conforme la dosis integral utilizada supera los 150 - 200 julios. Asimismo, se establece como dosis mínima necesaria para poder inducir un sarcoma radioinducido (RIS) 10 grays (Gy) (12).
La patogénesis de los RIS es desconocida. Existen numerosas hipótesis que tratan de explicar el origen de este grupo de tumores tan agresivos. Se ha descrito en la literatura que la causa puede estar relacionada con el daño irreversible que genera la radiación en el ADN, resultante de la inestabilidad genómica y de la inducción directa tumoral por la radiación mediante mutaciones de los genes relacionados con el cáncer. Algunos estudios moleculares realizados en los sarcomas radioinducidos demuestran la inactivación de la proteína p53 y la expresión y amplificación del oncogén MYC en la región 8q24. Este oncogén juega un papel esencial en la proliferación y diferenciación celular, en la apoptosis, en la estimulación de la angiogénesis y promueve la invasión tisular y el desarrollo de metástasis (6). Existe una serie en la que Guo y col. (13) realizaron estudios moleculares en una selección de casos con diagnóstico de lesiones asociadas a radiación, encontrando en un 25 % de los angiosarcomas secundarios, una coamplificación de la FLT4 (tirosin-quinasa 4, gen que codifica el factor de crecimiento endotelial 3 o VEGFR3) en asociación a una amplificación del oncogén MYC, no observando dichos hallazgos en otras lesiones vasculares atípicas radioinducidas. Estos resultados plantean la teoría de que la sobreexpresión de la FLT4 puede ser una herramienta clave para la progresión de dichos sarcomas. Clínicamente suele presentarse en forma de lesiones cutáneas, ya sean únicas o múltiples, que puede simular cambios benignos secundarios a radioterapia. En ocasiones, se asocia a una masa palpable (14). En este caso, la paciente debuta con lesiones dérmicas violáceas en el lecho de la tumorectomía previa, sin palparse masas o nódulos.
En cuanto al diagnóstico de esta patología, es importante la exploración física en pacientes con riesgo potencial, en el caso que se presenta, una paciente con cirugía conservadora de mama y tratamiento radioterápico posterior. Las pruebas de imagen tienen un valor limitado en este campo, ya que la mamografía puede ser negativa incluso en aquellos casos en los que ya existen lesiones dérmicas notorias, como ocurre con esta paciente. Existen estudios que reportan hasta un 33 % de pacientes con angiosarcoma mamario y mamografías negativas. Entre los hallazgos sonográficos que se pueden observar, destacan las masas hiperecoicas y heterogéneas que alteran la arquitectura normal de la mama (3). Así pues, entre las pruebas complementarias, la que presenta mayor fiabilidad y, por tanto, más valor en el diagnóstico, es la resonancia magnética nuclear (RMN) (15). No obstante, el diagnóstico definitivo lo da el estudio histológico de las lesiones. En el estudio anatomopatológico de la pieza quirúrgica de esta paciente, en las secciones teñidas con hematoxilina-eosina se identificó una lesión mal delimitada compuesta por luces vasculares dilatadas, irregulares y prominentes que diseccionaban a través de la dermis, infiltrando el tejido celular subcutáneo. Estos vasos presentaban tendencia a comunicarse unos con otros, formando una gran red anastomótica. Las células endoteliales mostraban núcleos pleomórficos, hipercromáticos y grandes. El estudio inmunohistoquímico reveló marcada positividad para CD31, CD34, ERG, FLI1 y AML y resultó negativo para HHV8, descartando la posibilidad de un sarcoma de Kaposi. El índice de proliferación (Ki67) fue de, al menos, un 80 %.
No existe consenso en el tratamiento a seguir, dada la baja incidencia y la gravedad de esta enfermedad, no hay series que puedan revelar con claridad los efectos de las distintas terapias. No obstante, se ha visto que tanto el diagnóstico precoz como la cirugía radical hacen que las tasas de supervivencia mejoren (16). El plan terapéutico se fundamenta en la cirugía, siendo el pilar básico e imprescindible para el tratamiento de esta entidad. La resección radical con mastectomía es la opción habitual (7), sin recomendarse el vaciamiento axilar, ya que se ha descrito que el angiosarcoma no tiende a metastatizar por vía linfática (15). Hay que prestar especial atención a los bordes quirúrgicos de la pieza, siendo de vital importancia, la negatividad de los márgenes. Thijssens y col. (17) encontraron que las resecciones R0 (microscópicamente libre de tumor) tenían tasas de supervivencia más altas que los R1 (microscópicamente positivo para tumor) o que los R2 (macroscópicamente positivos para tumor). En el caso que se presenta, la paciente se reinterviene en varias ocasiones por lesiones recidivantes, finalizando con una mastectomía radical de la mama afecta y una exéresis del lecho quirúrgico, reconstruido con colgajo libre, obteniendo los márgenes libres de tumor microscópicamente. No obstante, se está enfatizando cada vez más la necesidad de un tratamiento multidisciplinario en esta área, que incluya adyuvancia con quimioterapia y/o radioterapia. En cuanto a la quimioterapia, es un tema controvertido en el tratamiento de los sarcomas de tejidos blandos. Dado el pronóstico infausto de los pacientes con esta patología, no hay protocolos terapéuticos claros. Así pues, se han usado múltiples terapias, como la combinación de doxorrubicina e ifosfamida, con buenos resultados (15). Una serie de 69 pacientes con diagnóstico de angiosarcoma de mama, reclutadas en la Clínica MD Anderson, fueron tratadas con ciclos de antraciclina-ifosfamida y gemcitabina-taxanos, obteniendo una tasa de respuesta óptima en el 48 % de las pacientes, lo que sugería que el angiosarcoma de mama es una enfermedad potencialmente quimiosensible (18). El impacto de la radioterapia es mucho menor que la quimioterapia, ya que la tolerancia de estos pacientes a la dosis de radiación es limitada, debido a la ya recibida previamente. El riesgo-beneficio es controvertido, puesto que la toxicidad que se puede generar es muy alta, provocando fracturas, neumonitis o necrosis de tejidos blandos (15). En este caso, la paciente no llegó a recibir ningún tipo de tratamiento adyuvante ya que el exitus se dio antes de iniciar el protocolo de quimioterapia. Hay que seguir investigando en las terapias dirigidas a los factores de crecimiento endotelial, como el sunitinib, el sorafenib o el bevacizumab. El pronóstico de esta enfermedad es muy malo, con un riesgo de recidiva local y metástasis muy elevado. Hay series que hablan de una tasa de supervivencia a los 5 años de 27 % a 48 %, considerando uno de los factores pronóstico más relevante el número de lesiones. Se reportan cifras de supervivencia a los 2 años de 0 %, con más de una lesión cutánea. Otros de los factores pronósticos son el tamaño tumoral o el grado histológico del tumor (15). En términos generales, el pronóstico es muy desalentador, con una mediana de supervivencia de 15 meses desde el momento del diagnóstico (7). En este caso, la paciente fallece a los 12 meses del diagnóstico, tras varias intervenciones quirúrgicas multidisciplinares.
CONCLUSIONES
El angiosarcoma secundario de mama se trata de una entidad muy poco frecuente y con un pronóstico sombrío. Es una patología que asciende potencialmente debido al auge actual de la cirugía conservadora de mama. Clínicamente, se puede presentar como lesiones cutáneas únicas o múltiples, que pueden simular cambios benignos derivados de la radioterapia. No existen pruebas de imagen con patrones patognomónicos, por lo que el único diagnóstico definitivo lo aporta la histología de la biopsia escisional o la biopsia en sacabocado de piel. Así pues, es necesario prestar especial atención a las lesiones cutáneas en pacientes con antecedentes de radiación y procurar un diagnóstico precoz, ya que será decisivo en el pronóstico de la paciente. La educación sobre la autoexploración en las pacientes de riesgo puede ser crucial en este campo para saber reconocer las lesiones sospechosas y poder actuar con celeridad.
REFERENCIAS
1. Yang WT, Hennessy BT, Dryden MJ, Valero V, Hunt KK, Krishnamurthy S. Mammary angiosarcomas: Imaging findings in 24 patients. Radiology. 2007; 242 (3): 725-734. [ Links ]
2. Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K. Primary and secondary angiosarcoma of the breast. Gland Surgery. 2014; 3 (1): 28 - 34. [ Links ]
3. Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, Svec J, Zeman A. Clinical management of secondary angiosarcoma after breast conservation therapy. Rep Pract Oncol Radiother. 2010; 19 (1): 37 - 46. [ Links ]
4. Eppelheimer CN, Marti JL, Eisenberg A, Gan Q, Shabalova R, Cohen JM, Fulop T. A case of secondary angiosarcoma of the breast after breast-conserving surgery and radiation: Review of radiologic and pathologic findings. J Clin Imaging Sci. 2015; 5(3): 45. [ Links ]
5. Stewart FW, Treves N. Lymphangiosarcoma in post-mastectomy lymphedema; a report of six cases in elephantiasis chirurgica. Cancer. 1948; 1 (1): 64 - 81. [ Links ]
6. Shah S, Rosa M. Radiation-Associated Angiosarcoma of the breast: clinical and pathologic features. Arch Pathol Lab Med. 2016;140 (5): 477 – 481. [ Links ]
7. Uryvaev A, Moskovitz M, Abdach-Bortnyak R, Hershkovitz D, Fried G. Post-irradiation angiosarcoma of the breast: clinical presentation and outcome in a series of six cases. Breast Cancer Res Treat. 2015; 153 (1): 3 - 8. [ Links ]
8. Marchal C, Weber B, de Lafontan B, Resbeut M, Mignotte H, du Chatelard PP, et al. Nine breast angiosarcomas after conservative treatment for breast carcinoma: a survey from French comprehensive cancer centers. Int J Radiat Oncol Biol Phys. 1999; 44 (1): 113 – 119. [ Links ]
9. Casali PG, Blay JY. Soft tissue sarcomas: ESMO clinical practice guidelines for diagnosis, treatment and follow up. Ann Oncol. 2010;21(Suppl 5): 198-203. [ Links ]
10. Depla AL, Scharloo-Karels CH, de Jong MA, Oldenborg S, Kolff MW, Oei SB, et al. Treatment and prognostic factors of radiation-associated angiosarcoma (RAAS) after primary breast cancer: A systematic review. Eur J Cancer. 2014; 50 (10): 1779 - 1788. [ Links ]
11. Karlsson P, Holmberg E, Samuelsson A, Johansson KA, Wallgren A. Soft tissue sarcoma after treatment for breast cancer - a Swedish population-based study. Eur J Cancer. 1998; 34 (13): 2068- 2075. [ Links ]
12. Tahir M, Hendry P, Baird L, Qureshi NA, Ritchie D, Whitford P. Radiation induced angiosarcoma a séquela of radiotherapy for breast cancer following conservative surgery. Int Semin Surg Oncol. 2006; 3: 26. [ Links ]
13. Guo T, Zhang L, Chang NE, Singer S, Maki RG, Antonescu CR. Consistent MYC and FLT4 gene amplification in radiation-induced angiosarcoma but not in other radiation-associated atypical vascular lesions. Genes Chromosomes Cancer. 2011; 50 (1): 25-33. [ Links ]
14. Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, Suurmeijer AJ, Hoekstra HJ. Radiation-Associated Angiosarcoma After Breast Cancer: High recurrence rate and poor survival despite surgical treatment with R0 resection. Ann Surg Oncol. 2012; 19 (8): 2700 - 2706. [ Links ]
15. Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE. Radiation-Induced Sarcoma of the Breast: A systematic Review. Oncologist. 2012; 17 (3): 405 - 418. [ Links ]
16. Boyan W Jr, Farr M, Georges R. High grade angiosarcoma fifteen years after breast conservation therapy with radiation therapy: A case report. Int J Surg Case Rep. 2014; 5 (12): 1176 - 1177. [ Links ]
17. Thijssens KM, van Ginkel RJ, Suurmeijer AJ, Pras E, van der Graaf WT, Hollander M, Hoekstra HJ. Radiation-induced sarcoma: A challenge for the surgeon. Ann Surg Oncol. 2005; 12 (3): 237 - 245. [ Links ]
18. Sher T, Hennessy BT, Valero V, Broglio K, Woodward WA, Trent J, et al. Primary angiosarcoma of the breast. Cancer. 2007;110 (1): 173 - 178. [ Links ]