INTRODUCCIÓN
Los tumores de células de la granulosa (TCG) son neoplasias ováricas poco frecuentes que suponen el 5 % de los tumores ováricos 1. Se distinguen dos variedades: tipo adulto (TCGA) y tipo juvenil (TCGJ), sobre la base de su comportamiento clínico y características histológicas. El TCGJ tiene una incidencia que escasamente alcanza el 5 %, el 90 % tiene lugar en las tres primeras décadas de la vida 2, y tan solo un 3 % de los casos se da en mayores de 30 años 3. La presentación más frecuente es en forma de masa anexial de gran tamaño 2 y pueden producir esteroides sexuales, siendo la clínica hiperestrogénica la más habitual 4. El pronóstico depende fundamentalmente del estadio patológico, y las recidivas son comunes, incluso décadas tras el diagnóstico inicial 4. El abordaje inicial es similar a los tumores de estirpe epitelial, con estadificación quirúrgica y citorreducción, seguido de quimioterapia en los estadios avanzados, no estando recomendada la linfadenectomía ni el tratamiento complementario en estadios iniciales 1.
Se presenta un infrecuente caso de tumor de células de la granulosa tipo juvenil tras la menopausia.
CASO CLÍNICO
Mujer posmenopaúsica de 58 años, sin antecedentes médicos y quirúrgicos de interés, que acudió a urgencias por distensión y dolor abdominal. Tenía revisiones ginecológicas previas, la última realizada 6 años antes, con examen ecográfico pélvico normal, y no refirió alteraciones menstruales ni metrorragia con anterioridad. En la exploración física se observaron genitales externos normales, al examen con espéculo, se encontró vagina normal, con exudado vaginal moderado, y cérvix de multípara, con formación pediculada vascularizada que protruía por el orificio cervical externo y que se resecó por torsión (con resultado anatomopatológico de pólipo atrófico-quístico). El tacto vaginal bimanual reveló una masa pélvica de consistencia dura, no móvil, que ocupaba el fondo de saco de Douglas, sin adenopatías palpables. En la ecografía abdomino-pélvica se observó el útero de ecoestructura normal, con imagen hipoecoica intramural en fondo uterino de 1,15 x 1,38 cm (compatible con leiomioma uterino), sin distinguirse línea endometrial, el ovario izquierdo de aspecto hipotrófico de 1,82 x 0,94 cm, y una masa pélvica sólida, con vascularización central de 19,74 x 12,48 cm, sin líquido libre visible. Se completó la caracterización de la masa mediante una tomografía axial computarizada (TAC), que reveló unas dimensiones de 19 x 14 x 13 cm, predominantemente sólida, de contorno bien definido, con realce heterogéneo y áreas hipodensas sugestivas de necrosis/degeneración quística, que desplazaba asas intestinales, útero y vejiga, sin signos de infiltración (Figura 1).
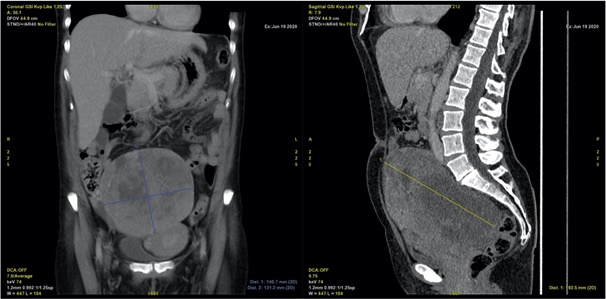
Figura 1 TAC en planos frontal (izquierda) y sagital (derecha) que demuestran una masa pélvica de 19 x 14 x 13 cm, de contorno bien definido, de predominio sólido, con múltiples áreas hipodensas sugestivas de hemorragia y necrosis, que desplaza estructuras pélvicas sin signos de infiltración.
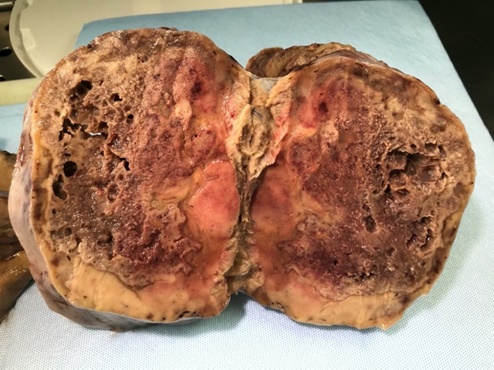
Los marcadores tumorales prequirúrgicos CA 125, antígeno carcinoembrionario (CEA), CA 19,9 y HE4 presentaron límites normales. Finalmente se realizó una biopsia de endometrio por aspiración por el hallazgo de pólipo endocervical vascularizado, sin visualizarse adecuadamente la línea endometrial en la ecografía, con resultado asimismo normal. Con diagnóstico de tumor ovárico derecho, sugestivo de malignidad, se realizó histerectomía y anexectomía bilateral laparotómica, con biopsias peritoneales (de parietocólico derecho e izquierdo, vesical, fondo de saco de Douglas y cúpula diafragmática) y biopsia de omento mayor, aspirado de líquido de lavado peritoneal y revisión de la cavidad abdominopélvica, sin observarse ascitis ni signos de enfermedad a distancia. Se obtuvo una tumoración ovárica derecha de 1920 g que midió 23 x 12 x 10 cm. Muestraba una superficie externa lisa y brillante. A la sección se observaron áreas sólidas de coloración blanco-amarillenta y áreas quísticas con extensas zonas de aspecto necrótico y hemorrágico (Figura 2).
El estudio histológico mostró una proliferación celular de patrón principalmente difuso con algunos cordones y presencia de espacios microquísticos con material eosinofílico claro en su luz. Las células eran de mediano tamaño, con núcleos vesiculosos sin hendiduras, ligeramente pleomórficos con presencia de un pequeño nucleolo y citoplasmas eosinófilos alrededor. El número de mitosis era de 7 a 8 por 10 campos de gran aumento. Había amplias áreas de necrosis y hemorragia (Figura 3).
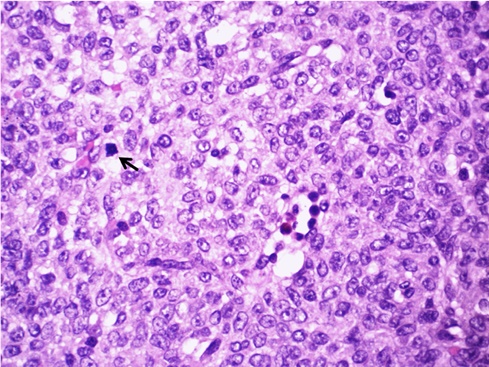
Figura 3 Proliferación difusa de células tumorales de núcleos vesiculosos, ligeramente pleomórficos, con un pequeño nucleolo, sin hendiduras y con citoplasmas eosinófilos alrededor. Presencia de mitosis (flecha) (Tinción hematoxilina-eosina. Aumento: 40X)
El estudio inmunohistoquímico de las células tumorales mostró tinción positiva con CD99 y positividad focal con inhibina (Figura 4). Fueron negativas las tinciones con citoqueratina AE1/AE3 y CD 34. El índice de proliferación celular marcado con Ki67 fue aproximadamente del 15 % - 20 %.
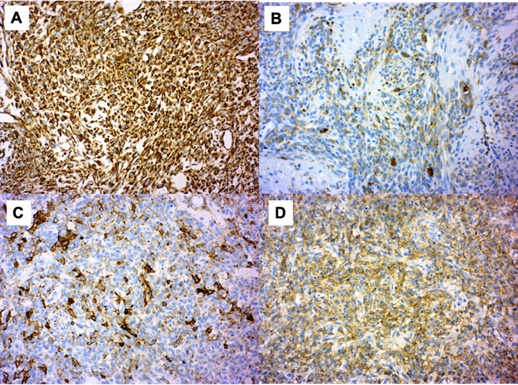
Figura 4 Estudio inmunohistoquímico: A-Vimentina: positivo, B-Inhibina: focalmente positivo, C-Actina: focalmente positivo, D-CD99: positivo (Aumento 20X)
Con estos hallazgos histológicos e inmunohistoquímicos se hizo el diagnóstico de TCGJ. Al tratarse de un tumor confinado al ovario sin romper su cápsula, con exploración intraoperatoria, biopsias y citología de lavado peritoneal negativas, con ausencia de extensión en las pruebas de imagen, se catalogó en comité clínico multidisciplinar como un estadio IA de la Federación Internacional de Ginecología y Obstetricia (FIGO) y se desestimó completar la cirugía con linfadenectomía. Por este motivo tampoco se realizó tratamiento adyuvante.
La paciente se encuentra asintomática y realiza revisiones periódicas con exploración ginecológica, ecográfica (como parte de cada revisión en la institución) y controles analíticos con hormona antimülleriana e inhibina normales.
DISCUSIÓN
Los TCG son las neoplasias más frecuentes con potencial maligno de los tumores de los cordones sexuales-estroma (el 70 %), siendo habitualmente la estirpe pura 5. Globalmente, son una entidad infrecuente, representando al 5 % al 8 % del total de las neoplasias ováricas, más aún en el caso de la forma juvenil, que supone tan solo un 5 % del grupo 1,3,6,7. Aunque los TCGJ ocurren habitualmente en niñas y mujeres jóvenes, pueden darse a cualquier edad, habiéndose reportado casos en mujeres ancianas 8. La frecuencia de los TCGJ en el adulto es muy escasa, y los estudios publicados de TCG incluyen muy pocos casos de TCGJ en mayores de 30 años, lo que no permite un estudio diferenciado 6,9.
Se desconocen las causas, aunque se cree que proceden de las células de la granulosa en proliferación del folículo preovulatorio tardío, con las que comparten características morfológicas y bioquímicas 3. En ambos casos, son capaces de producir péptidos esteroideos que conducen a la sintomatología endocrinológica que permite su diagnóstico precoz en numerosas ocasiones: estrógenos, inhibina, hormona antimülleriana (AMH) y más raramente andrógenos 4. De este modo, se pueden manifestar como pubertad precoz en las niñas y como alteraciones menstruales en la mujer adulta, siendo infrecuente la virilización 1. La exposición prolongada a estrógenos puede producir hiperplasia endometrial e incluso un adenocarcinoma endometrial concomitante, y debido a la elevada vascularización de estos tumores hasta el 10 % se presentan en forma de dolor abdominal y hemoperitoneo secundario a su ruptura 3. La clínica de distensión y dolor abdominal manifestada en este caso es la forma de presentación más frecuente (50 %), seguido de la ascitis (34 %) 10,11.
Ambos tipos presentan un aspecto macroscópico similar, sólido-quístico con áreas de hemorragia, y comparten características con las células de la granulosa normales (como la expresión del receptor de hormona folículoestimulante e inhibina) 7.
El tipo juvenil y el adulto difieren en cuanto a las características anatomopatológicas 7. Histológicamente, el tipo juvenil presenta un estroma mixoide o edematoso con un patrón macrofolicular, constituido por células que presentan un citoplasma eosinofílico abundante y en ocasiones vacuolado, con núcleos eucromáticos o hipercromáticos, con atipia variable 2. A diferencia de los TCGA no se observan los típicos cuerpos de Call-Exner 4. Las características que los diferencian del tipo adulto son: folículos irregulares en forma y tamaño, numerosas células luteinizadas, y los núcleos redondos, sin hendiduras e hipercromáticos, con marcado índice mitótico, siendo más frecuentes la atipia celular y el pleomorfismo 2,12.
A diferencia de los tumores epiteliales ováricos, los mecanismos patogénicos y genéticos son poco conocidos 3. Las mutaciones FOXL 2 (gen que codifica un factor necesario para el desarrollo de las células de la granulosa) que se observan en los tumores de células de granulosa del adulto están ausentes, lo que sugiere un origen molecular distinto y por tanto una entidad diferenciada de la variedad en el adulto 7,13. Sustentando esta teoría, se han hallado un elevado porcentaje de TCGJ con mutaciones somáticas en AKT (oncoproteína empleada por distintos mitógenos en las células de la granulosa) que activa AKT-1, que participaría en la patogénesis de la neoplasia 14. Otra mutación común en los TCGJ es la de la subunidad alfa en la posición 201 de la proteína G 4. Se ha propuesto que la vía TGF β-SMAD2/3 podría participar como promotor neoplásico, puesto que se encuentra activada en los TCGJ, y puede inhibir la apoptosis celular 10.
No es infrecuente la confusión con otros tumores, como el tumor del saco vitelino, de células claras o metástasis de cáncer de mama tipo lobulillar o melanoma; la inmunohistoquímica es de gran utilidad para la diferenciación 4.
El tratamiento estandarizado en los TCG es el quirúrgico, y resulta habitualmente curativo. Se debe realizar una histerectomía total, con anexectomía bilateral, descartando previamente patología endometrial mediante biopsia prequirúrgica (dada la posibilidad de hiperplasia endometrial o adenocarcinoma endometrial concomitante). Acorde a las últimas guías internacionales publicadas, ha de realizarse cirugía de estadificación, similar a la de los tumores ováricos de estirpe epitelial, que incluya: exploración de la cavidad abdominal, lavado peritoneal y biopsias de la cúpula diafragmática, espacios paracólicos y peritoneo pélvico, pudiendo incluir omentectomía que, acorde a una revisión de la Cochrane, podría ser parcial 15. La linfadenectomía únicamente está indicada en caso de sospecha metastática en las pruebas de imagen o intraoperatoria. Esto es debido a que el hallazgo de ganglios linfáticos metástasticos en estudio anatomopatológico definitivo es menor al 3,1 %, además de no afectar el periodo libre de enfermedad ni mejorar la supervivencia global, por lo que no debe realizarse en los tumores confinados al ovario 16. Por este motivo, en el presente caso se desestimó en comité clínico multidisciplinar completar la cirugía con linfadenectomía pélvica. En los casos con enfermedad avanzada hay que realizar una cirugía citorreductora lo más extensa posible 1. Se debe llevar a cabo preservación de la fertilidad en mujeres jóvenes con estadio inicial, realizando una salpingoooforectomía ipsilateral 1; incluso, se ha descrito su uso satisfactorio en enfermedad avanzada y recidivada 17. No existen estudios que contemplen el abordaje quirúrgico de los TCGJ en la mujer adulta, por lo que es necesario extrapolar los resultados de los trabajos publicados de TCGA y de TCGJ que habitualmente incluyen series de pacientes muy jóvenes18.
Para la estadificación se emplea el sistema FIGO, siendo la enfermedad habitualmente inicial 1. Existe alto consenso en identificar el estadio como el factor pronóstico más importante, llegando a alcanzar una supervivencia del 90 % los estadios I 3,9,16.
Las indicaciones actuales de tratamiento adyuvante quimioterápico son la enfermedad avanzada, recurrente o metastática 1,16. El caso que se presenta se trató de un estadio inicial, por lo que se desestimó el tratamiento adyuvante en comité multidisciplinario. No existe evidencia de la eficacia de la quimioterapia adyuvante, y no parece tener impacto en la tasa de supervivencia a 5 años 19. En cambio, parece que el tratamiento de la recurrencia con cirugía y quimioterapia combinadas aumenta el periodo libre de enfermedad y disminuye el riesgo de recidiva 20.
La radioterapia se reserva para el tratamiento paliativo de recidivas aisladas de la enfermedad avanzada 1, no obstante, los datos para evaluar su eficacia en los TCG son escasos 16. Con respecto a otros agentes, se han empleado hormonoterapia, que es una opción en la enfermedad inoperable, recurrente o metastática 1, y agentes antiangiogénicos e inmunológicos como el bevacizumab, que ha mostrado beneficio en pacientes con enfermedad recurrente, aunque son necesarios más estudios para establecer su eficacia 21.
Se han estudiado distintos factores clínicos, histológicos e inmunohistoquímicos para intentar predecir la recidiva y establecer indicaciones de terapia adyuvante; sin embargo, los resultados entre los distintos autores son dispares 6,9. En una revisión de la Cochrane de los posibles abordajes terapeúticos, incluyendo las distintas técnicas quirúrgicas (hasta la conservadora, para preservación de la fertilidad) y el tratamiento adyuvante con quimioterapia o radioterapia, no se hallaron conclusiones válidas para establecer la efectividad y seguridad de las mismas, por lo que no se pudieron establecer directrices para el manejo de estas pacientes 15.
Se consideran tumores de bajo potencial maligno y se asocian típicamente con una progresión lenta, aunque ha sido reportado algún caso de rápido crecimiento de TCGJ 11.
La recidiva habitualmente ocurre en los primeros cinco años 1. Fallece el 80 % de las pacientes con estadio avanzado o enfermedad recidivada, lo que contrasta con el aspecto aparentemente indolente de la entidad 3. La recidiva se produce en ocasiones tras un largo periodo libre de enfermedad, por lo que el seguimiento ha de ser prolongado. Parece que la tasa de recurrencias de los TCGJ es menor que en los TCGA 6, aunque algunos estudios señalan que el mayor empleo de cirugía preservadora de la fertilidad en mujeres con deseo reproductivo puede invertir esta relación 9. La mejor alternativa para realizar el seguimiento parece ser la combinación de AMH e inhibina, que mejora la detección de las recurrencias, correlacionándose sus valores con el tamaño del tumor 22,23 Parece ser que ambos marcadores están elevados en TCGA, independientemente del estatus menopaúsico, tanto en el tumor inicial como en la recurrencia 22. En el caso descrito, no se sospechó clínicamente un TCGJ por lo que no se solicitaron en el estudio inicial, pero sí se están solicitando en las revisiones periódicas para la detección precoz de una posible recidiva.
La supervivencia global a 5 años y a 10 años es elevada 1. No obstante, en caso de recurrencia, disminuyen tanto la supervivencia como el periodo libre de enfermedad 9.
CONCLUSIÓN
El TCGJ es una neoplasia muy infrecuente, más aún en la mujer adulta, siendo excepcional en la menopausia. La evidencia disponible procede de la extrapolación de resultados de TCG que incluyen ambos tipos, con una baja casuística de TCGJ, sin hacer diferenciación de dicha patología en la mujer adulta.