Acta Botánica Venezuelica
versión impresa ISSN 0084-5906
Acta Bot. Venez. v.28 n.2 Caracas 2005
ANATOMÍA CAULINAR DE LAS ESPECIES DEL GÉNERO STENOCEREUS (CACTACEAE)
Stem anatomy of the species of the genus Stenocereus (Cactaceae)
Teresa TERRAZAS, Sofía LOZA-CORNEJO e Hilda J. ARREOLA-NAVA
Programa de Botánica, Colegio de Postgraduados Montecillo, Estado de México. 56230 México
RESUMEN
Se describió la anatomía caulinar de 22 especies del género Stenocereus y se comparó con otras Cactoideae. Stenocereus presentó una cutícula lisa y delgada, las células epidérmicas presentaron divisiones oblicuas, distinguiéndose S. stellatus, S. treleasei y S. zopilotensis por su abundancia. La existencia de cuerpos de sílice en epidermis e hipodermis caracteriza al género. La abundancia de células de mucílago es un atributo que comparten las especies de Stenocereus con su taxón hermano; su ubicación en el córtex permitió reconocer dos grupos de especies. Destaca el desarrollo de la felodermis y la presencia de placa de perforación múltiple en elementos de vaso, caracteres descritos por primera vez para el género. La combinación células de mucílago y cuerpos de sílice permite distinguir a las especies de Stenocereus de otros miembros de la familia Cactaceae.
Palabras clave: Anatomía caulinar, Cactáceas, Cuerpos de sílice, Peridermis bidireccional, Stenocereus
ABSTRACT
Stenocereus stem anatomy was described and compared with other Cactoideae. Stenocereus had a smooth and thin cuticle, epidermal cells showed oblique divisions, which distinguish S. stellatus, S. treleasei and S. zopilotensis by their abundance. The occurrence of silica bodies in the epidermal and hypodermal cells characterizes the genus. The profusion of the mucilage cells is a character shared by the Stenocereus species with its sister taxon. In addition, the distribution of the mucilage cells in the cortex allowed recognizing two groups of species. Phelloderm development and the presence of multiple perforation plates in the secondary xylem were characters described for the first time for the genus. Abundance mucilage cells and silica bodies allow distinguishing Stenocereus species from other members of the family.
Key words: Stem anatomy, Cacti, Silica bodies, Bidirectional periderm, Stenocereus
INTRODUCCIÓN
El conocimiento sobre la anatomía caulinar en la familia Cactaceae es todavía escaso, debido a que en la mayoría de los estudios se ha evaluado sólo la superficie dérmica o exclusivamente el xilema secundario (Terrazas & Arias 2002). Más del 60% de las especies reconocidas no se han estudiado a pesar del alto número de endemismo a nivel genérico y específico tanto en Norteamérica como en Sudamérica (Hernández & Godínez 1994; Anderson 2001). La tribu Pachycereeae de la subfamilia Cactoideae, ha tenido una amplia diversificación de plantas columnares y arbustivas que han sido objeto de estudios de morfología de la semilla (Barthlott & Hunt 2000; Arias & Terrazas 2004; Arroyo-Cosultchi et al. en prensa), anatomía sistemática (Gibson & Horak 1978), anatomía del xilema secundario (Gibson 1973; Terrazas 2000; Terrazas & Loza-Cornejo 2003) y sistemática (Gibson et al. 1986; Arreola-Nava 2000; Terrazas & Loza-Cornejo 2002; Wallace 2002). Sin embargo, aun se carece de estudios anatómicos comparativos de las especies de cada uno de los géneros clasificados en esta tribu en busca de caracteres que apoyen la circunscripción genérica y específica.
Stenocereus Riccob. es uno de los diez géneros de Pachycereeae sensu Barthlott & Hunt (1993), que se reconoce como un grupo monofilético de amplia distribución desde el sur de Arizona hasta el norte de Venezuela y Colombia, y algunas islas del Caribe (Dávila-Aranda et al. 2002; Terrazas & Loza-Cornejo 2002). Este género contiene 22 especies (Arreola-Nava et al., com. pers.) y presenta una amplia diversidad de formas de crecimiento, entre ellas, árboles de porte recto y largo como en S. chacalapensisy S. griseus, hasta tallos completamente horizontales como en S. eruca (Bravo-Hollis 1978; Gibson 1989; Anderson 2001). Esta diversidad hace a Stenocereus un sistema de estudio apropiado para analizar la variación de los caracteres de los tejidos dérmico, fundamental y vascular en órganos vegetativos (tallos o ramas). El objetivo de esta investigación fue describir la anatomía caulinar de las especies de Stenocereus en busca de caracteres que permitieran distinguir entre grupos de especies y comparar los atributos anatómicos de las especies de Stenocereus con otros géneros de Cactoideae.
MATERIALES Y MÉTODOS
Con objeto de tener representada la variabilidad de cada especie de Stenocereus se recolectaron dos o más individuos pertenecientes a 22 especies en sus áreas de distribución en México y Suramérica. Las especies estudiadas y los números de respaldo depositados en CHAPA se presentan en la Tabla 1.
En cada sitio de recolecta se tomaron muestras de una rama adulta en la parte apical, media y basal, así como del tallo o rama más gruesa, en caso de los arbustos, de 5 a 10 cm del suelo, excepto para S. peruvianus que se obtuvo de un ejemplar en cultivo en el Jardín Botánico de Nueva York. El material se fijó en formaldehido-ácido acético-alcohol etílico (Johansen 1940) por 24 a 48 h. Posteriormente los tejidos se transfirieron a una solución de glicerina-alcohol etílico-agua (1:1:1) hasta iniciar la microtecnia. Muestras de tejidos primarios de diferentes dimensiones de las partes apical, media y basal de la rama y de los tejidos secundarios (floema secundario y peridermis) del tallo se ablandaron con etilendiamida (Carlquist 1982) por 32 h, se lavaron y procesaron siguiendo la microtecnia convencional de inclusión en parafina. Una vez incluidas las muestras se cortaron a un grosor de 14 µm con un micrótomo rotatorio, se tiñeron y montaron con resina sintética de acuerdo a Johansen (1940). El xilema secundario se cortó con un micrótomo de deslizamiento en secciones transversales, tangenciales y radiales a un grosor de 20 µm; se tiñeron con safranina y montaron con resina sintética (Johansen 1940). Se colocaron astillas de madera de la región adyacente al cambium vascular en frascos con solución de Jeffrey (Berlyn & Miksche 1976), dejándolos en una estufa a 50°C por 24 ó 48 horas. Una vez disociado el material se lavó e hicieron preparaciones temporales para cuantificar la longitud de los elementos de vasos y fibras y contar el número de septos por fibra. Para la descripción y análisis de los caracteres del xilema secundario se siguieron las recomendaciones de la Asociación Internacional de los Anatomistas de la Madera (IAWA Committee 1989) y los radios se clasificaron de acuerdo a Kribs (1935). Se realizaron 25 mediciones por carácter en cada uno de los 93 individuos estudiados. Las mediciones se hicieron con un analizador de imágenes (IMAGE-Pro Plus versión 3.1, Media Cybernetics 1997), adaptado a un microscopio Olympus BX-50. Con este equipo también se hicieron observaciones empleando lentes de polarización para diferenciar cristales de oxalato de calcio de otros compuestos minerales como cuerpos de sílice y se tomaron las fotografías que ilustran los diferentes tejidos.
RESULTADOS
Tejido primario
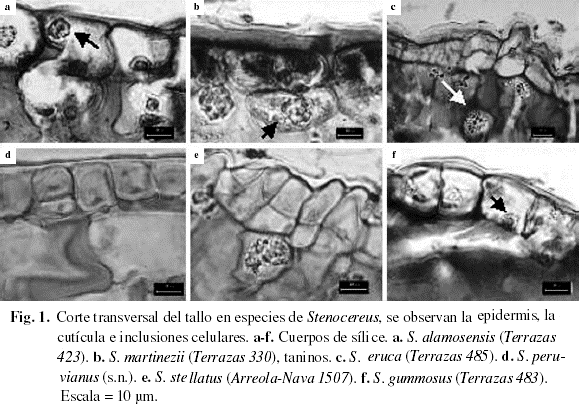
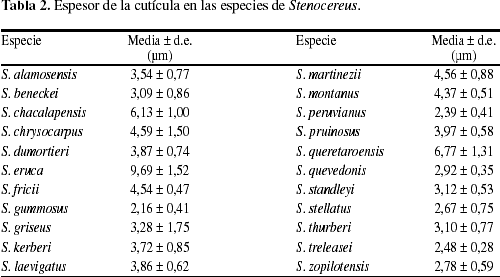
Cutícula lisa (Fig. 1), variando en grosor de <3 µm en S. gummosus, S. peruvianus, S. quevedonis, S. stellatus, S. treleasei y S. zopilotensis hasta más de 5 µm en tres especies (Tabla 2).
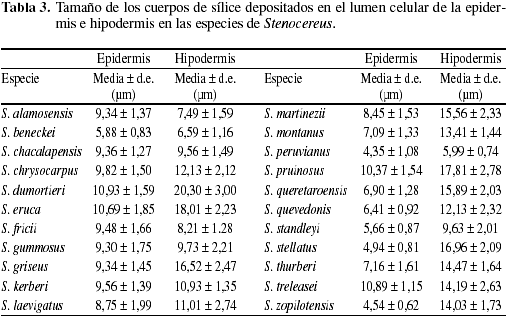
Epidermis simple en todas las especies (Fig. 1). Sin embargo, la célula epidérmica sufrió divisiones periclinales y oblicuas una vez generada la cutícula (Fig. 1d), por lo que se presentaron dos o tres estratos formando una epidermis multiestratificada en S. chacalapensis, S. chrysocarpus, S. dumortieri, S. fricii,S. griseus, S. martinezii, S. queretaroensis, S. quevedonis, S. stellatus, S. thurberi, S. treleasei y S. zopilotensis. En S. stellatus, S. treleasei y S. zopilotensis las divisiones oblícuas hicieron que las células más externas tuvieran la apariencia de papila (Fig. 1e). Células epidérmicas con escasas divisiones secundarias se encontraron en el resto de las especies. La forma de las células comúnmente fue cuadrada o rectangular con la pared periclinal más larga que la anticlinal. Los estomas fueron paracíticos y se localizaron al mismo nivel que las células epidérmicas. Un cuerpo de sílice de forma ovoide o redonda, ocluye el lumen de la célula epidérmica en todas las especies (Fig. 1). Su aspecto varió desde pequeño y escaso en S. beneckei (5,88 µm), S. peruvianus (4,35 µm), S. stellatus (4,94 µm) y S. standleyi (5,66 µm) hasta ser grande y abundante como en S. dumortieri (10,93 µm) y S. treleasei (10,89 µm), aunque la mayoría de las especies tuvo cuerpos de sílice entre 6 y 9 µm en su diámetro mayor (Tabla 3). El otro tipo de inclusión celular observado en las células epidérmicas fueron taninos presentes exclusivamente en S. martinezii (Fig. 1b).
Hipodermis colenquimatosa de paredes gruesas (Fig. 2). El número de capas varía de tres en S. eruca, cuatro en S. alamosensis y S. beneckei o cinco en S. peruvianus hasta diez en S. chacalapensis, S. fricii, S. martinezii, S. queretaroensis, S. stellatus y S. treleasei (Fig. 2a-f). Las células de la hipodermis están interrumpidas solamente por las cámaras subestomáticas (Fig. 2a, c, d). Los cuerpos de sílice se presentaron en todas las especies, pero su tamaño, forma y abundancia fue variable (Tabla 3, Fig. 1b, c, e). La dimensión del cuerpo de sílice fue similar al presente en la célula epidérmica, de menor tamaño como en S. fricii (8,21 µm) o de mayor tamaño como en S. dumortieri (20,30 µm) (Tabla 3).
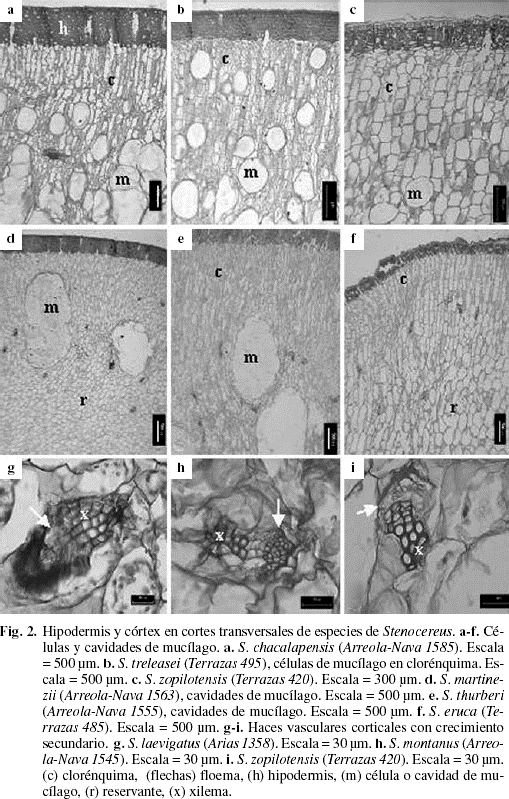
Córtex con dos regiones distintivas, la de clorénquima y la reservante (Fig. 2a-f). La región del clorénquima consistió de células de parénquima en empalizada, las cuales son rectangulares en la mayoría, con la pared anticlinal más larga o de forma cuadrada como en S. zopilotensis (Fig. 2c); arregladas en hileras radiales de cinco hasta ocho capas (Fig. 2a-f). Entre las células de clorénquima se observaron haces vasculares corticales e idioblastos con mucílago, células o cavidades, denominadas así por su tamaño. Las células de mucílago, generalmente de mayor tamaño que las circundantes de parénquima, se distinguieron en toda la región de empalizada en 13 especies (S. alamosensis, S. chacalapensis, S. dumortieri, S. fricii, S. griseus, S. kerberi, S. laevigatus, S. peruvianus, S. pruinosus, S. standleyi, S. stellatus, S. treleasei, S. zopilotensis), en la base de esta región en siete especies (S. beneckei, S. chrysocarpus, S. martinezii, S. montanus, S. queretaroensis, S. quevedonis, S. thurberi), o ausentes como en las especies S. gummosusy S. eruca. La región reservante presentó células de parénquima de forma isodiamétrica, con células de mucílago en todas las especies, excepto en S. eruca donde fueron raras y en S. martinezii y S. thurberi que presentaron cavidades (Fig. 2d, e). Los haces vasculares corticales fueron del tipo colateral, presentes tanto en el clorénquima como en la región reservante y de tamaño variable, pero en su mayoría se observó crecimiento secundario (Fig. 2g-i). El xilema únicamente tuvo elementos de vaso y parénquima; el floema tuvo una región colapsada distintiva y en la región no colapsada hubo tubos cribosos y células acompañantes. En la base de la rama las células de la región reservante estaban colapsadas radialmente y el contenido de las células de mucílago cristalizado. Escasas fibras se observaron sobre el floema secundario de algunos haces corticales de la región basal de la rama en S. alamosensis, S. gummosus, S. montanus, S. thurberi y S. stellatus. Los esferocristales, en las células de mucílago que estaban próximas al floema secundario, fueron notorios en S. alamosensis y S. kerberi.
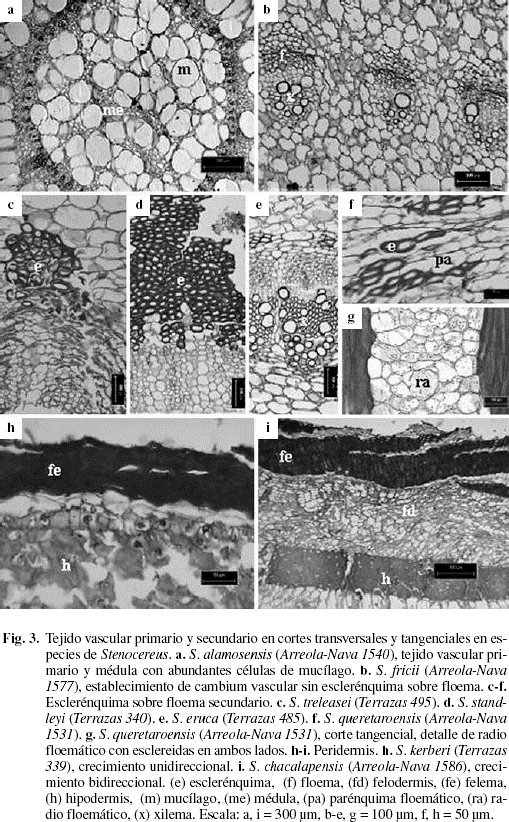
El tejido vascular primario presentó un cilindro de 20 o 50 haces colaterales (Fig. 3a), donde el metaxilema estuvo constituido por 2 a 13 vasos; el metafloema por tubos cribosos y células acompañantes (Fig. 3a). No se observaron fibras sobre el floema primario en la parte apical de las ramas o tallos, ni cuando se estableció el crecimiento secundario (Fig. 3b).
La médula tiene células de parénquima de forma isodiamétrica con granos de almidón, haces vasculares medulares y células de mucílago. La mayoría de las células de mucílago fueron de forma redonda, escasas en S. chacalapensis, S. fricii, S. griseus, S. laevigatus, S. martinezii, S. peruvianus, S. quevedonis y S. thurberi, abundantes en el resto de las especies (Fig. 3a), y ausentes en S. eruca. Los haces medulares fueron colaterales variables en número y tamaño, pero siempre con crecimiento secundario. Las fibras sobre floema en los haces medulares fueron escasas y únicamente se observaron en algunos individuos de S. gummosus y S. standleyi.
Tejido secundario
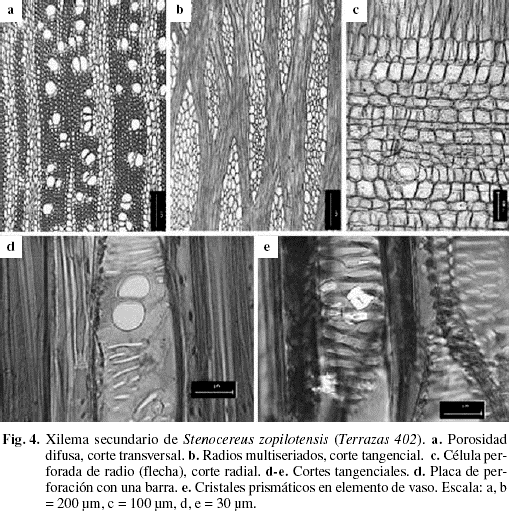
Una vez que el cambium vascular se diferenció, las regiones fasciculares e interfasciculares se fusionan tardíamente en algunas especies. A continuación se describe la madera de S. zopilotensis, porque para el resto de las especies dicha descripción ya fue publicada (Terrazas & Loza-Cornejo 2003).
En el xilema secundario se presentaron anillos de crecimiento inconspicuos (Fig. 4a). La porosidad fue difusa con una densidad de 15 vasos por mm2. Más del 50% de los vasos fueron solitarios, con dos a cuatro vasos arreglados en hileras radiales (Fig. 4a). Los vasos fueron comúnmente circulares. El diámetro tangencial tuvo una media de 82,34 ± 13,61 µm. Los elementos de vasos tuvieron una longitud de 301,21 ± 45,19 µm. La placa de perforación fue simple, pero ocasionalmente múltiple con una barra (Fig. 4d), las punteaduras intervasculares fueron pseudoescalariformes. Pequeños cristales prismáticos se observaron en la apertura de la punteadura (Fig. 4e); punteaduras radio-vaso fueron semejantes a las intervasculares. Las fibras fueron libriformes septadas con núcleo y abundantes punteaduras simples en la cara radial. Las fibras tuvieron una longitud de 920,00 ± 110,08 µm, con un diámetro medio de 22,91 ± 1,94 µm, un grosor de pared de 6,60 ± 0,64 µm. El parénquima axial es de tipo paratraqueal escaso, con dos células por serie parenquimatosa. Los radios heterogéneos se clasificaron como de tipo III de Kribs (1935), sin radios uniseriados (Fig. 4b). La altura total es de 1.930,45 ± 512,71 µm y presentaron de cinco a siete células de ancho. Los radios estuvieron formados por células erectas cortas, cuadradas y procumbentes (Fig. 4c). Células perforadas de radio se observaron ocasionalmente (Fig. 4c) y no se encontró ninguna inclusión celular.
El floema secundario presentó dos zonas distintivas (Fig. 3c-e). El floema no colapsado constó de tubos cribosos de forma redonda o angulosa arreglados en bandas (Fig. 3c), células acompañantes de forma angulosa y parénquima floemático. Los tubos cribosos presentaron placa cribosa simple, en posición horizontal. El esclerénquima se desarrolló tardíamente sobre el floema colapsado (Fig. 3c-f). En algunas especies, las esclereidas fueron escasas, entremezcladas en el floema colapsado (S. alamosensis, S. eruca y S. kerberi) en número no mayor a diez células, de pared más o menos delgada (Fig. 3e), pero en la mayoría, la acumulación fue abundante, en especial en la base del tallo (Fig. 3c, d). El parénquima radial floemático, a veces, se expandió; sus células no se lignificaron y contenían abundantes granos de almidón (Fig. 3g). Además, en la región del floema colapsado, las células del parénquima axial estaban turgentes y se alternaron con bandas de tubos cribosos y células acompañantes colapsadas, formando bandas que se lignificaron al alejarse del cambium vascular en algunas especies (Fig. 3f).
La peridermis se diferenció de las células de la epidermis. En la mayoría de las especies se observó que parte de las células epidérmicas con cuerpos de sílice quedaron por debajo del felógeno (Fig. 3h). La peridermis tuvo crecimiento unidireccional, diferenciándose sólo felógeno y felema o corcho (Fig. 3h) en diez especies (S. alamosensis, S. beneckei, S. eruca, S. kerberi, S. montanus, S. peruvianus, S. queretaroensis, S. standleyi, S. stellatus y S. treleasei), pero presentó crecimiento bidireccional en el resto de las especies (Fig. 3i). El felema constó de dos tipos de células que se alternaron, las más cercanas al felógeno constituyeron dos o cinco estratos de células de forma rectangular de paredes delgadas, suberificadas alternando con una o dos (S. dumortieri), dos a tres (S. eruca y S. montanus) u ocho (S. standleyi) estratos de células de pared gruesa, lignificada, pero con células colapsadas exclusivamente de pared delgada con suberina en S. alamosensis y S. kerberi (Fig. 3h). La felodermis se caracterizó por tener células arregladas radialmente que al alejarse del felógeno perdieron su arreglo, con abundantes cloroplastos y no se lignificaron (Fig. 3i). Además, en la felodermis se diferenciaron haces vasculares peridermales y células de mucílago. En algunos individuos se formaron peridermis sucesivas que se desarrollaron por debajo de la hipodermis. La hipodermis quedó aislada en forma de manchones entre peridermis sucesivas.
DISCUSIÓN
Los caracteres anatómicos estudiados que permitieron distinguir entre grupos de especies de Stenocereus fueron pocos, por lo que a continuación se discuten por tejido y se comparan con la información disponible en la literatura para otros géneros de Cactoideae. Los atributos de la dermis de los miembros de Stenocereus fueron similares a los reportados para otras especies de cactáceas columnares de Norteamérica (Loza-Cornejo & Terrazas 2003). La cutícula varió en grosor desde 2 µm hasta cerca de 10 µm en las especies del género Stenocereus. Se considera que esta variación no estuvo relacionada con el tamaño de los individuos o su distribución latitudinal, porque especies arbustivas como S. beneckei y S. gummosus tuvieron un espesor de cutícula similar a especies arbóreas como S. quevedonis, S. thurberiy S. zopilotensis. Además, especies de distribución norteña en México como S. alamosensisy S. gummosus presentaron una cutícula delgada al igual que S. beneckei, S. peruvianus y S. treleasei con distribución sureña en el hemisferio Norte.
En todas las especies estudiadas la epidermis fue simple. Sólo en diez se conservó como uniestratificada, en el resto de las especies de Stenocereus al igual que en otras especies de la familia Cactaceae (Terrazas & Mauseth 2002), las divisiones oblicuas fueron comunes una vez que la cutícula se acumuló. Tres especies, S. stellatus, S. treleaseiy S. zopilotensis, se distinguieron por las abundantes divisiones en las células epidérmicas, similar a lo reportado para especies de Polaskia (Gibson & Horak 1978; Gibson 1988a; Loza-Cornejo & Terrazas 2003). Mauseth & Landrum (1997) consideraron que esta capacidad de reestablecer las divisiones mitóticas en la célula epidérmica fue un carácter relictual en Cactoideae. Una explicación funcional a la capacidad de divisiones mitóticas en la célula epidérmica estuvo relacionada con la suculencia del tallo que requirió de expansión para tener una mayor superficie (Gibson 1996). En las especies de Stenocereus los estomas fueron paracíticos, ubicados al mismo nivel que el resto de las células epidérmicas. Esta distribución coincidió con lo observado en otras especies de Cactoideae (Eggli 1984; Loza-Cornejo & Terrazas 2003). Nobel (1999) señaló que cuando los estomas estaban hundidos o protegidos por cutícula gruesa, la resistencia a la pérdida de vapor de agua fue incrementada. Aunque no se observaron estomas hundidos o cutículas gruesas en las especies estudiadas del género Stenocereus, posiblemente las ceras y la superficie irregular originada por las divisiones oblicuas en las células epidérmicas favorecen la resistencia a la pérdida de vapor de agua.
Bajo la epidermis en todas las especies se encontró una hipodermis colenquimatosa, donde el número de capas varió de tres a diez entre especies. Esta amplitud correspondió a la reportada para otras especies de Cactoideae (Loza-Cornejo & Terrazas 2003). Para la hipodermis tampoco se detectó una relación alométrica entre el número de células que conformaron la hipodermis y la altura de los individuos, S. martinezii, S. stellatus y S. treleasei, árboles de altura o porte mayor a un metro, árboles de altura o porte menor a 50 cm y arbustos, respectivamente, fueron especies con hipodermis gruesa (9 a 10 capas celulares). El número de estratos en la hipodermis es un atributo que permitió distinguir dos grupos de especies. El primero con menos de seis capas de células (S. alamosensis, S. beneckei, S. eruca, S. gummosus, S. kerberi, S. quevedonisy S. standleyi) y el segundo agrupó al resto de las especies con más de siete capas celulares en la hipodermis.
Debe destacarse que Gibson & Horak (1978) mencionaron por primera vez la existencia de cuerpos de sílice en las células epidérmicas de las especies de Stenocereus y señalaron que hubo especies donde fueron escasos y su tamaño tan pequeño los hizo poco visibles. En la epidermis de S. eruca, S. stellatus y S. treleasei o la hipodermis de S. alamosensis, S. beneckei, S. kerberi, S. peruvianus y S. standleyi no se observaron cuerpos de sílice (Gibson & Horak 1978; Gibson 1988b, 1991). Sin embargo, fue registrada su existencia en las 22 especies del género, pero efectivamente fueron escasos en la epidermis de S. beneckei, S. eruca, S. fricii, S. peruvianus y S. zopilotensis y en la hipodermis de S. alamosensis, S. gummosus y S. peruvianus. La presencia de los cuerpos de sílice fue una de las sinapomorfías que definieron al género Stenocereus como un grupo monofilético (Arreola-Nava 2000; Terrazas & Loza-Cornejo 2002). Sólo se han reportado cuerpos de sílice en otras dos especies de cactáceas, Echinocereus pensilis (Loza-Cornejo & Terrazas 2003) y Wigginsia tephracantha (Monje & Baran 2000). Por ello, se está evaluando la variación en el tamaño de los cuerpos de sílice y la forma observada en la epidermis y en la hipodermis dentro y entre individuos de Stenocereus, así como su composición a través de métodos numéricos y análisis de rayos X.
El córtex fue similar al presentado en otras especies de Cactoideae con las típicas regiones de clorénquima y reservante (Sajeva & Mauseth 1991; Terrazas & Loza-Cornejo 2002; Terrazas & Mauseth 2002). En todas las especies se observaron haces vasculares corticales y células de mucílago aunque las últimas fueron escasas en S. eruca. La posición de las células que contienen mucílago permitió separar grupos de especies de Stenocereus. Por ejemplo, las cavidades de mucílago distinguieron a S. martinezii y S. thurberi. Estas cavidades ya habían sido descritas por otros autores (Gibson & Horak 1978; Terrazas & Loza-Cornejo 2002; Arreola-Nava & Terrazas 2003). Las siete especies de aréolas morenas reconocidas por Arreola-Nava & Terrazas (2003) presentaron abundantes células de mucílago bajo la región del clorénquima y este carácter también se podría emplear en futuros estudios para apoyar la monofilia del grupo.
La madera de S. zopilotensis fue similar en composición y arreglo celular a las otras especies del género; todas ellas tuvieron las características típicas de la madera fibrosa en Cactoideae con poco parénquima axial, vasos predominantemente solitarios y radios altos (Terrazas & Arias 2002). Las dimensiones del diámetro y densidad de los vasos fueron distintivos de especies arbóreas en el género (Terrazas & Loza-Cornejo 2003). Además, la madera de S. zopilotensis compartió con S. chrysocarpus, S. dumortieri, S stellatus y S. treleasei los cristales prismáticos depositados en las paredes de los elementos de vaso (Terrazas & Loza-Cornejo 2003). La presencia de esclerénquima en el floema secundario colapsado (no funcional) fue un atributo que las especies de Stenocereus compartieron con Neoraimondia (Mauseth & Kiesling 1997).
La peridermis en las especies estudiadas de Cactoideae se ha descrito de origen epidérmico y con desarrollo unidireccional (Terrazas & Arias 2002). El origen epidérmico de la peridermis se observó en todas las especies de Stenocereus. Destaca el hecho de que en 12 de las 22 especies de Stenocereus el desarrollo de la peridermis fue bidireccional, similar a la mayoría de las dicotiledóneas (Roth 1981). La peridermis con crecimiento bidireccional favoreció a las especies que presentaron peridermis a mantener células con cloroplastos cerca de la superficie y favorecer la movilización de los productos de la fotosíntesis como ocurre en otras especies arbóreas con tallos no suculentos (Nilsen 1995).
Se concluye que las especies de Stenocereus tienen una anatomía caulinar que permite separarlas de otros géneros por presentar abundantes mucílagos y cuerpos de sílice en la epidermis e hipodermis. Se sugiere que la presencia de abundantes idioblastos, células o cavidades con mucílago es una novedad evolutiva que comparten los miembros del clado Stenocereus con su grupo hermano.
AGRADECIMIENTOS
Se agradece al Consejo Nacional de Ciencia y Tecnología (33064-V) y a la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (P-L074) por el apoyo brindado para la realización de esta investigación, al Jardín Botánico de Nueva York por permitir a la primera autora tomar material de S. peruvianus de su colección, a los Doctores Salvador Arias y Cesario Catalán por su ayuda en el trabajo de campo, al Dr. Carlos Navea por haber recolectado una muestra de S. griseus en Venezuela y a los revisores por sus comentarios favorables al manuscrito.
BIBLIOGRAFÍA
1. Anderson, E.F. 2001. The cactus family. Timber Press, Portland. [ Links ]
2. Arias, S. & T. Terrazas. 2004. Seed morphology and variation in the genus Pachycereus (Cactaceae). J. Pl. Res. 117: 277-289. [ Links ]
3. Arreola-Nava, H.J. 2000. Sistemática de las especies de Stenocereus (A. Berger) Riccob. con aréolas morenas (Cactoideae: Cactaceae). Tesis de Maestría. Colegio de Postgraduados. Montecillo. [ Links ]
4. Arreola-Nava, H.J. & T. Terrazas. 2003. Especies de Stenocereus con aréolas morenas: clave y descripciones. Acta Bot. Mex. 64: 1-18. [ Links ]
5. Arroyo-Cosultchi, G., T. Terrazas, S. Arias & H.J. Arreola-Nava. (en prensa). The systematic significance of seed morphology in Stenocereus (Cactaceae). Taxon [ Links ]
6. Barthlott,W. & D.R. Hunt. 1993. Cactaceae. In: The families and genera of vascular plants (Kubitzki, K., ed.), pp. 161-197. Springer-Verlag, Berlin. [ Links ]
7. Barthlott,W. & D.R. Hunt. 2000. Seed diversity in the Cactaceae subfamily Cactoideae. Succ. Pl. Res. 5: 1-173. [ Links ]
8. Berlyn, G.P. & J.P. Miksche. 1976. Botanical microtechnique and cytochemistry. Iowa Univ. Press, Ames. [ Links ]
9. Bravo-Hollis, H. 1978. Las cactáceas de México. 2nd ed., Vol. 1. Universidad Nacional Autónoma de México, Ciudad de México. [ Links ]
10. Carlquist, S. 1982. The use of ethylenediamine in softening hard plant structures for paraffin sectioning. Stain Tech. 57: 311-317. [ Links ]
11. Dávila-Aranda, P., S. Arias-Montes, R. Lira-Saade, J.L. Villaseñor & A. Valiente-Banuet. 2002. Phytogeography of the columnar cacti (tribe Pachycereeae) in Mexico: A cladistic approach. In: Evolution, ecology and conservation of the columnar cacti and their mutualists (Fleming, T.H. & A. Valiente-Banuet, eds.), pp. 25-41. Arizona Univ. Press, Arizona. [ Links ]
12. Eggli, U. 1984. Stomatal types of Cactaceae. Pl. Syst. Evol. 146: 197-214. [ Links ]
13. Gibson, A.C. 1973. Comparative anatomy of secondary xylem in Cactoideae (Cactaceae). Biotropica 5: 29-65. [ Links ]
14. Gibson, A.C. 1988a. The systematics and evolution of subtribe Stenocereinae. 2. Polaskia. Cact. Succ. J. (Los Angeles) 60: 55-62. [ Links ]
15. Gibson, A.C. 1988b. The systematics and evolution of subtribe Stenocereinae. 5. Cina and its relatives. Cact. Succ. J. (Los Angeles) 60: 283-288. [ Links ]
16. Gibson, A.C. 1989. The systematics and evolution of subtribe Stenocereinae. 7. The Macherocerei of Stenocereus. Cact. Succ. J. (Los Angeles) 61: 104-112. [ Links ]
17. Gibson, A.C. 1991. The systematics and evolution of subtribe Stenocereinae. 10. The species group of Stenocereus griseus. Cact. Succ. J. (Los Angeles) 63: 92-99. [ Links ]
18. Gibson, A.C. 1996. Structure-function relations of warm desert plants. Springer-Verlag, Berlin, Heidelberg. [ Links ]
19. Gibson, A.C. & K.E. Horak. 1978. Systematic anatomy and phylogeny of Mexican columnar cacti. Ann. Missouri Bot. Gard. 65: 999-1057. [ Links ]
20. Gibson, A.C., K.C. Spencer, R. Bajaj & J.L. McLaughlin. 1986. The ever-changing landscape of cactus systematics. Ann. Missouri Bot. Gard. 73: 532-555. [ Links ]
21. Hernández M., H. & H.A. Godínez. 1994. Contribución al conocimiento de las cactáceas mexicanas amenazadas. Acta Bot. Mex. 26: 33-52. [ Links ]
22. IAWA Committee. 1989. IAWA list of microscopic features for hardwood identification. IAWA Bull. n.s. 10: 219-332. [ Links ]
23. Johansen, D.A. 1940. Plant microtechnique. MacGraw-Hill. New York. [ Links ]
24. Kribs, D.A. 1935. Salient lines of structural specialization in the wood rays of dicotyledons. Bot. Gaz. 96: 547-557. [ Links ]
25. Loza-Cornejo, S. & T. Terrazas. 2003. Epidermal and hypodermal characteristics in North American Cactoideae (Cactaceae). J. Plant Res. 116: 27-35. [ Links ]
26. Mauseth, J.D. & R. Kiesling. 1997. Comparative anatomy of Neoraimondia roseiflora and Neocardenasia herzogiana (Cactaceae). Haseltonia 5: 37-50. [ Links ]
27. Mauseth, J.D. & J.V. Landrum. 1997. Relictual vegetative anatomical characters in Cactaceae: the genus Pereskia. J. Plant Res. 110: 55-64. [ Links ]
28. Media Cybernetics. 1997. Image-Pro Plus, 3.1. Springfield, Maryland. [ Links ]
29. Monje, P.V. & E.J. Baran. 2000. First evidences of the bioaccumulation of α-quartz in Cactaceae. J. Plant Physiol. 157: 457-460. [ Links ]
30. Nilsen, E.T. 1995. Stem photosynthesis: extent, patterns, and role in plant carbon economy. In: Plant stems: physiology and functional morphology (Gartner, B.L., ed.), pp. 223-240. Academic Press, San Diego. [ Links ]
31. Nobel, P. 1999. Physicochemical, environmental plant physiology, 2nd. ed. Academic Press, San Diego. [ Links ]
32. Roth, I. 1981. Structural patterns of tropical barks. Encyclopedia of plant anatomy IX, part 3. Gebruder Bornträger, Berlín. [ Links ]
33. Sajeva, M. & J.D. Mauseth. 1991. Leaf-like structure in the photosynthesis, succulent stems of cacti. Ann. Bot. (Oxford) 68: 405-411. [ Links ]
34. Terrazas, T. 2000. Perforated ray cells in Pachycereeae genera (Cactoideae). IAWA J. 22: 457-462. [ Links ]
35. Terrazas, T. & S. Arias. 2002. Comparative stem anatomy in the subfamily Cactoideae. Bot. Rev. 68: 444-473. [ Links ]
36. Terrazas, T. & S. Loza-Cornejo. 2002. Phylogenetic relationships of Pachycereeae: a cladistic analysis based on anatomical-morphological data. In: Evolution, ecology and conservation of the columnar cacti and their mutualists (Fleming, T.H. & A. Valiente-Banuet, eds.), pp. 66-86. Arizona Univ. Press, Arizona. [ Links ]
37. Terrazas, T. & S. Loza-Cornejo. 2003. Anatomía de la madera y alometría de veinte especies de Stenocereus (Cactaceae). An. Inst. Biol. Ser. Bot. 74: 195-208. [ Links ]
38. Terrazas, T. & J.D. Mauseth. 2002. Shoot anatomy and morphology. In: Cacti: Biology and uses (Nobel, P.S., ed.), pp. 23-40. Univ. California Press. Berkeley. [ Links ]
39. Wallace, R.S. 2002. The phylogeny and systematics of columnar cacti: an overview. In: Evolution, ecology and conservation of the columnar cacti and their mutualists (Fleming, T.H. & A. Valiente-Banuet, eds.), pp. 42-66. Arizona Univ. Press, Arizona. [ Links ]












 uBio
uBio