Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Veterinarias
versión impresa ISSN 0258-6576
Rev. Fac. Cienc. Vet. v.49 n.2 Maracay dic. 2008
Inmunoensayo de capa fina (ICF) en el serodiagnóstico de la tripanosomiasis bovina causada por el trypanosoma vivax.
Thin layer immunoassay (TIA) for the serodiagnosis of cattle Trypanosomiasis caused by trypanosoma vivax.
Marcello S. Rossi S.*,1, Leonardo Sigales** y Danny Zapata***
*Sección de Microscopía Electrónica e Inmunohistoquímica, Instituto Anatomopatológico José A. ODaly, Universidad Central de Venezuela. Venezuela
**Departamento de Biología Celular, Escuela de Biología, Facultad de Ciencias, Universidad Central de Venezuela. Venezuela
***Facultad de Ingeniería, Universidad Central de Venezuela. Venezuela.
1 A quien debe dirigirse la correspondencia (To whom correspondence should be addressed ) Correo-E:didinium2001@yahoo.com
Resumen
El Trypanosoma vivax es el agente causal de la tripanosomiasis bovina. Las bajas parasitemias y sus oscilaciones típicas en la enfermedad, limitan el uso de métodos de diagnóstico directo. La prueba de ELISA es una técnica serológica con buena sensibilidad, especificidad y valor predictivo, pero con ciertos inconvenientes debido a su alto costo y difícil transferencia al campo. Dada la optimización previa de la técnica de ELISA para la detección de anticuerpos de bovino anti-T. vivax utilizando antígenos del Trypanosoma evansi, el objetivo de este trabajo fue el de optimizar la prueba de Inmunoensayo de Capa Fina (ICF) y aplicarla junto con la prueba de ELISA en un estudio seroepidemiológico comparativo. A manera general, los antígenos del T. evansi se sensibilizaron en las placas a distintas concentraciones en tampón carbonato 0,05 M pH 9,6, para posteriormente incubarlas en presencia de los sueros problema y de referencia, positivos y negativos, al T. vivax. El excedente de antígenos y sueros se eliminó por lavados con agua destilada y las reacciones antígeno-anticuerpo, se revelaron con los vapores de un baño de María en el caso del ICF y por incubación con anticuerpos secundarios conjugados a peroxidasa y un sustrato cromogénico para el ELISA. La seroprevalencia obtenida por ICF y ELISA fue del 38,66% y 36% respectivamente, a la vez que la distribución de la seroprevalencia por localidad, es similar en ambas pruebas. La fiabilidad del ICF en relación al ELISA quedó demostrada con una sensibilidad del 89,36% y especificidad del 75%. Los resultados demuestran que la prueba de ICF tiene una alta correlación con la prueba de ELISA, por ello la postulamos como una técnica alternativa en los estudios seroepidemiológicos de la tripanosomiasis bovina.
(Palabras clave: Ganado bovino, Trypanosoma vivax; Técnicas inmunológicas, anticuerpos)
Abstract
Trypanosoma vivax is the aethiological agent of bovine trypanosomiasis. The low parasitic burden and typical fluctuations, limit the direct diagnosis of the disease. The ELISA is a serological technique that has been used for the detection of trypanosomiasis. However, despite its good sensibility, specificity and predictive value, the high cost of this test has restricted its applicability under field conditions. Given the previous standardization of the ELISA assay for the detection of bovine antibodies against T. vivax using T. evansi antigens, the aim of this work was to standardize the Thin Layer Immunoassay (TIA) and apply it in conjunction with the ELISA test in a serological and epidemiological comparative study. Briefly, T. evansi antigens were sensitized in Petri dishes at different protein concentrations in 0.05 M carbonate buffer (pH 9.6). Subsequently, the Petri dishes were incubated in the presence of problem and reference sera, which were either positive or negative to T. vivax. The excess antigen and sera was eliminated by washes in distilled water and the antigen-antibody reactions were developed with a water steam in the TIA, followed by incubation with secondary antibodies (anti-bovine IgG) conjugated to Horseradish Peroxidase (HRP) and a chromogenic substrate in the ELISA. Results show that the values of seroprevalence obtained by both techniques were similar (38.66% and 36% for ICF and ELISA, respectively). Also, seroprevalence distribution in each locality was similar for both tests. The relative trustability of TIA was demonstrated with a sensibility of 89.36% and a specificity of 75%, respectively. These results suggest that TIA has a high correlation with ELISA and is suitable to be used in serological and epidemiological studies of bovine trypanosomiasis.
(Key words: Cattle, Trypanosoma vivax, Immunological techniques, antibodies)
Recibido: 03/03/08 - Aprobado: 01/10/08
Introducción
En Venezuela, la tripanosomiasis animal es una enfermedad severa que tiene un impacto negativo sobre el desarrollo pecuario nacional, al incidir de forma negativa en la producción de carnes, leche, cueros, fibra animal y poder de tracción animal.
En nuestro país esta enfermedad es causada por el Trypanosoma evansi y el Trypanosoma vivax, siendo el primero el agente etiológico de la tripanosomiasis equina (derrengadera), mientras que el segundo es responsable de la tripanosomiasis bovina (secadera y/o peste bobita) y más raramente de la caprina (Soulsby, 1988). La infección por estas especies de tripanosomas se caracteriza por ser transmitida mecánicamente por insectos hematófagos fundamentalmente del género Tabanus (Raymond, 1990; Otte y Abuabara, 1991) y al igual que otras tripanosomiasis de origen africano pueden evolucionar de modo agudo o crónico, ocasionando en la mayoría de los casos la muerte de los hospedadores debido a las profundas alteraciones que se producen en los tejidos y en la química sanguínea (Anosa, 1988).
En la actualidad existen muchas orientaciones en el control de la tripanosomiasis animal, que van desde el estudio de la biología de los parásitos, pasando por el control químico de las poblaciones de insectos transmisores, la caracterización bioquímica y antigénica de las macromoléculas parasitarias, el desarrollo de nuevos agentes quimioterapéuticos y la optimización y adopción de nuevos métodos serológicos y moleculares para el diagnóstico sensible y específico.
Desde el conocimiento de la enfermedad, el diagnóstico de la misma ha sido un problema, debido a que los métodos mas prácticos susceptibles de transferirse al campo no permiten conocer la infección de los hospedadores hasta que su estado de salud comienza a deteriorarse. En este sentido, el diagnóstico clínico no determina signos patognomónicos a la vez que los métodos parasitológicos (frotis de sangre frescos y teñidos con Giemsa, concentración en capilares de hematocrito y microcentrifugación acoplada a cromatografía de intercambio aniónico entre otros) solo son efectivos en los estados agudos de la enfermedad cuando los tripanosomas son fácilmente observables por cualquier método directo (Reyna, 1991). Adicionalmente, estas técnicas arrojan resultados con errores que oscilan en el orden del 20 al 25% y pueden ser poco sensibles debido a las oscilaciones características de las parasitemias relacionadas con la variación antigénica de estos tripanosomas africanos (Luckins et al.,1978; ILRAD, 1988). Debido a la baja sensibilidad de los métodos directos, se ha tratado de diagnosticar la enfermedad mediante técnicas serológicas de mayor sensibilidad, basadas bien en la identificación de los anticuerpos específicos que los hospedadores producen contra los tripanosomas o en la detección de los antígenos tripanosómicos.
De todas las pruebas serológicas (lisis dependiente de complemento, inmunofluorescencia indirecta, hemaglutinación mediada por anticuerpos), la técnica de ELISA se ha venido utilizando en casi todos los países que confrontan problemas con la tripanosomiasis, ya que es considerada una técnica excelente en el diagnóstico de la enfermedad por su alta sensibilidad, especificidad, valor predictivo y susceptibilidad de automatización. Sin embargo, debido a que el ELISA y la mayoría de las pruebas serológicas son difíciles de transferir al campo y requieren de reactivos y equipos generalmente costosos, se hace necesaria la búsqueda de nuevas alternativas diagnósticas.
En este sentido, como resultado del uso de la técnica de Inmunoensayo en Capa Fina (ICF) para el diagnóstico de enfermedades como la Fasciolosis (Gómez et al.,1979), Schistosomiasis (Nilsson et al.,1980a) y Enfermedad de Chagas (Nilsson y Voller, 1982), el objetivo de este trabajo fue el de optimizar, aplicar y validar una prueba de ICF para el estudio seroepidemiológico de la tripanosomiasis bovina causada por el T. vivax.
Materiales y Métodos
Animales de experimentación
Se utilizaron ratas Spragüe-Dawley hembras de 250 g de peso corporal vivo para expandir las poblaciones tripanosómicas a ser utilizadas en la preparación de los extractos antigénicos. Los animales se mantuvieron en un bioterio experimental y se alimentaron ad libitum con Ratarina® y agua.
Parásitos
Para la preparación de los extractos antigénicos se utilizó un aislado venezolano del T. evansi procedente del Hato El Frío en el Municipio Mantecal del Distrito Muñoz (estado Apure). El mismo se aisló a partir de un caballo infectado y se mantuvo criopreservado a -196°C (nitrógeno líquido) en tampón fosfato salino glucosado pH 8 (PSG) conteniendo 10% de dimetilsulfóxido (DMSO) como crioprotector (Rossi, 1994).
Sueros
Para la optimización de la prueba, se utilizaron 2 grupos de sueros de referencia: uno positivo al T. vivax (n = 55) y otro negativo (n = 20) a ese parásito, de acuerdo a los criterios que se describen a continuación.
Sueros de Referencia Positivos: Provenían de vacas Holstein infectadas experimentalmente con el T. vivax, parasitológicamente positivos al T. vivax por la técnica de microcentrifugación de Woo (1969), con signos clínicos característicos de la infección y serológicamente positivos al T. vivax por la técnica de ELISA (Rossi, 1994; Rossi et al., 1993; 1995; 1997).
Sueros de Referencia Negativos: Provenían de animales Holstein sanos, mantenidos en condiciones de aislamiento de los insectos transmisores del T. vivax, parasitológicamente negativos al T. vivax por la técnica de microcentrifugación de Woo (1969), sin los signos clínicos característicos de la infección y serológicamente negativos al T. vivax por la técnica de ELISA (Rossi, 1994; Rossi et al., 1993; 995; 1997).
Adicionalmente, con el fin verificar la aplicabilidad y bondades de la prueba de ICF en estudios seroepidemiológicos, una muestra de 120 sueros colectados en bovinos de 8 localidades del estado Zulia (El Valle, San Francisco, Los Lechosos, Monterrey, El Descanso, Santa Rita, San Salvador y el Paraíso), durante el año 1993 fue estudiada por las pruebas de ELISA (Rossi, 1994; Rossi et al., 1993; 1995; 1997) e ICF optimizada en el trabajo para determinar la seroprevalencia del T. vivax en los bovinos de estas localidades.
Purificación de los parásitos
Los tripomastigotes hematozóicos de las poblaciones heterogéneas, desarrolladas en la sangre de las ratas de experimentación, se purificaron por cromatografía de intercambio aniónico utilizando Dietil-amino-etil-celulosa (DEAE-celulosa) como fase estacionaria y tampón fosfato salino glucosado (PSG, por sus siglas en inglés) pH 8 como fase móvil (Lanham y Godfrey, 1970).
Preparación de los extractos antigénicos
Los extractos antigénicos se prepararon a partir de los tripomastigotes hematozóicos purificados en DEAE-celulosa, homogeneizando por disrupción ultrasónica las suspensiones con un contenido de 108 tripanosomas/mL. Las suspensiones de los parásitos en tampón fosfato salino pH 8 (PS; Lanham y Godfrey, 1970) se lisaron brevemente a 4°C mediante 4 pulsos de 1 min de duración y con una intensidad del 50%, con intervalos de descanso de 1 min a 4°C entre cada pulso. El extracto así preparado se estabilizó con inhibidores proteolíticos (1 mM Benzamidina, 5 mM Ácido Aminocapróico y 1 mM Fenil-metil-sulfonil-fluoruro) y se dividió en alícuotas de 200 µL que se almacenaron a -196°C hasta el momento de su uso.
Determinación de Proteínas
La determinación de la concentración de proteínas de los extractos antigénicos se realizó de acuerdo a lo descrito por Lowry et al. (1951).
Inmunoensayo en Capa Fina (ICF)
La prueba de inmunoensayo en capa fina (ICF) se realizó según las modificaciones realizadas por Sigales et al. (2002) a la prueba descrita por Gómez et al. (1979). Se sensibilizaron placas de Petri de plástico con 10 mL de distintas concentraciones de proteínas (50, 100, 150 y 200 µg/mL) del extracto antigénico del T. evansi en tampón carbonato 0,05 M pH 9,6, durante toda la noche a 4°C en cámara húmeda o durante 1 hora a 37°C en cámara húmeda. El exceso de material antigénico se eliminó con 3 lavados de 5 min con agua destilada a temperatura ambiente y la placa se seca en una estufa a 40°C. Una vez secadas las placas, se dispensaron 100 µL de los sueros diluidos (1:4, 1:20, 1:100, 1:500) en tampón fosfato salino pH 7,2 en áreas previamente delimitadas de 1 cm2 de la superficie interna de la placa. Las placas se incubaron con los sueros a 37°C durante 1 h, para finalmente eliminar el exceso mediante 3 lavados con agua destilada a temperatura ambiente. Es importante destacar, que de las condiciones de lavado ensayadas (agua destilada, PBS y PBS-Tween 20) la que mejor resultado arrojó fue la de agua destilada, puesto que el secado después del lavado con PBS determinó la formación de cristales de sales y en el caso de los lavados con PBS-Tween 20, el detergente produce una disminución de la tensión superficial que impide la formación de la gota de suero.
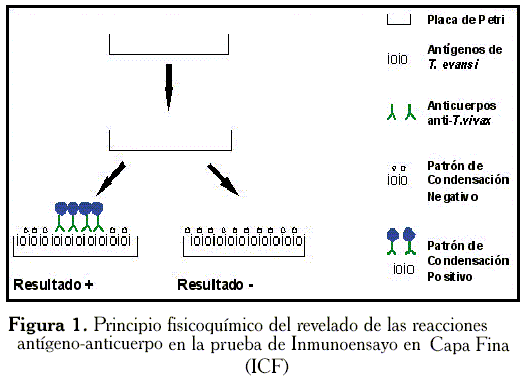
El revelado de las reacciones antígeno-anticuerpo se realizó después de secar muy bien las placas en una estufa a 40°C y exponer la superficie en la que ocurrió la reacción antígeno-anticuerpo a una corriente de vapor de agua a 60°C durante 1 a 2 min. En la Figura 1 se esquematiza el principio físico-químico de la detección de las reacciones antígeno-anticuerpo por la prueba de ICF. En la misma, se puede observar que la técnica se basa en la mayor hidrofilicidad de los complejos antígeno-anticuerpo con respecto a la monocapa de antígenos adsorbidos a la placa que no reaccionan con los anticuerpos en los sueros negativos. Con base en ésto, cuando se producen las reacciones antígeno-anticuerpo, como en el caso de los animales infectados experimentalmente con el T. vivax, el patrón de condensación de agua en la zona en la que se colocó el suero es de mayor tamaño en comparación al que generan los sueros negativos.
La optimización de esta técnica supone la evaluación de las condiciones del ensayo tales como: concentración del extracto antigénico del T. evansi, temperatura y tiempo de sensibilización de las placas, dilución de los sueros, tiempo y temperatura de incubación con los mismos, soluciones de lavado y condiciones de revelado de las reacciones antígeno-anticuerpo. Los resultados obtenidos en estos ensayos para el establecimiento de las condiciones óptimas de la prueba de ICF se resumen en la Tabla 1.
Tabla 1. Resultados de la optimización de la prueba de Inmnunoensayo en Capa Fina para el serodiagnóstico de la tripanosomiasis bovina causada por el T. vivax
| Variables a considerar | Condiciones óptimas (Resultado |
| Concentración del extracto antigénico del T. evansi | 150 μg/mL |
| Sensibilización de las placas con el extracto antigénico (Temperatura y Tiempo) | Toda una noche a 4°C ó 1 hora a 37°C |
| Dilución de los sueros | 1:20 |
| Tiempo de incubación con los sueros | 1 hora |
| Temperatura de incubación con los sueros | 37°C |
| Lavados | 3 veces con agua bidestilada a temperatura ambiente |
| Revelado | Vapor de agua a 60°C Durante 1-2 minutos |
Prueba de ELISA
La prueba de ELISA se realizó de acuerdo a las especificaciones descritas por Rossi (1994). A manera general, las microplacas de 96 pozos se sensibilizaron con 100 µL de una dilución 1:480 del antígeno de T. evansi diluido en tampón carbonato 0,05 M pH 9,6 durante 12 h a 4°C en cámara húmeda. El exceso de antígenos, sueros y anticuerpos secundarios no adsorbidos a la placa en cada etapa de la técnica se eliminó por lavados con tampón fosfato salino pH 7,2 con 0,1% Tween-20 (PBS-Tween). Los sitios de la placa no ocupados por los antígenos se bloquearon incubando las placas a 37 °C con 200 µL de PBS-Tween con 2% de gelatina como agente bloqueante durante 2 h. Las placas así tratadas se incubaron en cámara húmeda y a 37 °C con una dilución 1:100 de los sueros de referencia y problema, en solución bloqueante durante 1 h. Posteriormente, las microplacas con los anticuerpos séricos adsorbidos a los antígenos se incubaron con una dilución 1:2000 del anticuerpo secundario (IgG de conejo anti-IgG bovina) acoplado a peroxidasa de rábano blanco (EC 1.11.1.7) de acuerdo al método de Wilson y Nakane (1978). Las reacciones antígeno-anticuerpo se revelaron por 1 h de incubación de las microplacas a temperatura ambiente y en oscuridad con 100 µL de ácido 2,2-azino-bis(3-etil-bencil-tiazolin-6-sulfónico) en tampón Citrato pH 4,6 como substrato cromogénico de la enzima. Los resultados se evaluaron cuantitativamente por determinación de las densidades ópticas (absorbancias) a 405 nm en un lector de ELISA.
Para la evaluación de los sueros problema, en cada prueba de ELISA se incluyeron 1 blanco de reactivo (por triplicado) contra el cual se hacen las lecturas de densidad óptica; un control positivo (por triplicado) conteniendo 20 ng de IgG bovina/pozo (para verificar la actividad del anticuerpo secundario) y; 4 sueros bovinos de referencia positivos y negativos a T. vivax desde el punto de vista parasitológico (técnica de microcentrifugación de Woo) y serológico (técnica de inmunofluorescencia indirecta), procedentes de bovinos infectados experimentalmente y controles, respectivamente.
Validación de las Prueba
La validación de la prueba de ELISA se realizó utilizando los resultados obtenidos por la técnica de Inmunofluorescencia Indirecta (IFI) y la prueba de ELISA-T. vivax aplicada a un grupo de sueros de referencia positivos (n = 55) y negativos (n = 20) al T. vivax. En el caso de la prueba de ICF, la validación del ensayo se realizó con los resultados obtenidos por la prueba de ICF-T. vivax y la prueba de ELISA-T. vivax, previamente optimizado (Rossi, 1994). En ambos casos, se determinó la sensibilidad, especificidad y valores predictivos positivos y negativos de la prueba mediante tablas de contingencia de doble entrada (Tizard, 1982; Monfort y Miller, 1990).
Resultados
En la Tabla 1, se resumen los resultados de la optimización de la prueba de ICF-T. vivax. En la misma, se puede observar que la concentración del extracto antigénico del T. evansi se fijó en 150 µg/mL, a la vez que la dilución óptima de los sueros fue de 1:20, no existiendo diferencias entre los tiempos y temperatura de sensibilización de las placas. Los resultados de la aplicación de las pruebas de ELISA e ICF a la muestra de 75 sueros de bovinos se vaciaron en la tabla de contingencia de doble entrada que se muestra en la Tabla 2. A partir de la misma, se pudieron calcular los valores de la sensibilidad, la especificidad, el valor predictivo positivo y el valor predictivo negativo, relativo a la prueba de ELISA-T. vivax, asumida como prueba de Oro (Gold Standard) para establecer los criterios de fiabilidad del ICF-T. vivax. En la Tabla 3 se puede observar que los valores de sensibilidad, especificidad y valor predictivo de la ICF son altos, resultados que se ajustan a los requerimientos de una prueba de serodiagnóstico. Adicionalmente, se puede observar que estos valores son comparables a los de la prueba de ELISA-T. vivax, mostrando un alto coeficiente de regresión (r=0,95), el cual indica una alta correlación entre ambas técnicas.
Tabla 2. Tabla de contingencia de doble entrada para la validación de la prueba de ICF-T. vivax con la prueba de ELISA-T. vivax para la misma muestra de sueros
| Resultados | ELISA | Total | ||
| Positivo | Negativo | |||
| ICF | Positivo | 42 (56,0 %) | 7 (9,3 %) | 49 (65,3%) |
| Negativo | 5 (6,7 %) | 21 (28,0%) | 26 (34,7%) | |
Total | | 47 (62,7 %) | 28 (37,3 %) | 75 (100,0%) |
Tabla 3. Resultados de la validación de la prueba de ICF-T. vivax para el establecimiento de los criterios de fiabilidad en relación a la prueba de ELISA-T. vivax
| Criterio de fiabilidad | ICF-T. vivax | ELISA-T. vivax |
| Sensibilidad [S] | 89,36 % | 100 % |
| Especificidad [E] | 75,00 % | 89,09 % |
| Valor predictivo positivo [VP (+)] | 85,71 % | 96,10 % |
| Valor predictivo negativo [VP (-)] | 80,76 % | 98,05 % |
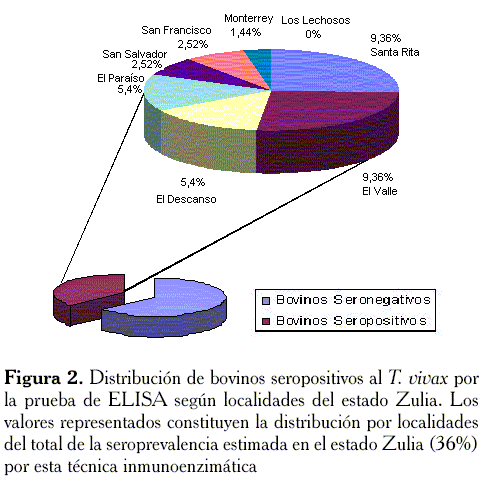
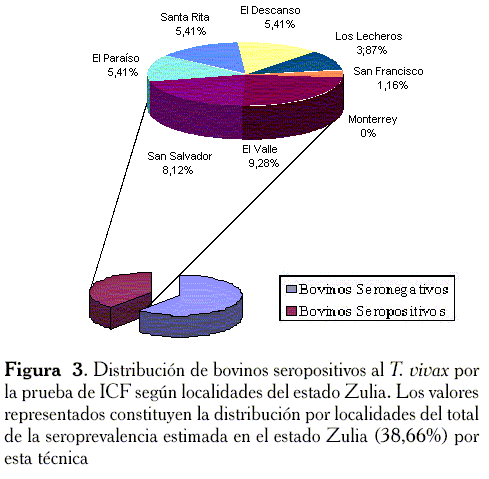
En las Figuras 2 y 3 se muestran los resultados de la determinación de la seroprevalencia del T. vivax en bovinos de 8 localidades del estado Zulia, determinados por las pruebas de ELISA-T. vivax e ICF optimizada. Los valores de seroprevalencia obtenidos por ambas pruebas (38,66% por ICF y 36% por ELISA), coinciden en la proporción de animales seropositivos a T. vivax en el estudio, si bien la distribución geográfica de la seroprevalencia resultó ser diferente en algunas localidades.
Discusión
El principio fisicoquímico de la detección de las reacciones antígeno-anticuerpo por la prueba de ICF se esquematiza en la Figura 1. En la misma se puede observar que la técnica se fundamenta en la mayor hidrofilicidad de los complejos antígeno-anticuerpo con respecto a la monocapa de antígenos adsorbidos a la placa que no reaccionan con los anticuerpos en los sueros negativos. Con base en ésto, cuando se producen las reacciones antígeno-anticuerpo, como en el caso de los animales infectados experimentalmente con el T. vivax, el patrón de condensación de agua en la zona en la que se colocó el suero es de mayor tamaño en comparación al que generan los sueros negativos.
Esta técnica serológica se desarrolló en la década de los 80 e inmediatamente fue aplicada en el diagnóstico de la Schistosomiasis. En un estudio realizado con la misma, se logra el serodiagnóstico positivo en 64 de 69 sueros de pacientes infectados con S. mansoni cuando se utilizan antígenos de vermes adultos (Nilsson et al.,1980a). Los antígenos utilizados muestran reactividad cruzada con filarias y Echinococcus, pero no con Fasciola, lo cual la postula como una técnica alternativa de diagnóstico debido a su bajo costo y simplicidad. En otro estudio en el que se compara la técnica de ICF con la de ELISA, se pudo demostrar que para una muestra de sueros positivos a S. haematobium y S. mansoni, la sensibilidad de la ICF fue del 95,6% frente a 96,4% obtenido por la técnica de ELISA. La única desventaja de esta técnica es el bajo número de falsos positivos con sueros de humanos y animales infectados con helmintos y el requerimiento de mayores concentraciones de antígeno (Ismail et al., 1979).
En el campo de la tripanosomiasis la prueba ha sido aplicada en el serodiagnóstico de la infección causada por el T. cruzi. En este estudio 156 sueros de pacientes infectados con el T. cruzi y 100 sueros de donantes fueron evaluados por la prueba de ICF y ELISA, encontrándose un alto grado de sensibilidad, especificidad y concordancia que postula al ICF como una técnica alternativa de diagnóstico de la Enfermedad de Chagas (Nilsson y Voller, 1982).
La técnica también ha sido aplicada con cierto éxito en el diagnóstico de las infecciones causadas por Entamoeba histolytica, arrojando resultados comparables a los obtenidos con las pruebas de hemaglutinación indirecta e inmunodifusión (Nilsson et al., 1980b).
Dada su simplicidad y bajo costo, la prueba de ICF es potencialmente transferible al campo, puesto que la misma no sólo puede ser ejecutada por personas con pocos conocimientos en serodiagnóstico, sino porque unicamente requiere de una estufa con control de temperatura, de las placas de Petri sensibilizadas con los extractos antigénicos y de los sueros y agua bidestilada para los lavados. En ausencia de una estufa, el problema del secado de las placas podría resolverse con un horno controlando la temperatura por convección con un ventilador. En cuanto a las placas sensibilizadas con los antígenos, las mismas podrían ser preparadas en grandes cantidades y almacenadas por largos períodos sin perder su antigenicidad (resultados no mostrados), siempre y cuando sean conservadas en un ambiente libre de humedad para prevenir el crecimiento de hongos. Estas ventajas, sumadas a la sencillez del revelado y la factibilidad de disponer de placas preincubadas con sueros de referencia negativos y positivos con distintos niveles de anticuerpos anti-T. vivax, permitiría el diseño de kits de diagnóstico de bajo costo y fácil uso.
Adicionalmente, el carácter cualitativo de la prueba podría eliminarse al convertirla en una prueba semicuantitativa. Para ello y midiendo el diámetro de las áreas de condensación, se podrían establecer puntos de corte que permitirían discriminar entre sueros positivos y negativos.
La magnitud de la diferencia (14,29%) entre las sensibilidades de las pruebas de ICF y ELISA-T. vivax (Rossi, 1994) podría disminuirse haciendo algunas modificaciones a la prueba de ICF, entre las que vale destacar: (i)el recubrimiento de las placas previamente sensibilizadas con una capa de agar en la que se pueden excavar pozos que permitirían aumentar el volumen de suero a evaluar; (ii)la inclusión de un paso adicional de incubación con un anticuerpo secundario de conejo anti-IgG bovina; (iii)la inclusión de un paso adicional de incubación con un anticuerpo secundario de conejo anti-IgG bovina, conjugado a peroxidasa o fosfatasa alcalina, seguido por incubación de las placas con un substrato cromogénico de las enzimas. En este sentido, el aumento del volumen de suero a evaluar se traduciría en la unión de más anticuerpos a los antígenos en la placa, esto aunado a la inclusión de un anticuerpo secundario anti-IgG bovina determinaría un aumento en el número de complejos protéicos hidrofílicos y por ende, de la sensibilidad de la prueba. La utilización de un anticuerpo secundario de conejo anti-IgG bovina conjugado a una enzima facilitaría la visualización de los resultados, permitiendo evidenciar las reacciones, por el desarrollo de una coloración en el sitio de ocurrencia de las reacciones antígeno-anticuerpo.
Si bien existen muchas alternativas para mejorar la sensibilidad de la prueba de ICF, las mismas no solo le restarían sencillez a la prueba, sino que también afectarían su transferencia tecnológica a las condiciones de campo.
Agradecimientos
Esta investigación se realizó con los recursos económicos aportados por los autores. Se agradece a la Dra. Bettina Day von Fedak por sus sugerencias en la diagramación de las Figuras. Al Dr. Francisco García (FCV-UCV) por suministrarnos el aislado de T. evansi utilizado, al Dr. Emir Espinoza (SASA) por la donación de alícuotas de los sueros de referencia positivos y negativos a T.vivax y al Dr. Pedro M. Aso (USB) por su asesoría en todo lo referente a la prueba de ELISA.
Referencias
1. Anosa, V.O. 1988. Haematological and biochemical changes in human and animal tripanosomiasis Part I. Revue Elev. Med. Vet. Pays. Trop., 41:65-78. [ Links ]
2. Gómez, A.; Arriaga de Morilla, C.; Morilla, A. 1979. Evaluación preliminar de la prueba de inmunoensayo en capa delgada para el diagnóstico serológico de la fasciolasis en animales. Vet. Méx., 10:181-186. [ Links ]
3. Internacional Laboratory for Research on Animal Diseases (ILRAD). 1988. New Approaches to the diagnosis of African Trypanosomiasis. ILRAD Reports., 6:1-4. [ Links ]
4. Ismail, M.; Draper, C.; Ouchterlony, O; Nilsson, L.A.; Terry, R. 1979. A comparison between a new serological method, thin layer immunoassay (TIA), and the enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies in schistosomiasis. Parasite Immunol., 1:251-258. [ Links ]
5. Lanham, S.M.; Godfrey, D.G. 1970. Isolation of salivarian Trypanosomes from man and other mammals using DEAE-celulose. Exp. Parasitol., 28:521-534. [ Links ]
6. Lowry, O.H.; Rosebrough, N.J.; Farr, L.A.; Randall, R.J. 1951. Protein measurement with the folin phenol reagent. J. Biol. Chem., 193:265-272. [ Links ]
7. Luckins, A.G.; Gray, A.R.; Rae, P. 1978. Comparison of the diagnostic value of serum immuno globulin levels, an enzyme-linked immunosorbent assay and fluorescent antibody tests in experimental infections with Trypanosoma evansi in rabbits. Ann. Trop. Med. Parasitol., 72:429-441. [ Links ]
8. Mofort, J.D.; Miller, G.Y. 1990. Evaluation and application of diagnostic tests in food animal practice. Comp. Cont. Educ. Pract. Vet., 12:1182-1190. [ Links ]
9. Nilsson, L-Å.; Björck, L; Capron, A; Elwing, H.; Ouchterlony, Ö. 1980a. Application of thin layer immunoassay (TIA) as a serodiagnostic tool in Schistosomiasis: A preliminary report. Trans. Royal. Soc. Trop. Med. Hyg., 74:201-204. [ Links ]
10. Nilsson, L- Å.; Petchclai, B.; Elwing, H. 1980b. Application of thin layer immunoassay (TIA) for demonstration of antibodies against Entamoeba histolytica. Am. J. Trop. Med. Hyg., 29:524-529. [ Links ]
11. Nilsson, L-Å.; Voller, A. 1982. A comparison of thin layer immunoassay (TIA) and enzyme-linked immunosorbent assay (ELISA) for the detection of antibodies to Trypanosoma cruzi. Trans. Royal. Soc. Trop. Med. Hyg., 76:95-97. [ Links ]
12. Otte, M.J.; Abuabara, J.Y. 1991. Transmisión of South American Trypanosoma vivax by the neotropical horsefly Tabanus nebulosus. Acta Trop., 49:73-76. [ Links ]
13. Raymond, H.L. 1990. Tabanus importunus, experimental mechanical vector of Trypanosoma vivax in French Guiana. Ann. Parasitol. Hum. Comp., 65:44-46. [ Links ]
14. Reyna, A. 1991. Ensayo Inmunoenzimático (ELISA) y su aplicación para la detección de anticuerpos de equinos anti-Trypanosoma evansi (Trypanosoma venezuelense). Postgrado en Patología Veterinaria, Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. [ Links ]
15. Rossi, M.; Aso, P.M.; Espinoza, E. 1993. Antígenos de Trypanosoma evansi y su utilización en el inmunodiagnóstico de la Tripanosomiasis Bovina. XLIII Convención Anual de AsoVAC. [ Links ]
16. Rossi, M. 1994. Ensayo Inmunoenzimático (ELISA) para el diagnóstico de la Tripanosomiasis Bovina Causada por Trypanosoma vivax. Licenciatura en Biología mención Biología Celular, Escuela de Biología, Facultad de Ciencias, Universidad Central de Venezuela. 113 p. [ Links ]
17. Rossi, M.; Aso, P.; Espinoza, E. 1995. Prevalencia de la Tripanosomiasis bovina en los estados Zulia, Falcón y Guárico: Un estudio Preliminar. XLV Convención Anual de AsoVAC. [ Links ]
18. Rossi, M.S.; Aso, P.M.; Espinoza, E. 1997. La Prueba inmunoenzimática (ELISA) en el serodiagnóstico de la Tripanosomiasis bovina en Venezuela. XIII Congreso de la Federación Latinoamericana de Parasitología (FLAP). [ Links ]
19. Sigales, L.; Rossi S.; M.S.; Zapata, D. 2002. El Inmunoensayo en capa fina en la seroepidemiología de la Tripanosomiasis bovina. XI Jornadas Científicas Dr. Héctor Scannone T. p. 30. (Abstr.). [ Links ]
20. Soulsby, E.J.K. 1988. Parasitología y enfermedades parasitarias de los animales domésticos. 7ma edición. Nueva Editorial Interamericana S.A. de C.V., México, 823 p. [ Links ]
21. Tizard, I. 1982. Serologic Assay. JAVMA., 181:1162-1165. [ Links ]
22. Wilson, B.; Nakane, P. 1978. Recent developments in the periodate method of conjugating horseradish peroxidase (HRPO) to antibodies. En: Immunofluorescence and Related Techniques, W. Knapp, Ed., Elsiever, Holanda. [ Links ]
23. Woo, P.T.K. 1969. The haematocrit centrifugue for the detection of trypanosomes in blood. Can. J. Zool., 47:921-923. [ Links ]