Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta Médica de Caracas
versión impresa ISSN 0367-4762
Gac Méd Caracas v.110 n.2 Caracas abr. 2002
Asma leve persistente. Estudio histopatológico de mucosa bronquial y nasal*
Drs. Trina Martin*, Marissa Campos*, Lisseloth Garrido**, Guillermo Isturiz****Servicio de Neumonología, Ciudad Hospitalaria "Enrique Arteaga".
**Facultad de Medicina, Cátedra Anatomía Patológica, UCV,
***Hospital "José Ignacio Baldó"
*Presentado en la Academia Nacional de Medicina en la sesión del día 23 de noviembre de 2000.
RESUMEN
Asma y rinitis son patologías inflamatorias relacionadas con severidad y respuesta terapéutica variable. El objetivo del presente estudio es determinar las características histopatológicas a nivel de mucosa bronquial y nasal de pacientes con asma leve persistente, y establecer si existe similitud entre ambas, lo que permitiría considerar nuevas estrategias diagnósticas y terapéuticas oportunas para mejorar la morbilidad.
Se estudiaron 10 pacientes con asma leve persistente, no fumadores, sin uso de corticoesteroides. Durante cuatro semanas previas al estudio se les practicó espirometría simple, pruebas de alergia, biopsia de mucosa bronquial y nasal, además de lavado bronquial. Todos los pacientes tuvieron un volumen espirado en el 1º segundo (VEF1s) mayor al 65 % del valor predictivo, con una segunda respuesta al broncodilatador 12 %. La prueba de alergia documentó atopia en 3 pacientes de 7 que realizaron la prueba.
Se observaron cambios inflamatorios similares en ambas mucosas, engrosamiento variable de la membrana basal sin diferencias estadísticamente significativas (P = 0,07); la célula reactiva común en todas las muestras de biopsia y lavado fue el eosinófilo asociado a severo infiltrado linfoplasmohistiocitario; además se observaron cristales de Charcot Leyden tanto a nivel tisular como en lavado bronquial.
Conclusión: Se encontraron cambios inflamatorios similares en ambas mucosas. Pacientes con comportamiento clínico funcional leve presentan cambios inflamatorios activos y severos durante todo el tracto respiratorio.
Palabras clave: Asma. Rinitis. Inflamación.
SUMMARY
Asthma and rinitis are inflammatory pathologies related with variable severity and therapeutic response.
The objective of the present study is to assess and compare the histopathological changes in nasal and bronchial mucosa of patients with mild persistent asthma and to settle down if similarity exists among both, what would allow to consider new strategies diagnoses and therapeutic opportunities to improve the morbidity.
Ten patients were studied with mild persistent asthma, no smokers, withdraw of corticosteroids for at least 4 weeks before the start, without respiratory tract infection 4 previous weeks to the study. They were practiced simple spirometry, allergy tests by means of micropuncture, biopsy of bronchial and nasal mucosa, with bronchial lavage. All the patients obtained a 1 second forced expiratory volume (FEV1) greater than 65 % of the predictive value with the broncodilator second response greater or similar to 12 %.
The allergy test documents atopia in 3 of 7 patients whom were tested.
Similar inflammatory changes were observed in both nasal an bronchial mucosa, variable thickness of the basal membrane without statistically significant differences (P= 0,07); the common reactive cell in all the biopsy samples and bronchial lavage was the eosinophil associated to severe infiltrated linfoplasmocitary, Charcot Leyden crystals were present at the bronchial lavage and at both mucosas.
Conclusion: Similar inflammatory changes were found at the nasal and bronchial mucosa. Patients with mild functional clinical behavior present active and severe inflammatory changes at the upper and lower respiratory tract.
Key words: Asthma. Rinitis. Inflammation.
INTRODUCCIÓN
El asma bronquial y la rinitis alérgica son patologías relacionadas, con un espectro de severidad y respuesta terapéutica variable. La mayoría de los pacientes asmáticos tienen síntomas de rinitis y viceversa, algunos pacientes con rinitis alérgica desarrollan asma.
Las numerosas líneas de investigación sobre asma y rinitis han determinado que la inflamación juega un papel crítico en la patogénesis de estas enfermedades y por ende en la génesis de los síntomas respiratorios.
Una vez que el estímulo alérgico o no alérgico es inhalado, las células efectoras inmunes liberan mediadores y citoquinas que finalmente median la vasodilatación y edema, el daño epitelial, la secreción mucosa, la contracción del músculo liso, la hipertrofia y la fibrosis subepitelial, todos presentes en grados diferentes de severidad, en pacientes asmáticos. Lo anteriormente señalado se resume en dos procesos patológicos que ocurren en la vía aérea: inflamación y reestructuración. La inflamación, ha sido ampliamente demostrada en pacientes con asma, se correlaciona con la severidad clínica y cuando se establece en forma crónica, ocurre un incremento en la acumulación de colágeno en la membrana basal del tejido bronquial, que conduce al proceso de reestructuración.
De esta manera, la reestructuración conduce al engrosamiento de la pared bronquial, lo que podría explicar el desarrollo de obstrucción crónica del flujo aéreo con disminución de la respuesta al broncodilatador y pérdida de la distensibilidad de las vías aéreas de los pacientes asmáticos.
Considerando estos hallazgos nos motivamos a estudiar los cambios histopatológicos en un grupo de pacientes con asma leve persistente, mediante biopsias de mucosa nasal y bronquial, asumiendo que los mismos deben correlacionarse por ser muestras de una vía aérea común.
Marco teórico
La prevalencia de asma y rinitis alérgica se incrementa en la población general y en una alta proporción de nuevos pacientes coexisten enfermedades de las vías aéreas superiores e inferiores.
Durante la década pasada los estudios sobre asma y rinitis han progresado. La perspectiva histórica de estas enfermedades inducidas por alergenos, como entidades distintas y separadas está siendo desplazada por la idea de que ellas son descritas mejor como una continuidad de la inflamación que compromete una vía respiratoria común, por tanto, las terapias tradicionales originalmente indicadas para asma y rinitis alérgica se han destinado a explorar su utilidad potencial tanto en enfermedad de las vías aéreas superiores como inferiores.
Históricamente las diferencias funcionales y estructurales del tracto respiratorio han servido como base para separar las vías aéreas en componentes superiores e inferiores. El asma y la rinitis alérgica han sido diagnosticadas como enfermedades diferentes (1).
Los recientes avances sobre las condiciones fisiopatológicas de las diferentes enfermedades inflamatorias y el progreso en las herramientas de investigación usadas para detectar los mediadores inflamatorios, han incitado a los miembros de las comunidades científicas y médicas a reconocer el asma y la rinitis alérgica como una inflamación continua de la vía aérea.
El asma y la rinitis son enfermedades comunes de las vías aéreas que afectan entre el 10 % y el 20 % de las personas en Estados Unidos respectivamente (1).
Numerosos estudios publicados han señalado que las ratas de prevalencia del asma y rinitis alérgica se han incrementado en las últimas dos a tres décadas. Cuando se interpretan estos datos, es importante considerar que las cifras informadas pueden ser influenciadas por las diferencias en los métodos de clasificación y diagnóstico. Los estudios indican que el asma y las condiciones alérgicas son más prevalentes en el Reino Unido, Australia y Nueva Zelanda; también se han informado altas tasas en Chile. En Europa, las tasas de prevalencia intermedia son vistas en la parte sur y las más bajas ocurren en la zona central. A pesar de los factores que pueden afectar las cifras, datos mundiales proveen evidencias precisas de que las prevalencias tanto del asma como la de rinitis alérgica se incrementaron (2).
En los países desarrollados e industrializados, se han registrado en las tres últimas décadas, las más altas prevalencias. En Tailandia los pocos estudios realizados en epidemiología de enfermedades atópicas han indicado prevalencias relativamente bajas. Recientemente, en una primera fase se ha desarrollado un cuestionario estandarizado del Estudio Internacional de Asma y Alergias en la Infancia (ISAAC), para estudiar y comparar las tendencias temporales y geográficas y conocer la prevalencia del asma, rinitis alérgica y eczema en los niños (3).
En Venezuela se ha iniciado el estudio ISAAC; encontrándose una prevalencia del 30 %, con predominio en adultos jóvenes (4).
En general, la prevalencia de asma, es mayor en los niños y adultos jóvenes. Se estima que a nivel mundial entre 1 % y 20 % de los niños y adultos jóvenes tienen asma y alrededor del 20 % de los pacientes (grupos de todas las edades), tienen rinitis alérgica (2).
Estudios recientes realizados al norte de Suiza indican que los factores principales para el desarrollo del asma son: historia familiar (grupo de todas las edades), fumadores activos (adultos), madres fumadoras (niños) y factores relacionados con la humedad del hogar (niños). Estos estudios demuestran que la sensibilización a los alergenos en la infancia son factores de riesgo importantes tanto para el asma como para la rinitis alérgica (2).
La contaminación del aire ambiental, factores climáticos y estilo de vida juega un papel muy importante en el desarrollo del asma y rinitis alérgica. Datos de la región norte de Suecia demuestra la asociación entre el asma y rinitis alérgica. Los resultados comprueban que un adulto con historia familiar de asma o rinitis tienen un riesgo de tres a cuatro veces mayor para desarrollar el asma y de dos a seis veces mayor para desarrollar rinitis que los adultos sin historia familiar (2).
Un estudio realizado en una comunidad de Michigan mostró que la prevalencia de la rinitis alérgica en pacientes con asma fue de cuatro a seis veces mayor que los de la población general. Entre 60 % y el 78 % de los pacientes con asma coexisten con rinitis alérgica (5,6).
También se ha notado que las enfermedades del tracto respiratorio superior pueden causar hiperreactividad en las vías aéreas inferiores. La sinusitis crónica es común en los pacientes que tienen asma y rinitis alérgica (7). Las infecciones virales causan crisis en pacientes que tienen asma preexistente (8).
En pacientes con rinitis, se demuestra que la ocurrencia de asma está relacionada con atopia, la sensibilidad a los alergenos domiciliarios, los niveles de inmunoglobulina E séricos total, la eosinofilia sanguínea y el asma materna (9). Generalmente el asma comienza en la niñez. La atopia es un factor de riesgo importante para asma, relacionado con la historia familiar. Los pacientes atópicos que tienen prueba cutánea positiva (10) y presentan valores de inmunoglobulina E elevados (10-12) tienen un riesgo de 3 a 5 veces mayor de presentar asma y persistir hasta la vida adulta, especialmente cuando se presenta antes de los 15 años (13).
El volumen espirado forzado en el 1º segundo (VEF 1) está determinado por la retracción elástica del pulmón, la resistencia de las vías aéreas y el grado de compresión de las grandes vías aéreas durante la maniobra forzada. En el asma existe un aumento de la resistencia de las vías aéreas, reflejadas en una disminución del VEF1 (14). La severidad en esta reducción es directamente proporcional a la severidad de los síntomas de asma. Si los síntomas están presentes diariamente, la reducción del VEF1 será del 10 % al 15 % anual. En asma leve existen evidencias que sugieren que los efectos son mayores en pacientes femeninos que masculinos (15).
El VEF1 y la variabilidad del flujo espiratorio pico (FEP) están asociados con la inflamación de las vías aéreas, pero el VEF1 posbroncodilatador es probablemente el valor mejor asociado. El significado de la inflamación de la pequeña vía aérea, se correlaciona con el VEF1. Este es considerado primariamente como una medida de las vías aéreas grandes, lo que merece discusión (16).
Macklem y Meade han informado que los flujos espiratorios máximos y el VEF1 son dependientes de tres factores: 1º. Retracción elástica del pulmón. 2º. Resistencia de las pequeñas vías aéreas. 3º. Área de sección transversal. Cuando el VEF1 disminuye, este podría ser el resultado de cambios en uno o todos los elementos antes mencionados. Por este motivo la hiperrespuesta de las vías aéreas en términos de PC20 es la medida más comúnmente usada, considerándose el marcador fisiológico más valioso en asma aguda y crónica (17,18). Se realizó un estudio aleatorizado durante dos años, donde se evaluó la hiperrespuesta de las vías aéreas (PC20), además de la evolución clínica e histológica de la enfermedad antes y después del tratamiento con esteroides. En este estudio se demostró que posterior al tratamiento, mejoró el PC20, disminuyó el engrosamiento del colágeno subepitelial en biopsias bronquiales, al comparar con el grupo control.
Además de la reducción de la hiperrespuesta en las vías aéreas, la mejoría fue relacionada con disminución del contaje de eosinófilos en la lámina propia bronquial (18). Las numerosas líneas de investigación han revelado que la inflamación cumple un papel crítico en la patogénesis del asma y la rinitis y por tanto en la génesis de los síntomas y signos respiratorios. Una vez inhalado el estímulo alérgico o no alérgico, las células efectoras liberan mediadores y citoquinas que producen vasodilatación y edema, daño epitelial, secreción de moco, hipertrofia y contracción del músculo liso y fibrosis subepitelial (19). Recientemente, se ha renovado el interés del papel que juega la histamina en las enfermedades de vías aéreas inferiores y se ha incrementado la teoría de que los leucotrienos son mediadores inflamatorios más potentes que la histamina, interviniendo además en las enfermedades de las vías aéreas superiores.
A nivel de la mucosa nasal, se ha encontrado un influjo, acumulación y activación de las células inflamatorias; la evaluación citológica e histológica de estas células es ampliamente utilizada para monitoreo del estado inflamatorio. Las proteínas secretadas por las células inflamatorias podrían ser usadas para medir la presencia y activación de esta población celular (20), tal como la proteína catiónica de los eosinófilos. En asma bronquial los niveles de PCE séricos reflejan la severidad de la enfermedad como también es expresada por la función pulmonar, reactividad a la histamina o propensión a desarrollar reacción asmática. En la asociación entre rinitis y asma, uno de los mecanismos propuestos es la vía aérea superior que inicialmente conduce a una broncoconstricción refleja. Una subpoblación de asmáticos tienen reflejos nasobronquiales y sinobronquiales que contribuyen en un 10 % a 12 % a disminuir el VEF1.
La provocación bronquial con histamina puede aumentar la resistencia del flujo aéreo nasal sugiriendo modulación de reflejos centrales que afectan ambos órganos. Las infecciones virales podrían afectar tanto las vías aéreas superiores e inferiores, conduciendo a la asociación común de rinitis seguida por una exacerbación de asma (19).
Todas las estructuras bronquiales están comprometidas en asma, los procesos de inflamación y reestructuración ocurren en vías aéreas grandes y pequeñas. La inflamación de la vía aérea ha sido ampliamente demostrada en pacientes con asma crónica y esto se correlaciona con la severidad clínica de la enfermedad. Sin embargo, la inflamación no está restringida al bronquio y la localización exacta de la misma es motivo de controversia (21).
Los marcadores celulares, bioquímicos, inmunológicos y moleculares en inflamación de las vías aéreas pueden ser estudiados mediante procedimientos de evaluación directos e indirectos. El lavado broncoalveolar, las biopsias, el cepillado bronquial y el esputo inducido, son procedimientos de evaluación directa de las vías aéreas, los cuales han aportado información valiosa respecto a los mecanismos biológicos subyacentes del asma (21).
Las primeras observaciones patológicas fueron realizadas en pacientes quienes habían fallecido por asma en el siglo XIX (21) y no fue sino hasta el año 1980 cuando se iniciaron los estudios en pacientes vivos gracias al uso del broncoscopio de fibra óptica y a técnicas tales como: microscopia electrónica (22), técnicas de inmunohistoquímica (23), hibridación in situ (24) y otras basadas en biología molecular lo cual mejoró significativamente este conocimiento. Las biopsias bronquiales ofrecen varias ventajas: 1º. Cambios patológicos que ocurren en la mucosa de pacientes con asma, pueden ser directamente observados en las muestras, vistos en el sitio de la enfermedad local, 2º El estado de activación de la célula y su producto secretado y 3º. La localización de la célula en la submucosa y el epitelio.
Sin embargo, existen varias desventajas en la biopsia bronquial. Las biopsias podrían ser inadecuadas para cuantificar la inflamación en asma, ya que ellas demuestran sólo anormalidades patológicas en las grandes vías aéreas, hasta la cuarta a sexta generación bronquial. El edema submucoso está frecuentemente presente, bien sea debido al asma o a la biopsia. El espécimen o la muestra, "particularmente de epitelio", podría esta alterado por el procedimiento de la biopsia (20).
El lavado bronquioalveolar de sujetos asmáticos contiene grupos de células epiteliales que se desprenden del epitelio, conservando aún la actividad ciliar, lo cual sugiere que la pérdida del epitelio puede estar relacionado a una falla específica en los mecanismos de adhesión intercelular más que a muerte celular. En asma los leucocitos eosinófilos son las células efectoras más comprometidas en este proceso de desprendimiento epitelial, pues la secreción de proteínas catiónicas derivadas de sus gránulos, liberada en el epitelio y demostrado por técnicas de inmunohistoquímica, condicionan la separación intraepitelial en las uniones celulares basal-suprabasales (25).
Diferentes tipos de células han caracterizado los infiltrados inflamatorios en las vías aéreas de los asmáticos (26). Estas incluyen células inflamatorias tales como eosinófilos, células mastocíticas, macrófagos, células T y neutrófilos (27), células estructurales tales como fibroblastos, celulares musculares lisas y células epiteliales, las cuales son de particular importancia en las interacciones entre el aire del ambiente y submucosa.
Estas células participan en la liberación de mediadores vasoactivos que están involucrados en la broncoconstricción aguda y crónica.
Diversos tipos de células pueden liberar citoquinas reguladoras que modulan y perpetúan la inflamación en las vías aéreas. Más recientemente la atención ha sido enfocada hacia la reestructuración de las vías aéreas en la cual los factores de crecimiento, los componentes de la matriz extracelular y metaloproteasas y sus inhibidores, desempeñan un papel complejo en asma (28). El epitelio está desprendido (29) y activado pero su regeneración parece ser normal (30). Cuando las células epiteliales están presentes, el epitelio es pseudoestratificado todavía con un número mayor de células ciliadas, las cuales tienen una apariencia frágil. Las células ciliadas parecen edematizadas, vacuolizadas y con pérdida de los cilios (31). La células epiteliales son significativamente menos viables en pacientes asmáticos (32).
Estas células parecen activarse a medida que ellas liberan una cantidad mayor de ácido hidroxieicosatetraenoico, prostaglandinas E2, fibronectina y endotelinas, bien sea espontáneamente o después de la estimulación (33,34), y presentan un incremento de marcadores de membranas (35) y de citoquinas (36).
En asma las células epiteliales pueden ser activadas por mecanismos dependientes de IgG o mediadores proinflamatorios tales como histamina (20) que pueden inducir obstrucción bronquial, inflamación y reestructuración de las vías aéreas. Los eosinófilos activados se encuentran en las vías aéreas de personas con asma sintomática (35). En asma crónica se ha encontrado un mayor incremento del número de eosinófilos. Estas células están usualmente activadas y localizadas más allá de la membrana basal. La mayoría de los pacientes alérgicos y no alérgicos con asma, incluyendo aquellos con asma leve, tienen eosinófilos en sus bronquios; existe una correlación significativa entre la activación de los eosinófilos y la severidad del asma (36,37).
Los linfocitos T son otros tipos de células principales del infiltrado mixto, presentes en las vías aéreas de pacientes quienes han fallecido por exacerbaciones de asma (38). Estas células presentan receptores CD4 mientras que las células CD8 son menos frecuentes aun durante las exacerbaciones.
Existe una correlación entre la severidad del asma y el número de células T y CD4 en biopsias. Las células T juegan probablemente un papel importante en el asma (39).
Usando técnicas de hibridización in situ, un fenotipo TH2 de células T, se ha observado en el líquido del lavado bronquioalveolar de asmáticos. Después de la exposición al alergeno, muchas células T específicas muestran el fenotipo TH2 en biopsias bronquiales o líquido del lavado bronquioalveolar (40). Las células mastocíticas, son células metacromáticas encontradas en bronquios de sujetos con o sin asma, sin embargo, ellas son degranuladas en las vías aéreas de pacientes con asma (41,42). Existe una correlación significativa entre la severidad del asma y el nivel de triptamina o triptasa, en el líquido de lavado bronquioalveolar (43).
Los fagocitos mononucleares, probablemente están involucrados en la patogénesis del asma, ya que están presentes en el infiltrado inflamatorio de las vías aéreas. Muchos estudios han revelado un aumento en la activación de los macrófagos alveolares y estos se han correlacionado con la severidad del asma (44).
En relación al proceso inflamatorio presente en asma, existe un evidente proceso de reestructuración que implica hipertrofia de glándulas mucosas, aumento en la masa de músculo liso bronquial y depósito de colágeno en la matriz, determinándose que los tipos III y V están aumentados y localizados por debajo del epitelio bronquial, lo que produce un engrosamiento de la capa reticular (45-48). Existen variaciones muy amplias en cuanto al grosor de la membrana basal reticular tanto en asmáticos como en sujetos controles. Un estudio realizado por un grupo australiano de inmunología respiratoria, compararon diferentes métodos (microscopia óptica contra microscopia electrónica) para medir el grosor de la membrana basal reticular y examinar el depósito de colágeno en la submucosa del bronquio de pacientes asmáticos, evaluaron 15 biopsias de mucosa bronquial de asmáticos y 13 controles sanos. Demostraron que la membraba basal reticular puede ser medida por métodos de microscopia óptica. Este estudio muestra en primer término que la submucosa de las vías aéreas en el asmático contiene significativamente más colágeno que los controles normales, lo que posibilita la formación de fibrosis de la vía aérea lo cual conduce a implicaciones funcionales mayores a las vistas previamente cuando se consideraba únicamente la membrana basal reticular. Según los autores, la medición por microscopia óptica, resulta exacta y menos costosa que la microscopia electrónica; además la tinción para colágeno tipo III y V en vías aéreas de asmáticos demuestra que el límite inferior de la membrana basal reticular a la submucosa está pobremente definida y se extiende discontinuamente en la submucosa (45).
Estudios comparativos entre asmáticos y controles sanos muestran en forma constante engrosamiento de la membrana basal reticular en asma (46-52). Jeffery y col. sugiere que el grosor de la membrana basal reticular es relativamente constante a través de la extensión de las vías aéreas (47).
Valores normales a 8 um han sido informados en 4 series (45,46,49,52) y son menores que el grosor promedio para controles normales señalados por otros grupos (47,49). La explicación del depósito de colágeno subepitelial, en asma no está todavía claro y ha sido atribuido a la frecuencia y duración del asma, actividad de linfocitos T, irritación epitelial y actividad fibroblástica (46,53). Además se ha encontrado en la submucosa actividad inflamatoria aun en asma leve, estable (41,54) planteándose que las células a nivel de la submucosa son capaces de producir citoquinas fibrogénicas.
Los linfocitos activados podrían actuar estimulando a las células mastocíticas para mantener la formación de tejido cicatricial mediante la actividad de las interleuquinas (IL-3,4,5), las cuales podrían además estimular a macrófagos (vía IL) para actuar con capacidad fibrogénica, por liberación del factor de necrosis tumoral (TNF ) (55).
Entre la dificultades en la evaluación de la estimación del colágeno en las vías aéreas se puede incluir número bajo de muestras y técnicas de muestreo y medidas variables. Otros trabajos sugieren que la actividad celular en esta región, es capaz de producir una variedad de la citoquinas inflamatorias y factores de crecimiento, que podrían actuar estimulando la fibrosis y con ello iniciar el proceso de reestructuración (47).
En el presente trabajo nos proponemos evaluar el espesor de la membrana basal y describir los cambios inflamatorios, en un grupo de pacientes atópicos, con asma leve persistente, tanto a a nivel bronquial como nasal.
Objetivos
General
Determinar las características histopatológicas en biopsias de mucosa nasal y bronquial de pacientes con asma leve persistente.
Específicos
Comparar las hallazgos histopatológicos entre las muestras de mucosa bronquial y nasal.
Investigar la relación entre el grado de inflamación de las vías aéreas y las características clínicas y funcionales de los pacientes en estudio.
Hipótesis
Si las vías aéreas superiores e inferiores comparten características histológicas similares y son susceptibles de presentar cambios inflamatorios relacionados con fenómenos de atopia, entonces se deben correlacionar los hallazgos histopatológicos en mucosa nasal y bronquial de pacientes con asma leve persistente.
Método
Se estudiaron diez pacientes con asma de acuerdo a la definido por la reunión de expertos en asma, en 1997 (53), que consultaron al Servicio de Neumonología del Hospital "José Ignacio Baldó", entre los meses de agosto de 1998 y abril de 1999, quienes cumplieron los siguientes criterios:
Inclusión
Síntomas > 2 veces por semana y < 1 vez al día (57).
Volumen espirado en el primer segundo (VEF1s) mayor del 65 % con una respuesta al uso del broncodilatador (200 microgramos de salbutamol), mayor de 200 cm3 o del 12 %.
Exclusión
Uso de corticoesteroides durante las últimas cuatro semanas, previas al estudio.
Hábito tabáquico
Infección respiratoria alta y/o baja, durante las cuatro semanas previas al estudio.
Estado hemodinámico inestable.
Arritmia cardíaca severa.
Alteraciones neurológicas.
Coagulopatías
Alergia a la lidocaína
Durante su permanencia en el estudio, los pacientes utilizaron bromuro de ipratropio con fenoterol inhalado, como terapia de rescate.
Se realizó espirometría utilizando espirómetro (Cybermedics) para determinar capacidad vital forzada (CVF), volumen espirado en el 1º segundo (VEF1), índice de Tiffenau (CVF/VEF1), flujo espiratorio pico (FEP) y flujos medio máximo (F25 -75).
Una vez seleccionado el paciente, se solicitó su consentimiento por escrito para participar en el estudio.
Se realizó prueba de alergia, mediante micropuntura (prueba Prick), con los antígenos (polvo casero y hongos) elaborados en el Instituto de Biomedicina; control positivo: histamina y control negativo: agua estéril; a nivel de la región antebraquial derecha se coloca 0,05 cm3 (1 gota) de cada antígeno y controles, previa punción, se esperan 30 minutos y se evalúa la presencia de eritema o pápula mayor de 0,5 cm de diámetro.
Se practicó broncofibroscopia en la sala de endoscopia del Servicio de Investigación de Enfermedades Respiratorias (SIER) del Hospital "José Ignacio Baldó", previa nebulización con solución fisiológica (3 cm3) y fenoterol-bromuro de ipratropio (1 cm3) y anestesia local a nivel de fosa nasal derecha y orofaringe con xylocaína al 2%.
Se utilizó broncofibroscopio Olympus CLU-4U mediante abordaje vía nasal, para recolectar muestra de lavado bronquial en bronquio intermedio, con 30 cm3 de solución estéril a 37ºC, recogida en trampa de Luckens. Posteriormente se realizó biopsia de mucosa bronquial (3 a 5 muestras) a nivel de la carina interlobar superior derecha y carinas intersegmentarias del bronquio intermedio con pinza FB-19C. Finalmente se tomaron 3 muestras de mucosa nasal a nivel del cornete inferior izquierdo.
Procesamiento de las muestras
Las muestras de biopsias y lavado fueron procesadas en el Servicio de Anatomía Patológica del Hospital "José Ignacio Baldó".
Las biopsias de mucosa bronquial y nasal se fijaron en formol al 10 % y fueron incluidas en parafina, para realizar cortes de 7 micras que fueron teñidos con hematoxilinaeosina (H-E), en total se realizaron 9 cortes por biopsia.
Las muestras de lavado bronquial, se centrifugaron a 1 500 rpm durante 15 minutos, se descartó el sobrenadante y se realizó extendido del sedimento en las láminas y se fijó en alcohol de 95º para su tinción con H-E.
Se utilizó microscopio óptico Zeiss con objetivo 40x y ocular 10x. En las biopsias se evaluaron las características del epitelio, membrana basal, corion y fibras musculares lisas. Para medir el grosor de la membrana basal se utilizó ocular micrométrico Nikon de 10x Optovar 1,25, correspondiendo cada milímetro del ocular a 2 micras.
En los lavados bronquiales se evaluó el tipo y número de células. El recuento celular se realizó determinando el número de células por campo de 40x, hasta completar 10 campos.
Análisis estadístico
Las variables numéricas fueron comparadas realizando test de Student pareado, considerando, P < 0,05 como nivel de significancia estadística. Las frecuencias se analizaron con prueba exacta de Fisher.
RESULTADOS
Se estudiaron 10 pacientes con asma leve persistente. El estudio se realizó previo consentimiento por escrito de los pacientes para participar en el mismo y con la aprobación por el comité de ética del Hospital "José Ignacio Baldó".
La distribución por edades se encuentran en un rango entre 15 y 44 años (media: 31 años), la distribución por sexo muestra 2 masculinos y 8 femeninos (Cuadro 1).
Se realizó espirometría a cada paciente obteniéndose los valores de volumen espiratorio forzado en el 1º segundo (VEF1), previo y posterior al uso del broncodilatador, capacidad vital forzada (CVF), Índice de Tiffeanau (VEF1/CVF), flujo espiratorio pico (FEP) y flujos espiratorios 25-75 (FEF 25-75) (Cuadro 2).
Distribución de pacientes según edad y sexo
| Paciente | Edad | Sexo |
| 1 | 24 | f |
| 2 | 33 | m |
| 3 | 32 | f |
| 4 | 29 | f |
| 5 | 37 | f |
| 6 | 21 | f |
| 7 | 40 | f |
| 8 | 15 | f |
| 9 | 44 | f |
| 10 | 34 | m |
Valores de espirometría simple (pre y posbroncodilatador)
| n | VEF1(%) | CVF(%) | Tiffenau | FEP | F25-75 | VEF1 pos | % VEF1 |
| 1 | 3,09 (75) | 4,72 (106) | 0,65 | 6,65 (72) | 1,95 (44) | 3,61 (106) | 17 |
| 2 | 2,18 (72) | 2,83 (82) | 0,77 | 3,91 (63) | 1,75 (47) | 2,80 (92) | 28 |
| 3 | 2,10 (70) | 3,20 (80) | 0,65 | 4,10 (62) | 1,62 (41) | 2,95 (98) | 42 |
| 4 | 2,00 (72) | 2,67 (82) | 0,74 | 5,83 (96) | 1,50 (45) | 2,46 (88) | 23 |
| 5 | 3,13 (101) | 4,03 (118) | 0,77 | 5,48 (88) | 2,75 (68) | 3,60 (117) | 47 |
| 6 | 2,13 (74) | 3,14 (89) | 0,67 | 4,23 (69) | 1,49 (45) | 2,84 (99) | 33 |
| 7 | 2,28 (74) | 3,64 (113) | 0,62 | 4,36 (64) | 1,51 (42) | 2,77 (90) | 21 |
| 8 | 1,73 (68) | 2,53 (85) | 0,68 | 5,58 (95) | 0,91 (30) | 1,98 (78) | 14 |
| 9 | 2,70 (74) | 4,10 (95,7) | 0,65 | 6,25 (73) | 1,27 (31) | 3,13 (86) | 16 |
| 10 | 2,10 (73) | 3,18 (79) | 0,66 | 4,03 (64) | 1,63 (45) | 2,93 (102) | 28 |
El promedio de VEF1s previo a la administración del broncodilatador es de 2,33 L/seg y posteriormente al mismo se obtuvo un promedio de 2,87 L/seg. Al comparar los valores de VEF1s pre y posbroncodilatador se obtiene una diferencia estadísticamente significativa (P= 0,0000085), con desviación estándar de 0,18 L/seg.
Se les realizó la prueba de alergia a sólo 7 pacientes, resultando 3 pacientes con respuesta positiva (2 a polvo casero y 1 a Dermatophagoydes), 4 respuestas negativas. Los 3 pacientes restantes no acudieron a realizarse la prueba.
Se realizó fibrobroncoscopia, practicándose lavado bronquial y biopsia de mucosa bronquial y nasal respectivamente. Se presentó broncoespasmo durante el procedimiento en 3 pacientes (30 %).
Los hallazgos del estudio histopatológico son los siguientes:
Mucosa nasal: en todos los casos estudiados se encontraron alteraciones del epitelio por: hiperplasia de células caliciformes, metaplasia escamosa del epitelio de revestimiento, desprendimiento del epitelio. En general, la membrana nasal se presentó engrosada (Cuadro 3). El corión presentó neovascularización severa con signos de congestión y edema, estravasación de glóbulos rojos y depósitos de fibrina. Infiltrado severo de macrófagos, eosinófilos y leucocitos neutrófilos, linfocitos escasos (Cuadro 4). En algunos casos se encontraron cristales de Charcot Leyden (Cuadro 5 y Figuras 1 y 2).
Medidas del grosor de la membrana basal en biopsias de mucosa bronquial y nasal (micrometros) Microscopio óptico 40x.
| n | Bp. bronquial | Bp. nasal |
| 1 | 10 | 10 |
| 2 | 20 | 20 |
| 3 | 30 | 20 |
| 4 | 10 | 10 |
| 5 | 20 | 20 |
| 6 | 30 | 20 |
| 7 | 10 | 10 |
| 8 | 50 | 20 |
| 9 | 25 | 5 |
| 10 | 5 | 5 |
Distribución de células reactivas en mucosa nasal.
Microscopio óptico 40x
| n | Macrófagos | Eosinófilos | Linfocitos | Neutrófilos |
| 1 | 3 | 8 | 0 | 5 |
| 2 | 0 | 7 | 0 | 0 |
| 3 | 2 | 7 | 0 | 0 |
| 4 | 2 | 5 | 3 | 6 |
| 5 | 2 | 5 | 3 | 6 |
| 6 | 2 | 8 | 0 | 0 |
| 7 | 2 | 3 | 0 | 0 |
| 8 | 5 | 6 | 3 | 3 |
| 9 | 5 | 18 | 1 | 12 |
| 10 | 1 | 6 | 0 | 3 |
Distribución de cristales de Charcot Leyden en biopsias de mucosa bronquial y nasal
| Charcot L | Si | No |
| BP bronquial | 5 | 5 |
| Bp nasal | 2 | 8 |
P= 0,35 (doble cola)
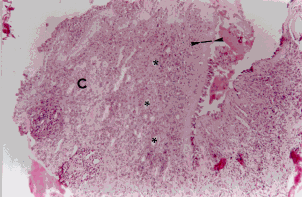
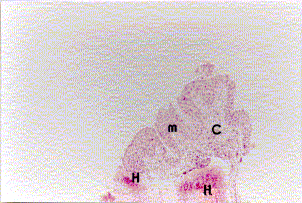
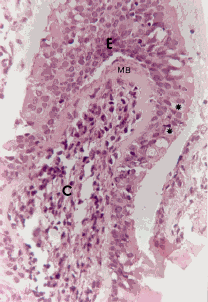
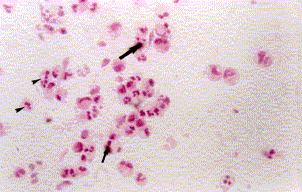
Figura 1a. Mucosa nasal: engrosamiento de la membrana basal (cabeza de flecha). Angiogénesis (asteriscos), infiltrado severo linfoplasmohistocitario y de eosinófilos. Coloración Hematoxilina-Eosina. Aumento fotográfico 100x.
Figura 1b. Mucosa nasal: angiogénesis (asteriscos) y eosinófilos (cabeza de flechas). Coloración Hematoxilina- Eosina. Aumento fotográfico 100x.
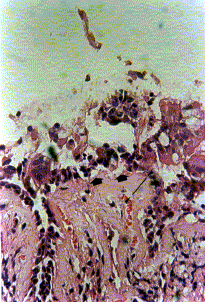
Figura 2a. Mucosa nasal: desprendimiento del epitelio (flechas). Engrosamiento de la membrana basal (cabeza de flechas). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
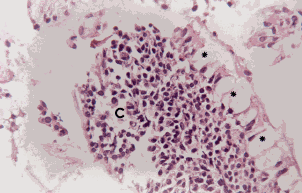
Figura 2b. Mucosa nasal: hiperplasia de células caliciformes (asteriscos). Eosinófilos intraepiteliales (cabezas de flecha), engrosamiento de la membrana basal (flechas), corion congestivo (c) con severo infiltrado linfoplasmohistiocitario. Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
Figura 2c. Mucosa nasal: moco con abundantes eosinófilos (asteriscos) y cristales de Charcot Leyden (cabezas de flechas). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
Mucosa bronquial: en el epitelio se observó hiperplasia de células caliciformes, focos de metaplasia escamosa, desprendimiento del epitelio, eosinófilos intraepiteliales y engrosamiento de la membrana basal (Cuadro 3).
Corion muy congestivo y edematoso con neovascularización y extravasación de glóbulos rojos (Cuadro 6).
En algunos casos se aprecia hiperplasia de glándulas mucosas, hiperplasia de fibras musculares lisas, presencia de cristales de Charcot Leyden (Figuras 3 a 7) y en un caso se evidenció la presencia de un hongo ambiental con morfología compatible con Alternaria (Figura 7b).
En relación con la distribución de las células reactivas en las biopsias de mucosa bronquial y nasal, el análisis estadístico demuestra que sólo existe similitud en cuanto a las cifras promedio de eosinófilos, resultando la comparación de los valores respectivos no estadísticamente significativas (P> 0,05). La variabilidad fue similar en ambas muestras.
Al comparar la presencia de cristales de Charcot Leyden entre las muestras de mucosa bronquial y nasal, no se encontraron diferencias estadísticamente significativas (P= 0,35).
Distribución de células reactivas en biopsia de mucosa bronquial.
Microscopio óptico 40x
| n | Macrófagos | Eosinófilos | Linfocitos | Neutrófilos |
| 1 | 1 | 3 | 4 | 5 |
| 2 | 2 | 5 | 3 | 7 |
| 3 | 5 | 8 | 3 | 3 |
| 4 | 2 | 3 | 0 | 0 |
| 5 | 10 | 8 | 2 | 3 |
| 6 | 10 | 11 | 3 | 12 |
| 7 | 10 | 9 | 2 | 12 |
| 8 | 12 | 4 | 15 | 10 |
| 9 | 12 | 11 | 15 | 12 |
| 10 | 5 | 6 | 5 | 7 |
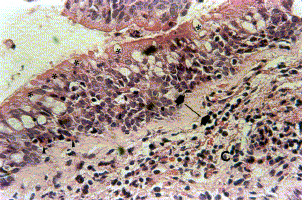
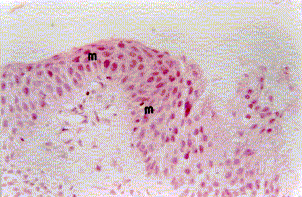
Figura 3a. Mucosa bronquial: metaplasia escamosa del epitelio (m), con corion severa congestión (c) y hemorragia focal (H). Coloración Hematoxilina-Eosina. Aumento fotográfico 100x.
Figura 3b. Mucosa bronquial: metaplasia escamosa del epitelio de revestimiento (m). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
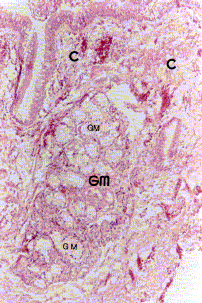
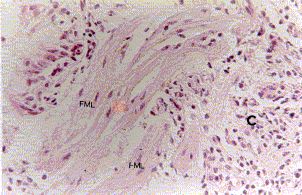
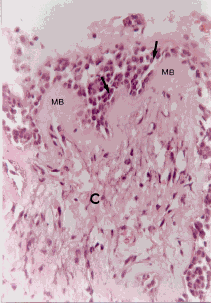
Figura 4a. Mucosa bronquial: se observa en el corion (C) con hiperplasia de glándula mucosa (GM). Coloración Hematoxilina-Eosina. Aumento fotográfico 100x.
Figura 4b. Mucosa bronquial: se observa en el corion (C) hiperplasia de fibras musculares lisas (FML). Coloración Hematoxilina-Eosina. Aumento fotográfico 100x.
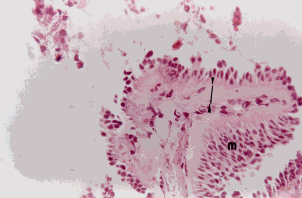
Figura 4c. Mucosa bronquial: con metaplasia escamosa focal del epitelio (M), engrosamiento de la membrana basal (MB). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
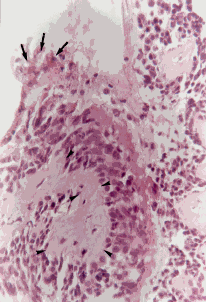
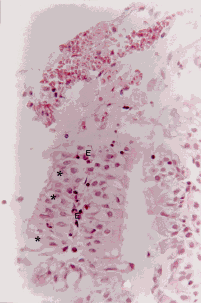
Figura 5a. Mucosa bronquial: desprendimiento del epitelio (E), hiperplasia de células caliciformes (asteriscos), membrana basal engrosada (MB) y severo infiltrado linfoplasmocitario en el corion (C)
Figura 5b. Mucosa bronquial: engrosamiento de la membrana basal (MB) y severa congestión del corion (C). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
Figura 5c. Mucosa bronquial: desprendimiento de células epiteliales (flechas) y membrana basal engrosada (cabeza de flecha). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
Figura 6a. Mucosa bronquial: se observa material mucoso con fibrina y glóbulos rojos adheridos a la superficie del epitelio. Coloración Hematoxilina-Eosina. Lupa.
Figura 6b. Mucosa bronquial: severa hiperplasia de células caliciformes (asteriscos), corion (C) con severo infiltrado linfoplasmohistiocitario. Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
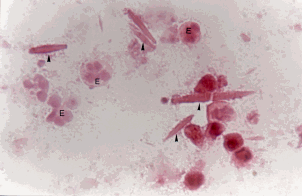
La citología de las muestras de lavado bronquial muestran células bronquiales dispuestas en pequeños grupos de células desprendidas, con cilios preservados ("grupos de células bronquiales desprendidas") (Figura 8).
Figura 6c. Mucosa bronquial: severa hiperplasia de células caliciformes (asteriscos) y eosinófilos intraepi-teliales (E). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
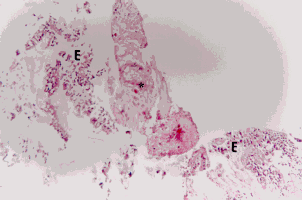
Figura 7a. Mucosa bronquial: material mucoso (M) con eosinófilos (E) y cristales de Charcot Leyden (cabezas de flecha). Coloración Hematoxilina-Eosina. Aumento fotográfico 1000x.
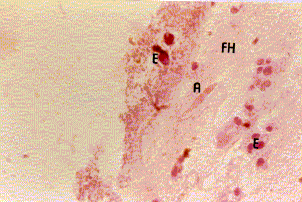
Figura 7b. Mucosa bronquial: material fibrinohe-morrágico (FH) donde se observan eosinófilos (E) y una estructura alargada compatible con elementos micóticos ambientales tipo Alternaria (A).
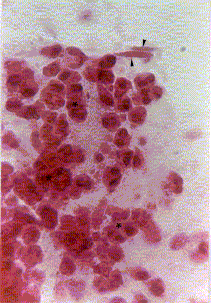
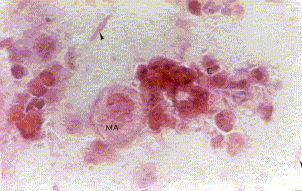
Figura 8a. Lavado bronquial: fondo hemorrágico donde se observan macrófagos alveolares (MA), detritus (D), eosinófilos (E) y cristales de Charcot-Leyden (cabezas de flecha). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
Además se observaron células caliciformes, células de metaplasia escamosa, macrófagos alveolares (algunos hemosiderófagos), eosinófilos, linfocitos, leucocitos neutrófilos (Cuadro 7).
Se observaron cristales de Charcot Leyden (Cuadro 5), glóbulos rojos y fibrina (Figura 8).
Se encontró una diferencia amplia entre las medidas del grosor de las membranas basales de mucosa bronquial y nasal, sin embargo, esta diferencia no alcanza significativamente estadística al nivel del 0,05 (P= 0,07), a pesar del alto rango de variabilidad.
Figura 8b. Lavado bronquial: se observan macrófagos alveolares (MA), eosinófilos (E) y leucocitos neutrófilos (N). Coloración Hematoxilina-Eosina. Aumento fotográfico 400x.
Distribución porcentual de células reactivas en lavado bronquial. MO 40x.
| Citología | Macrófagos | Eosinófilos | Linfocitos |
| 1 | 76 | 8 | 5 |
| 2 | 86 | 6 | 3 |
| 3 | 79 | 6 | 1 |
| 4 | 85 | 6 | 4 |
| 5 | 85 | 7 | 3 |
| 6 | 85 | 8 | 2 |
| 7 | 85 | 9 | 3 |
| 8 | 85 | 8 | 2 |
| 9 | 85 | 7 | 3 |
| 10 | 83 | 9 | 3 |
DISCUSIÓN
El presente estudio demuestra las características histopatológicas de pacientes categorizados como leves persistentes. En relación con la distribución de las variables edad y sexo en la muestra poblacional, se encuentra un predominio de adultos jóvenes y sexo femenino, frecuencias que no difieren de los datos epidemiológicos encontrados en otros estudios, con especial mención a la encuesta ISAAC, realizada en nuestro país (2,4,13).
Los pacientes seleccionados inicialmente por la frecuencia de los síntomas respiratorios, tuvieron valores de VEF1s entre el 65 % y 75 % de los valores predictivos, sólo un paciente presentó un VEF1s de 103 L/seg con una respuesta al broncodilatador superior al 12 %, por lo que se incluyó en el estudio dada la hiperreactividad bronquial.
Sólo se documento atopia por la prueba de alergía en tres pacientes. El hecho de que los pacientes restantes no resultaran positivos, no significa que no sean atópicos sino que podría ser debido al uso de antihistamínicos o que no posean células T específicas para el estímulo seleccionado, especialmente a Dermatophagoydes.
Desde el punto de vista histopatológico se nos presenta un proceso inflamatorio activo, dado por la presencia de células reactivas (macrófagos, neutrófilos, linfocitos y eosinófilos). Se destaca el eosinófilo porque constituye el estigma tisular de la patología alérgica.
La extensión de la inflamación compromete a la membrana basal, con engrosamiento de la misma en forma variable; al comparar las medidas en micrometros del grosor de las membranas basales (nasal y bronquial), se obtiene una gran variabilidad que igualmente ha sido encontrada en diferentes estudios que han incluido sujetos sanos y asmáticos (45,46,51,52).
En la mitad de los casos de las biopsias de mucosa bronquial (n = 5), se pudo evaluar el corion en profundidad para apreciar los cambios en la submucosa dados por hiperplasia de glándulas mucosas y de las fibras musculares lisas.
En los casos restantes de muestras de mucosa bronquial, no se pudo evaluar el corion, debido a la presencia de secreción hialina sobre la mucosa, lo que produce un desplazamiento de la pinza y por ende a tamaños de biopsia muy pequeños, sobre todo a nivel de mucosa nasal.
Por otra parte, en algunas muestras de lavado bronquial, se observaron abundantes glóbulos rojos que expresan la presencia del estado friable de la mucosa, aun cuando se realizaba el lavado bronquial previo a la biopsia.
No se demostraron diferencias histopatológicas entre los pacientes con prueba alérgica positiva o negativa.
Las características inflamatorias similares en ambas mucosas permitirían estudiar con gran exactitud, los cambios inflamatorios a nivel de mucosa nasal en pacientes asmáticos, lo que evitaría someterlos a procedimiento invasivo (fibrobroncoscopia).
Conclusión
1.Existen cambios inflamatorios en ambas mucosas nasal y bronquial.
2.La severidad del proceso inflamatorio es igual en ambas mucosas.
3.Los pacientes con un comportamiento clínico-funcional leve, presentan cambios inflamatorios activos y severos en todo el tracto respiratorio.
Recomendaciones
1.Uso de terapia antiinflamatoria en etapas tempranas de la patología.
2.Realizar estudio inmunohistoquímico en las biopsias practicadas para demostrar el engrosamiento de la membraba basal reticular.
REFERENCIAS
1.Grossman Jay MD. One airway, one disease. CHEST 1997;111(Suppl):11-16. [ Links ]
2. Lundback B. Epidemiology of rhinitis and asthma. Clin Exp Allergy 1998;2(Suppl):3-10. [ Links ]
3. Vichyanond P, Jirapongsannuruk O, Visitsuntorn N, Tuchinda M. Prevalence of asthma, rhinitis and eczema in children from the Bangkok area using ISAAC (Study for Asthma and Allergy in Children) questionnaires. J Med AssoThai 1998;81(3):175-184. [ Links ]
4.Shaw RA, Crane J, Pearce N, Burger CD, Bremner P, Woodman K, et al. Comparison of a video questionnaire with the IVATAD written questionnaire for measuring asthma prevalence. Clin Exper Allergy 2000; 119(22):561-568 [ Links ]
5.Braman SS, Barrows AA, DeCottis BA, Settipane GA, Corrao WM. Airway hyperresponsiveness in allergic rhinitis: A risk factor for asthma. Chest 1987;91:671-674. [ Links ]
6.Broder L, Higgins MW, Mathews KP, Keller JB. Epidemiology of asthma and allergic rhinitis in a total community: Tecumseh, Michigan. L Allergy Clin Immunol 1974;54:100-110. [ Links ]
7.Georgitis JW, Mathews BL, Stone B. Chronic sinusitis: Characterization of cellular influx and inflammatory mediators in sinus lavage fluid. Int Arch Allergy Immunol 1995;106:416-421. [ Links ]
8.Eggleston PA. Upper airway inflammatory diseases and bronchial hyperresponsiveness. J Allergy Clin Immunol 1988;81:1036-1041. [ Links ]
9.Magnan A, Fourren-Jullian C, Jullian H, Badier M, Lanteaume A, Velvloet D, Charpin D. Rhinitis alone or rhinitis plus asthma: What makes the difference? Eur Respir J 1998;12:1073-1078. [ Links ]
10.Burrows B, Sears M, Flannery E, Herbison G, Holdaway M. Relationships of bronchial hiperresponsivenes assessed by methacholine to serum IgE, lung function, symptoms and diagnoses in 11-year-old New Zealand children. J Allergy Clin Inmmunol 1992;90:376-385. [ Links ]
11.Sears M, Burrows B, Flannery E, Herbison G, Hewitt C, Holdaway M. Relation between airway responsi-veness and serum IgE in children with asthma and in apparently normal children. N Engl J Med 1991; 325:1067-1071. [ Links ]
12.Martinez F, Wright A, Taussig L, Holberg C, Halone M, Morgan W. Asthma and wheezing in the first six years of life. N Engl J Med 1995;332:133-138. [ Links ]
13. Sunyer J, Anto J, Kogevinas M, Barcelo M A, Soriano B, Tobias A, et al. Risk factors for asthma in young adults. Eur Respir J 1997;10:2490-2494. [ Links ]
14.Woolcock A. Effects of drugs on small airways. Am J Respir Crit Care Med 1998;157(Suppl):203-207. [ Links ]
15.Weiss S, Segal M, Tager I, Tosteson T, Redline S, Speizer F. The effects of asthma on pulmonary function in children: A longitudinal population-based study. Am Rev Respir Dis 1992;145:8-64. [ Links ]
16.Sont J, van Krieken J, Evertse C, Hooijer R, Willems L, Sterk P. Relationship between the inflammatory infiltrate in bronchial biopsy specimens and clinical severity of asthma in patients treated with inhalaed steroids. Thorax 1996;51:496-502. [ Links ]
17.Sont J, Willems LNA, Evertese CE, VanDenbroocke JP, Sterk PJ (the ampul study group). Long term managament of asthma: Is it worth to treat bronchial hyperresponsiveness beyond clinical symptoms and lung function? Am J Respir Crit Care 1997;155:A203. [ Links ]
18.Sont J, van Krieken J, Evertse C, Neeskens P, Willems LNA, Sterk PJ (the ampul study group). Additional reduction in airway subepithelial reticular layer thickeness can be obtained by a treatment strategy aimed at improving bronchial hyperresponsiveness (BHR) in asthma. Am J Respir Crit Care Med 1997;155:A502. [ Links ]
19.Casale T. Immunobiology of asthma and rhinitis: Pathogenic factores and therapeutic options. American Thoracic Society Workshop Summary 1997:16-18. [ Links ]
20.Klimek L, Rasp G. Norm values for eosinophil cationic protein in nasal secretions: Influence of specimen collection. Clin Experiment Allergy 1999;29:367-374. [ Links ]
21.Vignola A, Bousquet J, Chanez P, Gagliardo R, Merendino A, Chiappara G, Bonsignore G. Assessment of airway inflammation in asthma. Am J Respir Crit Care Med 1998;157(5 Suppl):184-187. [ Links ]
22.Beasley R, Roche W, Robrets J, Holgate S. Cellulars in the bronchial provocation. Am Rev Respir Dis 1989;136:806-817. [ Links ]
23.Filley W, Holley K, Kephart G, Gleich. Identification by inmunofluorescence of eosinophil granule major basic protein in lung tissues of patients with bronchial asthma. Lancet 1982;2:11-16. [ Links ]
24.Hamid Q, Azzawi M, Ying S, Moqbel R, Wardlaw C, Corrigan C, et al. Expression of mRNA for interleukin-5 in mucosal bronchial biopsies from asthma. J Clin Invest 1991;87:1541-1546. [ Links ]
25.Roche W. The pathology of bronquial asthma. En: Hasleton, editor. Spencers pathology of the lung. 5ª edición. New York: McGraw-Hill; 1996.p.695-697. [ Links ]
26.Bousquet J, Chanez A, Campbell A, Vignola M, Godard P. Cellular inflammation in asthma. Clin Exp Allergy 1995;2:39-42. [ Links ]
27.Howarth P, Redington A, Montefort S. Pathophysiology of asthma. Allergy 1993;48:50-56. [ Links ]
28.Bousquet J, Vignola P, Chanez A, Campbell G, Bonsignore G, Michel F. Airways remodelling in asthma. No doubt, no more? In Arch Allergy Immunol 1995;107:211-214. [ Links ]
29.Laitinen A, Partanen M, Hervonen A, Laitinen L. Electron microscopic study on the innervation of the human lower respiratory tract: Evidence of adrenergic nerves. Eur J Respir Dis 1985;67:209-215. [ Links ]
30.Djukanovic R, Roche R, Wilson J, Beasley O, Twentyman R, Howarth H, Holgate T. Mucosal inflammation in asthma. Am Rev Respir Dis 1990;142:434-457. [ Links ]
31.Laitinen L, Heino M, Latitinen A, Kava T, Haatela T. Damage of the aiway ephitelium and bronchial reactivity in patients with. Am Rev Respir Dis 1985;131:559-606. [ Links ]
32.Campbell G, Chanez A, Vignola P, Bousquet J, Couret F, Michel F, Godard P. Functional characteristics of bronchial ephitelum obtained brushing from asthmatic and normal subjects. Am Rev Respir Dis 1993;147:529-534. [ Links ]
33.Bradding P, Redington A, Djukanovic R, Conrad D, Holgate S. 15-Lipoxygenase inmunoreactivity in normal and asthmatic airways. Am Rev Respir Crit Care Med 1995;151:1201-1204. [ Links ]
34.Vignola A, Campbell M, Chanez P, Bousquet J, Paul-Lacoste P, Michel F, Godard P. HLA-DR and ICAM-I expression of bronchial ephitelial cellsin asthma and chronic bronchitis. Am Rev Respir Dis 1993;148:689-694. [ Links ]
35.Sousa A, Poston R, Lane S, Nakhosteen J, Lee T. Detection of GM-CSF in ashmatic bronchial epithelium and decrease by inhaled corticosteroids. Am Rev Respir Dis 1993;147:1557-1561. [ Links ]
36.Walker C, Kaegi M, Barun P, Blaser K. Activate T Cells and eosinophilia in bronchoalveolar lavages from subjects with asthma correlated with disease severity. J Allergy Clin Immunol 1991;88:935-942. [ Links ]
37.Bousquet J, Chanez P, Lacoste J, Barmeon G, Ghavanian N, Enander I, et al. Eosinophilic inflammation in asthma. N Engl J Med 1990;323:1033-1039. [ Links ]
38.Azzawi M, Johnston S, Majumbar S, Kay A, Jeffery P. T linphocytes and activated eosinophils in airway mucosa in fatal asthma and cystic fibrosis. Am Rev Res Dis 1992;145:1477-1482. [ Links ]
39.Corrigan C, Hamid Q, North J, Barkans J, Moqbel R, Durham S, et al. Peripheral blood CD4 but no CD8 t-lymphocytes in patient with exacerbation of asthma transcribe and translate messenger RNA encoding cytokines which prolong eosinophil survival in the context of a Th2-type pattem: Effect of glucocorticoid therapy. Am J Respir Cell Mol Biol 1995;15:17-27. [ Links ]
40.Osuma K, Mori A, Ogawa K, Nakata A, Kiddawa I, Okudaira H. Cloned Th cells confer eosinophilic inflammation and bronchial hyperresponsiveness. Int Arch Allergy Immunol 1999;118:136-139. [ Links ]
41.Djukanovic R, Wilson J, Britten K, Wilson S, Walls A, Roche W, et al. Quantitation of mast cells and eosinophils in the bronchial mucosa of symptomatic atopic asthmatics and healthy control subjects using inmunohistochemistry. Am Rev Respir Dis 1990;142:863-871. [ Links ]
42.Pesci A, Foresi A, Bertorelli G, Chetta A, Oliveri D. Histochemical characteristic and degranulation of mast cells in epitthelium and lamina propria of bronchial biopses from asthmatic and normal subjetcs. Am Rev Respir Dis 1993;147:684-689. [ Links ]
43.Bousquet J, Chanez P, Lacoste J, Enander I, Venge P, Perterson C, et al. Indirect evidence of bronchial inflammation assessed by titration of inflammatory mediators in BAL fluid of patients with asthma. J Allergy Clin Inmmunol 1991;88:649-660. [ Links ]
44.Chanez P, Vignola M, Paul-Eugene N, Dugas B, Godard P, Michel F, et al. Modulation by interleukin-4 of cytokine release from mononuclear phagocytes in asthma. J Allergy Clin Immunol 1994;94:997-1005. [ Links ]
45.Wilson J, Li X. The measurement of reticular basement membrane and submucosal collagen in the asthmatic airway. Clinical and Experimental Allergy 1997;27:363-371. [ Links ]
46.Roche W, Beasley R, Williams J. Holgate S. Subepithelial fibrosis in the bronchi of asthmatics. Lancet 1989;2:520-524. [ Links ]
47.Jeffery P, Wardlaw A, Nelson F, Collins J, Kay A. Bronchial biopsies in asthma: An ultrastructural, quantitative study and correlation with hyperactivity. Am Rev Respir Dis 1989;140:1745-1753. [ Links ]
48.James A, Pare P, Hogg J. The mechanics of airway narrowing in asthma. Am Rev Respir Dis 1989;139:242-246. [ Links ]
49.Olllerenshaw S, Woolcock A. Characteristics of the inflammation in biopsies from large airways of subjects with asthma and subjects with chronic airflow limitation. Am Rev Respir Dis 1992;145:922-927. [ Links ]
50.Jeffery P, Godfrey R, Adelroth E, Nelson F, Rogers A, Johansson S A. Effects of treatment on airway inflammation and thickening of basement membrane reticular collagen in asthma. Am Rev Respir Dis 1992;145:890-899. [ Links ]
51. Lundgren R, Söderberg M, Horstedt P, Stenling R. Morphological studies on bronchial mucosal biopsies from asthmatics before and after ten years treatment with inhaled steroids. Eur Respir J 1988;1:883-889. [ Links ]
52.Brewster CEP, Howarth PH, Djukanovic R, Wilson J, Holgate ST, Roche WR. Myofibroblasts and subepithelial fibrosis in bronchial asthma. Am J Respir Celi Mol Biol 1990;3:507-511. [ Links ]
53.McCarter JH, Vazquez JJ, Durtham NC. The bronchial basement membrane in asthma. Arch Path 1966;82:328-335. [ Links ]
54.Djukanovic R, Roche WR, Wilson JW, Beasley CR, Twenty-man O, Holgaste ST. The role of mucosal inflammation in asthma. Am Rev Respir 1990;142:434-457. [ Links ]
55.Dubinett SM, Huang M, Dhavani S, Kelly D, Lichtenstein A, Grody W, Mints L. In situ regulation of pulmonary macrophage regulation of TNF mRNA expression by IL2. Chest 1993;103 (Suppl):91-94. [ Links ]