Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta Médica de Caracas
versión impresa ISSN 0367-4762
Gac Méd Caracas. v.117 n.3 Caracas sep. 2009
Tuberculosis pleural. Utilidad de la reacción en cadena de la polimerasa en muestras de tejido
Dras. Patricia Sofía Rodríguez B*, Zulay Marcela Rivera P *, Liliana Suárez Blandenier**, María Fernanda Correa de H***, Ana Rabucha****, Claudia de Suárez****, Ayarit Villarroel Peniza de B*****
* Médicos internistas egresados del posgrado de Medicina Interna. Hospital General del Este Dr. Domingo Luciani. Caracas, Venezuela.
** Médico internista. Adjunto del Servicio de Medicina Interna. Hospital General del Este Dr. Domingo Luciani. Caracas, Venezuela.
*** Profesor Asociado. Instituto de Medicina Experimental Dr. José Gregorio Hernández, Universidad Central de Venezuela. Caracas, Venezuela.
**** Profesor Titular. Sección de Patología Cardiovascular. Instituto Anatomopatológico Dr. Antonio O'Daly. Universidad Central de Venezuela. Caracas, Venezuela.
***** Licenciada, Técnico de histopatología. Sección de Patología Cardiovascular. IAP-UCV. Caracas, Venezuela.
CORRESPONDENCIA Dra. Liliana Suárez B. Teléfonos: 58-02129853174-9866734 cel 04142319974
Financiamiento Este proyecto se realizó con recursos provenientes del Proyecto de Grupo Nº: 09-00-6803-2007 (PG) del Consejo de Desarrollo Científico y Humanístico de la UCV y con recursos del Proyecto G-2007001442 del FONACIT, Ministerio de Ciencia y Tecnología de la República Bolivariana de Venezuela.
Este trabajo forma parte de los resultados parciales de la tesis doctoral de la Dra. Liliana Suárez Blandenier y es producto del trabajo especial de investigación (TEI) para optar al título de Especialista en Medicina Interna de la UCV, de las doctoras: Patricia Sofía Rodríguez B y Zulay Marcela Rivera P.
RESUMEN
El diagnóstico etiológico del derrame pleural tuberculoso, es difícil. La clínica y los ensayos paraclínicos suelen ser inespecíficos. El objetivo de este trabajo fue evaluar la sensibilidad y especificidad de la reacción en cadena de la polimerasa en tejido pleural para el diagnóstico de tuberculosis en comparación con el cultivo e histopatología, en pacientes con derrame pleural que ingresaron al servicio de Medicina Interna del Hospital Dr. Domingo Luciani, Caracas, Venezuela, entre abril de 2005 y agosto de 2006. Se estudiaron 52 pacientes, M/F (30 (57,7 %)/22 (42,3 %), con una edad promedio de 39 años. El valor de sospecha clínica fue del 69,2 %. El cultivo resultó positivo en 6 casos (11,5 %) y se identificaron lesiones granulomatosas tuberculoides en 40,4 %. La reacción en cadena de la polimerasa mostró una sensibilidad del 50 % y especificidad del 61 %. Se concluyó que es una prueba eficaz para el diagnóstico de tuberculosis pleural.
Palabras clave: Mycobacterium tuberculosis. Tuberculosis pleural. Reacción en cadena de la polimerasa. Biopsia pleural. Derrame pleural.
SUMMARY
The diagnosis of tuberculous pleural effusion is difficult. The clinical trials and paraclinical essays are often nonspecific. The aim of this study was to evaluate the sensitivity and specificity of the polymerase chain reaction in pleural tissue for the diagnosis of tuberculosis in comparison with the culture and histopathological studies in patients with pleural effusion admited to the service of Internal Medicine Hospital Dr. Domingo Luciani, Caracas, Venezuela, between April 2005 and August 2006. We studied 52 patients, M / F (30 (57.7 %) / 22 (42.3 %), with an average age of 39 years. The value of clinical suspicion was 69.2%. The culture was positive in 6 cases (11.5 %) and tuberculoides granulomatous lesions were identified in 40.4 %. Polymerase chain reaction showed a sensitivity of 50 % and specificity of 61 %. It was concluded that it is an effective test for the diagnosis of pleural tuberculosis.
Key words: Mycobacterium tuberculosis. Pleural tuberculosis. Polymerase chain reaction. Pleural biopsy. Spillage pleural.
INTRODUCCIÓN
La tuberculosis es un problema de salud a nivel mundial, en especial en países en desarrollo. Para el 2006, a nivel mundial, se reportaron 9,2 millones de casos nuevos y 1,7 millones de muertes debido a esta enfermedad, de los cuales 0,7 millones de casos y 0,2 millones de muertes fueron en personas con el virus de inmunodeficiencia humana (VIH). En Venezuela, de acuerdo a la Organización Mundial de la Salud, la tasa de incidencia de tuberculosis encontrada para el año 2006 fue de 41 por cada 100 000 habitantes (1). Según esta institución la tasa de incidencia notificada para 2006 fue de 25 (2). Con los datos de mortalidad publicados en los Anuarios de Epidemiología y Estadística Vital, del Ministerio de Sanidad y Asistencia Social, hasta 1995 y en los Anuarios de Mortalidad, publicados por el Ministerio de Salud y Desarrollo Social desde 1996, en el quinquenio 1999-2003, la tasa promedio de mortalidad por todas las formas de tuberculosis, por cien mil habitantes, fue de 2,8 para todo el país, oscilando entre tasas de 4 y 5,7 (Distrito Capital, Vargas, Delta Amacuro, Portuguesa, Monagas y Amazonas) en el extremo superior y tasas entre 1,9 y 0,6 (Anzoátegui, Aragua, Carabobo, Mérida, Falcón y Nueva Esparta) en el extremo inferior. Cuando se distribuyen porcentualmente la mortalidad por TBC pulmonar y extrapulmonar, en los años 1950 y 2005, se observa que en ambos años la forma pulmonar es la predominante. Sin embargo, en el último año con los datos disponibles, la extrapulmonar ha pasado a ser el doble de la misma forma registrada en 1950 (3).
En el año 2006, en el Hospital General del Este Dr. Domingo Luciani, la tuberculosis fue la tercera causa más importante de enfermedad infecciosa, después de las infecciones respiratorias y el síndrome diarreico. Entre los años 2000 y 2006, se reportaron 432 nuevos casos de tuberculosis en pacientes hospitalizados (4).
El derrame pleural tuberculoso, constituye aproximadamente el 5 % del total de las presentaciones clínicas de la enfermedad y se clasifica como extrapulmonar, a pesar de la íntima relación existente entre una pleuritis aguda granulomatosa secundaria y una infección reciente de tuberculosis pulmonar, en personas que no tienen cambios radiológicos sugestivos de enfermedad parenquimatosa. Adicionalmente, se ha demostrado que el derrame pleural puede ocurrir en pacientes con reactivación de infecciones antiguas con compromiso pulmonar asociado (5). Actualmente se piensa que el desarrollo de la enfermedad se debe a la tuberculización de la pleura y no simplemente a una reacción inflamatoria de la misma, frente a las proteínas del bacilo. Sin embargo, la abundancia del derrame y la agudeza con que puede instalarse, hacen pensar que participa la hiperreactividad del huésped (6). En los pacientes ancianos usualmente resulta como la consecuencia de la reactivación de un foco subpleural antiguo que estaba latente o de una diseminación hematógena (7).
La pleuritis por tuberculosis representa un reto para el médico. Los dos principales problemas a enfrentar son inicialmente, establecer un diagnóstico definitivo precoz y posteriormente predecir el curso de la enfermedad, además de la probable respuesta al tratamiento (8).
El objetivo de este trabajo es demostrar la utilidad (sensibilidad y especificidad) de la amplificación de la secuencia IS6110 presente en el genoma de M tuberculosis (MT) por la reacción en cadena de la polimerasa (PCR) en tejido obtenido de muestras de biopsias de pleura en pacientes con derrame pleural, para el diagnóstico de tuberculosis. Igualmente relacionar la PCR en tejido pleural con el cultivo, la histopatologia y la sospecha clínica.
SUJETOS, MATERIALES Y MÉTODOS
El estudio es de tipo comparativo y de diseño transeccional, de campo, no experimental, de 16 meses de duración.
Pacientes Se analizaron muestras de pleura parietal de 52 pacientes de todas las edades y género, con derrame pleural, hospitalizados en el servicio de Medicina Interna del Hospital General del Este Domingo Luciani en el período comprendido entre abril del 2005 y agosto del 2006.
Se les practicó una biopsia pleural a aquellos pacientes con diagnóstico etiológico dudoso de tuberculosis pleural.
Criterios de inclusión
Se incluyeron todos los pacientes de cualquier edad y género, quienes presentaban derrame pleural (exudado linfocítico) sin diagnóstico etiológico y quienes de acuerdo a juicio clínico determinado por especialistas del servicio y neumonólogos, tenían indicación de biopsia pleural.
Procedimientos
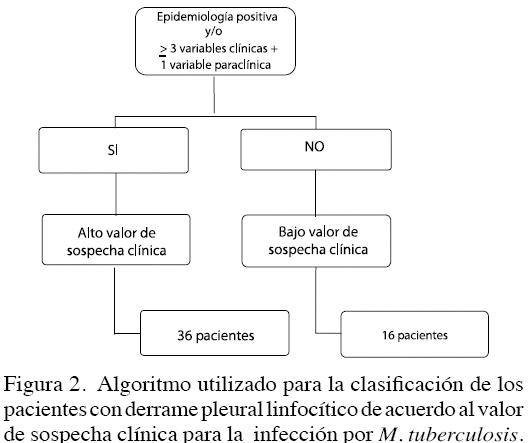
Se elaboró la historia médica completa y se realizó análisis de las radiografías del tórax; evaluación de los exámenes de laboratorio y se consignaron los datos predeterminados en el protocolo diseñado para estimar el valor de sospecha de diagnóstico de tuberculosis pleural en la población estudiada. Este protocolo se definió como de alto valor de sospecha clínica a los pacientes que presentaron los siguientes parámetros: antecedente epidemiológico definido por el contacto con enfermos con tuberculosis; más de 3 criterios clínicos, como el dolor pleurítico, tos, disnea, fiebre, pérdida de peso y sudoración nocturna así como un hallazgo paraclínico positivo como: velocidad de sedimentación globular elevada (30 mm) o trombocitosis (plaquetas > de 450 000 mm3). Los pacientes que no cumplieron con estos criterios, se clasificaron como de bajo valor de sospecha clínica.
Se realizó la biopsia transparietal de pleura a los pacientes que presentaban criterios de inclusión. Las muestras de tejido pleural fueron distribuidas de la siguiente forma: 1. En un tubo seco (medio de transporte seco) para realizar la PCR. 2. En un medio de transporte especial para cultivo. 3. En un frasco con una solución fijadora de formol al 10 % para el estudio histológico al microscopio de luz (óptico).
1. Se conservaron las muestras de las biopsias en medio seco a una temperatura de –70º C, las cuales posteriormente se enviaron a la Sección de Biología Molecular de Agentes Infecciosos del Instituto de Medicina Experimental de la Universidad Central de Venezuela para realizar PCR a cada una de ellas.
2. Se enviaron las muestras en medio de transporte para cultivo al laboratorio de Bacteriología del Instituto Nacional de Higiene Rafael Rángel y al Laboratorio Clínico de Referencia Dr. Pablo Ordaz.
3. Las muestras de la biopsia pleural fijadas con formol al 10 % se enviaron a la Sección de Patología Cardiovascular del Instituto Anatomopatológico Dr. José Antonio O`Daly (IAP) de la Universidad Central de Venezuela para su procesamiento, observación y diagnostico histopatológico.
Material: cultivo del material biópsico
Se realizó cultivo de muestras en el medio de Löwestein Jensen en el laboratorio Clínico de Referencia Dr. Pablo Ordaz e Instituto Nacional de Higiene Rafael Rangel, incubándose por 8 semanas.
Estudio histopatológico de la biopsia pleural
Las muestras o fragmentos de pleura obtenidos en la biopsia, fueron fijados en solución de formalina al 10 %. Después de su descripción macroscòpica y fotografía, fueron incluidos en parafina previa deshidratación y seguidamente seccionados con microtomo. Las secciones de 4 a 7 micras de grosor, fueron desparafinadas y coloreadas con coloraciones de rutina (hematoxilina-eosina) y coloraciones específicas (Ziehl-Neelsen (Z-N) y Auramina-Rodamina) para la identificación de bacilos ácido-alcohol resistentes.
Método de amplificación de secuencia de inserción IS6110
Se realizó la amplificación de secuencia de inserción IS6110 presente en las micobacterias a partir del ácido desoxirribonucleico (ADN) aislado de las muestras de tejido pleural en la Sección de Biología Molecular de Agentes Infecciosos del Instituto de Medicina Experimental de la Universidad Central de Venezuela. Aislamiento del ADN de las muestras de tejido Para el aislamiento de ADN de las muestras de tejido se procedió de la siguiente manera:
Las muestras de tejido (1 a 3 fragmentos) aproximadamente 2 a 3 mg fueron finamente cortados con bisturí estéril sobre una placa de Petri, en el gabinete de seguridad biológica. Los tejidos en un tubo de 1,5 mL fueron incubados con 200 mL de solución amortiguador TE 1X más 40 mL de solución stock de proteinasa K (10 mg/mL) durante 12 horas o más hasta la lisis total del tejido. El tejido digerido fue calentado por 20 minutos a 100º C para inactivar la proteinasa K y luego se dejo enfriar a temperatura ambiente. Se agregó 10 mL de lisozima (10 mg/m L) y luego se incubó al menos 1 hora a 37º C.
El tejido digerido (fase acuosa) se extrajo (2 veces) con un volumen igual de una solución de fenol/ cloroformo/alcohol isoamílico (24: 23:1), mediante agitación seguido de centrifugación a 12 000 x g por 1 minuto. La fase acuosa fue ajustada a 0,3 M con solución de acetato de sodio y se precipitaron los ácidos nucleicos al agregarles 0,7 volúmenes de alcohol isopropanol a –20 ºC por 1 hora. Una vez transcurrido este tiempo se centrifugó a 12 000 x g por 10 minutos y el sedimento (ácidos nucleicos) se lavó con etanol al 70 %. El sedimento de ADN se dejó secar a temperatura ambiente y se resuspendió en 50 ml de agua libre de ADNasa/ARNasa hasta su uso (9).
Reacción en cadena de la polimerasa La PCR se basó en la amplificación de la secuencia de inserción IS6110, que está repetida en múltiples oportunidades (1-25 veces) a lo largo del genoma del complejo Mycobacterium tuberculosis (M. tuberculosis, M. bovis, M. africanum y M. microti). Los productos de PCR fueron detectados por la electroforesis del gel de agarosa (10).
La reacción de amplificación se realizó bajo las siguientes condiciones: Amortiguador 20 mM Tris HCl (pH 8.4), 50 mM KCl, desoxirribonucleótido difosfatados 0,2 mM de dATP, dCTP, dTTP, y dGTP, cebadores INS1 (pt8F) 5´-GTGCGGATGGTCGCAGAGAT-3 y INS2 5´GCGTAGGCGTCGGTGACAAA-´3 0,2 mM cada uno, Taq ADN polimerasa platinum 2,5 U, 3 mM de MgCl2 (3 mL) y por último 5 mL del ADN aislado; para un total de 50 mL por cada vial a procesar (11).
La reacción en cadena de la polimerasa se llevó a cabo sometiendo las muestras a tres temperaturas diferentes que correspondieron a las etapas de desnaturalización, hibridación y extensión (polimerización) por cada ciclo de amplificación.
La desnaturalización se logró sometiendo a la muestra a una temperatura de 95º C por un minuto. Separándose la doble hélice del ADN y uniéndose los oligonucleótidos iniciadores a los sitios con secuencia complementarias al descender las muestras a una temperatura de 65º C, alineándose los iniciadores con la secuencia complementaria correspondiente. Una vez efectuada la alineación de los iniciadores por complementariedad de bases, a partir de los mismos se inició la extensión enzimática de cada hebra complementaria catalizada por la enzima polimerasa taq ADN (aislada de la bacteria Thermus aquaticus) al elevar la temperatura a 72º C, temperatura óptima de la enzima. Los ciclos de temperatura se realizaron en un termociclador automático, con un programa de 40 ciclos, con un tiempo de 1 minuto por cada fase del ciclo. A estos ciclos se agregó un ciclo inicial de 5 minutos a 95º C y uno final de 10 minutos a 72º C. Los productos amplificados se separaron electroforéticamente y fueron visualizados como una sola banda de 245 pb en un gel de agarosa al 1,5 % teñido con bromuro de etidio. Los productos amplificados se reamplificaron (PCR anidado) utilizando las mismas condiciones y cebadores, con la finalidad de disminuir la concentración de inhibidores presentes en la muestra de ADN aislado y para aumentar su concentración de los productos de PCR a detectar, por tratarse de muestras paucibacilares; luego se separaron electroforéticamente y fueron visualizados como una sola banda de 245 pb en un gel de agarosa al 1,5 % teñido con bromuro de etidio (12).
Análisis estadístico: con los resultados del cultivo, la histopatología y la biopsia pleural, como patrón oro, se calcularon la sensibilidad y especificidad de la PCR, así como sus límites de confianza del 95 % de variación. Se calculó el Chi2 de McNemar, ajustado por Yates, para estimar la probabilidad asociada a las diferencias encontradas, así como también el coeficiente Kappa de Cohén para evaluar la concordancia. Lo mismo se hizo con el cruce de los resultados de la histopatología con los del cultivo, como patrón oro. Finalmente se utilizó el Chi2 de Pearson para el análisis de la relación del valor de sospecha clínica con la PCR. El nivel de significancia adoptado fue el del 0,05.
RESULTADOS
De los 52 pacientes estudiados, 30 fueron hombres (69,0 %) y 22 mujeres (42,3 %), con una edad promedio de 38,8 ± 20,6 años. El mayor número de pacientes incluidos en este estudio proceden de la localidad de Petare, municipio Sucre del Distrito Federal. En efecto, el 74 % de los pacientes procedían de Petare, el 13 % de otros municipios del Distrito Federal y el 13 % restante de diferentes estados del país. La proporción de pacientes que manifestaron contacto cercano con tuberculosis y los hallazgos clínicos más relevantes están consignados en el Cuadro 1.
Distribución geográfica de pacientes con derrame pleural
| Sintomas | N=52 | % |
| Tos | 46 | 88,46 |
| Disnea | 45 | 86,54 |
| Pérdida de peso | 41 | 78,85 |
| Dolor pleurítico | 40 | 76,92 |
| Fiebre | 40 | 76,92 |
| Sudoración nocturna | 15 | 28,85 |
Los parámetros de laboratorio incluidos en el estudio fueron: la elevación de la velocidad de la sedimentación globular en valores mayores de 30 mm/hora, (n = 27 /51,9 %) y elevación del número de plaquetas mayor a 450 000/mm3 (n = 22 /42,3 %). En las radiografías de tórax, todos los pacientes presentaban derrame pleural unilateral sin evidencia de compromiso pulmonar subyacente. Figura 1. Los pacientes se clasificaron en de alto valor (n = 36) y de bajo valor de sospecha clínica (n = 16). Figura 2.
Cultivo. Utilizando como estándar el medio de cultivo Löwestein-Jensen, se sembraron todas las muestras de tejido pleural. Del total de las muestras sembradas resultaron positivas 6 (11,5 %).
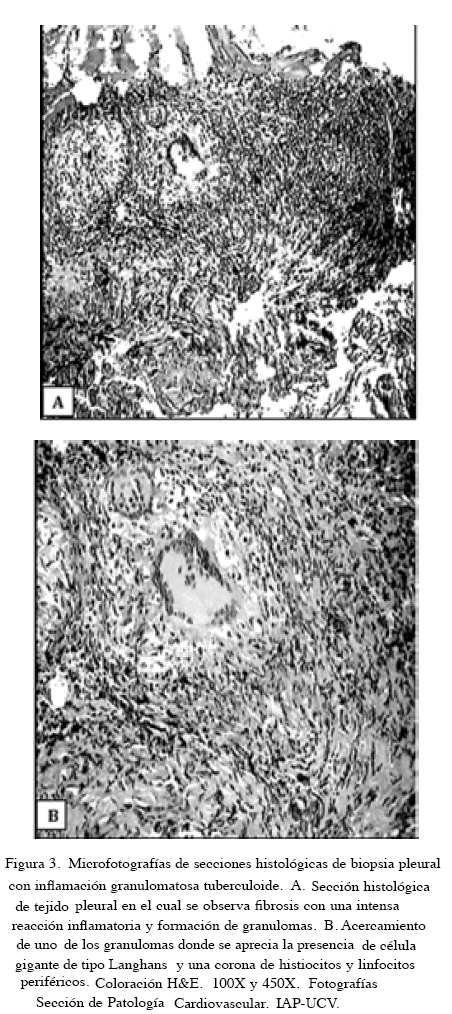
Biopsias pleurales. En 21 biopsias pleurales (40,3 %) se identificaron lesiones inflamatorias crónicas granulomatosas, algunas de ellas con necrosis con o sin presencia de células gigantes de tipo Langhans o de cuerpo extraño. Figura 3.
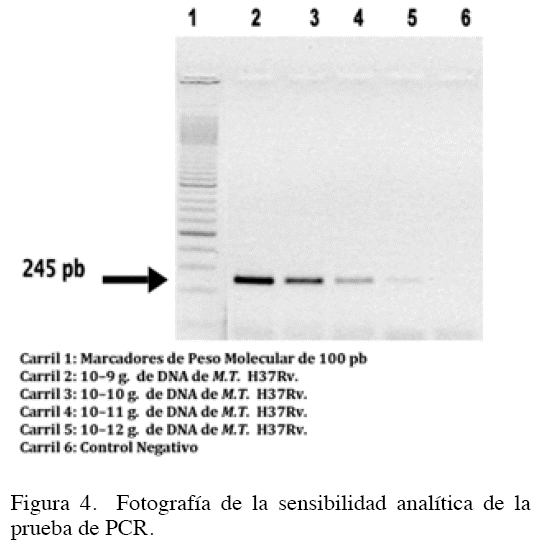
Reacción en cadena de la polimerasa. En la sensibilidad analítica de la prueba, se puede detectar el equivalente genómico de 10-12 g de ADN de la cepa H 37 Rv, que corresponde a 1-10 micobacterias. El registro fotográfico de los productos de PCR obtenidos a partir de concentraciones decrecientes (10-9 a 10-12 g) de ADN aislado de la cepa M. tuberculosis H 37 Rv se observa en la Figura 4. El carril 6 corresponde a una escalera del 100 pb del marcador de peso molecular.
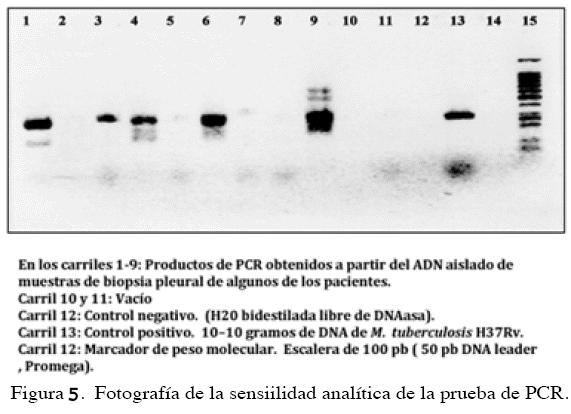
Se logró amplificar el blanco buscado en 23 de las 52 biopsias (44,2%), observándose mediante electroforesis un producto de PCR de 245 pb que corresponde al tamaño esperado utilizando el juego de cebadores, que va desde el nucleótido al de la secuencias IS6110 conocidas. La Figura 5 muestra el resultado de la amplificación obtenida de algunos de los pacientes. En unos casos se logró detectar una banda de mayor intensidad que la obtenida con el control positivo, lo cual sugiere una alta concentración de micobacterias en las muestra analizadas de al menos 10-100 bacterias.
La amplificación del blanco IS6610 típico del complejo Mycobacterium tuberculosis (MT) se obtuvo en 5 (83,3 %) de 6 tejidos que resultaron cultivo positivo. Tomando en cuenta al cultivo como estándar de oro para el diagnóstico de tuberculosis pleural, la sensibilidad y especificidad del PCR fue 83,3 % y 60,9 % respectivamente. (Cuadro 2). Además se presentan los límites de confianza con un 95 % de variación de estos valores. Se presentan también en el Cuadro 2 los resultados del Chi2 de McNemar, con sus correspondientes valores P, así como la concordancia expresada con el estadístico Kappa de Cohen.
Relación del culivo con hallazgos histopaológicos
| Cultivo | Histopatología | TBC pleural | ||||
| PCR | Positivo | Negativo | Positivo | Negativo | Positivo | Negativo |
| Positivo | 5 | 18 | 11 | 12 | 12 | 11 |
| Negativo | 1 | 28 | 10 | 19 | 12 | 17 |
| Sen/Esp* | 83,3 | 60,9 | 52,4 | 61,3 | 50 | 60,7 |
| LC 95 % | 35,9-99,6 | 45,4-74,9 | 29,8-74,3 | 42,2-78,2 | 29,1-70,9 | 40,6-78,5 |
| McNemar/ | 13,5 | K= 0,2 | 0,045 | K= 0,14 | 0,043 | K= 0,12 |
| Kappa | (P< 0,01) |
| (P> 0,05) |
| (P> 0,05) |
|
(*) Sen= sensibilidad/Esp= especificidad.
Se realizó el diagnóstico de MT por PCR en 11 de 21 muestras que mostraron lesiones granulomatosas histológicamente compatibles con tuberculosis (52,4 %) y en 12 pacientes donde las biopsias mostraron lesiones inflamatorias crónicas inespecíficas (38,7 %). La especificidad fue de 61,3 %.
De los 52 pacientes con derrame pleural a quienes se les practicó biopsia y cultivo, se diagnosticaron 24 pacientes con tuberculosis pleural con base en la presencia de hallazgos histopatológicos compatibles con lesiones inflamatorias crónicas granulomatosas y/o cultivo positivo de tejido pleural. La sensibilidad y especificidad de la PCR fueron 50 % y 60,7 % respectivamente.
Al comparar los hallazgos histopatológicos con el cultivo pleural como patrón oro se obtuvo una sensibilidad de 67 % y una especificidad de 58,6 % (Cuadro 3).
Relación del cultivo con hallazgos histopatológicos
| Histopatología | Cultivo | |
| Positivo | Negativo | |
| Positivo | 4 | 17 |
| Negativo | 2 | 29 |
| Sen/Esp* | 66,7 | 58,6 |
| McNemar/Kappa | 10,3 (P<0,01) | K= 0,14 |
De los 36 pacientes con valor de sospecha clínica alta resultaron 15 positivos a la PCR (41,7 %) y de los 16 con valor de sospecha clínica bajo, resultaron 9 positivas a la PCR (56,3 %). Sin embargo, la prueba de Chi2 para muestras independientes no alcanzó significancia estadística (Cuadro 4).
Relación del valor de sospecha clínica con la PCR
| PCR | ||||
| Valor de sospecha clínica | Positivo | Negativo | Total | % PCR positivos |
| Alto | 15 | 21 | 36 | 41,7 |
| Bajo | 9 | 7 | 16 | 56,3 |
Chi2= 0,96 P> 0,05 K= 0,13
DISCUSIÓN
El diagnóstico diferencial del derrame pleural del tipo exudado linfocítico presenta dificultades especialmente en relación a su origen neoplásico y al de origen infeccioso. En este último destaca el derrame pleural producido por el M tuberculosis, sin embargo deben ser diferenciadas de otros agentes infecciosos como la histoplasmosis, nocardia y otras micobacterias que también producen lesiones granulomatosas. Estas enfermedades deben ser identificadas de forma precoz, permitiendo un tratamiento específico oportuno, para reducir la morbimortalidad del paciente (13).
Es por ello, que han surgido nuevas técnicas diagnósticas, que tratan de disminuir las dificultades en lo relativo a rapidez, sensibilidad y especificidad de los métodos usados de rutina. Para la inclusión y uso de dichas pruebas en los flujogramas de diagnóstico se requiere disponer de información sobre su capacidad diagnóstica y discriminativa mediante su validación clínica al compararla con las técnicas tradicionales. Además se requiere conocer los costos de su aplicación sobre todo en países con bajos recursos económicos.
En este trabajo se evaluó la posibilidad de usar un método diagnóstico de tuberculosis pleural basado en la detección de secuencias nucleotídicas de M tuberculosis en muestras de tejido pleural obtenidas por biopsia transtorácica realizada a aquellos pacientes que ingresaron al Servicio de Medicina Interna con derrame pleural de tipo exudativo. El procedimiento invasivo se realizó para lograr el diagnóstico etiológico una vez que otros estudios (citoquímico, citomofológico y bacteriológico) realizados al líquido pleural, fueron no concluyentes.
La evaluación médica de los pacientes que ingresaron al estudio permitió su clasificación en grupos de alto o bajo valor de sospecha clínica de tuberculosis pleural, en base a datos epidemiológicos, clínicos y paraclínicos. Los pacientes con alto valor de sospecha clínica tenían: un contacto cercano con un caso de tuberculosis (epidemiología positiva) y/o la presencia de tres o más variables clínicas sugestivas de pleuritis tuberculosa, tales como: tos, disnea, pérdida de peso, dolor pleurítico, fiebre y sudoración nocturna. Además, la presencia de uno de los siguientes criterios paraclínicos: elevación de la velocidad de la sedimentación globular (> a 30 mm/ hora y/o trombocitosis reactiva (contaje plaquetario > a 450 000/mL).
En nuestro estudio, los síntomas más frecuentes encontrados en los pacientes se corresponden con los hallazgos encontrados en los estudios de Loeza y col. (14) y Garrido y Fuentes (10).
En cuanto a los parámetros de laboratorio encontramos el aumento de la velocidad de sedimentación globular en un 51,9 % de los casos y trombocitosis reactiva en un 42,3 %. Ambos criterios fueron usados con propósito de orientación y seguimiento del paciente (15). La sospecha clínica sigue siendo el pilar fundamental para la orientación diagnóstica, sobre todo en nuestro país donde la prevalencia de tuberculosis es alta y no disponemos en los centros asistenciales de todas las herramientas diagnósticas requeridas. De acuerdo a los datos epidemiológicos, clínicos y paraclínicos se obtuvo que 36 pacientes presentaron un alto valor de sospecha clínica.
En presencia de pacientes con derrame pleural exudativo linfocítico, sin diagnóstico etiológico establecido, el clínico decide practicar la biopsia pleural para realizar pruebas confirmatoria o excluyentes de tuberculosis pleural. Una vez obtenida por punción transtorácica dos o tres fragmentos de pleura parietal, estos deben ser cultivados en la búsqueda de los microorganismo causantes de la patología y sometida al estudio histopatológico que pudiese mostrar la presencia de lesiones inflamatorias asociadas a procesos infecciosos o neoproliferativos. Al procesar las muestras, sólo el 11,5 % (6 de 52) de los tejidos resultaron positivos en el cultivo. En nuestro trabajo, la recuperación de M. tuberculosis a partir de muestras de tejido pleural fue muy baja, si la comparamos con otros estudios realizados por otros autores, como el de Berger y Mejías (1973) quienes obtuvieron cultivos positivos de la biopsia en un 80 % de los pacientes con la enfermedad (16). Parte de la posibles causas del bajo aislamiento bacilar, puede deberse a las dificultades inherentes al crecimiento de la M. tuberculosis en los medios de cultivo artificiales, ya que estos son poco sensibles y sólo son capaces de detectar micobacterias en muestras que contengan entre 50 a 1 000 bacilos por mm3 (17).
Otro factor limitante, es el medio de cultivo empleado, como ha sido demostrado por Badak y col., donde aislaron de 178 muestras clínicas, 93 % de MT con el cultivo en medio de BACTEC TB-460, comparado con un 83 % en el medio de Löwestein- Jensen (18). De manera similar en el estudio realizado por Hasaneen y colaboradores se aisló el bacilo en tejido pleural en 26 pacientes (84,6 %) con Löwestein- Jensen comparado con BACTEC 12B, que lo supera con un 92,3 % (19). Otro aspecto a favor del uso de BACTEC 12B como medio de cultivo en estos estudios, resultó ser el corto tiempo de detección: 9,9 días en el primer trabajo y 13 días en el segundo estudio, siendo el mayor inconveniente, el costo de los equipos requeridos.
En nuestro estudio, se utilizó el cultivo en el medio sólido de Löwestein-Jensen que no es el más sensible para la detección del M tuberculosis, pero sí el más económico, y por ende, realizable en los laboratorios de bacteriología nacionales. Nuestros resultados de cultivo señalan la posibilidad de dificultades en nuestras capacidades de diagnóstico bacteriológico de tuberculosis a partir de muestras de tejido, que ameritan la revisión de la metodología utilizada aun en los centros de referencia, donde fueron cultivados estos tejidos. Además, nos obliga a revisar los protocolos para la toma, envío y traslado de muestras a ser procesadas para cultivo, donde también eventualmente podría darse la pérdida de la viabilidad de las escasas micobacterias presentes en la muestra de biopsia pleural.
Al asociar la relación existente entre los pacientes con aislamiento bacteriológico de micobacteria a través del cultivo y la aplicación de la PCR para la secuencia IS 6110 obtuvimos una amplificación positiva en el 83,3 % de los pacientes con cultivo positivo. También esta prueba resultó positiva en 18 casos donde no logramos obtener un cultivo positivo del agente infeccioso y en 28 casos ambas pruebas resultaron negativas. La prueba de PCR presentó una sensibilidad de 83 y una especificidad 61 al ser comparada con el cultivo como estándar oro. Se demostró estadísticamente que la PCR resultó ser más efectiva que el cultivo, como prueba diagnóstica. El grado de asociación o concordancia estadística no fue significativo, lo cual se corresponde con los estudios antes citados de Hasaneen y col. (2003) (19).
La posibilidad de resultados falsos positivos es uno de los problemas más serios en la realización de estas pruebas moleculares. Estas dificultades pueden ser minorizadas y controladas mediante la incorporación de controles negativos al realizar la PCR, al uso de guantes, al empleo de puntas de pipetas con filtro o especiales como las de desplazamiento positivo, y a la creación de ambientes separados para el procesamiento de las muestras. Otros elementos que pueden causar falsos positivos son los inherentes al aislamiento del ADN, la realización de la prueba de PCR en sí, y a la detección de ampliaciones. Además se requieren tres espacios físicos separados, donde se ubican los equipos e insumos para cada paso, así como un adecuado flujograma, desde que las muestras son recibidas hasta cuando se obtienen los resultados. En nuestro estudio, los falsos negativos de la PCR se pueden deber a la escasa presencia de bacilos en el tejido pleural y a la de inhibidores detectados en el propio tejido. Chen y col. concluyen en su estudio que los inhibidores estaban presentes con más frecuencia en los tejidos extrapulmonares que en el pulmón y que la eficacia del método es dependiente a la concentración de microorganismo en tejido (24). La reacción en cadena de la polimerasa en tejido demostró en nuestro estudio valores mayores de sensibilidad que los reportados por Moon y col. en el líquido pleural (17,5 %) (25).
También se realizó biopsia, en la búsqueda de lesiones granulomatosas o la detección de bacilos ácido alcohol resistentes mediante las coloraciones de ZN y auramina rodamina. En ninguno de los casos se logró visualizar el bacilo, lo cual no concuerda con otros estudios realizados (20). En general, debido a la escasa cantidad de bacilos presentes en los tejidos, la sensibilidad de los métodos mencionados, es baja. Adicionalmente, existen las dificultades en ejecutar los protocolos establecidos. La presencia de lesiones granulomatosas se demostró en el 40,3.%. El tiempo de reporte de dicho resultado fue más rápido que el cultivo y fue útil en la aproximación diagnóstica de tuberculosis pleural, favoreciendo el inicio del tratamiento. Al comparar los resultados de histopatología y el cultivo, ésta mostró valores de sensibilidad de 67 % y de un 58,6 % de especificidad, similar al estudio realizado por Valdés y col. (21) y Zablockis y col., cuya sensibilidad para la anatomía patológica fue de 65 % (22).
Fuentes y Garrido en el Complejo Hospitalario Dr. José Ignacio Baldó, El Algodonal, diagnosticaron tuberculosis pleural en un 87 % de los casos reportados desde 1996 hasta 1999 con la presencia de granulomas en la biopsia pleural y sólo en un 4 % a través de pruebas bacteriológicas, lo cual corrobora la importancia de la toma de muestras de tejidos y su estudio histopatológico. Durante la toma de la biopsia en nuestro estudio no se presentaron complicaciones relacionadas con la técnica, a diferencia del estudio anterior donde se complicaron 3,7 % de los pacientes con neumotórax o reacción vasovagal (10).
La biopsia pleural no debe ser considerada como prueba de diagnóstico definitivo o estándar de oro, debido a que otras patologías se pueden manifestar también como una reacción granulomatosa. Sin embargo, se ha ido institucionalizando su uso en nuestro sistema de salud por carecer de otras herramientas diagnósticas específicas que confirmen el diagnóstico etiológico o descarten otras enfermedades (23).
Comparando la PCR como método diagnóstico con la histopatología, demostramos estadísticamente que tienen igual eficacia y una concordancia que no fue significativa. La ventaja que tiene la PCR es la rapidez diagnóstica, acortándose el tiempo de espera de 10 días aproximadamente a 3 días en laboratorios especializados. Por otra parte, el resultado positivo indica la presencia del genoma del agente causal, lo que confirma su presencia en el tejido (12).
Sin embargo, en la actualidad, las técnicas de anatomía patológica son más accesibles, por estar disponibles en la mayoría de los centros hospitalarios de nuestro país y tener un costo menor. En centros privados este examen tiene un valor aproximado de 150 BsF (150 000 Bs). El costo estimado de una prueba de PCR incluyendo insumos colocados en el país por los distribuidores nacionales de los mismos, personal calculado en horas/hombre y depreciación de los equipos requeridos en 7 años, tiene un valor de 250 Bs.F. (250 000,00 Bs.). Otra de las dificultades de instalar la capacidad de diagnóstico molecular en nuestros hospitales, es que para la misma se requiere de personal entrenado y dedicado a la realización de estas pruebas.
Al tomar en cuenta las variables epidemiológicas, clínicas y paraclínicas encontramos que 36 de 52 pacientes presentaron alto valor de sospecha clínica. Del total de pacientes que tenían un alto valor de sospecha clínica (36) la PCR sugirió al MT como causal de la tuberculosis pleural en el 41,7 %, e insuficiente o no confirmatoria la prueba de PCR en el 58,3 % de los casos. De estos últimos, sólo el 33,3 % se clasificaron como casos de tuberculosis en base al pretest y biopsia positiva. De los pacientes que presentaron alto valor de sospecha clínica, podemos decir que verdaderamente sólo 16,6 % tenían tuberculosis pleural, tomando en cuenta el cultivo positivo, de los cuales 5 fueron PCR positivo y 4 con histología positiva. El porcentaje de positivos a la PCR fue mayor en relación con la sospecha clínica baja (56,3 %) pero la diferencia no alcanza significancia estadística.
Un alto porcentaje (69 % del total de casos) de los pacientes incluidos en ese estudio fueron clasificados con un elevado valor de sospecha clínica debido a los cambios en la percepción de los médicos tratantes sobre el problema nacional de la tuberculosis, incluyendo siempre a esta enfermedad dentro sus posibilidades.
Debemos considerar al sesgo presente como consecuencia de que la mayoría de estos pacientes referidos o que acuden a este centro de salud provienen de una misma área geográfica con altos valores de prevalencia de tuberculosis, correspondientes a varios sectores de Petare (73 %), ubicado en el Municipio Sucre de la Gran Caracas. Además, el Hospital General del Este ha asumido cierta responsabilidad en canalizar los casos de tuberculosis de su área de afluencia (poblaciones de la zona Este del estado Miranda como: los habitantes de Guarenas, Guatire, Higuerote, Rio Chico y Barlovento) localidades que en los últimos años ha aumentado su densidad poblacional por ser áreas de expansión de la capital.
En ese sentido, la tuberculosis es la tercera causa de hospitalización de origen infeccioso en nuestro centro y en la mayoría de los casos es debido a una evolución tórpida de la enfermedad (pacientes con tuberculosis avanzada o complicada con otras patologías) o por la necesidad de una confirmación diagnóstica, variando la estancia hospitalaria entre 4 semanas hasta 6 meses de acuerdo al progreso de cada caso.
Este hecho sugiere que la realización de las pruebas moleculares deberían estar incluidas dentro del algoritmo diagnóstico de pacientes con derrame pleural de tipo exudativo linfocítico, sólo cuando se decide realizar la biopsia de pleura con la finalidad de hacer el estudio bacteriológico y anatomopatológico del mismo. Dentro de las ventajas de realizar la PCR, se incluyen acortar a dos o tres días los tiempos de espera requeridos para que un cultivo resulte positivo (4-8 semanas) y/o para confirmar que las lesiones granulomatosas observadas en el tejido biopsiado, son producidas por una infección tuberculosa. Esto permitirá reducir los costos de hospitalización requeridos y los efectos secundarios indeseables producto de pruebas terapéuticas antituberculosas innecesarias.
Considerando como pacientes verdaderamente tuberculosos a aquellos que tenían cultivo y/o biopsia positiva, la sensibilidad y especificidad del método fue de 50 y 61 respectivamente comparativamente menor a las obtenidas con el cultivo como estándar de oro y como en el estudio de Hasaneen y col. (19) donde la sensibilidad y especificidad fue de 90 % y 100 % respectivamente. Esta discrepancia en los resultados pudo deberse a diferencias del método en el momento de la toma de la muestra, donde éstos autores realizaron 4 ó 5 punciones pleurales, mientras que en nuestro caso realizamos hasta 3 punciones, limitando el volumen de la muestra. Además debemos considerar que en nuestro estudio, la muestra en fresco se fragmentó en tres secciones destinadas a distintos laboratorios para luego ser procesadas, mientras que en el estudio antes mencionado, las muestras se fragmentaron en dos, de las cuales, una, fue homogenizada para ser distribuida en proporciones iguales, garantizando una repartición alicuotada de los bacilos en las muestras. Las dificultades que se nos presentan para la homogenización de las muestras son la necesidad de obtener más fragmentos de tejidos y realizar más punciones.
Sin pretender realizar un adecuado análisis de costo-beneficio debido a la escasa información sobre los costos reales de hospitalización en los servicios de salud pública, asumiendo como promedio de estancia hospitalaria de un paciente con diagnóstico presuntivo de tuberculosis pleural de 2 meses, incluyendo pago de personal calificado: médicos residentes, especialistas en medicina interna y neumonología, médicos radiólogos, enfermeras, bioanalistas y técnicos radiólogos, costos de insumos hospitalarios y de exámenes para el diagnóstico diferencial y monitoreo de procedimientos estimamos un valor de 115 000 BsF (115 000 000,00 Bs.) de hospitalización, lo cual refleja la posibilidad de incluir dentro del flujograma diagnóstico pruebas basadas en amplificación de ADN, las cuales de ser aplicadas podrían disminuir el tiempo de diagnóstico y a la vez los tiempos de hospitalización a semanas en lugar de meses.
CONCLUSIONES
De acuerdo a los resultados obtenidos en este trabajo, concluimos que la amplificación de la secuencia IS6110, del complejo Mycobacterium tuberculosis en muestras de tejidos, con la reacción en cadena de la polimerasa, es una prueba con una sensibilidad aceptable, específica y de ayuda para el diagnóstico de tuberculosis pleural. La inclusión de la amplificación, de la secuencia IS6110 presente en micobaterias del complejo Mycobacterium tuberculosis, por PCR a partir de muestras de tejidos en el algoritmo diagnóstico de los pacientes con derrame pleural de tipo exudado linfocítico, podría disminuir la estancia hospitalaria del paciente y los costos de hospitalización.
El estudio histopatológico de la biopsia de pleura es una técnica accesible y rápida con una adecuada sensibilidad y especificidad para el diagnóstico sugestivo de tuberculosis pleural.
Para lograr un diagnóstico etiológico definitivo de pleuritis tuberculosa es necesario asociar el valor de sospecha clínica del paciente con el estudio del tejido pleural por medio de los diferentes métodos disponibles: bacteriológicos, histopatológicos y de biología molecular.
RECOMENDACIONES
En pacientes que requieran la realización de biopsia pleural, recomendamos aumentar el número de punciones transtorácicas y obtener un mayor volumen de tejido, que permita la aplicación de múltiples pruebas necesarias para el diagnóstico etiológico en el paciente con derrame.
Al tener las muestras de tejido pleural éstas deben ser homogenizadas para ser distribuidas en proporciones iguales en los distintos medios de transporte y/o almacenamiento, garantizando una repartición alicuotada de los bacilos en cada uno de ellos, mejorando la posibilidad diagnóstica de los métodos aplicados.
Realizar estudios con un mayor número de pacientes, que tomen en cuenta para el diagnóstico definitivo de los casos la respuesta al tratamiento y la evolución de los mismos, aspectos que no pudimos desarrollar en este trabajo debido a la carencia de recursos requeridos para los estudios de seguimiento.
REFERENCIAS
1. Organización Mundial de la Salud. (Página principal en Internet). 2006 (acceso 07 de diciembre de 2008). Global tuberculosis control surveillance, planning, financing. Disponible en: URL: www.who.int/tb/publications/global_report [ Links ]
2. Organización Mundial de la Salud. (Página principal en Internet). 2006 (acceso 07 de diciembre de 2008) TB country profile. Venezuela. Disponible en: URL: http://www.who.int/GlobalAtlas/predefinedReports/TB/PDF_Files/ven.pdf [ Links ]
3. Martín Felipe, Avilán J. Panel Foro Estado actual de la lucha antituberculosa en Venezuela. Gac Méd Caracas. 2007;115(4):325-334. [ Links ]
4. Instituto Venezolano de los Seguros Sociales. Hospital Dr. Domingo Luciani (Venezuela). Informe de Enfermedades de Denuncia Obligatoria 2000-2006. Departamento de Epidemiología. Caracas (DF); 2006. [ Links ]
5. Qiu L, Teeter L, Liu Z, Ma X, Musser J, Graviss E. Diagnostic associations between pleural and pulmonary tuberculosis. J. J Inf (revista en línea) 2005 Diciembre (acceso el 15 de Octubre del 2006). 23. Disponible en: URL: http://www.elservierhealth.com/journals/jinf. [ Links ]
6. Penn R, Betts R. Infecciones respiratorias bajas. En: Betts R, Chapman S, Penn R, editores. Enfermedades Infecciosas. Madrid: Marban; 2004.p.318-395. [ Links ]
7. Seiscento M, Conde M, Pret M. Tuberculosis pleural. J Bras Pneumonol. 2006;32:124-130. [ Links ]
8. Wong Poon-Chuen. Management of tuberculous pleuritis: Can we do better? Respirology. 2005;10:144- 148. [ Links ]
9. Correa M, Técnicas de biología molecular aplicadas al diagnóstico. Sección de Biología Molecular de Agentes Infecciosos, Instituto de Medicina Experimental. Universidad Central de Venezuela. Caracas: 2001.p.33-43. [ Links ]
10. Fuentes Z, Garrido L. Tuberculosis pleural: Estudio epidemiológico, clínico y radiológico de 109 casos. Boletín SVM. 2000;20:108-112. [ Links ]
11. Kolk A, Kox L, Leeuwen J, Kuijper S. PCR assay for Mycobacterium Tuberculosis complex and other mycobacteria. Department of Biomedical Research. Royal Tropical Institute. Amsterdam. The Netherlands. 2002:2-23. [ Links ]
12. Panduro A, Rivas A, Sánchez L. Reacción en Cadena de la Polimerasa (PCR). En: Panduro A, editor. Biología Molecular en la Clínica. México: MacGraw-Hill Interamericana; 2000. p.23-55. [ Links ]
13. Bañales JL, Pineda PR, Fitzgerald JM, Rubio H, Selman M, Salazar M. Adenosine deaminase in the diagnosis of tuberculous pleural effusions: A report of 218 patients and review of the literature. Chest. 1991;99:355-357. [ Links ]
14. Loeza IJ, Perez GC, Torres CA, Salazar LM, Villarreal VH, Martínez RL. Efecto del género en la presentación de la tuberculosis pleural en un hospital de tercer mundo. Rev Inst Nal Enf Resp Mex. 2002;15:19-26. [ Links ]
15. Caminero J. Diagnóstico de la tuberculosis. En: Caminero J, editor. Guía de la tuberculosis para médicos especialistas. París: Compogravure impresión; 2003.p.77-81. [ Links ]
16. Berger HW, Mejia E. Tuberculous pleurisy. Chest. 1973;63:88-92. [ Links ]
17. Wolinsky E. Conventional diagnostic methods for tuberculosis. Clin Infect Dis. 1994; 19:396-401. [ Links ]
18. Badak F, Kiska D, Setterquist S, Hartley C, O´Conell M, Hopfer R. Comparison of mycobacteria growth indicator tube with BACTEC 460 for detection and recovery of mycobacteria from clinical specimens. J Clin Microbil. 1996; 34: 2236-2239. [ Links ]
19. Hasaneen N, Zaki M, Shalaby H, El-Morsi A. Polimerase Chain Reaction of pleural Biopsy is rapid and sensitive method for the diagnosis of tuberculous pleural effusion. Chest. 2003;124:2105-2111. [ Links ]
20. Clavijo E, Sánchez M, Anguita A, Viciana I, García A, Guerrero J, et al. Evolución temporal de la tuberculosis e infección por el virus de la inmunodeficiencia humana en la población atendida por un hospital de Málaga. Enferm Infecc Microbiol Clin. 2000 agosto. 18(7). (Revista en línea)(acceso el 05 de enero de 2008); Disponible en: URL: http://db.doyma.es/cgi-bin/wdbcgi.exe/doyma/mrevista.fulltext?pident=12249. [ Links ]
21. Valdés L, Álvarez D, San José E, Penela P, Valle JM, García-Pazos JM, et al. Tuberculous pleurisy: A study of 254 patients. Arch Intern Med. 1998;158:2017- 2021. [ Links ]
22. Zablockis R, Nargéla R, Satkauskas B. Needle Pleural Biopsy. Acta Médica Lituánica. 2002;9:104-107. [ Links ]
23. Kumar S, Seshadri M, Koshi G, John T. Diagnosing tuberculous pleural effusion: Comparative sensitivity of mycobacterial culture and histopathology. Br Med J. 1981;283:20. [ Links ]
24. Chen CM, Yuen KY, Chan KS, Yam WC, Yim KH, Ng WF, et al. Single tube nested PCR in the diagnosis of tuberculosis. J Clin Pathol. 1996; 49:290-294. [ Links ]
25. Moon J, Chang I, Kim S, Kim I, Lee H, Kim SK, et al. The clinical utility of Polymerase Chain Reaction for the diagnosis of pleural tuberculosis. Clin Infect Dis. 2005; 41:660-666. [ Links ]