Interciencia
versión impresa ISSN 0378-1844
INCI v.32 n.2 Caracas feb. 2007
Diversidad de hongos micorrízicos arbusculares (hma) y potencial micorrízico del suelo de una sabana natural y una sabana perturbada de la gran sabana, venezuela
Milagros Lovera y Gisela Cuenca
Milagros Lovera. Licenciada en Biología, Universidad Simón Bolívar, Venezuela. Profesional Asociado, Instituto Venezolano de Investigaciones Científicas (IVIC). Dirección: Centro de Ecología, IVIC. Apartado 21827, Caracas 1020A, Venezuela. e-mail: mlovera@ivic.ve
Gisela Cuenca. Licenciada en Biología, Universidad Central de Venezuela. Doctora en Ecología, IVIC, Venezuela. Investigador, IVIC, Venezuela. e-mail: gcuenca@ivic.ve
RESUMEN
Los efectos beneficiosos de las micorrizas arbusculares (MA) son bien conocidos, especialmente en la nutrición mineral de las plantas y en la protección contra agentes patógenos del suelo, entre otros. Si bien el 80% de las plantas terrestres son capaces de formar micorrizas, se considera que dicha asociación no tiene especificidad taxonómica. Sin embargo, evidencias recientes han mostrado que la diversidad de hongos MA (HMA) puede influir en la productividad y diversidad de las comunidades vegetales, así como en las relaciones competitivas y funcionamiento general de los ecosistemas naturales. Por otra parte, existen evidencias de que la diversidad de HMA sufre un impacto severo con las perturbaciones y algunas especies parecen ser más susceptibles que otras ante las actividades humanas. El objetivo del presente trabajo es comparar la diversidad de micorrizas y el potencial micorrízico del suelo de una sabana natural de La Gran Sabana, estado Bolívar, Venezuela, y una sabana perturbada adyacente, haciendo un inventario exhaustivo de las esporas de HMA presentes a lo largo del año, en el perfil del suelo y utilizando potes "trampa". Los resultados muestran la existencia de una elevada diversidad de especies de HMA en la sabana natural, muchas de las cuales parecen ser especies nuevas, y señala la alta vulnerabilidad de ciertos géneros de HMA como son Scutellospora y Gigaspora ante las perturbaciones. El cambio en la composición de especies pudiera estar implicado en la escasa recuperación y el tipo de vegetación a establecerse en estas sabanas después de una severa perturbación.
Diversity of arbuscular mycorrhizal fungi (amf) and mycorrhizal potential of the soil from a natural and a disturbed savannah from la gran sabana, venezuela
SUMMARY
The benefits provided by arbuscular mycorrhizas (AM) to plants are well known, especially those related to the improvement of mineral nutrition and protection against root pathogens, among others. Although 80% of vascular plants are able to form AM, it is considered that the association lacks specificity from a taxonomical point of view. However, recent evidence has arisen about the influence of the diversity of AM fungi (AMF) on the productivity, diversity, competitive relationships and functioning of natural ecosystems. In addition, there are evidences that support the idea that AMF diversity is severely affected by disturbance and that some AMF are particularly sensitive to human activities. The aim of this work is to compare the diversity of AMF and the mycorrhizal soil potential of an undisturbed savannah from La Gran Sabana, Bolivar state, Venezuela, with an adjacent disturbed savannah. An exhaustive inventory of AMF spores was done taking samples along the year, across the soil profile and using trap culture. Results show that there is a high AMF diversity in the natural savannah studied and many of the collected spores correspond to new species. Results also pointed out that spores belonging to Scutellospora and Gigaspora are highly vulnerable to disturbance. This change in AMF species composition might be related with the slow recovery and the type of plant community that finally will establish in these much degraded areas.
Diversidade de fungos micorrízicos arbusculares (hma) e potencial micorrízico do solo de uma savana natural e uma savana perturbada da gran sabana, venezuela
RESUMO
Os efeitos benéficos das micorrizas arbusculares (MA) são bem conhecidos, especialmente na nutrição mineral das plantas e na proteção contra agentes patógenos do solo, entre outros. Mesmo que 80% das plantas terrestres são capazes de formar micorrizas, se considera que dita associação não tem especificidade taxonômica. No entanto, evidências recentes têm mostrado que a diversidade de fungos MA (HMA) pode influir na produtividade e diversidade das comunidades vegetais, assim como nas relações competitivas e funcionamento geral dos ecossistemas naturais. Por outra parte, existem evidências de que a diversidade de HMA sofre um impacto severo com as perturbações e algumas espécies parecem ser mais susceptíveis que outras diante das atividades humanas. O objetivo do presente trabalho é comparar a diversidade de micorrizas e o potencial micorrízico do solo de uma savana natural de "La Gran Sabana", estado Bolívar, Venezuela, e uma savana perturbada adjacente, fazendo um inventário exaustivo das esporas de HMA presentes ao longo do ano, no perfil do solo e utilizando potes "armadilha". Os resultados mostram a existência de uma elevada diversidade de espécies de HMA na savana natural, muitas das quais parecem ser espécies novas, e destaca a alta vulnerabilidade de certos gêneros de HMA como são Scutellospora e Gigaspora ante as perturbações. A mudança na composição de espécies pudera estar implicada na escassa recuperação e o tipo de vegetação a estabelecer-se nestas savanas depois de uma severa perturbação.
PALABRAS CLAVE / Diversidad / Esporas / Micorrizas Arbusculares / Potencial Micorrízico / Sabanas Degradadas/
Recibido: 01/06/2006. Aceptado: 11/01/2007.
Introducción
Las micorrizas arbusculares (MA) han sido estudiadas intensamente en los últimos años y actualmente son indiscutibles sus efectos en la nutrición mineral de las plantas, especialmente en la captación de elementos de escasa movilidad en el suelo como P, Cu y Zn, y en la protección contra agentes patógenos (Smith y Read, 1997).
Si bien se considera que aproximadamente el 80% de las plantas pertenecen a familias capaces de formar MA (Trappe, 1987), aparentemente no existe especificidad taxonómica; es decir, cualquier planta hospedera puede establecer la simbiosis con cualquiera de las 200 especies de hongos micorrízicos arbusculares (HMA) descritas hasta el presente. Sin embargo, evidencias recientes obtenidas con técnicas moleculares (Vandenkoornhuyse et al., 2002) indican que las plantas son colonizadas preferencialmente por ciertas especies de HMA en base a sus efectos diferenciales sobre el crecimiento vegetal. Aunque esta especificidad no es absoluta, puede influir de un modo importante, no solo en la productividad de las comunidades vegetales (van der Heijden et al., 1998) sino también en la diversidad, relaciones competitivas y funcionamiento general de los ecosistemas naturales. Tomando esto en consideración, una disminución de la diversidad de HMA podría reducir la velocidad de recuperación de los ecosistemas perturbados y determinar, en cierta medida, la composición de especies de la comunidad vegetal a establecerse luego de una perturbación.
Dado que la morfología de la colonización micorrízica que se produce en las raíces de las plantas es de escaso valor taxonómico (Brundrett et al., 1996; Merryweather y Fitter, 1998), la taxonomía de los HMA se basa fundamentalmente en la morfología de sus esporas: forma, color, tamaño, grosor, tipo y naturaleza de las paredes que la constituyen, conexión hifal, ornamentaciones, etc. (Smith y Read, 1997), utilizándose la densidad de esporas de HMA (número de esporas/100g de suelo), como una medida de la importancia de las distintas especies de HMA en los suelos. Sin embargo, debido a las diferencias existentes en la capacidad de esporulación, ese parámetro no necesariamente refleja la abundancia real de las diversas especies de HMA. Recientemente, con el advenimiento de las técnicas de biología molecular, se ha comenzado a caracterizar las diversas especies de HMA presentes en las raíces de las plantas en base a la comparación de sus secuencias de ADN (Helgason et al., 1998), pero el problema de la significación estadística del muestreo en el campo con estas técnicas aún dista mucho de estar resuelto, por lo que la cuantificación de esporas, aún con sus limitaciones, sigue siendo la medida de diversidad de HMA más utilizada.
En trabajos anteriores se ha mostrado que la diversidad de HMA sufre un impacto severo con las perturbaciones y algunas especies parecen ser más susceptibles que otras frente a las actividades humanas, como es el caso de Scutellospora spp. (Cuenca et al., 1998; Picone, 2000; Siqueira et al., 1989). En particular, en La Gran Sabana, al sureste de Venezuela, algunas zonas seriamente perturbadas (préstamos) que fueron resembradas con Brachiaria decumbens además de fertilizadas y encaladas, presentaron un incremento en cuanto al número de esporas de HMA luego de la resiembra (Cuenca y Lovera, 1992). Sin embargo, su diversidad no se recuperó al nivel de los ecosistemas naturales aún después de 7 años de ocurrida la perturbación (Cuenca et al., 1998).
En la actualidad, en muchos préstamos este intento de recuperación ha sido infructuoso, siendo prácticamente nula su cobertura vegetal. El objetivo del presente trabajo es contrastar el componente micorrízico de estas sabanas perturbadas (préstamos), en las que prácticamente no se ha recuperado la cobertura vegetal, con el de la sabana natural adyacente, determinando el potencial infectivo y la diversidad de HMA en ambas situaciones. Para evaluar la composición de especies de HMA se realizó un inventario exhaustivo en distintas épocas del año (curso anual) y a distintas profundidades en el perfil del suelo, bajo la premisa que los cambios en la dinámica de las comunidades de los HMA que se presentan en la sabana perturbada podrían estar relacionados con su escasa capacidad de recuperación.
Materiales y Métodos
Sitio de estudio
En las cercanías del aeropuerto de Luepa (5°47N y 61°27O), a los bordes de la carretera que va desde la Troncal 10 hasta la Estación Científica de Parupa (ECP), en La Gran Sabana, estado Bolívar, Velezuela, se demarcaron un total de 6 parcelas de 10×30m cada una. De estas parcelas, tres se marcaron en una sabana perturbada (préstamo), en la cual los primeros 50cm de suelo fueron removidos para la construcción de la carretera aproximadamente 10 años antes de la realización de este trabajo. Las otras tres parcelas se demarcaron en un área de sabana natural adyacente dominada por Axonopus pruinosus y Bulbostylis paradoxa, entre otras especies. La precipitación mensual y la evapotranspiración para el año de mediciones se muestra en la Figura 1, donde se evidencia un clima estacional con un período de sequía de diciembre a marzo.
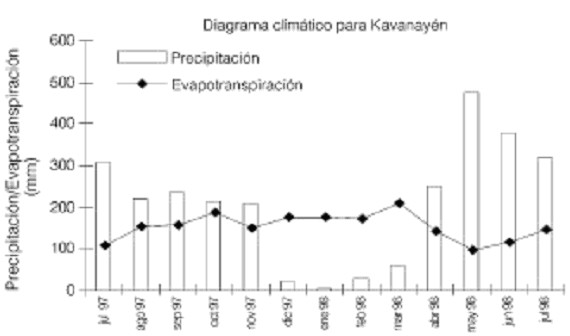
Figura 1. Precipación mensual y evapotranspiración de la Estación de Kavanayén en la Gran Sabana, durante el período de estudio.
Análisis de Suelos
Se realizaron análisis de los suelos tanto de la sabana natural como del préstamo a distintas profundidades en el perfil. La materia orgánica fue determinada por el método de Walkey y Black (Jackson, 1976), los cationes intercambiables (Ca++, K+, Mg++ y Na+) fueron extraídos con una solución de NH4OAc 1M (Thomas, 1982) y determinados por espectrofotometría de absorción atómica. La acidez intercambiable (Al++++H+) fue obtenida utilizando como solución extractora KCl 1M y determinada por titulación con NaOH (McLean, 1965). La textura fue determinada por el método de Bouyucos (Day, 1965). El P intercambiable fue extraído por el método de membranas según Tiessen y Moir (1993) y medido en el extracto de acuerdo a Murphy y Riley (1962). El N total fue obtenido por digestión de la muestra en ácido sulfúrico concentrado y peróxido de hidrógeno y determinado posteriormente en un autoanalizador Technicon.
Mediciones realizadas
a- Bioensayo para determinar el potencial micorrízico (infectividad) de los suelos. Para realizar este bioensayo se siguió la metodología propuesta por Plenchette et al. (1989). Se pregerminaron un total de 100 plántulas de Vigna luteola para cada tipo de suelo, las cuales se sembraron en conos plásticos de 80cm3 llenos con el suelo a evaluar diluido al 1, 3, 10, 30 y 100% con el mismo suelo previamente esterilizado (8kGy). Se sembraron 10 plantas en cada dilución para cada tipo de suelo para un total de 200 plantas en todo el bioensayo. Este procedimiento se llevó a cabo con los suelos de las parcelas seleccionadas, en cuatro momentos del año a saber: julio, octubre, enero y abril, entre 1997 y 1998.
Las plantas se cosecharon 20 días después de la siembra, evaluando la presencia de colonización micorrízica mediante la tinción de Phillips y Hayman (1970). La presencia de al menos un punto de entrada o inicio de colonización micorrízica en la raíz se consideró como un registro positivo. Los datos se expresaron como MSI50 por 100g de suelo seco y están correlacionados positivamente con el potencial micorrízico de los suelos.
b- Variaciones anuales de las poblaciones de esporas de HM. Para inventariar los HMA presentes se colectaron a lo largo del año muestras superficiales de suelo (0-15cm) en cada una de las 6 parcelas demarcadas. Cada muestra se obtuvo al colectar al menos 15 paladas de suelo al azar a través de cada parcela. Las muestras se guardaron en bolsas plásticas cerradas hasta su traslado al laboratorio. Transcurridos menos de 15 días después de la colección en el campo, las muestras fueron homogeneizadas cuidadosamente y las esporas aisladas a partir de 50g de suelo por el método de tamizado húmedo y decantado seguido de centrifugación en sacarosa (Sieverding, 1991). Las esporas aisladas fueron preservadas en azida sódica 0,05% (Morton et al., 1993) hasta su análisis microscópico. Se hicieron tres aislamientos de 50g c/u de cada una de las parcelas estudiadas. Para el estudio de las variaciones estacionales en las poblaciones de HMA se colectaron muestras en cuatro épocas del año, las mismas que para el bioensayo.
Solo las esporas que lucían intactas y saludables se contaron y separaron en distintos grupos morfológicos bajo el microscopio estereoscópico (60×). De cada morfotipo se preparó una lámina permanente utilizando alcohol polivinílico en lactoglicerina (PVLG) como medio de montaje o PVLG + reactivo de Melzer, de acuerdo a la metodología sugerida por Morton et al. (1993). Las esporas fueron identificadas hasta género y cuando fue posible hasta especie, utilizando la literatura especializada. De cada morfotipo se prepararon láminas de referencia, y se ingresaron en el herbario de HMA del IVIC.
c- Distribución de las esporas de HMA en el perfil del suelo. Se estudió la presencia de esporas de HMA a lo largo del perfil de suelo hasta unos 40cm de profundidad en la época de lluvia (julio) y en la época de sequía (enero), tanto en la sabana natural como en el préstamo. Las muestras se tomaron con un barreno cada 10cm hasta los 40cm de profundidad, en cada una de las parcelas previamente demarcadas. Las muestras se procesaron de manera idéntica a como se describió en b.
Con los datos obtenidos en b- y c- se calculó la riqueza de especies, el índice de diversidad según Whittaker (1975) y la concentración de dominancia o Índice de Simpson según Barbour et al. (1987). Finalmente, las parcelas naturales y perturbadas se compararon entre sí mediante el Índice de Similitud de Sörensen (Barbour et al., 1987).
d- Reclutamiento de HMA mediante "potes trampa". Para complementar el inventario de especies se prepararon "potes trampa", los cuales son cultivos mixtos de HMA obtenidos a partir del suelo del campo (Bever, 1994). Para ello, parte de las muestras homogeneizadas se usaron para llenar potes de 3kg de capacidad en los que se sembraron semillas pregerminadas de V. luteola, la cual actuó como hospedero para los hongos micorrízicos presentes en dichas muestras. Al cabo de un mínimo de 4 meses y un máximo de un año, se aislaron las esporas de HMA presentes en dichos potes utilizando el método de Sieverding (1991).
Resultados
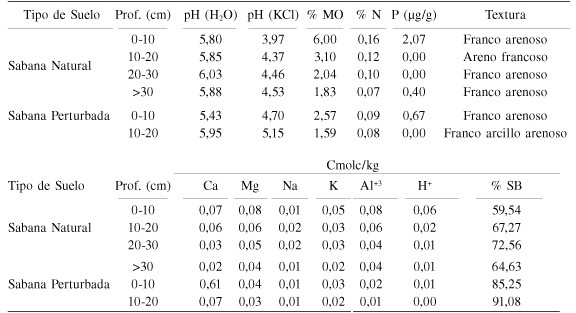
El suelo de la sabana de Luepa (Tabla I) es ácido y sumamente bajo en nutrientes, pero especialmente en P y bases cambiables, lo que hace que el % de saturación de bases sea muy bajo. Los datos del perfil del suelo para la sabana natural muestran una disminución del contenido de materia orgánica hacia los estratos más profundos del perfil. El N presenta valores medios y los suelos son bien drenados.
Tabla 1. Caracteristicas quimicas y físicas de los sueldos de la Sabana Natural y pertubada de Luepa.
La situación de oligotrofia extrema se acentúa aún mas en el préstamo (Tabla I), donde prácticamente no existen nutrientes. Aun puede apreciarse el efecto del encalado que se aplicó 2 años después de la perturbación cuando se intentó recuperar esta zona (Cuenca y Lovera, 1992), siendo el valor de Ca++ diez veces superior al de la sabana natural. Otra diferencia notable entre los dos sistemas es el contenido de materia orgánica, que en el préstamo es sumamente bajo, asemejándose a los de las capas más profundas de la sabana natural. El Al+++ por su parte, no constituye un problema en ninguna de las dos condiciones analizadas.
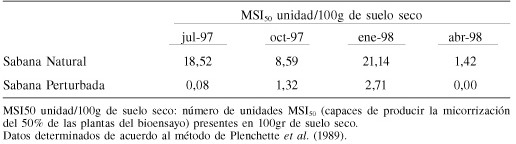
En la Tabla II se presentan los datos de infectividad obtenidos siguendo el método de Plenchette et al. (1989). En este caso resulta evidente el mayor potencial micorrízico de la sabana natural (SN) en contraposición con el préstamo (P). Los datos, además, indican una mayor infectividad en enero y julio para SN. Los valores de infectividad del préstamo fueron sumamente bajos todo el año, con un ligero aumento para el mes de menor precipitación (enero). No se encontraron correlaciones significativas entre los datos de precipitación y la infectividad de los suelos.
Tabla 2. Infectividad de los Sueldos de la Sabana Natural y la Sabana pertubada de Luepa a lo largo del año de muestreo.
Del inventario de las especies de HMA, los resultados más resaltantes obtenidos son:
El número de esporas de la sabana natural es bastante bajo a través de todo el año y muestra un máximo en abril (Figura 2a). El préstamo presentó una densidad de esporas aún menor que la sabana natural, alcanzando su valor mínimo en enero, cuando la sequía fue máxima. Sin embargo, a pesar de la ausencia de vegetación, se encontraron algunas esporas vivas en estas parcelas en las cuatro fechas de muestreo. La riqueza y el índice de diversidad de especies de la sabana natural fueron superiores a los del préstamo (Figura 2b, c) salvo en julio, cuando los valores se solaparon. La concentración de dominancia (Figura 2d) fue mayor para el préstamo en comparación con la sabana para todas las fechas, indicando que en el préstamo la dominancia está repartida entre un menor número de especies. Este índice no varió a lo largo del año de muestreo.
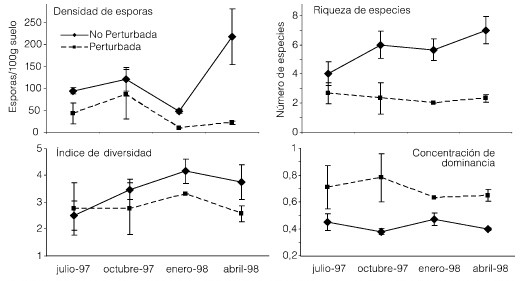
Figura 2. Desindad de esporas (± ES), RIQUEZA DE ESPECIES (± ES), índice de diversidad y concentración de dominancia (± ES) de las especies de HMA presentes en la sabana natural y perturbada de Leupa.
En cuanto a la distribución de las esporas en el perfil del suelo para la época de sequía, los resultados se muestran en la Figura 3. No se hallaron esporas vivas en el préstamo durante el muestreo realizado en la época seca, por lo que se muestran solo los datos relativos a la sabana natural. El número de esporas colectadas fue bajo también en este caso y presentó una leve tendencia a disminuir hacia las capas más profundas del perfil (Figura 3a). La riqueza y el índice de diversidad variaron poco a través del perfil (Figura 3b, c) y la concentración de dominancia, que arrojó valores relativamente altos, presentó un valor máximo entre los 20 y 30cm de profundidad (Figura 3d). En contraste, los valores obtenidos para la época de lluvia (Figura 4a) muestran una disminución en el número de esporas para esta época en relación con la de sequía en la sabana natural y una franca disminución de las mismas hacia las capas más profundas del suelo. En el préstamo las esporas vivas se encontraron en esta época del año y los valores no variaron a las dos profundidades muestreadas. En este caso resultó imposible, debido a la elevada pedregosidad del terreno, de hasta 51%, colectar muestras por debajo de los 20cm de profundidad.
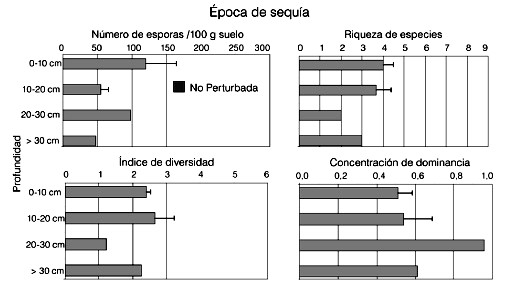
Figura 3. Desindad de esporas (± ES), RIQUEZA DE ESPECIES (± ES), índice de diversidad y concentración de dominancia (± ES) de las especies de HMA en el perfil del suelo en la época de sequía (enero 1998) en la sabana natural de Leupa.
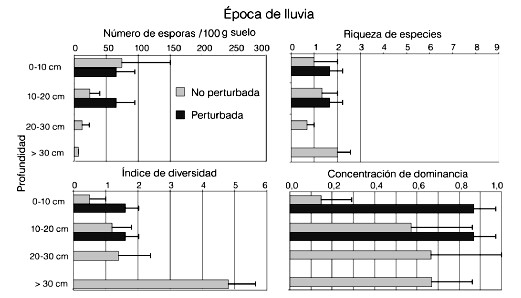
Figura 4. Desindad de esporas (± ES), RIQUEZA DE ESPECIES (± ES), índice de diversidad y concentración de dominancia (± ES) de las especies de HMA en el perfil del suelo en la época de lluvia (julio 1997) en la sabana natural y perturbada de Leupa.
La riqueza de especies en la época de lluvias no varió apreciablemente a través del perfil (Figura 4b) pero, en cambio, el índice de diversidad (Figura 4c) arrojó su valor máximo para la sabana natural a los 30cm de profundidad y mostró una tendencia a aumentar a mayor profundidad. El préstamo no presentó variaciones en las dos profundidades a las que se midió esta variable y tampoco sus valores fueron diferentes de los de la sabana natural a pesar de la ausencia de vegetación. Finalmente, la concentración de dominancia (Figura 4d) fue claramente mayor para la situación perturbada y tendió a hacerse mayor hacia la parte más profunda del perfil en el caso de la sabana natural.
En la sabana natural se encontraron en total 29 morfotipos o tipos de esporas con morfología diferente. De ellas, la mayoría presentaron caracteres que no se ajustan a las descripciones publicadas en la literatura. De hecho, solo se pudieron identificar 4 de los 29 morfotipos presentes en las parcelas seleccionadas. La especie más abundante fue Glomus "marrón hifa transparente" al cual pertenecían más del 50% del total de esporas colectadas en esta sabana a lo largo de todo el año de muestreo, tanto en la parte más superficial del suelo como en el perfil. En segundo lugar, con un 25% de abundancia relativa, estuvo Entrophospora "crema", la cual probablemente sea una especie nueva. En total, solo 7 especies de las 29 presentes alcanzaron abundancias superiores al 1%. Entre ellas se encuentran (con abundancias relativas entre 2 y 6%) Glomus "amarillo hifa transparente", Glomus "deforme", Glomus "rojo vino", Glomus "ocre pared gruesa" y Entrophospora colombiana. En la Figura 5 (a-g) se muestra el aspecto al microscopio de las esporas de estas especies.
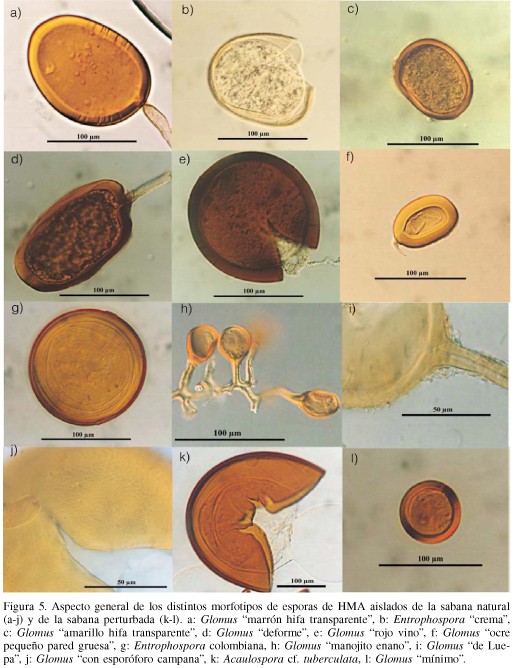
En la sabana perturbada o préstamo, solo se hallaron un total de 12 morfotipos, de los cuales el más abundante fue Acaulospora cf tuberculata, especie totalmente ausente en la sabana natural. Ella constituyó más del 50% de las esporas colectadas en estas parcelas, seguida de Glomus "marrón hifa transparente" con una abundancia de más del 35%. Glomus "mínimo", Entrophospora colombiana y Glomus "deforme" aparecieron con abundancias entre 2 y 3%, para un total de solo 5 especies que superaron el 1% de abundancia relativa. De ellas, sólo Acaulospora tuberculata y Glomus "mínimo" no estuvieron entre las más abundantes de la sabana natural, por lo que se muestran en la Figura 5 (k-l).
La comparación de ambas situaciones (Figura 6) resulta de interés. En ambos casos el sistema está dominado por esporas del género Glomus (>70%). Cabe destacar la desaparición de los géneros Gigaspora y Scutellospora, los cuales, aunque se encontraron en baja proporción en la sabana natural (~3%), no aparecieron en ninguna de las muestras de la sabana perturbada. En consecuencia, los géneros Acaulospora y Entrophospora spp. aumentaron su importancia relativa en la condición perturbada.
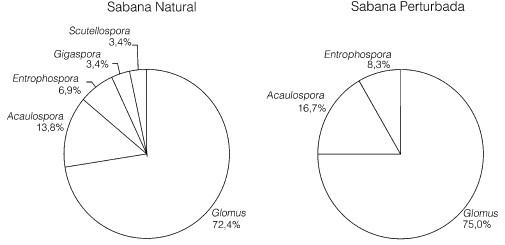
Figura 6. Distribución porcentual de los génerosde HMA en la sabana natural y la sabana perturbada de Luepa.
Con la utilización de los "potes trampa" se detectaron tres especies que nunca aparecieron en las muestras de suelo tomadas directamente en el campo. Las mismas fueron el Glomus "de Luepa", el Glomus "con esporóforo campana" y el Glomus "manojito enano" hallados en la sabana natural (Figura 5, h-j). Por lo tanto hay que agregar tres especies más de Glomus a la lista de 21 morfotipos de este género ya existentes. El índice de similaridad de Sörensen arrojó un valor de 0,48 indicando que ambos sistemas comparten, sin embargo, casi la mitad de las especies de HMA.
Discusión
Varios aspectos de interés pudieron ser dilucidados en el presente trabajo. Uno de ellos es el hecho que en el préstamo, a pesar de la ausencia de cobertura vegetal, se pudieron colectar, aunque en baja proporción, esporas vivas de HMA. Probablemente este tipo de propágulos sea el principal responsable de la infectividad del suelo de la sabana perturbada obtenida en el bioensayo, dada su capacidad de resistir ante la ausencia de hospederos.
En la sabana las esporas se concentran, como es usual, en los primeros centímetros del perfil. En general, el número de esporas vivas encontradas en las parcelas estudiadas es muy bajo si se lo compara con otros reportes de la literatura. En este sentido, Janos (1996) sugiere que en zonas tropicales húmedas las condiciones de temperatura y humedad óptimas prevalecientes favorecen el ataque por parte de patógenos y depredadores, originando una disminución en el número de esporas viables presentes.
Adicionalmente, en la época de lluvias se presentan condiciones más favorables para la germinación de las esporas y, por lo tanto, el número de ellas que puede ser colectado en el campo tiende a ser menor (Bever, 1994). Sin embargo, los presentes resultados en relación al curso anual de la densidad de esporas, si bien muestran valores bajos en la época de lluvia (julio), presentan un número de esporas aún menor en enero (sequía). Esto podría estar asociado a la existencia de dos máximos de esporulación, uno en octubre y otro mayor en abril, que se vieron reflejados en el bioensayo como una mayor actividad micorrízica (germinación de esporas y en consecuencia una disminución en su número) en el siguiente muestreo de enero (sequía) y julio (lluvia), respectivamente. En el caso del préstamo el único máximo de esporulación existente parece tener lugar en octubre, viéndose un leve aumento del potencial infectivo del suelo en el siguiente muestreo de enero (sequía). Estos resultados permitirían especular la existencia de una pérdida diferencial de especies de HMA de acuerdo a la estacionalidad de su esporulación, afectándose particularmente aquellas que lo hacen en abril, con la consiguiente disminución del poder infectivo del suelo de los préstamos en la época de lluvia.
Una de las hipótesis propuestas en trabajos anteriores (Cuenca et al., 1998) supone, que en las áreas perturbadas no ingresarían nuevas especies de HMA, o ese reingreso sería muy escaso debido a la baja capacidad de dispersión de estos hongos hipógeos. Las esporas encontradas en las áreas perturbadas serían de este modo las mismas que se encontraban en las capas más profundas del suelo luego de que los estratos superiores fueron removidos. Aunque en este caso la mayoría de las especies presentes en el préstamo también estaban originalmente en la sabana natural (10 de las 12 especies presentes en total en el préstamo), se destaca sin embargo el caso de Acaulospora tuberculata, la cual nunca fue colectada en la sabana natural y sin embargo apareció como dominante en el préstamo y el Glomus "hialino de pared delgada", del cual solo se colectó una espora en el préstamo y ninguna en la sabana natural. Este resultado coloca a A. tuberculata como una especie de gran interés por su adaptabilidad o "preferencia" por las condiciones perturbadas.
Otro resultado que se desprende de este estudio es la mayor susceptibilidad de las Gigaspora y Scutellospora spp. a las perturbaciones. En un trabajo previo se señalaron una serie de especies pertenecientes al género Scutellospora colectadas en La Gran Sabana, como muy sensibles a las perturbaciones (Cuenca et al., 1998). Los resultados obtenidos en el presente trabajo apoyan esta presunción, incluyendo a Gigaspora spp. como un grupo también susceptible ante las perturbaciones.
En cuanto al inventario de HMA realizado, éste revela un número muy elevado de especies de HMA presentes en un área relativamente pequeña, sobre todo si se toma en cuenta que hasta el presente, a nivel mundial, el número de especies de HMA descritas no supera las 200.
La gran mayoría de los HMA colectados en este trabajo no se ajustan a las características de las especies descritas en la literatura. Al menos 6 de las especies colectadas, debido a sus ornamentaciones y/o características únicas, son reportadas por primera vez, representando sin lugar a dudas especies no descritas. Este hallazgo, reportado por lo demás varias veces a lo largo de diez años de estudio de la diversidad de HMA presente en La Gran Sabana (Walker et al., 1998; Herrera-Peraza et al., 2001), contrasta con la idea de la inexistencia de diferencias en la diversidad de HMA presente en áreas tropicales y áreas templadas, hecho comúnmente aceptado en la literatura referente a los HMA (Allen et al., 1995). Esto podría deberse al hecho que las áreas tropicales han sido menos investigadas, dado el menor número de micorrizólogos que trabajan en ellas; o bien, podría constituir un caso particular para la región de La Gran Sabana, relacionado con el bajo impacto de las poblaciones humanas en estos ecosistemas protegidos. Finalmente, una interesante hipótesis que merece la pena explorar es que La Gran Sabana, que de por sí posee una historia geológica única, sea también un centro de diversificación de este grupo de organismos. Trabajos futuros deberán focalizarse hacia el esclarecimiento de tales supuestos.
En suma, el presente trabajo muestra la importancia de realizar muestreos exhaustivos que contemplen las variaciones estacionales a distintos niveles de profundidad a través del perfil del suelo, para describir adecuadamente la diversidad de HMA presente en un determinado ambiente. En nuestro caso, a través de este tipo de muestreo se evidenció a) la alta diversidad de especies de HMA existente en la región tropical estudiada, b) el efecto de las perturbaciones en relación a la pérdida de diversidad de HMA, y c) la sensibilidad particular de ciertos géneros, como Scutellospora y Gigaspora, ante las perturbaciones. Estos cambios en la composición de la comunidad de HMA pudieran estar implicados en la escasa recuperación y en el tipo de vegetación a establecerse en estas sabanas perturbadas.
Agradecimientos
Los autores agradecen a Ricardo Herrera por su contribución en la descripción taxonómica de los distintos morfotipos, a Zita de Andrade, recientemente fallecida y quien participó activamente en esta investigación, a Erasmo Meneses por su colaboración en el trabajo de laboratorio y cuidado de los potes trampa, a Fundacite Guayana por su apoyo financiero, y a la Autoridad Gran Sabana, especialmente al personal de la Estación Científica de Parupa, sin cuyo apoyo hubiera sido imposible realizar este trabajo.
REFERENCIAS
1. Allen EB, Allen MF, Helm DJ, Trappe JM, Molina R, Rincón E (1995) Patterns and regulation of mycorrhizal plant and fungal diversity. En Collins HP, Robertson GP, Klug MJ (Eds.) The significance and regulation of soil biodiversity. Kluwer. Dordrecht, Holanda. pp. 47-62. [ Links ]
2. Barbour MG, Burk JH, Pitts WD (1987) Terrestrial Plant Ecology. Benjamin/Cummings. Menlo Park, CA, EEUU. 634 pp. [ Links ]
3. Bever JD (1994) Feedback between plants and their soil communities in an old field community. Ecology 75: 1965-1977. [ Links ]
4. Brundrett M, Bougher N, Dell B, Grove T, Malajczuk N (1996) Working with Mycorrhizas in Forestry and Agriculture. ACIAR. Pirie. Canberra, Australia. 374 pp. [ Links ]
5. Cuenca G, Lovera M (1992) Vesicular-arbuscular mycorrhizae in disturbed and revegetated sites from La Gran Sabana, Venezuela. Can. J. Bot. 70: 73-79. [ Links ]
6. Cuenca G, De Andrade Z, Escalante G (1998) Diversity of Glomalean spores from natural, disturbed and revegetated communities growing on nutrient-poor tropical soils. Soil Biol. Bioch. 30: 711-719. [ Links ]
7. Day PR (1965) Particle fractionation and particle size analysis. En Black CA et al. (Eds.) Methods of Soil Analysis. Part 1. Physical and Mineralogical Properties. ASA-SSSA. Madison, WI, EEUU. pp 545-567. [ Links ]
8. Helgason T, Daniell TJ, Husband R, Fitter AH, Young JPW (1998) Ploughing up the wood-wide web? Nature 394: 431. [ Links ]
9. Herrera-Peraza R, Cuenca G, Walker C (2001) Scutellospora crenulata, a new species of Glomales from La Gran Sabana, Venezuela. Can. J. Bot. 79: 674-678. [ Links ]
10. Jackson ML (1976) Análisis Químico del Suelo. 3ª ed. Omega. Barcelona, España. 662 pp. [ Links ]
11. Janos DP (1996) Mycorrhizas, succession and the rehabilitation of deforested lands in the humid tropics. En Frankland JC, Magan N, Gadd GM (Eds.) Fungi and environmental change. Cambridge University Press. Nueva York, EEUU. pp 129-162 [ Links ]
12. McLean EO (1965) Aluminium. En Black CA (Ed.) Methods of Soil Análisis. Part 2 Agronomy ASA-SSSA. Madison, WI, EEUU. 9: 1035-1049. [ Links ]
13. Merryweather J, Fitter AH (1998) The arbuscular mycorrhizal fungi of Hyacinthoides non-scripta. II. Seasonal and spatial patterns of fungal populations. New Phytol 138: 131-142. [ Links ]
14. Morton JB, Bentivenga SP, Wheeler WW (1993) Germ plasm in the international collection of arbuscular and vesicular-arbuscular mycorrhizal fungi (INVAM) and procedures for culture development, documentation and storage. Mycotaxon 48: 491-528. [ Links ]
15. Murphy J, Riley JP (1962) A modified single solution method for the determination of phosphate in natural waters. Anal. Chim Act 27: 31-36. [ Links ]
16. Phillips JM, Hayman DS (1970) Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Trans. Br. Mycol. Soc. 55: 158-161. [ Links ]
17. Picone C (2000) Diversity and abundance of arbuscular-mycorrhizal fungus spores in tropical forest and pasture. Biotropica 32: 734-750. [ Links ]
18. Plenchette C, Perrin R, Duvert P (1989) The concept of soil infectivity and a method for its determination as applied to endomycorrhizas. Can. J. Bot. 67: 112-115. [ Links ]
19. Sieverding E (1991) Vesicular-Arbuscular Mycorrhiza Management in Tropical Agrosystems. GTZ. Eschborn, Alemania. 371 pp. [ Links ]
20. Siqueira JO, Colozzi-Filho A, Oliveira E (1989) Ocorrencia de micorrizas vesicular-arbusculares em agro e ecossistemas naturais do estado de Minas Gerais. Pesq. Agropec. Bras. 24: 1499-1506. [ Links ]
21. Smith SE, Read DJ (1997) Mycorrhizal Symbiosis. Academic Press. Cambridge, MA, EEUU. 605 pp. [ Links ]
22. Thomas GW (1982) Exchangeable cations. En Page AL (Ed.) Methods of Soil Analysis Part 2. Agronomy Monograph N° 9, 2nd ed. American Society of Agronomy. Madison, WI, EEUU. pp. 159-165. [ Links ]
23. Tiessen H, Moir JO (1993) Characterization of available P by sequential extraction. En Carter MR (Ed.) Soil sampling and methods of analysis. Lewis. Ann Arbor, MI, EEUU. pp. 75-86. [ Links ]
24. Trappe JM (1987) Phylogenetic and ecological aspects of mycotrophy in the angiosperms from an evolutionary standpoint. En Safir G (Ed.) Ecophysiology of VA mycorrhizal plants. CRC. Boca Ratón, FL, EEUU. pp 5-25. [ Links ]
25. Vandenkoornhuyse P, Husband R, Daniell IJ, Watson JM, Duck M, Fitter AH, Young JPW (2002) Arbuscular mycorrhizal community composition associated with two plant species in a grassland ecosystem. Mol. Ecol. 11: 1555-1564. [ Links ]
26. van der Heijden MGA, Klironomos JN, Ursic M, Moutoglis P, Streitwolf-Engel R, Boller T, Wiemken A, Sanders IR (1998) Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature 396: 69-72. [ Links ]
28. Walker C, Cuenca G, Sánchez F (1998) Scutellospora spinosissima sp nov, a newly described Glomalean fungus from low nutrient communities in Venezuela. Ann. Bot. 82: 721-725. [ Links ]
29. Whittaker RH (1975) Communities and Ecosystems. MacMillan. Nueva York, EEUU. 385 pp. [ Links ]












 uBio
uBio