Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Agronomía
versión impresa ISSN 0378-7818
Rev. Fac. Agron. v.19 n.1 Caracas ene. 2002
Establecimiento in vitro de explantes adultos del guanábano (Annona muricata L.) tratados con hipoclorito de sodio1
In vitro establishment of adult explants of soursop (Annona muricata L.) treated with Sodium hypochlorite
M. Ramírez-Villalobos2, A. Urdaneta2 y S. León de Sierralta3.
1. Proyecto cofinanciado por: CONDES-LUZ No 01458-98 y 1790-00, Centro Fruticola del Zulia-CORPOZULIA
2. Departamento de Botánica. Facultad de Agronomía. La Universidad del Zulia. Apartado 15205. Maracaibo, Zulia 4005. Venezuela. e-mail: mcramire@cantv.net, mcramire@luz.ve.
3. Departamento de Química. Facultad de Agronomía. La Universidad del Zulia. Apartado 15205. Maracaibo, Zulia 4005. Venezuela.
RESUMEN
Se evaluó el efecto del hipoclorito de sodio durante el establecimiento in vitro de explantes procedentes de plantas adultas de guanábano cultivadas en el campo. Ápices y segmentos nodales se desinfectaron superficialmente con hipoclorito de sodio (HS) al 0; 0,5; 1 y 2% por tiempos de exposición de 5 y 10 min. En los ápices, las dosis de 0,5 y 1% de HS con tiempos de exposición de 10 min disminuyó la presencia de hongos, y la de 1% por 5 min causó un menor daño en la viabilidad de los explantes. En los segmentos nodales, el HS redujo los porcentajes de explantes con hongos y contaminados totales (hongos y bacterias). La desinfección con 1% durante 5 ó 10 min mostró el más alto porcentaje de explantes viables, y las dosis 0 y 0,5% presentaron los menores valores de explantes oscurecidos. Los resultados indicaron que el hipoclorito de sodio no controló los microorganismos contaminantes presentes en los explantes.
Palabras clave: ápices, segmentos nodales, contaminación, viabilidad, Annona muricata.
ABSTRACT
The effect of Sodium hypochlorite on in vitro establishment of explants from adult field grown soursop plants was evaluated. Shoot tips and nodal segments were superficially disinfected with sodium hypoclorite (SH) at 0; 0,5; 1 y 2% with exposition times of 5 and 10 min. In the shoot tips, the doses 0,5 and 1% of SH with exposure times of 10 min reduced the presence of fungus, and 1% during 5 min. caused less damage on the viability of explants. In nodal segments, the SH reduced the percentage of fungus and total contamination (fungus and bacteria) explants. Disinfection with 1% during 5 or 10 min. produced the highest percentage viable plants, and doses 0 and 0,5% presented the lowest percentages of explant browning. The results showed that sodium hypochlorite does not control contaminating micro-organisms present on the explants.
Key words: shoot tips, nodal segments, contamination, viability, Annona muricata.
Recibido el 20-4-2001 Aceptado el 26-11-2001
INTRODUCCION
El guanábano (Annona muricata L.) es originario de América tropical y perteneciente a la familia Annonace. Este frutal tuvo una amplia expansión en tiempos Prehispánicos y no se conoce en estado silvestre. En Venezuela es la especie más importante de las Annona comestibles cultivadas. La creciente demanda e interés por la guanábana por parte del consumidor e industrias, hacen que ésta sea muy apreciada por sus propiedades alimenticias y excelente sabor comercial, para la elaboración de jugos, helados, néctares, mermeladas, dulces y pulpa congelada (1).
El cultivo del guanábano presenta grandes perspectivas en el país, debido a su adaptación a diferentes condiciones edafoclimáticas (1). Por otra parte, su fruta es importante en grandes mercados frutícolas de América del Sur, América Central y del Caribe. Se estima que Venezuela es el país con mayor superficie sembrada en América del Sur, con un área plantada superior a las mil hectáreas (8). Aunque, la mayoría de la producción proviene de plantas dispersas en fincas (5).
La propagación del guanábano puede ser efectuada por vía semilla o material vegetativo. El primer caso es muy común en nuestro país, no siendo recomendable porque las plantas obtenidas presentan variaciones de altura, rendimientos, calidad de la fruta, entre otras, además de iniciar la producción tardíamente. La propagación vegetativa sería la más indicada por proporcionar plantas uniformes, tanto en la copa como en el patrón, y con inicios de producción temprana. En ésta existen varios métodos como el acodado aéreo, estaquillado, injertación y cultivos de tejidos in vitro, siendo el más utilizado el de injertación (1, 8), aunque este método no es el más fácil, pues los patrones regularmente tardan alrededor de un año para alcanzar el desarrollo óptimo (5). En cuanto al acodado aéreo y estaquillado no se ha obtenido éxito (13).
El cultivo in vitro como técnica, consiste en cultivar asépticamente una porción aislada de la planta bajo condiciones de ambiente controlado, para que las células expresen su potencial intrínseco o inducido (16). Esta técnica tiene posibilidades de ser aplicada en el género Annona a fin de obtener grandes cantidades de plantas sanas en menor tiempo (3, 6, 13, 15). El desarrollo de un protocolo que permita propagar in vitro material de plantas elitescas en su fase adulta, facilitaría el proceso de selección y multiplicación.
Existen investigaciones relacionadas con la micropropagación del guanábano, para lo cual se ha empleado material juvenil (2) y adulto; sin embargo, este último ha sido recolectado de plantas bajo condiciones de invernadero (6). Experiencias con material adulto cultivado directamente en el campo han reflejado bajos porcentajes de explantes vivos (15).
El objetivo de este trabajo fue evaluar el efecto del hipoclorito de sodio y tiempo de exposición en la contaminación, viabilidad y oscurecimiento de explantes de guanábano al establecerlos in vitro.
Materiales y métodos
Material vegetal. Se seleccionaron brotes terminales de 10 cm, del tercio central de plantas adultas de guanábano cultivadas en el campo, experimental CENFRUZU-CORPOZULIA los cuales perma-necieron en antioxidante Sigma (ácido cítrico y ácido ascórbico) hasta el traslado al laboratorio.
Tipo de explante. Se prepararon ápices y segmentos nodales del tercer y cuarto nudo del brote. Se consideró primer nudo, aquel cuya hoja estuviese expandida. Los explantes permanecieron en antioxidante hasta la desinfección superficial. Previa a ésta se efectuó un enjuague con agua destilada
Procedimiento de desinfección superficial. Los explantes se trataron con las dosis de 0; 0,5; 1 y 2% de hipoclorito de sodio (Cloro comercial: hipoclorito de sodio al 5,25%), combinadas con dos tiempos de exposición, 5 y 10 min. Posteriormente, se realizaron tres enjuagues con agua destilada esterilizada.
Medio de cultivo y condiciones de incubación. La siembra se hizo en tubos de ensayo (150 mm x 25 mm) con 10 ml de medio nutritivo de Murashige y Skoog (MS) (7) a la mitad de la concentración de las sales, complementado 0,5 mg L-1 de Bencilaminopurina, 20 g L-1 de Sacarosa y 7 g L-1 de Agar. El pH del medio se ajustó a 5,8 antes de esterilizarlo en autoclave a 121°C y 1,1 Kg cm-2 por 15 min. Las condiciones de incubación de los explantes fueron bajo luz fluorescente con irradiancia de 19 mmol m-2 s-1 por 12 h de fotoperíodo a una temperatura de 25±1°C.
Tratamientos, diseño estadístico y variables de estudio. En cada tipo de explante se evaluaron 8 tratamientos. El diseño estadístico fue totalmente al azar en parcelas divididas en el tiempo con 4 repeticiones, ubicando en la parcela principal el nivel de hipoclorito de sodio, tiempo de exposición e interacciones y en la parcela secundaria al tiempo de cultivo e interacciones con el mismo.
La unidad experimental estuvo representada por 5 explantes. A los 10 y 20 días de la siembra se midieron los porcentajes de explantes con hongos, bacterias, contaminados o total (bacterias y hongos), viables y oscurecidos. Los hongos se detectaron por medio de la presencia de micelio y las bacterias a través de los exudados presentes en el explante o en la base de éste, en contacto con el medio de cultivo. Se denominó explante viable aquel de color verde, descartándose los verde amarillento o pardo y explante no oscurecido al de color verde con oscurecimiento sólo en las superficies cortadas.
Análisis estadístico. Se ejecutó a través del procedimiento GLM del programa SAS (18), cuando hubo efectos significativos se aplicó la prueba de mínimos cuadrados.
Resultados y discusión
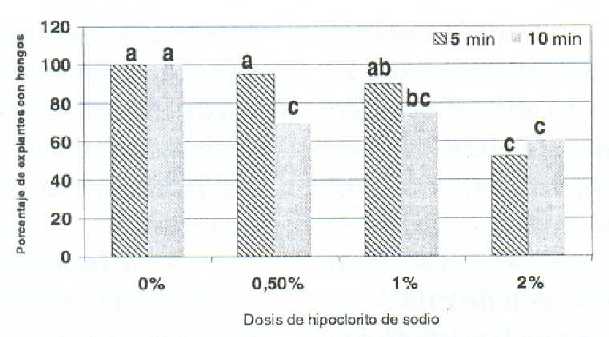
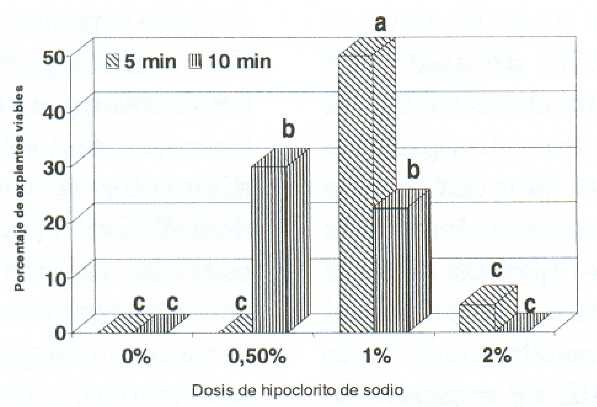
En ápices de guanábano, la interacción hipoclorito de sodio por tiempo de exposición en el desinfectante superficial, tuvo diferencias significativas (P<0,05) en los porcentajes de explantes con hongos y viables. En la primera variable se aprecia que los menores porcentajes se registraron cuando se combinó hipoclorito de sodio al 2% con 5 ó 10 min de exposición, asimismo, a dosis de 0,5 y 1% durante 10 min (figura 1). Para la segunda, el uso de hipoclorito de sodio al 1% por 5 min alcanzó el máximo valor, 50% (figura 2).
La baja viabilidad en las dosis de 0 y 0,5% se asociaron a la invasión total del explante por microorganismos contaminantes, principalmente hongos, que ocasionaron con el tiempo la muerte del mismo (12), y en la dosis de 2%, a un efecto tóxico del hipoclorito de sodio, el cual ha sido observado en guayabo (11), ajonjolí (17) y mora (9). Adicionalmente, el porcentaje de explantes viables fue superior al obtenido por Rincón et al. (15) de 28%, cuando desinfectaron los ápices guanábano con 2,65% de hipoclorito de sodio.
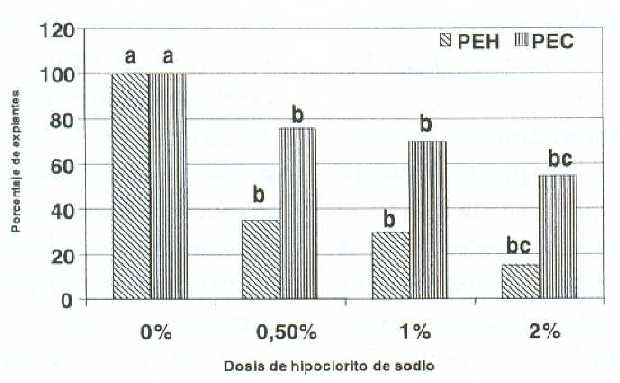
En los segmentos nodales, las dosis de hipoclorito de sodio presentaron diferencias significativas (P<0,05) sobre los porcentajes de explantes con hongos y contaminados totales (figura 3). Estos disminuyeron con la aplicación del desinfectante, no habiendo diferencias entre las dosis 0,5; 1 y 2%.
Al comparar los resultados con otros trabajos ejecutados en guanábano se encontró que muy pocos indican la contaminación, viabilidad y oscurecimiento de los explantes durante su establecimiento in vitro. Así mismo, la mayoría no especifican el procedimiento de desinfección superficial empleado (2, 6). Sin embargo, al comparar los porcentajes de contaminación adquiridos con los de Rincón et al. (15) se observó que son altos, lo cual mostró que la desinfección superficial con hipoclorito de sodio del material vegetal adulto cultivado en el campo, no resultó efectivo para controlar los microorganismos contaminantes (10). Esta respuesta se asemeja con investigaciones realizadas en otras especies, donde se reportan una alta contaminación, entre ellos: guayabo con 80% (11) y 100% de contaminación (20), chayote 85% (19), yerba mate 75% (14) y helecho 90% (4).
Figura 1. Efecto de la interacción de la dosis de hipoclorito de sodio con el tiempo de exposición sobre el porcentaje de explantes con hongos, durante el cultivo in vitro ápices de guanábano (Annona muricata L.).
Figura 2. Efecto de la interacción de la dosis de hipoclorito de sodio con el tiempo de exposición sobre el porcentaje de explantes viables, durante el cultivo in vitro ápices de guanábano (Annona muricata L.).
Figura 3. Efecto de la dosis de hipoclorito de sodio sobre los porcentajes de explantes con hongos (PEH) y contaminados totales (PEC: hongos y bacterias) en segmentos nodales de guanábano (Annona muricata L.) cultivados in vitro.
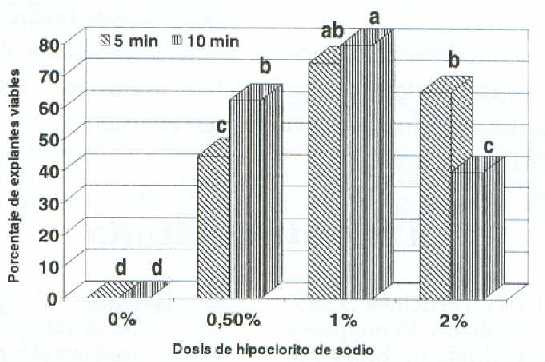
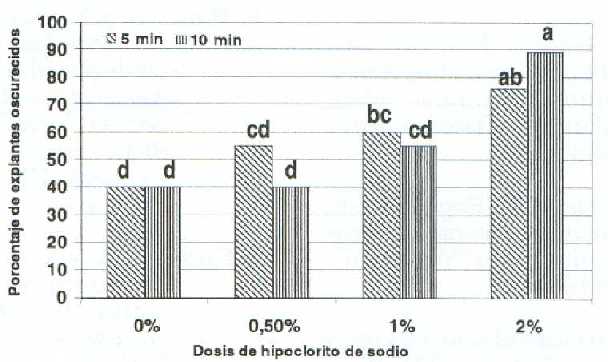
La interacción dosis de hipoclorito de sodio por tiempo de exposición influyó significativamente (P<0,05) en las variables porcentaje de explantes viables, y oscurecidos (figuras 4, 5). Se nota en la figura 4 que la aplicación de hipoclorito de sodio al 1% por 5 ó 10 min incrementó las dos primeras variables, mientras que en el testigo se obtuvo 0 y 10%, respectivamente, lo cual estuvo vinculado a la alta contaminación. En los tratamientos con 2% de hipoclorito de sodio ambas variables tendieron a disminuir, posiblemente debido a un efecto tóxico. Al respecto, Ramírez y Angarita (9) mencionaron que concentraciones mayores al 0,5% de hipoclorito de sodio afectan la viabilidad en explantes de mora.
Los mínimos porcentajes de explantes oscurecidos se obtuvieron con 0 y 0,5% de hipoclorito de sodio con tiempos de exposición de 5 y 10 min y la dosis de 1% por 10 min. Dichos valores contrastaron con los obtenidos en la dosis de 2% (figura 5). Estos resultados tienen analogía con los reportados por Salazar y Romero (17), quienes señalaron que explantes de ajonjolí tendieron a tornarse oscuros por la acción del hipoclorito de sodio. De igual manera, con las experiencias de Ramírez y Salazar (11), en las cuales los tiempos de exposición en hipoclorito de sodio al 5,25% mayores de 8 min, produjeron el oscurecimiento de los explantes de guayabo.
Figura 4. Efecto de la interacción de la dosis de hipoclorito de sodio con el tiempo de exposición sobre el porcentaje de explantes viables en segmentos nodales de guanábano (Annona muricata L.) cultivados in vitro.
Figura 5. Efecto de la interacción de la dosis de hipoclorito de sodio con el tiempo de exposición sobre el porcentaje de explantes oscurecidos en segmentos nodales de guanábano (Annona muricata L.) cultivados in vitro.
CONCLUSIONES
La desinfección superficial con hipoclorito de sodio no permitió el establecimiento aséptico de ápices y segmentos nodales del guanábano.
El hipoclorito de sodio al 0,5 y 1% con tiempos de exposición de 10 min disminuyó la presencia de hongos en los ápices.
Los segmentos nodales tratados con hipoclorito de sodio mostraron un menor porcentaje de explantes con hongos y contaminados totales.
La dosis de 1% de hipoclorito de sodio por 5 min permitió un menor daño del explante y por ende una mayor viabilidad de los ápices de guanábano.
El hipoclorito de sodio al 1% por 5 ó 10 min registró un mayor porcentajes de explantes viables en los segmentos nodales.
Las dosis 0 y 0,5% presentaron los menores valores de explantes oscurecidos.
LITERATURA CITADA
1. Avilan, L., F. Leal y D. Bautista. 1992. Manual de Fruticultura. Principios y manejo de la producción. Segunda Edición. Tomo I. Editorial América C. A. Caracas, Venezuela. 776 p. [ Links ]
2. Bejoy, M. y M. Hariharan. 1992. In vitro plantlet differentiation in Annona muricata. Plant Cell Tissue and Organ Culture 31: 245-247. [ Links ]
3. Encina, C., A. Barcelo, A. Herrero y E. Pliego. 1994. In vitro morphogenesis of juvenile Annona cherimola Mill. bud explants. Journal of Horticultural Science 69: 1053-1059. [ Links ]
4. Furelli, L. y E. de García. 1987. Regeneración de plantas a partir de explantes foliares del helecho Pteris cretica "Winsettii". Agron. Trop. 3: 19-30. [ Links ]
5. Guzmán, F. 1982. La Guanábana. Revisión Bibliográfica. En: p. 232-253. Fruticultura Tropical. Federación Nacional de Cafeteros de Colombia. Programa de Desarrollo y Diversificación de zonas cafeteras. Colombia. [ Links ]
6. Lemos, E. y J. Blake. 1996. Micropropagación of juvenile and mature Annona muricata L. Journal of Horticultural Science 71:395-403. [ Links ]
7. Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassays with tabacco tissue. Phys. Plant. 15: 473-493. [ Links ]
8. Pinto, A. y E. Silva. 1994. Graviola para exportação: Aspectos técnicos da produção. Ministério da Agricultura, do Abastecimiento e da Reforma Agrária. Secretaria de Desenvolvimiento Rural-SRD. Programa de Apoio à Produção e Exporta. EMBRAPA-SPI. Brasilia, DF.41 p. [ Links ]
9. Ramírez, A. y A. Angarita. 1990. Estudios preliminares para la propagación clonal in vitro de mora (Rubus glaucus L.). Agronomía Colombiana 7: 17-25. [ Links ]
10. Ramírez, M. 1998. Tratamientos a plantas madres y al explante para el establecimiento in vitro del guayabo (Psidium guajava L.). Trabajo de Grado. Maracaibo: La Universidad del Zulia. Facultad de Agronomía. División de Estudios para Graduados. Programa de Fruticultura. 132 p. [ Links ]
11. Ramírez, M. y E. Salazar. 1997. Establecimiento in vitro de segmentos nodales de guayabo (Psidium guajava L.). Rev. Fac. Agrom. (LUZ). 14: 497-506. [ Links ]
12. Ramírez, M. y E. Salazar. 1998. Método de desinfección y efecto de citocininas en el cultivo in vitro de segmentos hojas de Psidium guajava L. Rev. Fac. Agrom. (LUZ). 15: 162-173. [ Links ]
13. Rasai, S., A. George y A. Kantharajah. 1995. Tissue culture of Annona spp. (cherimoya, atemoya, sugar apple and soursop): A review. Scientia Horticulturae 62: 1-14. [ Links ]
14. Rey, H., O. Burtnik, P. Sansberro y L. Mroginski. 1991. Medios de cultivo para el establecimiento in vitro de explantos de la yerba mate (Ilex paraguariensis). Turrialba 41: 306-310. [ Links ]
15. Rincón, A., R. Ortega, J. Urdaneta, S. León de Sierralta, B. Bracho y M. Ramírez. 1999. Establecimiento aséptico de brotes laterales de Annona spp. Rev. Fac. Agron. (LUZ). 16: Supl. 1: 76-81. [ Links ]
16. Roca, W. y L. Mroginski. 1991. Establecimiento de un laboratorio para el cultivo de tejidos vegetales. En: p. 1-17. W. M. Roca y L. A. Mroginski (Eds). Cultivo de Tejidos en la Agricultura. Fundamentos y Aplicaciones. Centro Internacional de Agricultura Tropical (CIAT). Cali, Colombia. Publicación N° 151. [ Links ]
17. Salazar, E. y C. Romero. 1997. Cultivo in vitro de segmentos de hojas de ajonjolí (Sesamun indicum L.) Rev. Fac. Agrom. (LUZ) 13: 293-302. [ Links ]
18. SAS, Institute, INC. 1987. SAS (Statistycal Analysis System) the Institute INC, Cary, NC, USA. [ Links ]
19. Somarribas, G., J. Sandoval y L. Müller. 1991. Propagación vegetativa del chayote (Sechium edule (Jacq) Sw). Fase de establecimiento. Turrialba 41: 538-544. [ Links ]
20. Viloria, Z. 1993. Cultivo in vitro de nudos de guayabo (Psidium guajava L). Fase I. Trabajo de Ascenso. La Universidad del Zulia. Facultad de Agronomía. Maracaibo, Venezuela. 35 p. [ Links ]