Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Agronomía
versión impresa ISSN 0378-7818
Rev. Fac. Agron. v.20 n.2 Caracas abr. 2003
Anatomía de estructuras vegetativas y origen de los estolones, microtubérculos y raíces
adventicias en plantas in vitro de papa (Solanum tuberosum L.) cv. Granola.
Anatomy of the vegetative structure and origin of stolons, microtubers and adventitious roots of in
vitro potato (Solanum tuberosum L.) plants cv Granola.
J. E. Salas R1, N. J. Mogollón M2. y M. E. Sanabria2, 3.
1 INIA (Instituto Nacional de Investigaciones Agropecuarias). Jesr63@yahoo.es.
2 Universidad Centroccidental "Lisandro Alvarado", Postgrados de Agronomía. Unidad de Biotecnología Vegetal. norcam@cantv.net
3 Unidad de Investigación en Fitopatología; mesanabria@yahoo.com
Resumen
Con la finalidad de describir la anatomía de estructuras vegetativas y el origen de los estolones, microtubérculos y raíces adventicias de plantas in vitro de papa (S. tuberosum L.) cv. Granola, se muestrearon plantas cultivadas en las fases de crecimiento y desarrollo e inducción a la tuberización. En esta última, desde la iniciación hasta la formación de los microtubérculos. Las muestras se fijaron en F.A.A. al 90%, procesándose según las técnicas convencionales de estudios anatómicos para la obtención de láminas semipermanentes y permanentes de secciones transversales y longitudinales de los órganos en estudio. Paralelamente se realizaron preparaciones con aclarados de las porciones apicales, medias y basales de las láminas foliares, a fin de estudiar las características de la epidermis. En el tallo aéreo los tejidos vasculares estaban dispuestos en haces colaterales separados por zonas de tejido parenquimático, a partir del cual se originaron el cambium interfascicular, xilema, floema y raíces adventicias; mientras que los estolones en las zonas axilares de dicho tallo. Los microtubérculos se formaron en la zona sub-apical del estolón y en la zona axilar del tallo aéreo. En estas estructuras, el felógeno se originó a partir de las capas celulares subepidérmicas. En la hoja, ambas epidermis resultaron ser uniestratificadas, con tricomas simples, unicelulares o pluricelulares, y algunos glandulares. Los estomas, paracíticos y anomocíticos, se observaron en ambas superficies. Las raíces adventicias resultaron ser diarcas. Al comparar estos resultados con los obtenidos en otros cultivares de S. tuberosum y otros géneros de Solanaceae, se encontraron diferencias anatómicas marcadas.
Palabras clave: Anatomía de órgano vegetativos, cultivo in vitro, Solanum tuberosum.
Abstract
Potato plants (S. tuberosum L.) cv. Granola, produced under in vitro conditions were sampled during the phases of growth, development and induction of tuber development in order to describe the anatomy of vegetative structures and the origin of stolons, micro-tubers and adventitious roots. This last activity was studied from initiation up to the formation of micro-tubers. Samples were fixed in 90% F.A.A. following conventional techniques for anatomical studies. Both permanents and semi-permanent slides of transverse and longitudinal sections of the tissues being studied were prepared. Decolorized portions of apical, intermediate and basal parts of the foliar lamina were also processed for studying some of the epidermal characteristics. The vascular bundles of aerial stems were arranged in collateral axis and separated by zones of parenchymatous tissues from which the interfacial cambium, xylem, phloem and adventitious roots were originated, while stolons emerged up from the axillar zone of the same stem. The micro-tubers were formed in the sub-apical portions of the stolons and in the axillary area of the aerial stem. In such structures, the phellogen was originated from sub-epidermal cellular layers. Both epidermis turned out to be uni-stratified, with trichoms being simple, uni-cellular, pluri-cellular and some cases glandular. Paracytic and anomositic stoma were also observed on both surfaces. Finally the adventitious roots were found to be diarchic. Marked anatomical differences arose when comparing our results with those of other researches where others cultivars of S. tuberosum and others genera of the Solanaceae family were used.
Key words: Anatomy of vegetative organ, in vitro conditions, Solanum tuberosum.
Recibido el 7-3-2001 l Aceptado el 25-7-2002
Introducción
En América Latina, la papa (Solanum tuberosum L.), ocupa el sexto lugar entre los cultivos alimenticios en términos de producción total, después del maíz, la yuca, el trigo, el arroz y el plátano; y el séptimo en área cultivada, luego de los productos mencionados, con la adición del sorgo (9). Desde el punto de vista de su valor nutritivo, se encuentra en un lugar priviligiado, y por su importancia en la dieta humana, la NASA (USA) consideró usarla para el sostenimiento de la vida en el espacio (11).
Esta especie, perteneciente a la familia Solanaceae, es una planta herbácea con tres tipos de tallo, uno aéreo, circular o angular en sección transversal, sobre el cual se disponen hojas compuestas en filotáxis espiral; otro estolonífero formado por brotes laterales más o menos largos que nacen de la base del primero, y por último, el tubérculo engrosado, subterráneo. Las raíces son adventicias, superficiales o profundas (4, 8, 10).
En el tallo aéreo, los tejidos vasculares primarios se disponen en haces bicolaterales, abiertos y con desarrollo de floema interno y externo.
La diferenciación del floema interno parece ser similar al observado en otras especies de esta misma familia ( 3).
Los estolones presentan una zona meristemática sub-apical, de donde se originan los tubérculos mediante un engrosamiento radial, producto del alargamiento de las células parenquimáticas y la pérdida de la polaridad de las mismas (3). Aún hoy en día no existe una descripción consistente de la tuberización. Por lo general, se asume que durante la formación del tubérculo, el crecimiento longitudinal del estolón se detiene y las células parenquimáticas de la corteza, de la médula y de regiones perimedulares sufren divisiones y alargamiento (14). Cutter (3), señaló que la peridermis se forma por divisiones periclinales de las células epidérmicas o de tejidos hipodérmicos. La endodermis presenta bandas de Caspary y desaparece tempranamente. En tubérculos maduros, existen pocos elementos conductores y no hay un cambium vascular continuo. Las lenticelas son circulares y el número de las mismas varía por unidad de superficie, tamaño del tubérculo y condiciones ambientales.
Las hojas son bifaciales, con ambas epidermis uniestratas compuestas por células de paredes sinuosas en vista superficial. Los tricomas pueden ser uniseriados, glandulares y con una cabeza pluricelular más o menos esférica (3).
Artschwager y Hayward, citados por Cuter (3), encontraron raíces jóvenes diarcas; sin embargo, de Vries citado por esta última autora, afirmó que son triarcas y en las adventicias de cv Arran Pilot se presentaron entre cuatro y seis polos protoxilemáticos. El origen de estas raíces se ubicó en la zona vascular, pero no se establecieron con exactitud, los tejidos que intervinieron en la formación del primordio radical.
Considerando la importancia del cultivo y la escasa información disponible sobre el tema investigado, el presente trabajo tuvo como objetivo describir la anatomía de las estructuras vegetativas y determinar el origen de los estolones, microtubérculos y raíces adventicias de plantas in vitro de papa (S. tuberosum L.) cv. Granola y relacionar los resultados con los obtenidos en el estudio de otros géneros de Solanaceae.
Materiales y métodos
Las plantas in vitro de papa (S. tuberosum L.) cv. Granola utilizadas en este estudio se obtuvieron del Banco de Germoplasma del FONAIAP-Mérida. Con el fin de disponer de suficiente material vegetal, segmentos nodales de 0,5 a 0,6 cm de longitud provistos de una yema axilar, se multiplicaron en un medio básico de Murashige y Skoog sin reguladores del crecimiento (12). Estos crecieron y desarrollaron bajo un fotoperíodo de 16 horas/luz, 67,6 mol.s-1.m-2 de luminosidad y a 25°C 1 de temperatura, alcanzando una altura de 5,0 a 6,0 cm. Durante esta fase se realizaron muestreos para estudiar la anatomía del tallo aéreo, hojas y raíces adventicias.
Posteriormente, cuando las plantas in vitro alcanzaron una edad de 45 días, fueron inducidas a tuberización, empleando el mismo medio de cultivo, pero adicionando benziladenina (8 a 12 mg/l) e incrementando la sacarosa de 3 a 8%. Esta fase se realizó en completa oscuridad durante un período de 75 días, lapso durante el cual se hicieron muestreos cada siete días, desde su inicio hasta la formación de los estolones y microtubérculos, a objeto de determinar el origen de éstos órganos.
La preservación de las muestras se hizo con formol-alcohol-ácido acético (F.A.A.) al 90% por un período mínimo de 12 horas. Se utilizaron doce plantas para la preparación de tres tipos de montajes: a.- Láminas semi-permanentes de secciones transversales y/o longitudinales de los órganos vegetativos, realizadas a mano alzada y montadas con agua:glicerina (v:v); b.- Láminas permanentes de secciones transversales y longitudinales de estas mismas estructuras, deshidratadas en alcohol butílico terciario a concentraciones crecientes (desde 50% hasta 100%) e incluidas en paraplast X-tra (50-54ºC de punto de fusión). Las estructuras fueron seccionadas a 15 micrómetros con un micrótomo de deslizamiento marca Leica y c.- Aclarados de ambas superficies de la lámina foliar utilizando la porción media de los órganos, las cuales se sometieron a la acción de cloro comercial por tres días y montadas en agua:glicerina (v:v). En los tres casos la tinción fue supravital, directa, total y pancromática, con safranina y azul de astra en el primer y último caso y con eosina en el segundo (7).
Resultados y discusión
A. Anatomía.
1. Tallo aéreo
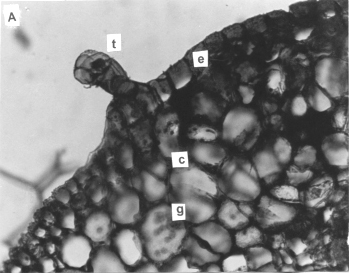
El tallo en sección transversal (figura 1) se observó cilíndrico, con una capa de células epidérmicas de forma tabular o elipsoidal y disposición compacta, cuyas paredes mas externas se encontraban cutinizadas. Los tricomas simples, glandulares, cortos, con el pedicelo bicelular y la cabeza globosa de cuatro células, semejantes a los descritos por García y Torres (5) para plantas cultivadas in vivo de Physalis angulata (Solanaceae). En contraste a lo señalado por estas mismas autoras al estudiar cuatro especies Physalis propagadas por métodos convencionales, la corteza no desarrolló colénquima, resultando ser completamente parenquimática, con células de paredes delgadas, pequeños espacios intercelulares y granos de almidón elípticos y excéntricos. Los tejidos vasculares se observaron dispuestos en un anillo discontinuo de tres fascículos colaterales abiertos, de tamaño variable y separados por zonas interfasciculares completamente parenquimáticas. No se observó la diferenciación de floema interno como el descrito por Fukuda y Bonnemain, citados por Cutter (3) para otros cultivares de Solanum y por García y Torres (5) para las especies de Physalis estudiadas.
Figura 1: Sección transversal del tallo aéreo de plantas in vitro de papa (S. tuberosum L.) cv. 'Granola'. A (200x): (e) epidermis, (t) tricoma, (c) corteza y (g) granos de almidón. B. (400X): (f) floema, (x) xilema, (cf) cambium fascicular, (ci) cambium interfascicular y médula (m).
A medida que avanzó el crecimiento, las zonas entre los haces vasculares fueron ocupadas por parénquima interfascicular; asimismo, se observó el desarrollo de fibras protegiendo el floema.
La zona medular estaba formada por parénquima semejante al descrito para la corteza, con granos de almidón elípticos y excéntrico y grupos de tres a cuatro células esclerenquimáticas aisladas en este tejido.
2. Estolón
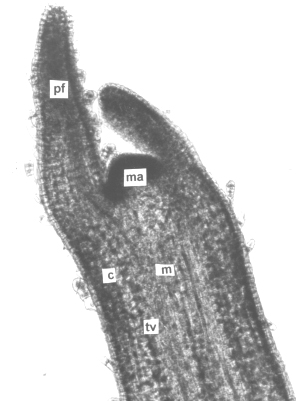
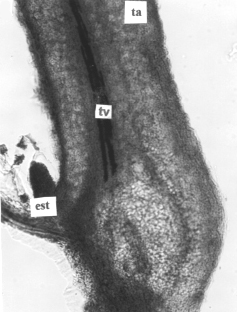
En sección longitudinal, el estolón (figura 2) mostró una anatomía muy semejante a la descrita para el tallo aéreo, presentando una epidermis uniestrata y cutinizada. Se observaron tricomas cortos, tectores, simples y unicelulares; pluricelulares, erectos o recurvados con base unicelular y del tipo glandular corto, con pedicelo bicelular y cabeza globosa de cuatro a seis células, similares a los descritos por García y Torres (5, 6) para el tallo aéreo y la lámina foliar de especies de Phylalis propagadas por métodos convencionales. Los tejidos vasculares constituyendo haces colaterales, la corteza y la médula formadas por parénquima amilífero con granos de almidón elípticos y excéntricos.
La zona apical del estolón se observó completamente meristemática ubicada entre un par de primordios foliares opuestos, y por debajo de la inserción de éstos, la diferenciación de tejidos vasculares primarios, la corteza y la médula.
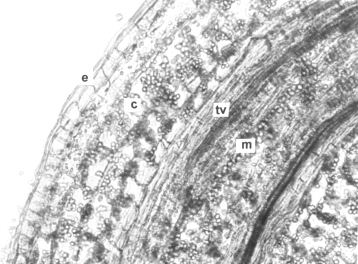
Figura 2. Sección longitudinal del estolón de plantas in vitro de papa (S. tuberosum L.) cv. 'Granola.'. A. Ápice del estolón (200x). B. Detalles de la zona subapical del estolón (400X). (pf) primordio foliar, (ma) meristema apical, (tv) tejidos vasculares, (c) corteza, (e) epidermis y (m) médula.
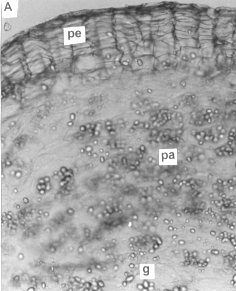
3. Microtubérculo
En los microtubérculos (figura 3) la epidermis se sustituye tempranamente por una peridermis, y el felógeno se origina a partir de las capas celulares subepidérmicas. Se observaron haces vasculares primarios dispersos en el parénquima amilífero, el cual presentaba gran cantidad de granos de almidón. Este tejido ocupaba la corteza, región perimedular y médula del órgano. No se observó la formación de endodermis como la reportada por Kumar y Wareing; Artschwager y Reeve et al., citados por Cutter (3).
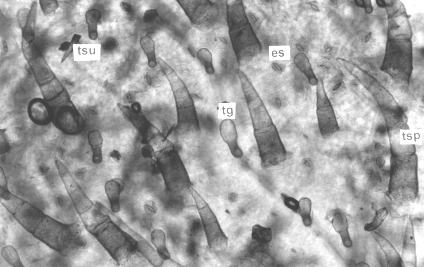
En vista superficial, las epidermis adaxial y abaxial, se observaron conformadas por células de paredes sinuosas, como las descritas por García y Torres (6) para P. pubescens y P. peruviana cultivadas in vivo. Los estomas se presentaron en ambas epidermis (hojas anfiestomáticas) y estaban distribuidos de forma irregular, predominando los del tipo paracítico, aunque también se observaron algunos anomocíticos. Esto concuerda con lo encontrado por Benítez y Ferrarotto (1) en especies del género Cestrum propagadas por métodos convencionales. Ambos tipos de estomas han sido señalados como típicos de la familia Solanaceae por Bessis y Guyot (2). El índice estomático resultó ser de 5,46 para la superficie adaxial y de 20,0 para la abaxial. Se observaron numerosos tricomas y varios tipos tricomáticos, cuya constitución coincide con la señalada por García y Torres (6) para especies de Physalis. Hacia el ápice y margen de la lámina foliar se presentaron pelos cortos, tectores, simples y unicelulares y, en la parte media, tectores, pluricelulares, rectos o recurvados con base unicelular y del tipo glandular corto, con pedicelo bicelular y cabeza globosa de cuatro a seis células.
En sección transversal, la lámina foliar mostró una epidermis adaxial uniestrata, con células cutinizadas, de forma tabular y dispuestas compactamente. La hoja era bifacial en cuanto a la distribución del mesófilo, lo cual es muy común en la familia Solanaceae como lo indicado por Metcalfe y Chalk, citados por García y Torres (6). El clororénquima constituido por una capa de empalizada y de dos a tres de esponjoso, con células de paredes delgadas y separadas por espacios intercelulares, ambas con cloroplastos. La cutícula de la epidermis abaxial se observó de menor grosor y con células más pequeñas que la adaxial.
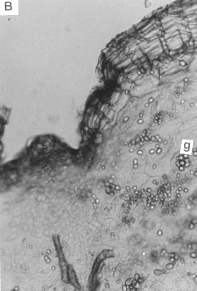
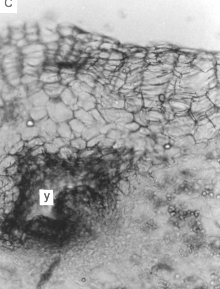
Figura 3. A, B y C. Secciones transversales del microtubérculo de plantas in vitro de papa (S. tuberosum L.) cv. 'Granola'. (200x). (pe) peridermis, (pa) parénquima amilífero, (g) grano de almidón (y) yema,.
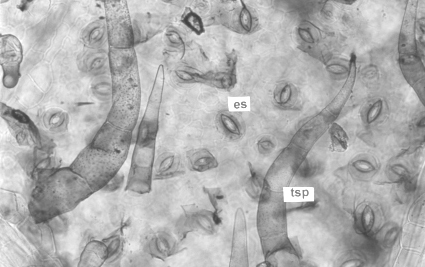
Figura 4. Vista frontal de la lámina foliar de plantas in vitro de papa (S. tuberosum L.) cv. 'Granola' mostrando tipos de tricomas y estomas. (1000X). A. Superficie adaxial y B. Superficie abaxial. (tg) tricoma glandular, (tsu) tricoma simple unicelular, (tsp) tricoma simple pluricelular y (es) estoma.
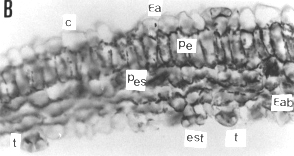
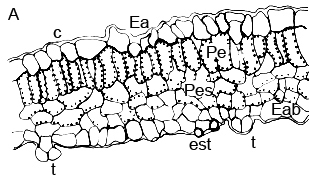
Figura 5. Sección transversal de la lámina foliar de plantas in vitro de papa (S. tuberosum L.) cv. 'Granola' (A. Esquema general) B. (100X): (ea) epidermis adaxial, (c) cutícula, (pe) parénquima en empalizada, (pes) parénquima esponjoso, (eab) epidermis abaxial, (es) estoma y (t) tricomas.
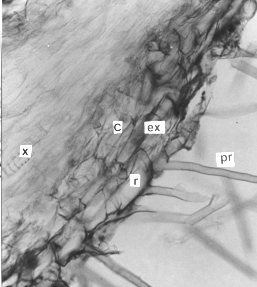
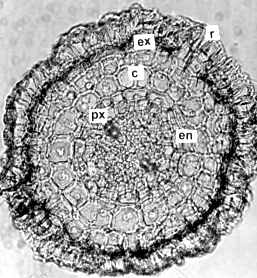
Figura 6. Raíz adventicia de plantas in vitro de papa (S. tuberosum L.) cv. 'Granola'. A. Sección transversal (100X) y B. Sección longitudinal (400X). (r) rizodermis, (ex) exodermis, (c) corteza, (en) endodermis, (px) polo protoxilemático, (pr) pelos radicales (c).
5. Raíz adventicia.
Las secciones transversales (figura 7) y longitudinales de las raíces adventicias mostraron una rizodermis continua y uniestrata. Los pelos radicales eran unicelulares, sin cutícula y de origen exógeno. La corteza completamente parenquimática; la exodermis y la endodermis se diferenciaron muy tempranamente, ambas uniestratificadas y por debajo de esta última se ubicó el periciclo uniseriado. El xilema y el floema primarios presentaron una disposición radial; dos polos xilemáticos, alternando con igual número de polos floemáticos. Esto coincide con lo señalado por Artschwager y Hayward, citados por Cutter (3), al indicar que las raíces jóvenes pueden ser diarcas; pero difieren con Vries, citado por esta misma autora, al reportar raíces triarcas en el cv. Arran Pilot. El centro del corte se observó formado por células parenquimáticas pequeñas, sin espacios intercelulares.
B. Origen de los estolones, microtubérculos y raíces adventicias.
1. Formación del estolón.
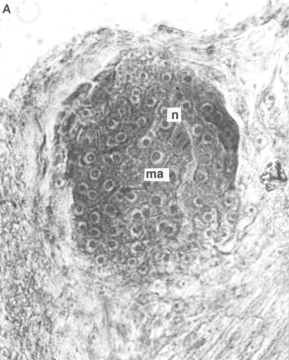
En sección transversal (figura 7) del tallo aéreo se observó la formación del estolón a partir de tejidos no diferenciados resguardados en las zonas axilares de este órgano, los cuales se diferencian de otros tejidos que los rodean por sus núcleos grandes y su densa tinción con eosina. El primordio de estolón inicialmente presentó tejidos no diferenciados y durante su formación y el desarrollo de sucesivos entrenudos, la anatomía del tallo aéreo se alteró como cosecuencia de cambios provocados por la emergencia del mismo hacia la superficie. El ápice del estolón originó un par de primordios foliares inicialmente opuestos, luego alternos y entre ellos el domo del meristema apical. Posteriormente continuaron las divisiones y subsecuentemente la diferenciación de otros tejidos en la porción proximal de este órgano.
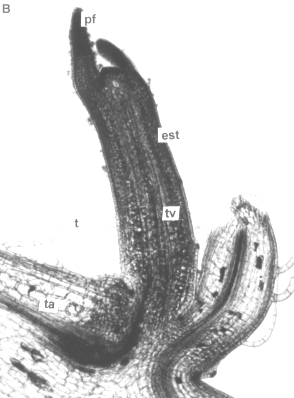
Figura 7. Zona axilar del tallo aéreo de plantas in vitro de papa (S. tuberosum L.) cv 'Granola' mostrando el desarrollo de un estolón. A. Sección transversal. (ma) masa de tejido meristemático, (n) núcleos en división (1000x). B Sección longitudinal. (est) estolón en desarrollo, (pf) primordios foliares, (tv) tejidos vasculares, (ta) tallo aéreo y (t) tricomas (100x).
2. Formación de microtubérculos a partir del estolón (figuras 8 y 9).
En las plantas in vitro se pudo observar que la formación de los microtubérculo fue el resultado de dos modalidades: unos se originaron a partir de la yema axilar del tallo aéreo, la cual sufre un pequeño alargamiento antes de comenzar el engrosamiento en el ápice y otros en la zona subapical del estolón. En el primer caso se observaron muy cercanos al eje o apenas separados de este órgano por un corto estolón.
Una vez desarrollado el estolón, su crecimiento se detuvo y se evidenció la formación de un engrosamiento provocado por divisiones celulares y/o aumento del diámetro de las células parenquimáticas de la corteza, médula y zonas perimedulares del entrenudo ubicado por debajo del ápice. Esto coincide con lo reportado por Xin et al. (14), quienes señalaron divisiones y alargamiento de las células parenquimáticas en estas zonas durante la formación de microtubérculos.

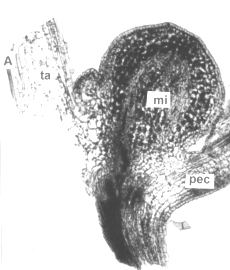
Figura 8. A. Sección longitudinal de la zona axilar del tallo aéreo de la planta in vitro de papa (S. tuberosum L.) mostrando la formación de un microtubérculo (100X). B. Plantas in vitro mostrando el desarrollo de microtubérculos en el tallo aéreo. (mi) microtubérculo, (pec) pecíolo, (ta) tallo
El felógeno se formó a partir de la o las primeras capas corticales y por divisiones sucesivas originó la peridermis, tejido que sustituyó a la epidermis.
En secciones longitudinales del tallo aéreo se pudo evidenciar una masa de células meristemáticas en posición axilar, la cual se organizó en un meristema apical por divisiones anticlinales y periclinales. Estas células originan un primordio de estolón de crecimiento muy limitado, proceso que terminó muy tempranamente, iniciándose la formación de un microtubérculo muy cerca del tallo aéreo. El posterior desarrollo del microtubérculo es semejante al descrito anteriormente. Al respecto, Vreugdenhil et al. (13) señalaron que el desarrollo de las yemas axilares en tubérculos, estolones o brotes está relacionado con la composición del medio de cultivo, ocurriendo la formación de las dos primeras estructuras en presencia de altas concentraciones de sacarosa (8%). Dicha concentración fue igual a la del medio nutritivo usado en esta investigación para la inducción de microtubérculos.
3. Formación de raíces adventicias (figura 10).
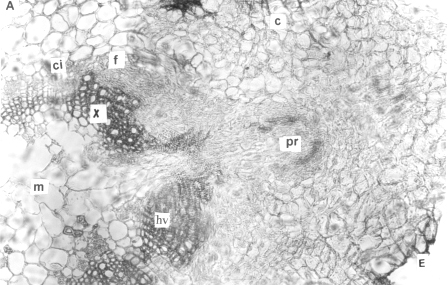
En la plantas in vitro fijadas a partir del séptimo día de inducción a la tuberización, el parénquima de las zonas interfasciculares del tallo aéreo comenzó a dividirse, formando las células iniciales de la raíz y causando modificaciones en la anatomía de este órgano. Luego de catorce días, el grupo de células así generado se individualizó, formando el primordio de raíz que se diferenció de los tejidos circundantes por sus núcleos grandes y una densa tinción con eosina; así como por los tejidos propios del órgano que se estaba diferenciando. Mediante divisiones sucesivas, estas estructuras se abrieron paso a través de los tejidos corticales del tallo y emergieron a la superficie del mismo, llevando en su extremo distal la cofia. Seguidamente ocurrió un rápido crecimiento en el medio de cultivo y en esta etapa ya fue posible diferenciar las distintas zonas histológicas de la raíz. Estos resultados difieren de lo señalado por Vries, citado por Cutter (3) para cv Arran Pilot, quien determinó el origen de la raíz a partir de células de la zona interfascicular, sin especificar los tejidos intervienen en su formación.
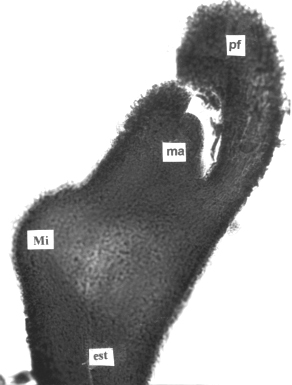

Figura 9. A. Sección longitudinal del tallo aéreo de plantas in vitro de papa (S. tuberosum L.) mostrando la formación de un estolón (50x). B. Sección longitudinal del ápice del estolón mostrando el desarrollo de un microtubérculo en la región subapical (50X). C. Plantas in vitro con formación de microtubérculos en los estolones. (ta) tallo, (tv) tejidos vasculares, (est) estolón, (Mi) microtubérculo, (ma) meristema apical, (pf) primordio foliar.
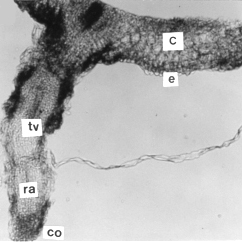
Figura 10. Sección transversal de la base del tallo aéreo de plantas in vitro de papa (S. tuberosum L.) mostrando la formación de una raíz adventicia. A. Formación del primordio de raíz a partir del parénquima interfascicular (x) B. Raíz adventicia emergiendo del tallo (x). (pr) primordio de raíz, (ci) cambium interfascicular, (c) corteza, (hv) haz vascular, (x) xilema, (f) floema, (m) médula, (e) epidermis, (tv) tejidos vasculares, (ra) raíz adventicia y (co) cofia
Conclusiones
En el tallo de Solanum tuberosum cv. Granola cultivada in vitro no se observó la formación de floema interno, por lo que los haces se describen como colaterales abiertos.
Los estolones se originaron a partir de tejidos no diferenciados en las zonas axilares del tallo aéreo y los microtubérculos en la zona subapical del estolón, así como a partir de la yema axilar del tallo aéreo, muy cercanos al eje o separados del mismo por un corto estolón. El felógeno en los microtubérculos se originó a partir de tejidos hipodérmicos.
En la lámina foliar, los tipos tricomáticos variaron al comparar la zona del ápice con la media o la base y los estomas observados fueron de tipo paracítico y/o anomocíticos, con distribución irregular.
Las raíces adventicias resultaron ser diarcas y los tejidos parenquimáticos que intervinieron en la formación del primordio radical se ubicaron en la zona interfascicular del tallo aéreo.
Literatura citada
1. Benítez de R. C. y M. Ferrarotto. 1997. Arquitectura foliar en tres especies de Cestrum (Solanaceae-Cestreae) de Venezuela. Anales de Botánica Agrícola 4: 5-10. [ Links ]
2. Bessis, J. y M. Guyot, 1979. An attempt to use stomatal characters in sytematic and phylogenetic studies of Solanaceae. In: Hawkes, J.R., R. Lester y A. Skelding (eds.). The Biology and taxonomy of the Solanaceae. Linn. Soc. Symp., Ser. 7. Academic Press, London. pp. 321-326. [ Links ]
3. Cutter, E.G. 1978. Structure and development of potato plant. pp. 70-152. In: The potato crop (ed.) P.N.H. Harris. Chapman and Hall, London. 730 p. [ Links ]
4. Font Quer, P. 1973. Diccionario de Botánica. Editorial Labor. Barcelona, España. 1244 p. [ Links ]
5. García, M., F. de Torres. 1997a. Anatomía caulinar comparada de cuatro especies del género Physalis (Solanaceae). Anales de Botánica Agrícola 4:11-22. [ Links ]
6. García, M. y F. de Torres.1997b. Anatomía foliar de cuatro especies del género Physalis (Solanaceae). Anales de Botánica Agrícola 4:23-32. [ Links ]
7. Gaviño de la T. G., C., Suarez y H. Figueroa. 1972. Técnicas biológicas selectas de laboratorio y campo. Editorial Limusa-Wiley S.A. México. [ Links ]
8. Hernández, C.E. y R. Pineda.1992. Genética y mejoramiento de la papa. In: La papa. El descubrimiento que conquistó al mundo. Curso Internacional de papa. Pamplona, Colombia. 75 p. [ Links ]
9. Herrera, J. 1992. Importancia y potencial económico de la papa en América Latina. In: La papa, el descubrimiento que conquistó al mundo. Curso Internacional de Papa. Pamplona. Colombia. 7 p. [ Links ]
10. Huamán, Z. 1986. Botánica sistemática y morfología de la papa. Centro Internacional de la papa. Lima, Perú. pp 3-22. [ Links ]
11. Lujan, L. 1992. Semilla de papa en Colombia. In: La papa, el descubrimiento que conquistó el mundo. Curso Internacional de Papa. Pamplona. Colombia. 28 p. [ Links ]
12. Salas, J.E. 1998. Producción y almacenamiento de tubérculos de papa (Solanum tuberosum L.) cv Granola. Trabajo de Grado. Posgrado de Horticultura. Decanato de Agronomía. Universidad Centro-ccidental "Lisandro Alvarado". Barquisimeto, Venezuela. 119 p. [ Links ]
13. Vreugdenhil, D., Y. Boogaard, R. Visser y S. de Brujin. 1998. Comparisson of tuber and shoot formation from in vitro cultured potato explant. Plant cell, Tissue and Organ Culture 53:197-204. [ Links ]
14. Xin, E., D. Vreugdenhil y A. M. Lammeren. 1998. Cell division and cell enlargement during potatoes tuber formation. Journal of Experimental Botany. 49:573-582. [ Links ]