Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Agronomía
versión impresa ISSN 0378-7818
Rev. Fac. Agron. v.23 n.2 Caracas jun. 2006
Una metodología para la propagación in vitro de Aloe vera L.
A methodology for the in vitro propagation of Aloe vera L.
N. Albany1, J. Vilchez2, S. León de Sierralta1, M. Molina1 y P. Chacín1.
1Dpto. Química, Facultad de Agronomía. Universidad del Zulia. Apartado 15205. Maracaibo ZU. 4005ZU, Venezuela.
2Dpto. Botánica, Facultad de Agronomía. Universidad del Zulia. Apartado 15205. Maracaibo ZU. 4005, Venezuela.
Autor para correspondencia email: nilca_albany@cantv.net; jorge_vilchez@cantv.net
Resumen
La zábila (Aloe vera L.) es uno de los cultivos de importancia económica de la familia Liliaceae. La propagación por hijuelos no satisface el mercado nacional; siendo factible la producción masiva de plantas de zábila mediante la propagación in vitro. Se realizó un ensayo para evaluar el efecto de diferentes concentraciones de NaClO (1, 2 y 3%) en la desinfección superficial durante la fase de establecimiento (FE). En la fase de multiplicación (FM), se evaluó el estado físico del medio de cultivo (líquido y semi-sólido) en interacción con el seccionamiento del explante (corte transversal y transversal-longitudinal parcial); además se evaluó el tamaño de las vitroplantas (pequeñas: <5 cm, medianas: 5-10 cm y grandes: >10 cm) para la fase de aclimatización (FA). Se utilizó un diseño completamente aleatorizado para evaluar las variables porcentaje de contaminación (%C) y porcentaje de mortalidad (%M) de los explantes en la FE, coeficiente de multiplicación (CM), altura del explante (AE) en la FM y porcentaje de sobrevivencia (%S) en la FA. Se detectaron diferencias significativas (P<0,05) entre las concentraciones de NaClO donde el menor %C (9,09%) se obtuvo con 3%. En la FM, sólo el estado físico del medio de cultivo arrojó diferencias estadísticas (P<0,01) para AE, siendo 3,85 cm en líquido y 2,83 cm en semi-sólido. En la FA no se encontraron diferencias significativas para el %S. Todas las vitroplantas se adaptaron a condiciones ex vitro a pesar de su tamaño inicial.
Palabras clave: Aloe vera L., zábila, establecimiento, multiplicación, aclimatización.
Abstract
Aloe (Aloe vera L.) is one of the economically important crops of the Liliaceae family. Vegetative propagation does not satisfy national demand being possible the mass production of aloe plants through in vitro propagation. An experiment was completed in order to evaluate the effect of different concentrations of NaClO (1, 2 and 3%) in the surface sterilization during the establishment stage (ES). In the multiplication stage (MS), the interaction of the culture media (semi-solid or liquid) with two different sectioning of the explants (transversally cut and transversally with partly lengthwise cuts) was evaluated, also in the acclimatization stage (AS) vitroplant survival was studied according to their size (small<5cm, medium 5-10 cm and large >10 cm). A completely randomized design was used to evaluate the variables: contamination percentage (C%) and mortality rate (M%) in the ES, multiplication coefficient (MC) and height of the explants (HE) in the MS and survival rate (S %) in the AS. Significant differences (P<0.05) were observed among NaClO concentrations being 3% the best (9.09%C). In the MS only the physical state of the culture medium rendered any statistical differences (P<0.01) for height of explants (HE) with 3.85 cm in liquid and 2.83 cm in semi-solid. No statistical differences were found in the AS for S%. All vitroplants adapted to ex-vitro conditions regardless their initial size.
Key words: Aloe vera L., establishment, multiplication, acclimatization
Recibido el 5-11-2004 Aceptado el 20-6-2005
Introducción
La zábila (Aloe vera L.) es un miembro de la familia de las liliáceas, originaria del norte de África e introducida en las Antillas y América tropical donde crece en forma natural y se cultiva comercialmente (4). Es una planta de crecimiento herbáceo perenne, que posee tallos cortos, con un sistema radical superficial (10,16).
La zábila es una especie de gran importancia en la medicina natural e industrial; de sus hojas se extrae una sustancia denominada aloína, cuyos principios activos son componentes de numerosas preparaciones medicinales empleadas para el tratamiento de dolores de cabeza y estomacales, así como para el combate de infecciones cutáneas, entre otras enfermedades. Además, la utilización de sus raíces y hojas es de gran importancia en la elaboración de cosméticos, pinturas y barnices (10, 14, 15).
En Venezuela, la expansión del área cultivada destinada a satisfacer la demanda creciente de aloína y el aumento del consumo de productos medicinales ha encontrado limitaciones debido a la carencia de técnicas de propagación comercial eficientes.
La alta esterilidad masculina que presenta la zábila dificulta la propagación sexual de esta especie. Por tanto su propagación es principalmente vegetativa a través de hijuelos. Este método presenta bajos índices de multiplicación y riesgos de diseminación de enfermedades fungosas y bacterianas (14).
El cultivo de tejidos constituye una de las alternativas tecnológicas más utilizadas para conseguir la propagación clonal rápida de cultivos que presentan bajos índices de multiplicación, puesto que se puede lograr la producción masiva de plantas sanas de alta calidad, libre de cualquier patógeno que pueda afectar el desarrollo y aprovechamiento del cultivo (6). Roy y Sakar (15) sugieren que el cultivo in vitro puede ser utilizado como una técnica de propagación rápida de zábila. Este trabajo tiene como objetivo desarrollar una metodología para la micropropagación de zábila (Aloe vera L.).
Materiales y métodos
El material vegetal usado fueron hijuelos de plantas de zábila jóvenes cultivados en macetas en el umbráculo del Laboratorio de Fisiología vegetal (10º41'12''LN y 71º38'05''LO) de la Facultad de Agronomía, Universidad del Zulia (LUZ), Venezuela. La micropropagación, se realizó en el Laboratorio de Cultivos de Tejidos de la Facultad de Agronomía de LUZ durante el período comprendido entre noviembre 2003-junio 2004 y comprendió tres fases: establecimiento, multiplicación y aclimatización.
Fase de establecimiento
Para el establecimiento se seleccionaron hijuelos sanos de tamaño comprendido entre 20 y 30 cm medidos desde la base del tallo hasta el extremo distal de la hoja más larga. A cada hijuelo se le eliminaron los restos de sustrato y raíces, y se lavaron con agua corriente y jabón líquido comercial. Posteriormente se eliminó totalmente la hoja externa de cada hijuelo y se realizó un corte transversal del follaje, quedando reducida la altura del explante a 3 cm aproximadamente. Finalmente se repitió el lavado con agua jabonosa y luego se realizó un enjuague con abundante agua corriente.
Bajo un diseño experimental completamente aleatorizado con tres tratamientos y diez repeticiones, se estudió la desinfección del material vegetal con hipoclorito de sodio (NaClO) al 1, 2 y 3% a partir de cloro comercial (5,25% NaClO), durante 10 minutos en agitación constante. En seguida en condiciones asépticas dentro de la cámara de flujo laminar se realizaron tres enjuagues consecutivos con agua bidestilada estéril.
Para el establecimiento in vitro se tomaron los explantes según los tratamientos indicados, y se les redujo el tamaño a 1 cm de altura y 0,5 cm de diámetro aproximadamente. Estos explantes fueron colocados en tubos de ensayo (100x125 mm) conteniendo 10 mL de medio de cultivo constituido por: 50% de las sales del medio de cultivo Murashige y Skoog (MS) (11), 1 mg.L-1 de tiamina-HCl, 100 mg.L-1 mioinositol, 25 mg.L 1 de cisteina, 100 mg.L-1 ácido ascórbico, 1 mg.L-1 de 6-benzylaminopurina (BAP), 30 g.L-1 de sacarosa y 10 g.L-1 de agar (FISHER®); ajustando el pH a 5,8. Los medios de cultivo fueron esterilizados en autoclave a 121°C y 1,1 kg.cm2 durante 20 min.
Los explantes fueron colocados en una cámara de incubación a una temperatura de 27°C±2°C bajo luz blanca fluorescente continua de 150 mmol.m-2.s-1. Transcurridos 15 días de cultivo se evaluaron los porcentajes de mortalidad (%M) y contaminación (%C), considerando los hongos, levaduras y bacterias como agentes contaminantes. En esta investigación se estableció como vitroplanta establecida, aquel explante que transcurrido 15 días de cultivo estaba libre de contaminantes visibles y había desarrollado al menos una hoja.
Fase de multiplicación
A partir de vitroplantas de 21 días, se estudió el efecto del seccionamiento del explante (corte transversal y transversal-longitudinal parcial) en interacción con el estado físico del medio de cultivo (semi-sólido y líquido en agitación) sobre el coeficiente de multiplicación (CM) y la altura del explante (AE).
El corte transversal se realizó a una altura promedio de 1 cm desde la base hacia la zona distal de las hojas (figura 1a), de igual manera se realizó el corte transversal-longitudinal parcial al cual se adicionó un corte longitudinal desde la zona apical hacia la zona basal abarcando las tres cuartas partes de la altura del explante (figura 1b). El medio de cultivo fue similar al descrito en la fase de establecimiento para el medio semi-sólido (figura 1c) y para el medio líquido se excluyó el agar como componente del medio de cultivo (figura 1d). Se evaluó un total de cuatro tratamientos sobre las variables CM y AE con un diseño experimental completamente aleatorizado y diez repeticiones.
Figura 1. Micropropagación de zábila. a: corte transversal del explante; b: corte transversal-longitudinal parcial; c: multiplicación en medio semi-sólido; d: multiplicación en medio líquido en agitación y e: plantas adaptadas a condiciones ex vitro.
Se colocaron cuatro explantes por envase de 250 mL de capacidad (frascos para el medio semi-sólido y Erlenmeyer para el medio líquido) los cuales contenían 20 mL del medio de cultivo. Los explantes bajo el efecto del medio líquido se colocaron en un agitador orbital a 50 rpm y los cultivados en medio semi-sólido fueron colocados en una cámara de incubación. En ambos casos las condiciones de cultivo fueron las mismas de la fase de establecimiento. Transcurridos 21 días de cultivo se evaluó el coeficiente de multiplicación definido como el número de explantes finales en relación al explante inicial y la altura del explante determinada desde la base del explante hasta la zona distal de la hoja en cm.
Fase de aclimatización
Las vitroplantas provenientes de la fase de multiplicación se transfirieron a un medio de cultivo semi-sólido de igual composición al descrito en la fase de establecimiento exento del regulador de crecimiento (BAP). Estas vitroplantas se incubaron por un período de 21 días, con la finalidad de inducir el enraizamiento de las mismas.
Después del enraizamiento, las vitroplantas se clasificaron en tres grupos de acuerdo al tamaño: pequeñas (<5 cm), medianas (5 a 10 cm) y grandes (>10 cm) y se evaluó el efecto del tamaño de la vitroplanta sobre la sobrevivencia en condiciones ex vitro. El tamaño se midió desde el extremo basal de la vitroplanta hasta el ápice de la hoja más larga. Estos tres tratamientos se analizaron a través de un diseño experimental completamente aleatorizado con 30 repeticiones por tratamiento.
Las vitroplantas fueron transplantadas a bandejas de anime (poliuretano) con 150 orificios de 70 cc de capacidad cada uno. El sustrato estuvo constituido por una mezcla de 40% de arena, 40% de abono de río y 20% de viruta de coco. Las vitroplantas se aclimataron en el umbráculo de la cátedra de Fisiología, Facultad de Agronomía-LUZ, bajo condiciones de luz natural, temperatura promedio de 35ºC y frecuencia de riego de tres veces por semana durante las dos primeras semanas y después una vez por semana el resto del periodo. Transcurridos 60 días después del transplante se evaluó el porcentaje de sobrevivencia de las vitroplantas de zábila.
En cada fase de la micropropagación los datos de las variables estudiadas fueron evaluados mediante un análisis de varianza simple y prueba de comparación de medias por Tukey, excepto las variables expresadas en porcentaje donde se realizó la comparación de proporciones complementado con la prueba exacta de Fisher. Todos los análisis estadísticos se realizaron con el programa computarizado Statistix versión 8.0 para ambiente Windows de Microsoft®.
Resultados y discusión
Fase de establecimiento
Después de 15 días de cultivo en medio de establecimiento, no se detectaron diferencias estadísticas (P<0,05) para el porcentaje de mortalidad al usar NaClO en concentraciones de 1, 2 y 3% por un periodo de 10 min. Sin embargo, se observó ennegrecimiento de los explantes a medida que se aumentó la concentración de NaClO.
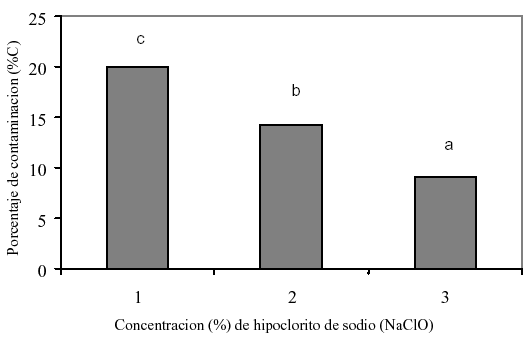
El análisis estadístico detectó diferencias significativas (P<0,05) para el porcentaje de contaminación. A medida que aumentó la concentración del NaClO disminuyó la incidencia de contaminantes, obteniendo menor contaminación con la concentración del 3% (9,09%), seguido del 2% (14,25%) y del 1% (20%) de NaClO (figura 2).
Figura 2. Efecto de la concentración de hipoclorito de sodio (NaClO) sobre el porcentaje de contaminación de los explantes de Aloe vera L, después de tres semanas de cultivo. Letras distintas de una misma columna difieren estadísticamente para P<0,05 según la prueba de comparación de proporciones complementada con el test exacto de Fisher.
El porcentaje de contaminación obtenido en esta investigación fue menor que el señalado por Matos et al. (9) quienes reportaron un 24% de contaminación al utilizar 15% de una solución de cloro comercial (5,25% de NaClO), seguido de la aplicación de un producto antibacterial y antimicótico (Gerdex) por 20 min, en cada caso. Sin embargo, en ambos trabajos los agentes contaminantes observados en mayor proporción fueron hongos y levaduras. En esta investigación la diferencia en cuanto al porcentaje de contaminación pudo ser debida al uso de un explante de tamaño pequeño (1 cm de altura y 0,5 cm de diámetro aproximadamente), y al uso de plantas donadoras creciendo en condiciones de umbráculo, tal como es recomendado en la literatura (2).
Liao et al. (8), utilizaron un protocolo de desinfección previamente establecido más complejo, que consistió en un lavado con agua corriente bajo chorro durante 24 h; seguido de una desinfección superficial con etanol al 70% v/v durante 1 min y luego una desinfección en 0,1% de HgCl2 p/v durante 10 min, finalmente realizaron cinco enjuagues con agua desionizada esterilizada. Es evidente que el protocolo de desinfección propuesto en esta investigación es más sencillo que el reportado por Matos et al. (9) y Liao et al. (8).
Fase de multiplicación
Después de 21 días de cultivo en el medio de multiplicación el análisis estadístico no detectó diferencias para el efecto del estado físico del medio de cultivo (semi-sólido y líquido en agitación) en interacción con el manejo del explante, sobre el CM (cuadro 1); obteniéndose un promedio general de 3,75 brotes por explante inoculado. No obstante, en A. vera var. chinensis (Haw) y A. barbadensis, se han reportado CM superiores de 15 y 9, brotes/explante respectivamente (8, 10); en medios semi-sólidos, pero la composición del medio de cultivo varió fundamentalmente en las concentraciones y relaciones de los reguladores de crecimiento.
Caudro 1. Efecto del estado físico del medio de cultivo sobre la alturade la vitroplanta de Aloe vera L., después de 21 días de cultivo. Letras distintas difieren estadísticamente para P<0,01 según la prueba de comparación de media de Tukey.
| Estado físico del medio de cultivo | Altura de vitroplanta (cm) |
| Líquido en agitación | 3,85a |
| Semi-sólido | 2,83b |
Los resultados obtenidos en esta investigación favorecen la elección de medios de cultivo líquidos para el establecimiento de un protocolo más sencillo, eficiente y rentable en la fase de multiplicación; ya que la exclusión del agar o cualquier otro agente gelificante en los medios de cultivo puede disminuir hasta un 60% los costos del medio (13). Además la etapa de elaboración de los medios de cultivo se simplifica y se agiliza el proceso de transferencia de los explantes en el nuevo medio de cultivo; ya que sólo se agregan al envase, a diferencia de la transferencia al medio semi-sólido que requiere el cuidado de colocarlos en la posición y profundidad adecuada. Por otra parte el uso de medios líquidos abre la posibilidad de la automatización de la micropropagación (13).
El estado físico del medio arrojó diferencias significativas (P<0,01) para la variable: altura de las vitroplantas (cuadro 1). Se obtuvieron vitroplantas de mayor altura con un promedio de 3,85 cm al usar el medio de cultivo líquido en agitación; mientras que, en medio de cultivo semi-sólido se obtuvo un promedio de 2,83 cm. Este señalamiento es similar al reportado por Kawiak et al. (7) en Drocera anglica, quienes obtuvieron mayor crecimiento al cultivarla en medio de cultivo líquido en agitación.
La mayor altura de las vitroplantas de zábila en el medio de cultivo líquido pudo ser una consecuencia de una mayor disponibilidad de los nutrientes; ya que se ha señalado que la absorción de éstos se encuentra reprimida en los medios semi-sólidos (17). Sin embargo, una de las desventajas del uso de medios de cultivo líquidos es la hiperhidricidad que pueden desarrollar las vitroplantas (3, 5). Este fenómeno no fue observado en esta investigación, probablemente por la acción de agitar constantemente el medio de cultivo. La agitación constante permite una mayor aireación del medio de cultivo líquido siendo una de las recomendaciones en la literatura para evitar o disminuir el efecto de la hiperhidricidad de los tejidos (12).
Fase de aclimatización.
Previo a la fase de aclimatización se observó que las vitroplantas comenzaron a emitir raíces después del sexto día de cultivo in vitro en medio sin regulador de crecimiento y al cabo de tres semanas mostraron un buen desarrollo del sistema radical. Igualmente Roy y Sarkar (15) observaron el desarrollo de raíces en el medio MS sin regulador de crecimiento después de cinco semanas y un sistema radical bien desarrollado después de siete semanas en la micropropagación de A. vera.
El análisis estadístico no mostró diferencias significativas (P<0,01) para el porcentaje de sobrevivencia en función del tamaño de las vitroplantas. Después de 60 días de adaptación a las condiciones ex vitro (figura 1e), todas las plantas estaban vivas y mostraron un crecimiento uniforme a pesar de las diferencias de tamaño al momento del transplante.
Durante las fases iniciales de la micropropagación las vitroplantas crecen en medios de cultivo que contienen azúcares, vitaminas y otras sustancias orgánicas, lo que determina el desarrollo heterótrofo o mixótrofo de los mismas (nula o baja capacidad fotosintética, respectivamente). Sin embargo, durante la fase de adaptación estas plantas son forzadas a ser completamente autótrofas y a sintetizar los compuestos orgánicos necesarios a partir de minerales, agua, CO2 y luz.
Es muy probable que la capacidad de las vitroplantas de zábila para adaptarse a condiciones ex vitro sin mayor inconveniente, se debió a que esta especie posee un mecanismo fotosintético ácido crasuláceo y al pasar de la condición heterótrofa (in vitro) a autótrofa (ex vitro) posee mayor resistencia a la pérdida de agua por excesiva transpiración; lo cual se ha reportado como una de las principales causas de muerte de vitroplantas en esta fase (1).
Queda demostrado que las vitroplantas de zábila pueden superar la adaptación a condiciones ex vitro, siendo este uno de los objetivos de la fase de aclimatización como es señalado por Agramante (1).
Con esta metodología es posible obtener una planta de zábila adaptada a condiciones ex vitro aproximadamente en tres meses.
Conclusiones
La desinfección de los explantes para la fase de establecimiento fue exitosa al utilizar 3% de NaClO durante 10 minutos, en agitación constante.
En la fase de multiplicación se logró un mayor tamaño de las vitroplantas en el medio de cultivo líquido.
La metodología seguida para la fase de aclimatización fue exitosa y se logró obtener vitroplantas adaptadas a condiciones ex vitro.
Literatura citada
1. Agramonte, D., F. Jiménez y M. Dita. 1998. Aclimatación. p. 193-206. En: Pérez J. (Ed.). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas. 1era edición. Universidad Central de las Villas. Santa Clara, Cuba. [ Links ]
2. Alvarado, Y. 1998. Contaminación microbiana en el cultivo in vitro. p. 81-104. En: Pérez J. (Ed.). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas. 1era edición. Universidad Central de las Villas. Santa Clara, Cuba. [ Links ]
3. Debergh, P.C. 1983. Effects of agar brand and concentration on the tissue culture medium. Physiol. Plant. 59:270-276. [ Links ]
4. Esteva, O. 1981. Planta de los jardines de Venezuela. Ediciones Armitano C.A. Caracas, Venezuela. 404 p. [ Links ]
5. Etienne H. y M. Berthouly. 2002. Temporary immersion systems in plant micropropagation. Plant Cell Tissue and Organ Culture 69:215-231. [ Links ]
6. Hurtado, D. y M.E. Merino. 1994. Cultivo de tejidos vegetales. 3era Edicion. Editorial Trillas. S.A. de C.V. México. 232 p. [ Links ]
7. Kawiak, A., A. Krolicka y E. Lojkowoska. 2003. Direct regeneration of Drosera from leaf explants and shoot tips. Plant Cell Tissue and Organ Culture 75:175-178. [ Links ]
8. Liao, Z., M. Chen, F. Tan, X. Sun y K. Tang. 2004. Micropropagation of endangered Chinese aloe. Plant Cell Tissue and Organ culture 76:83-86. [ Links ]
9. Matos, A., J. Molina y D. Acosta. 2000. Establecimiento de una metodología eficiente para el cultivo in vitro de Aloe vera L. Ciencia 8(3):280-284. [ Links ]
10. Meyer, H.J y L. Van Staden. 1991. Rapid in vitro propagation of Aloe barbadensis Mill. Plant Cell Tissue and Organ Culture 26:167-171. [ Links ]
11. Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15:473-497. [ Links ]
12. Orellana, P. 1998. Propagación vía organogénesis. p. 151-178. En: Pérez J. (Ed.). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas. 1era edición. Universidad Central de las Villas. Santa Clara, Cuba. [ Links ]
13. Pérez, J., E. Jiménez y D. Agramante. 1998. Propagación vía organogénesis. p. 179-190. En: Pérez J. (Ed.). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas. 1era edición. Universidad Central de las Villas. Santa Clara, Cuba. [ Links ]
14. Rincón, V.R. 1998. Micropropagación en Zábila (Aloe barbadensis Mill), a través de cultivo in vitro utilizando meristemos vegetativos. Monografía. 35 p. [ Links ]
15. Roy, S.C. y A. Sarkar. 1991. In vitro regeneration and micropro-pagation of Aloe vera L. Scientia Horticulturae 47:107-113. [ Links ]
16. Schnee, L. 1973. Plantas comunes de Venezuela. Universidad central de Venezuela. Caracas Venezuela. 737 p. [ Links ]
17. Smith, M. y L. Spoomer. 1995. Vessels, gels, liquid media and support systems. p. 145-163. En: J. Aitken-Christie, T. Kozai, M.A.L. Smith (Eds.). Automation and environmental control in plant tissue culture. Kluwer Academic Publishers, Dordrecht. [ Links ]