Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.48 n.4 Maracaibo dic. 2007
Estudio clínico-epidemiológico sobre pediculosis capitis en escolares de Coro, estado Falcón, Venezuela.
Dalmiro Cazorla, Aixa Ruiz y María Acosta.
Laboratorio de Entomología, Parasitología y Medicina Tropical (LEPAMET), Centro de Investigaciones Biomédicas, Universidad Nacional Experimental “Francisco de Miranda”. Coro, Venezuela. Correo electrónico: Lutzomyia@hotmail.com.
Autor de correspondencia: Dalmiro Cazorla. Laboratorio de Entomología, Parasitología y Medicina Tropical (LEPAMET), Centro de Investigaciones Biomédicas, Universidad Nacional Experimental Francisco de Miranda, Apartado 7403. Coro 4101, Venezuela. Correo electrónico: Lutzomyia@hotmail.com. Telefax: 58(268)2521668.
Resumen. Entre marzo-julio de 2003, se realizó un trabajo para estudiar aspectos epidemiológicos y clínicos de la pediculosis capitis en 327 (175 varones y 152 mujeres) escolares de un sector de la ciudad de Coro, estado Falcón, Venezuela. El diagnóstico ectoparasitológico se realizó por observación directa de huevos, estados imaginales y/o pre-imaginales sobre el cuero cabelludo y/o pelo de la cabeza. Los resultados revelaron una prevalencia de pediculosis capitis del 28,8% (94/327), con porcentajes de infestación significativamente mayores en las niñas (84,0 vs. 15,9%) [Odds Ratio (OR) = 11,4; p = 0,0001] y los escolares con longitudes de cabello mayores de 3 cm (OR = 11,0; p = 0,0001), sin embargo, no fueron diferentes entre grupos de edades, razas, color o tipos de pelo (P > 0,05). Se detectó un predominio de liendres (85,1%) ubicadas mayormente entre 3 y 5 cm del cuero cabelludo (27,7 y 21,3%), en todas las regiones de la cabeza (39,4%). Los síntomas significativamente asociados a pediculosis fueron el prurito (18% en niños infestados y 9,5% en los no infestados), con predominio nocturno (19,2% de los casos), y las adenomegalias (7,3% en niños infestados y 5,5% en los no infestados) que prevalecieron en la región cervical (14,9%) (p = 0,0001). Dentro de otros posibles factores de riesgo significativamente involucrados en la dinámica de transmisión y mantenimiento de la infestación, resaltan el bajo estrato social (OR = 2,4; p = 0,02), el hacinamiento (≥ 2 persona/cama; OR = 18,4; p = 0,0001), el intercambio de peines (OR = 3,8; p = 0,0001), tener convivientes con pediculosis (OR = 2,8; p = 0,0001), y haber tenido una infestación anterior (OR = 9,5; p = 0,0001).
Palabras clave: Pediculosis, Pediculus capitis, escolares, epidemiología, clínica, Venezuela.
Clinical and epidemiological study of pediculosis capitis in schoolchildren from Coro, Venezuela.
Abstract. Between march-july 2003, a cross-sectional survey was conducted to investigate clinical and epidemiological data on Pediculus capitis infestation among 327 (175 males and 152 females) primary school age children of an urban sector of Coro city, from the semiarid region of Falcon state, north-western Venezuela. Children were evaluated ectoparasitologically by visual inspections of heads. Overall prevalence was 28.8% (94/327). Pediculosis capitis infestation rates were significantly higher in girls (84.0 vs. 15. 9%) [Odds Ratio (OR) = 11.4; p = 0.0001] and schoolchildren with hair length > 3cm (OR = 11.0; p = 0.0001), nevertheless these were not significantly different among age groups, races, colour and type of hair (P > 0.05). Among the clinical findings, only head pruritus (18 vs 9.5%), especially at night (19.2% cases), and lymphadenopathy (7.3 vs. 5.5%) mostly located at the cervical region (14.9%), showed significantly higher percentages in infested children than in uninfested ones. Of interest was that lower socioeconomic levels (OR = 2.4; p = 0.02), high levels of overcrowding conditions (≥ 2 persons/bed: OR, 18.4; p = 0. 00001), sharing of combs and brushes (OR = 3.8; p = 0.0001), living with infested people (OR = 2.8; p = 0.0001), and showing previous infestation (OR = 9.5; p = 0.0001), also appeared to be significant factors associated with transmission and maintenance of pediculosis capitis among school children.
Key words: Pediculosis, Pediculus capitis, epidemiology, schoolchildren, clinic, Venezuela.
Recibido: 25-10-2006. Aceptado: 01-03-2007.
INTRODUCCIÓN
Pediculus capitis (P. humanus capitis), o piojo de la cabeza, es el agente etiológico de la pediculosis capitis humana (1, 2).
La pediculosis capitis es una de las ectoparasitosis más frecuentemente detectadas, especialmente en niños en edad escolar, estimándose en cientos de millones el número de casos en el globo terráqueo (1, 3, 4). No obstante, las tasas de infestación varían de lugar en lugar, registrándose en algunos países más de la mitad de los escolares infestados (1, 5). Dentro de los factores que permiten el mantenimiento de estas altas tasas, se encuentran la existencia de numerosos pediculicidas inefectivos, su uso incorrecto, y al desarrollo de cepas resistentes de P. capitis (6, 7), así como también a factores propios e intrínsecos del hospedador humano, tales como sexo, edad, raza, status socio-económico, y características del pelo (8-10).
A juzgar por las referencias de la Organización Mundial de la Salud (OMS) (1), en Venezuela no existen estadísticas ni registros epidemiológicos específicos y obligatorios de pediculosis capitis, lo que lleva a pensar que a la ectoparasitosis se le considera un problema de salud de poco interés (11). Al piojo humano que parasita la cabeza se le ha infectado experimentalmente con el agente etiológico del tifus epidémico Rickettsia prowazekii, y recientemente se ha evidenciado su infección natural con la bacteria Bartonella quintana, agente etiológico de la fiebre las trincheras (trench fever), por lo que tiene un papel en la transmisión de esta enfermedad (12, 13). Sin embargo, clásicamente no se le atribuye la transmisión directa de patógenos, aunque si la infestación no se trata puede ocasionar infecciones secundarias en la piel por el rascado del cuero cabelludo irritado (10). Además, los individuos manifiestan muchas veces reacciones alérgicas a la picada y a los excrementos, y prurito, lo que lleva eventualmente a una falta de atención y concentración del escolar, excoriaciones, conjuntivitis, linfoadenopatía e, inclusive, aunque muy rara vez, a elefantiasis en el oído externo, y en condiciones extremas de pobreza y abandono, el ectoparásito puede ocasionar despigmentación y adelgazamiento del cuero cabelludo, anemia crónica, miasis secundaria, plica polónica (tricoma) y complicaciones renales y reumáticas (14-20).
Tal como lo señalan Gratz (1), Clore y Longyear (16), Hensel (21) y Manrique y col. (22), la pediculosis capitis afecta al núcleo familiar no sólo por las manifestaciones clínicas que ocasiona, sino también desde los puntos de vista económico, emocional y social. Económicamente, debido a los costos relativamente altos que se deben sufragar para su medicación, y a lo cual se deben añadir los gastos de lavado doméstico y/o lavandería comercial, y el tiempo que se debe emplear para ésto. Desde el punto de vista emocional, la familia se conmociona al tener la creencia de que los piojos de la cabeza son el producto de tener una vivienda sucia. Por otra parte, los escolares son muchas veces enviados a sus hogares, y no se les permite el regreso a clases hasta que no se les desparasite, lo que es causa de vergüenza para sus representantes, y muchas veces reciben el rechazo social de amigos y vecinos. Así mismo, es importante mencionar que estudios realizados con dibujos en niños, mostraron que éstos asociaron los piojos de la cabeza con ansiedad y miedo, i.e., entomofobia (7, 23, 24).
Como bien lo indican Borges y Mendes (10), la problemática de la pediculosis capitis se comprende mucho mejor si se realizan los estudios a nivel regional, ya que las tasas de prevalencia pueden verse influenciadas por las características sociales, culturales y genéticas propias de una población.
Todos estos inconvenientes planteados anteriormente, motivaron a realizar este estudio clínico-epidemiológico sobre la pediculosis capitis, en un intento por relacionar las tasas de infestación con el sexo, raza, longitud y características del pelo, status socioeconómico, hábitos higiénicos y manifestaciones clínicas en escolares de la ciudad de Coro, capital del estado Falcón, en la región Nor-Occidental de Venezuela.
MATERIALES Y MÉTODOS
El estudio de tipo descriptivo, prospectivo y transversal, se llevó a cabo entre marzo y julio de 2003, en 327 niños, 175 varones (46,5%) y 152 mujeres (53,5%), de 6-15 (![]() = 8,68 ± 2,07) años de edad, que representaron la matrícula de la Escuela Básica “Pía de Andara”. La misma se encuentra ubicada en el sector marginal periférico “La Cañada” de la ciudad de Coro (Lat.: 11°24´N; Long.: 69°40´O), capital del Estado Falcón, en la región semiárida nor-occidental de Venezuela, cuyos detalles bioclimáticos ya se han reseñado en una publicación anterior (25).
= 8,68 ± 2,07) años de edad, que representaron la matrícula de la Escuela Básica “Pía de Andara”. La misma se encuentra ubicada en el sector marginal periférico “La Cañada” de la ciudad de Coro (Lat.: 11°24´N; Long.: 69°40´O), capital del Estado Falcón, en la región semiárida nor-occidental de Venezuela, cuyos detalles bioclimáticos ya se han reseñado en una publicación anterior (25).
Los padres y representantes, junto con sus hijos escolares y las autoridades del plantel, fueron notificados acerca de los objetivos del estudio antes de su inclusión en el mismo, y previa firma del consentimiento informado por escrito. Así mismo, a los padres y representantes y a la comunidad en general, se les dictaron charlas informativas y educativas sobre todo lo relacionado con la pediculosis y su prevención. Se siguieron las normas de bioética establecidas en la Declaración de Helsinski de la Asociación Médica Mundial en su versión adoptada en la LII Asamblea General de Edimburgo del año 2000.
La evaluación clínica de los niños se realizó con especial énfasis en la búsqueda de signos y síntomas generalmente asociados con pediculosis capitis, incluyendo, entre otros, excoriaciones, prurito, ulceraciones, adenopatías cervicales y/o submaxilares y pápulas.
El examen ectoparasitológico para piojos se llevó a cabo mediante manipulación del cabello, el diagnóstico se realizó por observación directa, alrededor de 3-5 minutos de búsqueda, de huevos (liendres), estadios ninfales y/o adultos de P. capitis sobre el cuero cabelludo y cabello. Se registró la distancia de las liendres al cuero cabelludo, y la región de la cabeza donde se localizaron más frecuentemente los piojos. Se consideró como positiva para pediculosis, la presencia de al menos un estadio trófico del ectoparásito (adulto o ninfa), o de un huevo que contenía un embrión aparentemente viable o desarrollado, de acuerdo a criterio de Pollack y col. (26). Así mismo, se detallaron en cada escolar la raza (color de piel: negra y no negra) (10), sexo, edad, y las características del pelo: longitud, color y tipo. En relación al tipo de pelo, se tomó el siguiente sistema de clasificación: liso, ondulado y rizado (10). El color del pelo se clasificó en claro (rubio y rojizo) y oscuro (negro y castaño) (10). Para las longitudes, se siguió el esquema de: cortos (< 3 cm) y mediano-largo (>3 cm). A los niños que resultaron positivos, y sus convivientes con diagnóstico de la ectoparasitosis, se les suministró tratamiento pediculicida.
A cada padre o representante se le entregó una encuesta ad hoc, para indagar sobre aspectos socio-económicos de higiene personal y familiar. Se consideró que existía hacinamiento en un núcleo familiar, cuando habitaban más de 6 personas por casa, más de 2 personas por habitación, y 2 ó más personas por cama.
El estrato socio-económico de los núcleos familiares u hogares de los escolares, se estableció por el método de Graffar modificado por Méndez y col. (27), una metodología estandarizada y aceptada a nivel mundial.
La relación de las manifestaciones clínicas y la identificación de los factores de riesgo asociados con la pediculosis capitis se determinó mediante las pruebas estadísticas de Chi cuadrado (X2) y X2 de Mantel - Haenczel. Cuando se encontró una asociación estadísticamente significativa, la fuerza de dicha asociación entre los factores y la pediculosis capitis, se determinó mediante el cálculo de los Odds Ratio (OR) o productos de la razón cruzada o de momios. Mientras mayor sea un OR mayor será el riesgo. Se consideró como estadísticamente significativo un valor de probabilidad de P < 0,05. Los datos se analizaron mediante paquetes estadísticos MINITAB versión 13.20 (MiniTab Inc., 2000) y Statgraphics Plus for Windows 20 (Statistical Graphic Corp., 1994-1996), y Página Web para cálculos estadísticos StatPages.net (members.aol.com/johnp71/javastat.html).
RESULTADOS
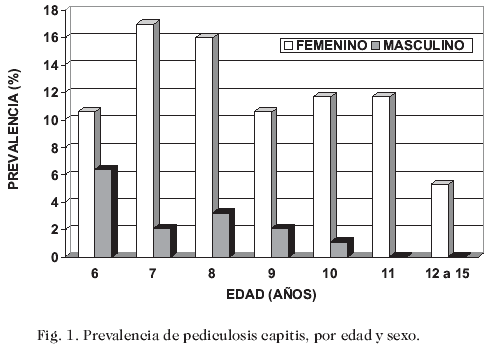
Del total de 327 niños examinados, se encontraron 94 (28,8%) escolares infestados por P. capitis, de los cuales 79 (84,0%) correspondieron al sexo femenino y 15 (15,9%) al masculino, con una diferencia estadísticamente significativa (p = 0,00001) (Figura 1).
Como se observa en la figura, la prevalencia de pediculosis capitis fue más elevada en los niños de 6, 7 y 8 años con 17,0%, 19,2% y 19,2% respectivamente, declinando fuertemente en aquellos de 12 a 15 años (5,32%); sin embargo, éstas diferencias no fueron estadísticamente significativas (p = 0,3).
Los huevos (liendres) de P. capitis fueron los estadios de desarrollo predominantes, al detectarse en el 85,1% (80/94) de los niños, aunque 14,9% (14/94) de los escolares presentaron tanto imagos como huevos del ectoparásito. Las distancias (cm) a las cuales se ubicaron las liendres con sus respectivos porcentajes de niños infestados, fueron: 0,5(2,5%), 1-1,5(16,0%), 2(10,6%), 3(27,7%), 4(5,3%), 5(21,3%), 6(2,1%), 8(7,5%), 10(3,2%) y >10 (4,3%).
El ectoparásito se ubicó en las regiones occipital, parietal, frontal y temporal en 22, 3, 11,7, 6,4 y 2,1% de los casos. Así mismo se registraron infestaciones en dos regiones cefálicas (fronto/occipital: 5,3%, y fronto/parietal, parieto/occipital, temporal/occipital: 4,3% cada uno), o en varias (generalizada) (39,4%). Al realizar el estudio clínico, se pudo observar que los signos y síntomas más frecuentemente detectados en los escolares fueron el prurito en cuero cabelludo (18% en niños infestados y 9,5% en los no infestados), y las adenomegalias (7,3% en niños infestados y 5,5% en los no infestados), ambos significativamente asociados con la pediculosis capitis (p = 0,00001 y p = 0,00001, respectivamente), resultados que se exhiben en la Tabla I. Aunque 37,2% de los escolares infestados no presentaron prurito, éste se manifestó a diferentes horarios de la manera siguiente: 19,2% de los casos durante la noche, 14,9% todo el día, 11,7% matutinalmente, y 9,6% en horas vespertinas. La mayoría de los niños infestados (74,5%) no desarrollaron adenomegalias, las cuales se presentaron con predominio en la regiones cervical y cérvico/occipital en un 14,9 y 5,3% de los casos respectivamente, seguidas de las regiones occipital y aurícula/cervical (2,1% cada una) y la auricular (1,1%).
MANIFESTACIONES CLÍNICAS ASOCIADAS CON PEDICULOSIS CAPITIS EN ESCOLARES
| Signos y síntomas | Infestados Nº (%) | No Infestados Nº (%) | p |
| Adenomegalias | 24 (7,3) | 18 (5,5) | 0,00001* |
| Excoriaciones | 11 (3,4) | 14 (4,3) | 0,1 |
| Pápulas | 0 (0,0) | 7 (2,1) | 0,2 |
| Úlceras | 0 (0,0) | 1 (0,3) | 1,0 |
| Eritema | 1 (0,3) | 6 (1,8) | 0,7 |
| Escamas | 7 (2,1) | 17 (5,2) | 1,0 |
| Vitiligo | 2 (0,6) | 3 (0,9) | 1,0 |
| Conjuntivitis | 2 (0,6) | 3 (0,9) | 1,0 |
| Prurito | 59 (18,0) | 31 (9,5) | 0,00001* |
* Estadísticamente significativo.
Cuando se compararon las prevalencias por piojos con respecto a la raza, se observó que los individuos de piel negra exhibían los porcentajes mayores (29,5%), sin embargo, estas diferencias no fueron estadísticamente significativas (p = 0,7), tal como se observa en la Tabla II.
CARACTERÍSTICAS DEL PELO Y RAZA DE LA POBLACIÓN DE ESCOLARES Y SU ASOCIACIÓN CON PEDICULOSIS CAPITIS
| Característica | Infestados Nº (%) | No Infestados Nº (%) | Total Nº (%) | P |
| Raza | ||||
| Negra | 69 (29,5) | 165 (70,5) | 234 (71,6) | 0,7 |
| No negra | 25 (26,9) | 68 (73,1) | 93 (28,4) | |
| Color de pelo | ||||
| Oscuro | 92 (29,5) | 220 (70,5) | 312 (95,4) | 0,2 |
| Claro | 2 (13,3) | 13 (86,7) | 15 (4,6) | |
| Tipo | ||||
| Liso | 46 (25,4) | 135 (74,6) | 181 (55,4) | 0,1 |
| Ondulado | 33 (29,7) | 78 (70,3) | 111 (34,0) | |
| Rizado | 15 (42,9) | 20 (57,1) | 35 (10,7) | |
| Longitud | ||||
| £ 3 cm (Corto) | 12 (7,7) | 144 (92,3) | 156 (47,7) | 0,00001* |
| >3 cm (mediano-largo) | 82 (48,0) | 89 (52,1) | 171 (52,3) |
|
* Estadísticamente significativo.
El análisis de las características del color (oscuro/claro), y el tipo del pelo (liso/ondulado/rizado), reveló que las mismas no poseen una asociación significativa con la infestación por P. capitis de los escolares (p = 0,2; p = 0,1, respectivamente) (Tabla II).
Como se aprecia en la Tabla II, los escolares con longitud de pelo mayor de 3 cm (mediano-largo) presentaron un porcentaje de infestación significativamente mayor (48,0 vs. 7,7%) (p = 0,00001).
Dentro de las características de higiene personal, se encontraron significativamente asociadas a pediculosis captitis, tal como lo reveló el análisis de X2 (Tabla III), el intercambio de peines y/o cepillos (p = 0,00001), tener convivientes con pediculosis (P = 0,00001) y haber tenido una infestación anterior (p = 0,00001).
CARACTERÍSTICAS DE HIGIENE PERSONAL Y SOCIO-ECONÓMICAS DE LA POBLACIÓN ESCOLAR Y SU ASOCIACIÓN CON PEDICULOSIS CAPITIS
| Característica | Infestados Nº (%) | No Infestados Nº (%) | Total Nº (%) | p |
| Intercambio peines y/o cepillos | ||||
| Sí | 76 (38,4) | 122 (61,6) | 198 (60,6) | 0,00001* |
| No | 18 (14,0) | 111 (86,1) | 129 (39,5) | |
| Convivientes con pediculosis | ||||
| Sí | 68 (38,2) | 110 (61,8) | 178 (54,4) | 0,00001* |
| No | 26 (17,5) | 123 (82,6) | 149 (45,6) | |
| Frecuencia de lavado de pelo | ||||
| 1 vez | 23 (25,3) | 68 (74,7) | 91 (27,8) | 0,5 |
| ³ 2 | 71 (30,1) | 165 (69,9) | 236 (72,2) | |
| Infestación anterior | ||||
| Sí | 83 (44,6) | 103 (55,4) | 186 (56,9) | 0,00001* |
| No | 11 (7,8) | 130 (92,2) | 141 (43,1) | |
| Tenencia de mascotas | ||||
| Sí | 72 (30,8) | 162 (49,5) | 234 (71,6) | 0,3 |
| No | 22 (23,7) | 71 (76,3) | 93 (28,4) | |
| Jugar con mascotas | ||||
| Sí | 32 (26,7) | 88 (73,3) | 120 (36,7) | 0,6 |
| No | 62 (30,0) | 145 (70,1) | 207 (63,4) | |
| Jugar en piso de tierra | ||||
| Sí | 42 (28,4) | 106 (71,6) | 148 (45,3) | 1,0 |
| No | 52 (29,1) | 127 (71,0) | 179 (54,7) | |
| Personas/casa | ||||
| ³ 6 | 58 (29,0) | 142 (71,0) | 200 (61,2) | 1,0 |
| <6 | 36 (28,4) | 91 (71,7) | 127 (38,8) | |
| Personas/habitación | ||||
| ³ 3 | 47 (28,0) | 121 (71,0) | 168 (51,4) | 0,9 |
| <3 | 47 (29,6) | 112 (70,4) | 159 (48,6) | |
| Personas/cama | ||||
| 1 | 18 (8,7) | 190 (91,4) | 208 (63,6) | 0,00001* |
| ³ 2 | 76 (63,9) | 43 (36,1) | 119 (36,4) | |
| Nivel socio-económico (Graffar) | ||||
| I, II, III | 9 (15,0) | 51 (85,0) | 60 (18,4) | 0,02* |
| IV, V | 85 (31,8) | 182 (68,2) | 267 (81,7) |
|
* Estadísticamente significativo.
En relación con las características socio-económicas, se halló que el status socio-económico de pobreza y pobreza crítica (estratos IV y V del método de Graffar) (p = 0,02) y el hacinamiento de 2 ó más personas por cama (P = 0,00001), estaban significativamente asociadas con la pediculosis capitis (Tabla III).
La obtención de los Odds Ratio (OR; 95% intervalo de confianza) permitió detectar como factores de riesgo significativamente asociados a la infestación por P. capitis ser del sexo femenino (OR = 11,4; 6,1 – 20,5), poseer longitud de pelo mayor de 3 cm (OR = 11,0; 5,2 – 21,0), intercambiar peines y/o cepillos (OR = 3,8; 2,1 – 6,6), convivir con personas con pediculosis capitis (OR = 2,8; 1,6 – 4,7), haber tenido una infestación anteriormente (OR = 9,5; 4,7 – 18,7), dormir en una misma cama 2 ò más personas (OR = 18,4;10,0 – 34,1), y estar en núcleos familiares de estratos IV y V en la escala de Graffar (OR = 2,4; 1,2 – 5,5).
DISCUSIÓN
No es fácil comparar las tasas de infestación por P. capitis obtenidas en los diferentes países, y aun dentro del mismo país, ya que los estudios se hacen en diferentes épocas, años y poblaciones que poseen divergencias, entre otras, de tipo socio-económico, educacional y/o cultural. Así, las tasas obtenidas en el presente estudio son menores que las reportadas en Perú (100%), Panamá (96%), Argentina (38-61,4%), Uberlandia y Ceará, Brasil (35 y 56%, respectivamente), Valera, región andina venezolana (58-73%), y mayores a las de Chile (21,7- 25,4%), Manaus, Brasil (28%), Costa Rica (10%), y Caracas, D.F., Venezuela (11,4%) (1, 10, 11, 28-34).
El sexo de los escolares aparece como un factor de riesgo significativamente asociado a la transmisión de P. capitis en el sector “La Cañada” de la ciudad de Coro, Estado Falcón, Venezuela (OR = 11,4). El hecho de que se detectaran porcentajes significativamente mayores de infestación de pediculosis capitis en las niñas que en los varones (84,0% vs. 15,9%), puede explicarse, en primer término, por el hallazgo de que los últimos tenían el cabello más corto, lo que podría eliminar vestigios de infestaciones previas, además de que el diagnóstico y control de la ectoparasitosis resulta más fácil y rápido (10, 35). Así mismo, el cabello largo, y muchas veces suelto de las niñas, ayuda a la diseminación del ectoparásito cuero cabelludo-cuero cabelludo, al tener éste mayor superficie de contacto para asirse y por la dificultad para el cuidado y revisión del mismo (34). Esta aseveración encuentra apoyo en los resultados del presente estudio al detectarse que la longitud del pelo es un factor significativamente asociado a la infestación por P. capitis (OR = 11,0). Así mismo, también debe tomarse en consideración que muchas veces las niñas poseen contactos sociales más estrechos que los varones, teniendo la costumbre de intercambiar objetos de uso personal, tales como peines y cepillos, factor este último que también se encontró significativamente asociado a la pediculosis capitis en los escolares del presente estudio (OR = 3,8) (28, 35, 36). Estas diferencias entre géneros en los porcentajes de infestación coinciden con la mayoría de las investigaciones previas a nivel global (1, 36, 37).
En el presente estudio a pesar de que los grupos etarios de 6, 7 y 8 años exhibieron las mayores tasas de infestación, estas diferencias no fueron estadísticamente significativas cuando se compararon con los restantes grupos de edades, lo que sugiere que todos los escolares tenían similares condiciones de riesgo para adquirir la infestación por P. capitis.
Se puede usar el criterio de que la liendre sujeta al cabello, se mueve del cuero cabelludo 1 cm por mes, en la medida que el mismo crece, esto con la finalidad de estimar el tiempo de ocurrencia de la infestación (35). Catalá y col. (20) han resaltado la importancia de la medición de la distancia de las liendres con respecto al cuero cabelludo, al considerar que las infestaciones son recientes (menos de 30 días) o antiguas cuando las liendres se ubican a menos o a más de 1 cm del cuero cabelludo, mientras que al observarse los estadios móviles del ectoparásito (ninfas y/o adultos) correspondería a una infestación activa confirmada. En los escolares del presente estudio, se observó mayor cantidad de liendres en los cabellos, y a distancias del cuero cabelludo mayores de 1 cm, que de ninfas y/o adultos de P. capitis, por lo que si se aplica el criterio anterior, la mayoría de las infestaciones son antiguas. Como bien lo indican Catalá y col. (20), la estimación de este parámetro tiene mucha relevancia al momento de decidir acerca de la implementación de la medida anti-Pediculus. En este sentido, debido a que el uso indiscriminado de champúes, lociones y cremas pediculicidas puede potencialmente llevar a la aparición de resistencia por parte de las poblaciones de P. capitis, y problemas de toxicidad, especialmente en los niños, aunado a sus costos de adquisición (6, 38, 39), se recomienda, tal como se le indicó a las madres y/o representantes, y a la comunidad en general, emplear dichos pediculicidas en los escolares con infestación activa, y un peine fino ayudado con el pelo mojado, para retirar las liendres en aquellos niños con infestaciones antiguas (20, 40).
Usualmente se refiere que P. capitis tiende a situarse con mayor predominio en la región cefálica occipital, sin embargo, cuando la carga ectoparasitaria es elevada, se pueden detectar en cualquier área de la cabeza (40, 41), tal como se encontró en los escolares del presente estudio.
El prurito y las adenopatías con predominio nocturno y en la región cervical de la cabeza, respectivamente, fueron las únicas manifestaciones clínicas significativamente asociadas a la presencia de P. capitis, en los escolares, resultados que han sido observados por otros investigadores (17, 41-43). Ambas manifestaciones clínicas, producto de la respuesta inmune hacia los antígenos presentes en la saliva del piojo, pueden causar que los niños se estresen, particularmente en horas nocturnas al provocarles insomnio, lo que interfiere con su capacidad de atención durante el proceso de aprendizaje, además de su posible estigmatización social (17, 33, 44). En un estudio realizado en Israel, Mumcuoglu y col. (17) caracterizaron las etapas de las reacciones dérmicas hacia la picada de P. capitis como: fase I, sin síntomas clínicos; fase II, pápulas con prurito de mediana intensidad; fase III formación de pápula inmediatamente después de la picada, seguida de reacción retardada en la misma y prurito intenso; fase IV, reacción dérmica en la pápula disminuida y prurito poco intenso. Es posible que de acuerdo a esta clasificación, los niños incluidos en esta investigación presentasen pediculosis capitis en fase IV; sin embargo, en los escolares infestados no se observaron pápulas, y un 19,2 y 14,9% de éstos presentaron prurito nocturno y durante todo el día, respectivamente. Por lo tanto, las manifestaciones clínicas detectadas pudieran representar una variación regional-dependiente, por lo que urge la necesidad de realizar estudios más amplios y controlados, en un intento por caracterizar los perfiles clínicos de la infestación en la población venezolana, y particularmente en la falconiana. Es significativo comentar, que dentro de las linfadenopatías localizadas producidas por enfermedades infecciosas, especialmente a nivel pediátrico, las ocasionadas por la respuesta hacia la presencia de P. capitis generalmente se señalan a nivel occipital (45). Teniendo en cuenta que las adenopatías de ubicación cervical se encuentran mayormente asociadas a las infecciones virales del tracto respiratorio, y al hecho de que en el presente estudio las linfadenopatías cervicales asociadas a la infestación por P. capitis fueron las más prevalentes, es recomendable, por lo tanto, incluirlas en la lista de las etiologías de agrandamiento de nódulos linfáticos cervicales de los niños venezolanos (44, 45).
A pesar de que otros autores han detectado diferencias estadísticamente significativas entre los porcentajes de infestación por P. capitis en relación con la raza, el color y el tipo de pelo (1, 10, 35), en el presente estudio, no se halló una relación significativa con estas características. Esto lleva a sugerir en primer lugar, que el mestizaje predominante en el medio venezolano no permite tener una muestra más representativa de las razas y tipos y colores de pelo (11), y por otra parte, que son variaciones de tipo local, probablemente de origen genético, lo que pareciera reforzar la hipótesis según la cual estos factores asociados a la pediculosis capitis son regional-dependientes (10).
Un hecho significativo en la pediculosis capitis es que a pesar de que la prevalencia global se encuentra en incremento, aún no se conoce con exactitud la naturaleza exacta de su transmisión (46,47). Sin embargo, la mayoría de los autores concuerdan que la transmisión persona a persona (cabeza a cabeza) es una de las rutas más importantes, lo cual se potencia con el contacto cercano debido al hacinamiento (47, 48). Esto último encuentra asidero en los resultados del presente estudio, donde se obtuvo una fuerte asociación entre la pediculosis capitis y el compartir la cama con 2 ó más personas (OR = 18,4), aunado al hecho de que más de la mitad de los escolares convivían con personas infestadas (OR = 2,8) y habían tenido una infestación anterior (OR = 9,5). Otro de los modos de transmisión propuestos es mediante los fomites (49), vía que podría ser también importante en los hogares y a nivel de aula, toda vez que el intercambio de peines y/o cepillos arrojó un OR elevado de 3,8. Por otra parte, el hallazgo de que jugar en piso de tierra, no tuvo relación significativa con la infestación por P. capitis, pareciera apoyar la asunción de la poca importancia de la transmisión del piojo de la cabeza a través del contacto con el suelo (46).
Kokturk y col. (36) en un estudio epidemiológico sobre pediculosis capitis en escolares de Turquía, observaron que los niños que poseen mascotas (gatos o perros) presentaron significativamente mayores tasas de infestación que sus contrapartes que no las tenían, remarcando ser la primera vez que se reportaba tal asociación, y que además no podían explicar su mecanismo. En contraste con estos hallazgos, en el presente estudio no se detectó una relación significativa entre la ectoparasitosis y la tenencia de mascotas ni jugar con ellas.
A pesar de que en la actualidad se dispone de todo un arsenal en el mercado farmacéutico de drogas y peines anti- Pediculus, la pediculosis capitis se mantiene, al menos endémicamente, en los escolares del barrio “La Cañada” de la ciudad de Coro, estado Falcón, Venezuela. El hecho de que la mayoría (>80%) de los hogares de los escolares del sector son de estratos socio-económicos bajos y/o paupérrimos, una condición que se encontró significativamente asociada a la transmisión de P. capitis (OR = 2,4), limita la accesibilidad a adecuados pediculicidas, información, atención médica, y medidas higiénicas, lo que permite mantener un alto porcentaje de hacinamiento, intercambio de peines, tener convivientes con pediculosis, factores de riesgo claves para el contacto estrecho y cercano persona-persona, fomites-persona (46, 47), los cuales se encontraron significativamente asociados con la presencia de la infestación en los escolares del presente estudio. En este contexto de carencias y marginalidad, la pediculosis capitis no representa un problema primordial para las familias, aunado al hecho de que se subestima su importancia como patología, y de que generalmente se acude a la consulta médica por los signos y síntomas asociados a la infestación (28, 36).
A la luz de los hallazgos del presente estudio, donde se detectaron varios factores asociados a la transmisión de la pediculosis capitis (el estado socio-económico de pobreza, el dormir en hacinamiento, conductas antihigiénicas como el intercambio de peines y/o cepillos), las autoridades sanitarias al implementar las políticas de salud pública deberían tomar en cuenta este trabajo. Por lo tanto, además de darse tratamiento pediculicida, se deben mejorar las condiciones socio-económicas, educativas y culturales de la población expuesta a mayor riesgo, tanto en el ambiente familiar como escolar; esto se logra mediante la promoción de la educación para salud y su aplicación en las prácticas de higiene, el mejoramiento ambiental y sanitario de los espacios familiares y escolares y un permanente suministro de agua potable.
AGRADECIMIENTOS
Al Decanato de Investigación de la Universidad Nacional Experimental “Francisco de Miranda” (UNEFM), Coro, estado Falcón, Venezuela (Proyecto 2003-0024). A estudiantes del Programa de Medicina, UNEFM, S. Barros, H. Davelaar, L. Medina y Y. Torres,
REFERENCIAS
1. Gratz N. Human lice. Their prevalence, control and resistant to insecticides. Geneva, Suiza: WHO/CTD/WHOPES/97.8; 1997, pp 1-28. [ Links ]
2. Leo N, Hughes J, Yang X, Poudel S, Brogdon W, Barker S. The head and body lice of humans are genetically distinct (Insecta: Phthiraptera, Pediculidae): evidence from double infestations. Heredity 2005; 95:34-40. [ Links ]
3. Donaldson R. The head louse in England: prevalence amongst schoolchildren. J R Soc Health 1976; 96:55-57. [ Links ]
4. Chouela E, Abeldano A, Cirigliano M, Ducard M, Neglia V, Forgia M, Colombo A. Head louse infestations: epidemiologic survey and treatment evaluation in Argentinean schoolchildren. Int J Dermatol 1997; 36:819-825. [ Links ]
5. Taplin D, Meinking T. Pyrethrins and pyrethroids for the treatment of scabies and pediculosis. Semin Dermatol 1987; 6:125-135. [ Links ]
6. Mumcuoglu K. Control of head louse (Anoplura: Pediculidae) infestations: past and present. Am Entomol 1996; 42:175-178. [ Links ]
7. Muncuoglu K. Prevention and treatment of head lice in children. Pediatr Drugs 1999; 1: 211-218. [ Links ]
8. Sinniah B, Sinniah D, Rajeswari B. Epidemiology of Pediculus humanus capitis infestation in Malaysian school children. Am J Trop Med Hyg 1981; 30:734-738. [ Links ]
9. Arene F, Ukaulor A. Prevalence of head louse (Pediculus capitis) infestation among inhabitants of Niger Delta. Trop Med Parasitol 1985; 3:140-142. [ Links ]
10. Borges R, Mendes J. Epidemiological aspects of head lice in children attending day care centres, urban and rural schools in Uberlandia, Central Brazil. Mem Inst Oswaldo Cruz 2002; 97:189-192. [ Links ]
11. Piquero-Casals J, Piquero-Casals V, Pérez M, Quintero I, Ramírez B, Piquero Martín J. Pediculosis capitis en escolares del Distrito Sanitario N°3 en Caracas, Venezuela. Dermatología Venezolana 2004; 42:19-22. [ Links ]
12. Murray F, Torrey S. Virulence of Rickettsia prowazeskii for head lice. Ann NY Academ Sci 1975; 266:25-34. [ Links ]
13. Sasaki T, Poudel SK, Isawa H, Hayashi T, Seki N, Tomita T, Sawabe K, Kobayashi M. First molecular evidence of Bartonella quintana in Pediculus humanus capitis (Phthiraptera: Pediculidae), collected from Nepalese children. J Med Entomol 2006; 43:110-112. [ Links ]
14. Mahzoon S, Azadeh B. Elefantiasis of external ears: rare manifestation of pediculosis capitis. Acta Derm Venereol 1983; 63: 363-365. [ Links ]
15. Linardi P, Botelho J, Maria M. Crendices e falsos conceitos que dificultan açoes profilácticas con pediculose “capitis”. J Pediatria 1988; 64:248-255. [ Links ]
16. Clore E, Longyear I. Comprenhesive pediculosis screening programs for elementary school. J School Health 1990; 60: 212-214. [ Links ]
17. Mumcuoglu K, Klaus S, Kafka D, Teiler M, Miller J. Clinical observations related to head lice infestation. J Am Acad Dermatol 1991; 25:224-252. [ Links ]
18. Botero D, Restrepo M. Parasitosis Humanas. 4a Edición. Medellín (Colombia): Corporación Para Investigaciones Biológicas; 2003, p 401-404. [ Links ]
19. Reinhard K, Buikstra J. Louse infestation of the Chiribaya culture, Southern Peru: variation in prevalence by age and sex. Mem Inst Oswaldo Cruz 2003; 98 (Supl.1): 173-179. [ Links ]
20. Catalá S, Carrizo L, Córdoba M, Khairallah R, Moschella F, Nacif J, Nieto A, Torres J, Tutito R. Prevalência e intensidade da infestação por Pediculus humanus capitis en escolares de seis a onze anos. Rev Soc Bras Med Trop 2004; 37:499-501. [ Links ]
21. Hensel P. The challenge of choosing a pediculicide. Public Health Nursing 2000; 17: 300-304. [ Links ]
22. Manrique T, Cardena N, Levy J, Mondolfi A. Estudio comparativo entre una fórmula de aceite mineral vs. un champú pediculicida para el tratamiento de la infestación por piojos. Arch Venez Pueric Pediat 2000; 63:27-32. [ Links ]
23. Mumcuoglu K. Head lice in drawings of kindergarten children. Isr J Psychiatry Relat Sci 1991; 28: 25-32. [ Links ]
24. Vander Stichele R, Dezeure E, Bogaert M. Systematic review of clinical efficacy of topical treatments of head lice. BMJ 1995; 311:604-609. [ Links ]
25. Acosta M, Cazorla D, Garvett M. Enterobiasis en escolares de una población rural del Estado Falcón, Venezuela y su relación con el nivel socio-económico. Invest Clin 2002; 43: 173-181. [ Links ]
26. Pollack J, Kiszewski E, Spielman A. Overdiagnosis and consequent mismanagement of head louse infestations in North America. Pediatr Infect Dis J 2000; 19:689-693. [ Links ]
27. Méndez-Castellanos H, López M, Landaeta M, González A. Estudio transversal de Caracas. Arch Venez Pueric Pediat 1986; 49:111-115. [ Links ]
28. Villalobos C, Ranalletta M, Sarandón R, González A. La pediculosis de ayer y de hoy. Un estudio epidemiológico sobre la infestación de Pediculus capitis en niños de La Plata, Buenos Aires, Argentina. Entomol Vect 2003; 10:567-577. [ Links ]
29. Meinking T, Taplin D. Comparative Efficacy of treatment for Pediculus capitis Infestations. Arch Dermatol 1986; 122:267. [ Links ]
30. Taplin D, Meinking T. Pediculosis Infestations. Pediatric Dermatol 1995; 7:1480-1515. [ Links ]
31. Sagua H, Rivera AM, Zamora M, Neira I, Araya J, Maluenda R. Estudio epidemiológico de la pediculosis capitis y sarna en escolares básicos de Antofagasta, Chile, 1995. Bol Chil Parasitol 1997; 52:33-36. [ Links ]
32. Gemmato De Tedesco A, Albesiano de González H, Rojas E. Participación comunitaria para el tratamiento de pediculosis escolar en la ciudad de Valera, Venezuela. Arch Venez Med Tropical 1998; 2:37-49. [ Links ]
33. Calderón-Arguedas O, Solano M, Sánchez C. El problema de la pediculosis capitis en escolares del área metropolitana de San José, Costa Rica. Parasitol Latinoam 2003; 58:177-180. [ Links ]
34. Catalá S, Junco L, Vaporahy R. Pediculus capitis infestation according to sex and social factors in Argentina. Rev Saude Publica 2005; 39:438-443. [ Links ]
35. Mumcuoglu K, Miller J, Gofin R, Adler, B, Ben-Ishai F, Almog R, Kafka D, Klaus S. Epidemiological studies on head lice infestation in Israel. I. Parasitological examination of children. Int J Dermatol 1990; 29:502-506. [ Links ]
36. Kokturk A, Baz K, Bugdayci R, Sasmaz T, Tursen U, Kaya T, Ikizoglu G. The prevalence of pediculosis capitis in schoolchildren in Mersin, Turkey. Int J Dermatol 2003; 42: 694-698. [ Links ]
37. Speare R, Buettner P. Head lice in pupils of a primary school in Australia and implications for control. Int J Dermatol 1999; 38:285-290. [ Links ]
38. Picollo M, Vassena C, Casadio A, Massimo J, Zerba E. Laboratory studies of susceptibility and resistance to insecticides in Pediculus capitis. J Med Entomol 1998; 35: 814 -817. [ Links ]
39. Burgess I. Human lice and their control. Ann Rev Entomol 2004; 49:457-481. [ Links ]
40. Nash B. Treating head lice. BMJ 2003; 326: 1256-1257. [ Links ]
41. Maguiña-Vargas C, Osores F, Farías H, Torrejón D, Alcorta T. Enfermedades por ectoparásitos: segunda parte. Dermatol Perú 2005; 15:38-50. [ Links ]
42. Morsy T, Sarwat M, Fawzi A, Arafa M, Lashen A. Some clinical features of pediculosis among school children. J Egypt Soc Parasitol 1994; 24:121-125. [ Links ]
43. Heukelbach J, Wilcke T, Winter B, Feldmeier H. Epidemiology and morbidity of scabies and pediculosis capitis in resource-poor communities in Brazil. Br J Dermatol 2005; 153:150-156. [ Links ]
44. Abdel S, El Sedfy H, El Sayed H, Abdel H, Morsy T, Salama M, Hamdi K. Seropositivity against pediculosis in children with cervical lymphadenopathy. J Egypt Soc Parasitol 1994; 24:59-67. [ Links ]
45. Tordecillas J, Joannon P, Montenegro B. Adenopatías en la infancia. Rev Ped Elec [En línea] Agosto de 2005 Vol.2 N°2: 21-24. issn 0718-0918. Disponible en: http://www.revistapediatria.cl/vol2num2/7.htm [ Links ]
46. Speare R, Buettner P. Hard data needed on head lice transmission. Int J Dermatol 2000; 39:877-878. [ Links ]
47. Canyon D, Speare R, Muller R. Spatial and kinetic factors for the transfer of head lice (Pediculus capitis) between hairs. J Invest Dermatol 2002; 119:629-631. [ Links ]
48. Burkhart CN, Burkhart CG. The route of head lice transmission needs enlightenment for proper epidemiologic evaluations. Int J Dermatol 2000; 39:878-879. [ Links ]
49. Burkhart CN. Fomite transmission with head lice: a continuing controversy. Lancet 2003; 361:99-100. [ Links ]












 uBio
uBio