Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.51 n.4 Maracaibo dic. 2010
Adenosin deaminasa como molécula coestimuladora y marcador de inmunidad celular.
Mary Carmen Pérez-Aguilar 1, Loredana Goncalves 2, Alba Ibarra 3 y Rafael Bonfante-Cabarcas 1.
1 Unidad de Bioquímica, Decanato de Ciencias de la Salud “Dr. Pablo Acosta Ortiz”, Universidad Centroccidental Lisandro Alvarado. Barquisimeto, Venezuela.
2 Laboratorio de Inmunología de Parasitosis (LABINPAR), Facultad de Ciencias, Universidad de los Andes. Mérida, Venezuela.
3 Laboratorio de Biología Celular y Microscopía Electrónica, Decanato de Ciencias de la Salud “Dr. Pablo Acosta Ortiz”, Universidad Centroccidental Lisandro Alvarado. Barquisimeto, Venezuela.
Autor de correspondencia: Mary Carmen Pérez-Aguilar. Unidad de Bioquímica, Decanato de Ciencias de la Salud, Universidad Centroccidental Lisandro Alvarado. Av. Libertador con Av. Andrés Bello. Barquisimeto 3001, Venezuela. Teléfono: 0251-2591854. Correo electrónico: marypsinap@gmail.com
Resumen.
La adenosin deaminasa (ADA), es una enzima del metabolismo de las purinas que ha sido objeto de mucho interés debido a que el defecto congénito de esta enzima causa el síndrome de inmunodeficiencia combinada severa. Una de las tres isoformas de la enzima (ecto-ADA) es capaz de unirse a la glicoproteína CD26 y a los receptores de adenosina A1 y A2B. La interacción ADA-CD26 produce una señal coestimuladora en los eventos de activación de las células T y en la secreción de IFN-g, TNF-a e IL-6. Durante dicha activación la actividad de la enzima está regulada de manera positiva por IL-2 e IL-12 y negativamente por IL-4, basado en un mecanismo de translocación. Diversos estudios señalan que los niveles séricos y plasmáticos de ADA se elevan en algunas enfermedades causadas por microorganismos que infectan principalmente a los macrófagos; así como en trastornos hipertensivos, lo cual podría representar un mecanismo compensatorio como consecuencia de la elevación de los niveles de adenosina y la liberación de mediadores hormonales e inflamatorios estimulados por la hipoxia.
Palabras clave: adenosín deaminasa, hipoxia, coestimulación, inmunidad celular, sinapsis inmunológica.
Adenosine deaminase as costimulatory molecule and marker of cellular immunity.
Abstract.
Adenosine deaminase (ADA) is an enzyme of purine metabolism which has been the subject of much interest because the congenital defect of this enzyme causes severe combined immunodeficiency syndrome. One of the three isoforms of the enzyme (ecto-ADA) is capable of binding to the glycoprotein CD26 and adenosine receptors A1 and A2B. ADA-CD26 interaction produces a costimulatory signal in the events of T cell activation and secretion of IFN-g, TNF-a and IL-6. During this activation, the enzyme activity is regulated positively by IL-2 and IL-12 and negatively by IL-4, based on the mechanism of translocation. Diverse studies suggest that seric and plasmatic levels of ADA rise in some diseases caused by microorganisms infecting mainly the macrophages and in hypertensive disorders, which may represent a compensatory mechanism resulting from increased adenosine levels and the release of hormones and inflammatory mediators estimulated by hipoxia.
Key words: adenosine deaminase, hypoxia, costimulation, cellular immunity, immunological synapse.
Recibido: 11-06-10. Aceptado: 22-07-10.
INTRODUCCIÓN
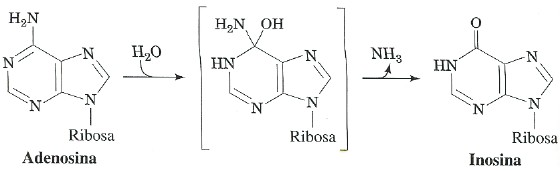
La Adenosin Deaminasa (ADA), es una enzima polimórfica del catabolismo de las purinas que cataliza la desaminación de adenosina y 2’-deoxyadenosina para producir inosina y 2’-deoxyinosina respectivamente (Fig. 1), liberándose amonio en el proceso (1). Esta enzima está ampliamente distribuida en el organismo, encontrándose actividad ADA en prácticamente todos los tejidos; sin embargo, su mayor actividad se encuentra en células linfoides, siendo más elevada en las células T que en las células B (2).
Fig. 1. Acción hidrolítica de la ADA. La ADA cataliza la desaminación de adenosina para producir inosina, liberándose amonio en el proceso.
Existen tres isoformas de la enzima denominadas ADA1, ADA2 y ecto-ADA. ADA-1, es una proteína monomérica de 40 kDa, con una actividad óptima a un pH entre 7 y 7,5 la cual es totalmente inhibida a 100 mM de eritro-9-(2-hydroxynon-3-il) adenina (EHNA), está presente en todos los tejidos y es de gran importancia en el desarrollo y proliferación de los linfocitos. La ausencia congénita de dicha isoforma en linfocitos y eritrocitos, causa el síndrome de inmunodeficiencia combinada severa (1,3). ADA-2 es un monómero de 100 kDa, con una actividad óptima a un pH de 6,5 y es resistente a la inhibición por EHNA. Es la isoforma predominante en suero, se encuentra solo en monocitos y macrófagos y es liberada por estas células cuando son estimuladas por la presencia de microorganismos en su interior (1, 4).
Aunque ADA1 y ADA2 son exclusivamente citosólicas, la tercera isoforma es considerada una ectoenzima (ecto-ADA) puesto que se ha detectado en la superficie de células B, macrófagos y células T de sangre periférica (5, 6).
Hasta el momento, se han descrito dos tipos de proteínas de unión a la ecto-ADA, una de ellas es la dipeptidil peptidasa IV (CD26) y el segundo tipo de proteínas incluye a los receptores de adenosina A1 y A2B (7, 8).
CD26 es una glicoproteína multifuncional de 110 KDa expresada en la superficie de las células epiteliales de los túbulos renales proximales, el intestino y vías biliares; en varios tipos de células endoteliales, en fibroblastos y leucocitos (9, 10). Se ha reportado que CD26 se expresa en células dendríticas foliculares (11), mientras que los receptores de adenosina se expresan en las células dendríticas mieloides (12) y plasmocitoides (13). Dicha glicoproteína ejerce diversos mecanismos de acción entre los cuales se destacan la transducción de señales (9), la adhesión a sustratos como la fibronectina y el colágeno, (10) la migración transendotelial y la regulación de la actividad ecto-ADA (9). La importancia funcional de CD26 en la cascada de señalización de células T, junto con la función de la ADA en el desarrollo de la respuesta inmune, sugiere una participación directa de la ecto-ADA en la activación de células T (14).
La adenosina es un nucleósido formado de la unión de adenina con un anillo de ribosa (también conocido como ribofuranosa), a través de un enlace glucosídico b-N9 (15). Muchas de las acciones ejercidas por dicho nucleósido son mediadas a través de receptores específicos denominados purinoceptores P1 o receptores purinérgicos (2). Los purinoceptores P1, pertenecen a la superfamilia de receptores acoplados a proteína G y están involucrados en una variedad de sistemas de transducción de señal y eventos tales como la producción de anticuerpos, la proliferación celular y la regulación positiva de la cadena a del receptor de IL-2 (CD25) (2, 4, 5).
Estudios sobre la variación de la actividad de la adenilato ciclasa empleando análogos de adenosina han permitido clasificar dichos receptores en dos tipos: A1, los cuales median la diminución en los niveles de cAMP y A2 los cuales median su incremento (5, 6). La caracterización farmacológica del subtipo de receptores A2 en diferentes tejidos permitió el descubrimiento de dos poblaciones conocidas como A2A y A2B, en base a sus afinidades por el agonista CGS21680 (7).
RECEPTORES DE ADENOSINA Y COMPLEJO ADA-CD26 EN LA REGULACIÓN DE LAS CONCENTRACIONES DE ADENOSINA
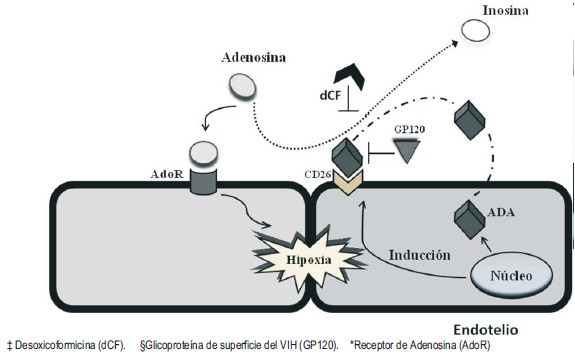
En condiciones de daño tisular, como en la isquemia generada a consecuencia de la disminución del aporte de oxígeno a los tejidos (15), las concentraciones endógenas de adenosina se elevan rápidamente (Fig. 2), y la estimulación de la proteína G acoplada a receptores de adenosina induce diversos efectos tales como vasodilatación, inhibición de la inflamación y modulación de la actividad del sistema nervioso simpático (5).
Fig. 2. Modelo de inducción coordinada de ecto-ADA y CD26. En zonas de inflamación en curso y donde disminuye el suministro de oxígeno, la hipoxia coordina la inducción de la ADA endotelial y de CD26. La enzima se sintetiza y es liberada de la célula endotelial para unirse a CD26. Debido al incremento en los niveles de ADA, la adenosina se metaboliza a inosina. La inhibición de ADA por dCF o por GP120 puede contribuir a aumentar los efectos vasculares de la adenosina durante la hipoxia aguda.
La ecto-ADA mantiene su función incluso después de unirse a CD26, catalizando la desaminación de la adenosina extracelular cuando se encuentra en elevados niveles que son tóxicos para los linfocitos (6). Eltzschig y col. (16), demostraron que durante la hipoxia se induce la unión ADA- CD26 y que la actividad ADA fue incrementada en un modelo murino de hipoxia aguda y en pacientes con hipoxia crónica. Por lo tanto, el control de las concentraciones extracelulares de adenosina, ejercida por la interacción ADA-CD26 puede ser cuantitativamente importante en caso de descenso de la regulación, inactivación de los transportadores de nucleósidos o bajo estrés metabólico, además de proveer un importante mecanismo de balance en condiciones de un elevado recambio en el metabolismo del nucleótido adenina.
La adenosina por medio de su unión a los receptores A2B disminuye de forma significativa la producción de IL-2 e induce la inactivación de macrófagos al reducir la expresión de moléculas del Complejo Mayor de Histocompatibilidad (MHC) de clase II, la actividad de la enzima óxido nítrico sintasa y la producción de citocinas pro-inflamatorias (7, 8). Por otra parte, la unión del nucleósido a los receptores A2B expresados en células T y en células dendríticas, disminuye la regulación de la respuesta inmune (7). Teniendo esto en cuenta, es previsible que la ADA por medio de la degradación de adenosina mejore las funciones de ambos grupos celulares.
Las células dendríticas, son células presentadoras de antígeno (APC) profesionales por excelencia (14, 17). En su estado inmaduro residen en la mayoría de los tejidos, actuando como centinelas ante la invasión por patógenos (14). Tras el contacto con microorganismos, citocinas inflamatorias y daño celular, pierden su capacidad fagocítica y migran hacia los órganos linfoides secundarios sometiéndose a un proceso de maduración que implica el incremento en la expresión en su superficie de moléculas del MHC y moléculas coestimuladoras como CD54, CD80, CD86 y CD83 (14).
Durante la activación de las células T se requieren al menos dos señales, la primera señal es proporcionada por la unión del péptido en el contexto del MHC al complejo TRC-CD3 y la segunda señal, por las moléculas coestimuladoras que interactúan con sus ligandos expresados en la superficie de la APC (18, 19). La función fundamental de la coestimulación en la activación de las células T se refleja en el hecho de que en ausencia de una señal coestimuladora, se induce un estado de anergia celular.
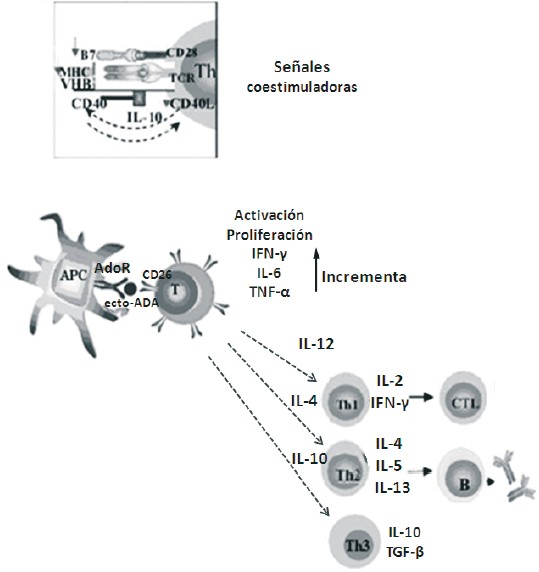
Pacheco y col. (8), observaron que la ecto-ADA anclada a la superficie de células dendríticas mediante su unión a receptores de adenosina interactúa con la proteína CD26 expresada en las células T, potenciando su activación y proliferación e incrementando la producción de los niveles de IFN-g, IL-6 y TNF-a, sin efecto alguno en la producción de citocinas del tipo Th2 (Fig. 3). Todas estas evidencias muestran que el complejo ADA-CD26 forma parte de la sinapsis inmunológica y tiene una función coestimuladora en la activación de células T (8).
Fig. 3. Interacción ADA-CD26 en la sinapsis inmunológica. La ecto-ADA anclada a la superficie de células dendríticas (APC), mediante su unión a receptores de adenosina (AdoR) interactúa con la proteína CD26 expresada en las células T, potenciando su activación y proliferación e incrementando la producción de los niveles de IFN-g, IL-6 y TNF-a, sin efecto alguno en la producción de citocinas del tipo Th2.
Cordero y col. (6), encontraron que ecto-ADA es regulada por citocinas durante la activación de células T, siendo principalmente IL-2 e IL-12 las que regulan la expresión de ecto-ADA y de CD26, mientras que IL-4 disminuye la expresión de ecto-ADA sin modificar la de CD26. Adicionalmente, observaron que la ADA circulante al igual que la transcripción y traducción del ARNm no estuvieron reguladas por las citocinas. Estos resultados, junto con la ausencia total de modulación de la ADA, la cantidad variable de la enzima purificada de membranas plasmáticas y el efecto de brefeldina A sobre la expresión de la ADA y de CD26, indica que las citocinas regulan la translocación de ecto-ADA hacia la superficie de la célula a través de un mecanismo en el que CD26 no está involucrada (19). Dado que la ecto-ADA protege a las células activadas de los efectos citotóxicos de la adenosina extracelular, es posible que este control constituya parte del mecanismo inmunoregulador de la adenosina, mediado a través de receptores purinérgicos en leucocitos.
ACTIVIDAD DE LA ADA EN LOS TRASTORNOS HIPERTENSIVOS DEL EMBARAZO
Algunos autores consideran a la ADA un marcador de inmunidad celular, puesto que su actividad plasmática y sérica se eleva en enfermedades que alteran la respuesta inmune mediada por células (2, 8). El aumento de la actividad sérica de la enzima ha sido observado en los trastornos hipertensivos del embarazo, el infarto agudo al miocardio y en diversas enfermedades infecciosas causadas principalmente por microorganismos con tropismo por los macrófagos, como es el caso de Mycobacterium tuberculosis, Leishmania mexicana, Leishmania donovani, Salmonella typhi, Virus de la Inmunodeficiencia Humana y el Virus de la Hepatitis (20-23).
Durante el embarazo, se produce una supresión transitoria de la inmunidad mediada por células, por lo que la actividad de la ADA podría desempeñar una función significativa en este proceso regulador. Diverso estudios reportan una disminución en los niveles séricos de la ADA en mujeres que cursan un embarazo normal, en comparación con mujeres no embarazadas. Estas diferencias pudiesen estar asociadas al estado de inmunosupresión que tiene lugar durante el embarazo, al incremento de las hormonas estradiol y cortisol, las cuales inhiben la actividad ADA o a mecanismos compensatorios que tienden a mantener la integridad vascular para incrementar el flujo sanguíneo uterino y placentario (24, 25).
Los trastornos hipertensivos forman parte de una serie de alteraciones vasculares que complican el curso del embarazo y que junto con las infecciones y las hemorragias, ocupan las principales causas de mortalidad materna y perinatal en todo el mundo (26). A diferencia del embarazo con curso normal, en los embarazos complicados principalmente por la pre-eclampsia, se incrementa la respuesta inmune mediada por células (27).
Aunque la etiología y la patogénesis de la pre-eclampsia no están completamente comprendidas, algunas observaciones sugieren que la invasión deficiente del trofoblasto hacia las arterias espirales es responsable de la mala adaptación de la circulación útero/placentaria (28), resultando en una remodelación deficiente de las arterias espirales, que conllevan a vasos con diámetros menores, convirtiendo al sistema placentario normal de alto flujo y baja resistencia, en un sistema de bajo flujo y alta resistencia, lo que genera una isquemia placentaria, que desencadena la liberación de sustancias que ocasionan hipoxia y lesión endotelial (29). Entre las sustancias liberadas se encuentra la adenosina, la cual tiene acción inmunomoduladora en los procesos inflamatorios y ha sido ampliamente reconocida como sustancia endógena importante que protege de las consecuencias deletéreas de la isquemia-reperfusión (30).
La invasión trofoblástica deficiente, ha sido señalada como una posible consecuencia del aumento en la producción de TNF-a por los leucocitos deciduales activados (25); por lo que, si la citocina influye en la invasión del trofoblasto a los vasos al favorecer la hipoxia, pudiera inferirse que en la placenta se establece un verdadero circuito citocina-hipoxia-citocina, ya que se ha demostrado experimentalmente cultivando explantes placentarios, que la placenta pre-eclámptica produce TNF-a e IL-1b, y que al disminuir el aporte de oxígeno a los cultivos se incrementa la producción local de ambas citocinas (31).
Por otro lado, se ha determinado que en mujeres con abortos espontáneos recurrentes, hiperemesis grávida y pre-eclampsia, la actividad ADA en suero materno y en cordón umbilical se eleva (32, 33). Los cambios en los niveles plasmáticos y séricos de la enzima durante la pre-eclampsia fueron investigados por Yoneyama y col. (34, 35), quienes detectaron una elevada actividad ADA en pacientes pre-eclámpticas, lo cual estuvo asociado con cambios en la proporción de células secretoras de IFN-g. Estos resultados fueron confirmados por Karabulut y col. (36).
Adicionalmente, Kafkasli y col. (37) evaluaron la posible correlación entre la actividad de la ADA en plasma materno, fetal y en el tejido placentario con el tipo de pre-eclampsia, observando que el incremento en la actividad ADA está relacionado con la enfermedad, pero no con la severidad de sus síntomas clínicos, lo que indica que la inducción de la actividad de esta enzima podría ser una adaptación metabólica natural a los elevados niveles de adenosina durante la hipoxia (13).
FUNCIÓN DE LAS ISOENZIMAS DE LA ADA EN HEPATITIS VIRAL Y OTRAS ENFERMEDADES HEPÁTICAS
La hepatitis B y hepatitis C, son enfermedades con una alta prevalencia mundial y con un curso clínico complejo, ocupando una posición importante dentro del grupo de enfermedades hepáticas en el mundo (38). Aproximadamente 350 millones de personas están infectadas por el Virus de la Hepatitis B (VHB), y la Organización Mundial de la Salud estima que 170 millones de personas están infectadas por el Virus de la Hepatitis C (VHC) (39, 40).
La característica biológica más importante del VHB y VHC, se debe a la probabilidad de desarrollar hepatitis crónica (40, 41). El curso natural de la infección por el VHB es variable, pudiendo evolucionar a cirrosis hepática y carcinoma hepatocelular (42), mientras que, la infección por el VHC se vuelve crónica en el 80% de los pacientes infectados, donde del 20 al 30% de estos casos progresa a cirrosis en un plazo de 20 años (38). Los mecanismos involucrados en el daño hepático producido en los pacientes infectados con estos virus no han sido completamente dilucidados; sin embargo, se han asociado a factores relacionados al virus, al hospedador y a las citocinas producidas por las células T CD4+ y células T citotóxicas (43).
El estudio de la actividad ADA, como un marcador de inmunidad celular en la hepatitis podría ser considerada una herramienta útil en el seguimiento del estado clínico de los pacientes infectados (44). En este sentido, Kalkan y col. (45) detectaron los niveles séricos de ADA en pacientes con hepatitis B aguda y crónica, observando que no existían diferencias significativas en los niveles de la enzima en ambos grupos de individuos. Por esta razón, Kaya y col. (46), llevaron a cabo un estudio en el que evaluaron los niveles de ADA, la carga viral y los niveles de las transaminasas alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) en pacientes infectados por el VHB y VHC sin tomar en consideración la cronicidad de la enfermedad, encontrando que los niveles séricos de ADA fueron más elevados en los pacientes con hepatitis C y hepatitis B al compararlos con individuos sanos; aun cuando las diferencias de la actividad ADA no fueron significativas en ambos grupos de pacientes infectados. No obstante, al agrupar los pacientes en base a la carga viral encontraron una elevada actividad ADA en los pacientes con una alta carga viral para el VHB y VHC, así como una correlación positiva entre ADA-ALT y ADA-AST. El incremento de la actividad ADA observado en estos pacientes, podría reflejar la incrementada actividad fagocítica mediada por los macrófagos, y al mismo tiempo proporcionar información útil para el diagnóstico y evaluación de la patogenia de la enfermedad.
Con la finalidad de aclarar el significado del aumento de ADA en diferentes enfermedades hepáticas, Kobayashi y col. (47), detectaron la actividad de las isoenzimas ADA1 y ADA2 en suero y células mononucleares de sangre periférica. La actividad sérica de ADA fue elevada en pacientes con hepatitis aguda, fibrosis hepática alcohólica, hepatitis crónica activa, cirrosis hepática y hepatocarcinoma, al ser comparados con la de los individuos sanos. Clínicamente, la actividad de ADA2 se correlacionó con los niveles séricos de gammaglobulina y fue significativamente menor después de la estimulación con fitohemaglutinina (PHA), aunque la actividad total de ADA se incrementó después de la estimulación.
Fernández y col. (48), definieron el patrón de neopterina y de las isoenzimas de ADA en la cirrosis hepática, ensayando los niveles séricos de ADA en presencia y ausencia de un inhibidor específico de ADA1. Los niveles séricos de ADA1, ADA2 y neopterina fueron mayores en los pacientes cirróticos que en los sanos. La actividad de ADA2 fue mayor en pacientes con cirrosis hepática causada por el VHC que en aquellos pacientes con cirrosis hepática de etiología diferente, sin hallar correlación alguna entre ADA2 y la neopterina, lo que indica que diferentes procesos fisiológicos están involucrados en el incremento de ambas proteínas (48). Todos estos hallazgos sugieren que ADA2 es una isoenzima involucrada en la insuficiencia hepática y en la infección causada por virus hepatotrópicos, por lo que podría constituir un nuevo marcador pronóstico.
CONCLUSIONES
La isoenzima ecto-ADA anclada a la superficie de las células dendríticas a través de los receptores de adenosina A2B, se une a la proteína CD26 expresada en la superficie de las células T, formando parte de la sinapsis inmunológica y proporcionando una señal coestimuladora que incrementa la activación de las células T y su polarización hacia el fenotipo Th1. El hecho de que además de CD26, ecto-ADA pueda unirse a otras proteínas de superficie, abre nuevas perspectivas en la investigación acerca de la posible función de la enzima en las interacciones que se llevan a cabo durante la ontogenia de las células del sistema inmune.
El incremento observado en los niveles séricos de ADA en diversas enfermedades, podría deberse a un mecanismo compensatorio como consecuencia de la elevación de los niveles de adenosina, así como a la liberación de mediadores hormonales e inflamatorios estimulados por la hipoxia y muestra la importancia de monocitos y macrófagos en el control de enfermedades causadas por microorganismos intracelulares.
REFERENCIAS
1. Gakis C. ADA isoenzimes ADA1 and ADA2: diagnostic and biological role. J Eur Respir. 1996; 9:632-633. [ Links ]
2. Cristalli G, Costanzi S, Lambertucci C, Lupidi G, Vittori S, Volpini R. Adenosine Deaminase: functional implications and different classes of inhibitors. Med Res Rev 2001; 21:105-128. [ Links ]
3. Ginés S, Mariño M, Mallol J, Canela EI, Morimoto C, Callebaut Christian, Hovanessian A, Casadó V, Lluis C, Franco R. Regulation of epithelial and lymphocyte cell adhesion by adenosine deaminase- CD26 interaction. Biochem J 2002; 361: 20-209. [ Links ]
4. Martín M, Huguet J, Centelles JJ, Franco R. Expression of ectoadenosine deaminase and CD26 in human T cells triggered by the TCR-CD3 complex: Possible role of adenosine deaminase as costimulatory molecule. J Immunol. 1995; 155:4630-4643. [ Links ]
5. Franco R, Valenzuela A, Lluis C, Blanco J. Enzymatic and extraenzymatic role of ecto-adenosine deaminase in lymphocytes. Immunol Rev 1998; 161:27-42. [ Links ]
6. Cordero OJ, Salgado FJ, Fernández-Alonso CM, Herrera C, Lluis C, Franco R, Nogueira M. Cytokines regulate membrane adenosine deaminase on human activated lymphocytes. J Leukoc Biol 2001; 70:920-930. [ Links ]
7. Herrera C, Casadó V, Ciruela F, Schofield P, Mallol J, Lluis C, Franco R. Adenosine A2B receptors behave as an alternative anchoring protein for cell surface adenosine deaminase in lymphocytes and cultured cells. Mol Pharmacol 2001; 59:127-134. [ Links ]
8. Pacheco R, Martinez-Navio JM, Lejeune M, Climent N, Oliva H, Gatell JM, Gallart T, Mallol J, Lluis C, Franco R. CD26, adenosine deaminase, and adenosine receptors mediate costimulatory signals in the immunological synapse. Proc Natl Acad Sci 2005; 102:9583-9588. [ Links ]
9. De Meester I, Korom S, Van Damme, Scharpe S. CD26, let it cut or cut it down. Immunol Today 1999; 20:367-375. [ Links ]
10. Gorrell MD, Gysbers V, McCaughan GW. CD26: a multifunctional integral membrane and secreted protein of activated lymphocytes. Scand J Immunol 2001; 54:249-264. [ Links ]
11. Gliddon DR, Howard CJ. CD26 is expressed on a restricted subpopulation of dendritic cells in vivo. Eur J Immunol. 2002; 32:1472-1481. [ Links ]
12. Fossetta J, Jackson J, Deno G, Fan X, Du XK, Bober L, Soudé-Bermejo A, de Bouteiller O, Caux C, Lunn C, Lundell D, Palmer RK. Pharmacological analysis of calcium responses mediated by the human A3 adenosine receptor in monocyte-derived dendritic cells and recombinant cells. Mol Pharmacol 2003; 63:342-350. [ Links ]
13. Schnurr M, Toy T, Shin A, Hartmann G, Rothenfusser S, Soellner J, Davis ID, Cebon J, Maraskovsky E. Blood 2004; 103:1391-1397. [ Links ]
14. Lanzavecchia A, Sallusto F. Dynamics of T lymphocyte responses: intermediates, effectors, and memory cells. Science 2000; 290:92-97. [ Links ]
15. Dekker GA. Risk factors for Preeclampsia. Clin Obstet and Gynecol 1999; 42:422-435. [ Links ]
16. Eltzschig HK, Faigle M, Knapp S, Karhausen J, Ibla J, Rosenberger P, Odegard KC, Peter L, Thompson LF, Colgan SP. Endothelial catabolism of extracellular adenosine during hypoxia: the role of surface adenosine deaminase and CD26. Blood 2006; 108:1602-1610. [ Links ]
17. Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature 1998; 392:245-252. [ Links ]
18. Lee KH, Holdorf AD, Dustin ML, Chan AC, Allen PM, Shaw AS. T cell receptor signaling precedes immunological synapse formation. Science 2002; 295:1539-1542. [ Links ]
19. Hershfield MS. New insights into adenosine-receptor-mediated immunosuppression and the role of adenosine in causing the immunodeficiency associated with adenosine deaminase deficiency. Eur J Immunol 2005; 35:25-30. [ Links ]
20. Valls V, Ena J, Roca V, Perez-Oteyza C, Angeles Figueredo M, Enriquez-de-Salamanca R. Significance of adenosine deaminase measurement in sera of patients with HIV-1 infection. AIDS 1990; 4:365-366. [ Links ]
21. Gakis G, Calia GM, Naitana AG, Ortu AR, Contu A. Serum and pleural adenosine deaminase activity: Correct interpretation of the findings. Chest. 1991; 99:1555-1556. [ Links ]
22. Ungerer JP, Burger HM, Bissbort SH, Vermaak WJ. Adenosine deaminase isoenzymes in typhoid fever. Eur J Clin Microbiol Infect Dis. 1996; 15:510-512. [ Links ]
23. Erel O, Kocyigit A, Gurel MS, Bulut V, Seyrek A, Ozdemir Y. Adenosine deaminase activities in sera, lymphocytes and granulocytes in patients with cutaneous leishmaniasis. Mem Inst Oswaldo Cruz.1998; 93:491-494. [ Links ]
24. Yoneyama Y, Suszuki S, Sawa R, Otsubo Y, Miuro A, Kuwabara Y, Ishino H, Kiyokawa Y, Doi D, Yoneyama K, Araki T. Serum adenosine deaminase activity and its enzymes pattern in women with norma pregnancies. Arch Gynecol Obstet 2003; 267:205-207. [ Links ]
25. Lee SJ, Hwang HS, Kim BN, Kim MA, Lee JW, Park YW, Kim YH. Changes in serum adenosine deaminase activity during normal pregnancy. J Korean Med Sci 2007; 22:718-721. [ Links ]
26. Duley L. The global impact of preeclampsia and eclampsia. Sem Perinatol 2009; 33:130-137. [ Links ]
27. Kolusari A, Kurdoglu M, Bugdayci G, Adali E, Yildizhan R, Cebi A, Demir H, Sahin G, Kamaci M. Relationship between erythrocyte catalase and serum adenosine deaminase activities in eclampsia. J Matern Fetal Neonatal Med 2009; 22:321-324. [ Links ]
28. Roberts JM, Pearson GD, Cutler JA, Lindheimer M. Summary of the NHLBI working group on research on hypertension during pregnancy. Hypertens Pregnancy 2003; 22:109-127. [ Links ]
29. Ayuk PT, Matijevic R. Placental ischaemia is a consequence rather than a cause of pre-eclampsia. Med Hiphoteses 2006; 67: 792-795. [ Links ]
30. Ryzhov S, Zaynagetdinov R, Goldstein AE, Novitskiy SV, Dikov MM, Blackburn MR, Biaggioni I, Feoktistov I. Effect of A2B adenosine receptor gene ablation on proinflammatory adenosine signaling in mast cells. J Immunol 2008; 180:7212-7220. [ Links ]
31. Benyo DF, Miles TM, Conrad KP. Hypoxia stimulates cytokine production by villous explants from the human placenta. J Clin Endocrinol Metab 1997; 82:1582-1588. [ Links ]
32. Kutlar I, Aksoy F, Koyluoglu O, Ugur MG, Balat O, Tarakcioglu M. Adenosine deaminase activity in serum and placenta of patients with anembryonic pregnancies and missed abortions. Arch Gynecol Obstet 2005; 272:124-126. [ Links ]
33. Vilchez D, Pérez-Aguilar MC, Saba S, Bonfante-Cabarcas R. Los niveles séricos de adenosin deaminasa y ácido úrico se correlacionan en pacientes gestantes con trastornos hipertensivos. Rev Chil Obstet Ginecol 2009; 74:217-224. [ Links ]
34. Yoneyama Y, Sawa R, Suzuki S, Otsubo Y, Miura A, Kuwabara Y, Ishino H, Kiyokawa Y, Doi D, Yoneyama K, Kobayashi H, Araki T. Serum adenosine deaminase activity in women with preeclampsia. Gynecol Obstet Invest. 2002b; 54:164-167. [ Links ]
35. Yoneyama Y, Sawa R, Suzuki S, Miura A, Kobayashi H, Doi D, Yoneyama K, Araki T. Relation between adenosine deaminase activities and cytokine-producing T cells in women with preeclampsia. Clin Biochem 2002; 35:303-306. [ Links ]
36. Karabulut AB, Kafkash A, Burak F, Gozukara EM. Maternal and fetal plasma adenosine deaminase, xanthine oxidase and malondialdehyde levels in pre-eclampsia. Cell Bichem Funct 2005; 23:279-283. [ Links ]
37. Kafkasli A, Karabulut AB, Atmaca R, Laurini R. Clinical correlation between adenosine deaminase activity and pre-eclampsia severity. J Int Med Res 2006; 34:247-255. [ Links ]
38. Williams R. Global challenges in liver disease. Hepatology 2006; 44:521-526. [ Links ]
39. Kane M. Global programme for control of hepatitis B infection. Vaccine 1995; 13:47-49. [ Links ]
40. Lavanchy D. Hepatitis C: public health strategies. J Hepatol 1999; 31:146-151. [ Links ]
41. Lee WM. Hepatitis B virus infection. N Engl J Med. 1997; 337:1733-1745. [ Links ]
42. Chen DS. From hepatitis to hepatoma: lessons from type B viral hepatitis. Science 1993; 262:369-370. [ Links ]
43. Pawlotsky JM. Hepatitis C virus infection: virus/host interactions. J Viral Hepat 1998; 5:3-8. [ Links ]
44. Galanti B, Nardiello S, Russo M, Fiorentino F. Increased lymphocyte adenosine deaminase in typhoid fever. Scand J Infect Dis 1981; 13:47-50. [ Links ]
45. Kalkan A, Bulut V, Erel O, Avci S, Bingol NK. Adenosine deaminase and guanosine deaminase activities in sera of patients with viral hepatitis. Mem Inst Oswaldo Cruz 1999; 94:383-386. [ Links ]
46. Kaya S, Cetin ES, Aridogan BC, Arikan S, Demirci M. Adenosine deaminase activity in serum of patients with hepatitis: a useful tool in monitoring clinical status. J Microbiol Immunol Infect. 2007; 40:288-292. [ Links ]
47. Kobayashi F, Ikeda T, Marumo F, Sato C. Adenosine deaminase isoenzymes in liver disease. Am J Gastroenterol 1993; 88: 266-271. [ Links ]
48. Fernández E, Rodrigo L, Riestra S, Carcía S, Gutiérrez F, Ocio G. Adenosine deaminase isoenzymes and neopterin in liver cirrhosis. Clin Gastroenterol 2000; 30:181-186. [ Links ]












 uBio
uBio