Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.55 no.2 Maracaibo jun. 2014
Farmacogenómica del tratamiento de primera línea en el cáncer gástrico: avances en la identificación de los biomarcadores genómicos de respuesta clínica.
Carlos Castro-Rojas1,2,3, Rocío Ortiz-López1,2 y Augusto Rojas-Martínez1,2.
1Departamento de Bioquímica y Medicina Molecular, 2Centro de Investigación y Desarrollo en Ciencias de la Salud, Universidad Autónoma de Nuevo León, Monterrey, México. 3Instituto de Investigación en Nutrición, Genética y Metabolismo, Universidad El Bosque, Bogotá D.C., Colombia.
Autor de correspondencia: Augusto Rojas-Martínez. Departamento de Bioquímica y Medicina Molecular, Facultad de Medicina y Centro de Investigación y Desarrollo en Ciencias de la Salud, Universidad Autónoma de Nuevo León. CP 64460, Monterrey, México. Correo electrónico: arojasmtz@gmail.com
Resumen. Debido a la inespecificidad de los síntomas, el cáncer gástrico (CG) es diagnosticado frecuentemente en etapas avanzadas, lo que da cuenta de los altos índices de mortalidad debido a esta neoplasia a nivel mundial. El esquema de tratamiento adyuvante o neoadyuvante en los países occidentales incluye el uso de fluoropirimidinas citotóxicas y compuestos de platino formadores de aductos en el ADN. La respuesta clínica al tratamiento con estos fármacos depende principalmente de la sensibilidad del tumor, la cual a su vez está condicionada por el nivel de expresión de los blancos terapéuticos y de las enzimas de reparación del ADN. Sumado a esto, algunos polimorfismos de línea germinal en genes asociados al metabolismo y a la respuesta a estos fármacos, han mostrado asociación con respuestas pobres y con el desarrollo de eventos adversos, incluso con resultados fatales. La identificación de biomarcadores genómicos, en la forma de polimorfismos genéticos o la expresión diferencial de genes específicos asociados a la respuesta quimioterapeútica ha sido motivo de intensa investigación como base para la aplicación de la farmacogenómica en el establecimiento de una terapia farmacológica racional y personalizada del CG. Sin embargo, ante la eventual aplicación de la farmacogenómica en el ámbito clínico, es necesario establecer el valor pronóstico real de dichos biomarcadores mediante los estudios de asociación genotipo-fenotipo, así como su prevalencia en el contexto de cada población de pacientes. Estos aspectos son indispensables al evaluar la relación costo-efectividad de la introducción de los productos de la medicina genómica predictiva en el tratamiento del CG.
Palabras clave: farmacogenómica, neoplasias gástricas, fluorouracilo, cisplatino.
Pharmacogenomics of the first-line treatment for gastric cancer: advances in the identification of genomic biomarkers for clinical response to chemotherapy.
Abstract. Gastric cancer (GC) is often diagnosed at later stages due to the lack of specificity of symptoms associated with the neoplasm, causing high mortality rates worldwide. The first line of adjuvant and neoadjuvant treatment includes cytotoxic fluoropyrimidines and platin-containing compounds which cause the formation of DNA adducts. The clinical outcome with these antineoplastic agents depends mainly on tumor sensitivity, which is conditioned by the expression level of the drug targets and the DNA-repair system enzymes. In addition, some germ line polymorphisms, in genes linked to drug metabolism and response to chemotherapy, have been associated with poor responses and the development of adverse effects, even with fatal outcomes in GC patients. The identification of genomic biomarkers, such as individual gene polymorphisms or differential expression patterns of specific genes, in a patient-by-patient context with potential clinical application is the main focus of current pharmacogenomic research, which aims at developing a rational and personalized therapy (i.e., a therapy that ensures maximum efficacy with no predictable side effects). However, because of the future application of genomic technologies in the clinical setting, it is necessary to establish the prognostic value of these genomic biomarkers with genotype-phenotype association studies and to evaluate their prevalence in the population under treatment. These issues are important for their cost-effectiveness evaluation, which determines the feasibility of using these medical genomic research products for GC treatment in the clinical setting.
Keywords: pharmacogenomics, stomach neoplasm, flurouracil, cisplatin.
Recibido: 04-09-2013. Aceptado: 20-03-2014
INTRODUCCIÓN
A pesar del declive sostenido en su incidencia, el cáncer gástrico (CG) es en la actualidad la segunda causa de muerte por cáncer a nivel mundial, con tasas de sobrevida globales a 5 años cercanas al 20%. La alta tasa de mortalidad en el CG es en parte debida a que el diagnóstico se realiza frecuentemente en los estados avanzados de la enfermedad, ante lo cual la resección quirúrgica y la quimioterapia tienen un valor limitado (1). Aunque varios estudios clínicos justifican el uso de la quimioterapia adyuvante y neoadyuvante en el CG, en general no existe un consenso sobre cuál debería ser el esquema estándar, por lo que la constante es la adopción de diferentes esquemas alrededor del mundo en donde las fluoropirimidinas como el 5-fluorouracilo (5-FU), el tegafur y la capecitabina, combinados con cisplatino ó oxaliplatino, se han convertido en los fármacos de referencia para la mayoría de los tratamientos y estudios clínicos actuales. Consecuentemente, a pesar de la creciente evidencia a nivel histológico y molecular de que existen al menos dos tipos distintos de adenocarcinoma gástrico que muestran diferentes patrones de respuesta frente a los tratamientos quimioterapéuticos, los pacientes son tratados con el mismo esquema farmacológico, el cual frecuentemente resulta en diferencias marcadas en la respuesta clínica y en bajos niveles de respuesta objetiva (2). Aún más, existe evidencia de la asociación entre ciertas variantes polimórficas en los genes responsables del metabolismo y de la respuesta a los agentes quimioterapéuticos y la incidencia de eventos adversos graves en los pacientes que reciben el tratamiento a nivel sistémico (3).
Ante la necesidad de mejorar la respuesta al tratamiento quimioterapéutico del CG, dos enfoques de investigación farmacogenómicos están siendo utilizados en la actualidad. El primero es la identificación de biomarcadores de valor predictivo, que al igual que el HER2/NEU, EGFR y el VEGF, se encuentran frecuentemente sobre-expresados en el CG y que se constituyen de este modo en blancos terapéuticos potenciales de la terapia molecularmente dirigida para poblaciones específicas de tumores gástricos (4-6). El segundo enfoque está dirigido a la identificación y validación de biomarcadores genómicos sobre la base de la variabilidad en la respuesta observada entre las diferentes poblaciones de pacientes frente a los agentes quimioterapeúticos utilizados en el contexto clínico (7).
Con el desarrollo de las nuevas tecnologías de la biología molecular para el estudio de las variaciones genéticas, bien en la forma de polimorfismos de un solo nucleótido (SNPs) o de variaciones estructurales (variaciones en el número de copias, indels, inversiones) y de los cambios en los perfiles de expresión a escala genómica en respuesta a los tratamientos, la farmacogenómica se constituye en una herramienta fundamental de investigación en la búsqueda de los determinantes genéticos y los biomarcadores de respuesta a quimioterapia con la proyección de encontrar su aplicación en el ámbito clínico en este nuevo paradigma del tratamiento del CG (8). Ambos enfoques confluyen en última instancia hacia la racionalización de la quimioterapia del CG con el objetivo de asegurar la máxima eficacia posible y reducir la incidencia de eventos adversos.
En la presente revisión se aborda el esquema quimioterapéutico de primera línea para el CG según las guías de manejo clínico actuales en diferentes regiones del mundo, desde la perspectiva de los factores genéticos y moleculares que se han asociado con la ausencia de eficacia y con el desarrollo de eventos adversos que afectan la calidad de vida de los pacientes y que a menudo requieren de la suspensión del tratamiento. Finalmente se exponen los principios que orientan la aplicación de la farmacogenómica en el ámbito clínico y el posible impacto que está puede tener en la personalización del tratamiento del CG.
TRATAMIENTO QUIMIOTERAPÉUTICO DEL CÁNCER GÁSTRICO
El CG es la enfermedad neoplásica maligna que tiene lugar en cualquier región comprendida entre la unión gastroesofágica y el píloro. Dado que el adenocarcinoma es la forma predominante de tumor maligno del estómago, presente en el 90-95% de los casos, el término cáncer gástrico generalmente se refiere a esta forma histopatológica (1).
La gastrectomía es en la actualidad la mejor alternativa de tratamiento con fines curativos para el CG en los estadíos más tempranos de la enfermedad (Etapas clínicas I-IIIA, American Joint Comittee on Cancer, AJCC). Incluso después de la resección con intención curativa, las tasas de recurrencia son del orden del 40 al 60% para el CG localmente avanzado. En los estados más avanzados y de diagnóstico más frecuente (Etapas clínicas IIB-IV, AJCC) se recurre a la quimioterapia combinada o no con radioterapia para la disminución de la masa tumoral o únicamente con fines paliativos. En el primer caso la evidencia clínica muestra que la quimioterapia adyuvante tiene mejores resultados que la intervención quirúrgica solamente. En el último caso, también existe evidencia a partir de estudios clínicos aleatorizados de que la quimioterapia representa un beneficio en términos de supervivencia y calidad de vida para los pacientes, si ésta se compara con un tratamiento de soporte únicamente (9, 10).
De acuerdo con los resultados de un meta-análisis efectuado recientemente a partir de diversos estudios clínicos que comparan la eficacia de la monoterapia y de diversas combinaciones de agentes quimioterapéuticos en el CG, la evidencia indica que el 5-FU y el cisplatino pueden considerarse como agentes efectivos de primera línea en la terapia de combinación con o sin antraciclinas para el tratamiento del CG. Junto a estos puede sumarse el trastuzumab para aquellos tumores tipificados como HER2/NEU+ (11). Sin embargo, ante la inexistencia de un esquema de tratamiento estándar a nivel global, varios países han adoptado esquemas propios sobre la evidencia aportada por los estudios clínicos efectuados en poblaciones específicas de pacientes (Tabla I). Aunque los diferentes esquemas comparten las fluoropirimidinas y a los compuestos de platino como tratamiento combinado de primera línea en la terapia adyuvante, existen diferencias en las guías de tratamiento del cáncer metastásico y localmente avanzado entre países occidentales y orientales. Más aún, para algunos países es inexistente el tratamiento de segunda línea. La dificultad para establecer un esquema estandarizado es en gran parte un reflejo de la imposibilidad de comparar los diversos estudios clínicos debido a diferencias en los factores asociados a los mismos, tales como la heterogeneidad en los regímenes de tratamiento, las diferencias en la estadificación del tumor, las diferencias en la calidad de las intervenciones quirúrgicas, las diferencias en la localización del tumor y las diferencias étnicas de las poblaciones bajo estudio (10, 12).
ESQUEMAS DE TRATAMIENTO QUIMIOTERAPÉUTICO PARA EL CÁNCER GÁSTRICO
| European Society for Medical Oncology, UK (65) | National Comprehensive Cancer Network, USA (66) | Secretaría de Salud de México (67) | Japanese Gastric Cancer Association (68, 69) | |
| Esquema adyuvante de primera línea | ECF (IA) ó cisplatino+5-FU+ trastuzumab para Her2/neu+ (IB) | ECF (I) ó cisplatino+5-FU (I) | ECF (I) ó cisplatino+5-FU+ trastuzumab para Her2/neu+ (IIa) | S-1 + cisplatino |
| Esquema neoadyuvante* | ECF ó EOX (IA) | cisplatino+5-FU+ trastuzumab para Her2/neu+ (I) | ECF ó DCF (A) | En investigación |
| Esquema de segunda línea | Irinotecan (IIB) | No hay recomendación | No hay recomendación | No hay recomendación |
Entre paréntesis se indica el nivel y grado de evidencia clínica según cada país. ECF=Epirubicina (E), Cisplatino (C), 5-FU (F). EOX=Epirubicina (E), Oxaliplatino (O), Capecitabina (X). S-1= tegafur+gimeracil+oteracilpotásico. DCF=Docetaxel (D), Cisplatino (C), 5-FU (F).
* Esquema neoadyuvante para cáncer metastásico y localmente avanzado.
DETERMINANTES GENÉTICOS ASOCIADOS A LA RESPUESTA AL 5-FLUOROURACILO (5-FU) Y COMPUESTOS ANÁLOGOS
Como se ha mencionado previamente, las fluoropirimidinas utilizadas en monoterapia o en combinación con otros agentes, componen la columna vertebral del tratamiento quimioterapéutico del CG, siendo el 5-FU de administración sistémica el fármaco más antiguo de esta familia de agentes citotóxicos y el de más amplio uso en la actualidad. Los más recientes compuestos análogos del 5-FU, desarrollados para su administración por vía oral y que han sido evaluados en estudios clínicos de fase III incluyen a la capecitabina y al S-1. Este último recomendado por las guías de tratamiento del CG en Japón. A continuación se describen los principales determinantes genéticos asociados a la respuesta a estos fármacos.
5-FU
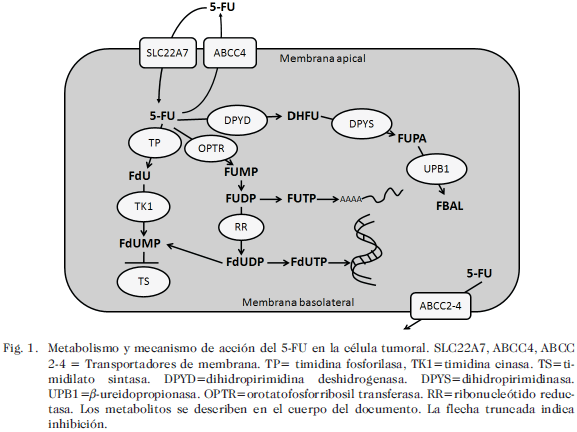
El efecto antitumoral del 5-FU se ha relacionado a tres de sus metabolitos: 1) La 5-fluorouridina-2’-deoxiuridina-5’-trifosfato (FdUTP), causante de la inestabilización del ADN; 2). La 5-fluorouridina-5’-trifosfato (FUTP), que se incorpora al ARN y causa la terminación temprana de la transcripción 3) La 5-fluoro-2’-deoxiuridina-5’-monofosfato (FdUMP), este último se cree que es el principal responsable del efecto antitumoral gracias a la inhibición no competitiva de la enzima timidilato sintasa (TS), necesaria para la síntesis de dTMP (13).
Una vez ingresa a la circulación, más del 80% del fármaco administrado es metabolizado rápidamente en el hígado por la enzima dihidropirimidina deshidrogenasa (DPYD) y convertido al metabolito farmacológicamente inactivo 5-fluorodihidrouracilo (DHFU), siendo éste el paso limitante del metabolismo de detoxificación del 5-FU (Fig. 1). Otros pasos sucesivos se encargan de la transformación de este metabolito en fluoro- b-alanina (FBAL), el producto final de todo el proceso de biotransformación del fármaco. Del total del fármaco administrado, aproximadamente el 20% se elimina de manera inalterada (14).
Uno de los primeros reportes en cuanto a toxicidad inducida por 5-FU en un estudio clínico a gran escala, indicó la muerte de 10 % de los pacientes, como consecuencia de la administración del fármaco (15). Desde entonces el número de reportes de toxicidad relacionada con este fármaco se ha incrementado, hecho relacionado con la amplia utilización del 5-FU en la mayoría de los esquemas de tratamiento de los tumores del aparato digestivo. En consecuencia, se ha determinado que aproximadamente un 15% de los pacientes a los que se les administra 5-FU en infusión intravenosa, desarrollan algún tipo de respuesta tóxica de grado 3 ó 4 (National National Cancer Institute-Common Terminology Criteria for Adverse Events, NCI-CTACE), de las que se han reportado anemia, neutropenia, trombocitopenia, leucopenia, diarrea, síndrome mano-pie y mucositis (16-18). A partir de la evidencia clínica y molecular se ha propuesto a la enzima DPYD junto con la enzima TS, como las principales determinantes de la farmacocinética, la toxicidad clínica y la resistencia frente al 5-FU, por lo que gran parte de la investigación farmacogenómica del 5-FU se han enfocado al estudio de las variantes polimórficas en los genes de estas dos enzimas (19, 20).
La enzima DPYD presenta una considerable variación entre la población (Tabla II). Se ha estimado que un 3-5% de los sujetos presentan una baja actividad de la misma, por lo que se le ha relacionado con los efectos tóxicos causados por la administración de 5-FU y compuestos análogos en esta población (21). Aunque la mayoría de las variantes identificadas no tienen un impacto significativo en la actividad de la enzima, un haplotipo correspondiente a tres variantes polimórficas intrónicas y a un SNP no sinónimo en la región codificante del gen, ha sido asociado directamente a eventos de toxicidad grave con resultados fatales en pacientes sometidos a tratamiento con 5-FU, resaltando la importancia de los polimorfismos en regiones no codificantes de este gen en la respuesta clínica y la relativa diferencia de sus frecuencias alélicas entre varias poblaciones europeas (22). A la fecha se han reportado 10 haplotipos basados en SNPs y delecciones/inserciones para el gen DPYD en la base de datos PharmGKB asociados a una deficiencia en la actividad enzimática de DPYD (23).
POLIMORFISMOS DE RELEVANCIA CLÍNICA PARA EL TRATAMIENTO DEL CÁNCER GÁSTRICO CON FLUOROPIRIMIDINAS
| Gen | Relación con el 5-FU | Polimorfismo | Efecto en la enzima | Respuesta Clínica | Fuente |
| DPYD | Metabolismo | DPYD*2A (IVS14+1G>A) | Actividad nula | Mayor toxicidad | (50) |
| DPYD | Metabolismo | DPYD 464T>A | Actividad disminuida | Mayor toxicidad | (70) |
| DPYD | Metabolismo | DPYD*3 (1897delC) | Actividad nula | Mayor toxicidad | (71) |
| DPYD | Metabolismo | DPYD*13 (1679T>G) | Actividad nula | Mayor toxicidad | (72) |
| DPYD | Metabolismo | DPYD*4 (1601G>A) | Actividad nula | Mayor toxicidad | (73) |
| DPYD | Metabolismo | DPYD 1129-5923G>C | Actividad disminuida | Mayor toxicidad | (74) |
| DPYS | Metabolismo | DPYS 833G>A | Actividad nula | Mayor toxicidad | (75) |
| TS | Respuesta | TS 3’UTR del6/del6 | Menor expresión | Mayor respuesta | (24) |
| MTHFR | Respuesta | MTHFR 1298 A>C | Menor actividad | Mayor respuesta | (31) |
| XDP | Transporte | XDP Lys751Gln | Actividad disminuida | Mayor respuesta | (76) |
DPYD=dihidropirimidina deshidrogenasa. DPYS=dihidropirimidinasa. TS=timidilato sintasa. MTHFR=metilentetrahidrofolato reductasa. XDP=xerodermapigmentosa.
Por otro lado, se han descrito varios polimorfismos en el gen de la enzima TS con implicación directa en la eficacia al tratamiento basado en fluoropirimidinas (Tabla II). En un estudio clínico de fase II en el que se evaluó la eficacia y la toxicidad del esquema FOXFOL-6 modificado (infusión de 5-FU, ácido folínico y oxaliplatino) en pacientes con CG avanzado y su relación con ciertos polimorfismos en genes de respuesta a ambos fármacos, se demostró la asociación significativa entre el polimorfismo del gen TS, representado en una delección de 6 pb en la región 3’UTR, con un tiempo de progreso de la enfermedad y una supervivencia global significativamente más favorables que en el resto de los pacientes. Teniendo en cuenta que este polimorfismo se asocia con reducidos niveles de expresión de la enzima y que está es blanco terapéutico del 5-FU, es posible que la presencia de este polimorfismo incremente la sensibilidad del tumor al efecto de este fármaco (24). Está hipótesis es respaldada por la observación de que los polimorfismos del gen TS más relevantes en el contexto clínico, son aquellos que modifican el nivel de expresión de la enzima (25). Otro polimorfismo que tiene implicación en la expresión de la enzima es la presencia de repeticiones dobles (2R) o triples (3R) en tándem de 28 bp en la región promotora del gen TS. Si bien, se ha confirmado que la presencia del alelo 3R se relaciona con un mayor nivel de expresión de TS, la asociación entre este polimorfismo y la sensibilidad al 5-FU aún no se ha establecido de manera concluyente (26, 27).
Sumado al incremento en el riesgo de CG entre sujetos de la población mexicana que portan el genotipo T/T asociado al polimorfismo c.677C>T en el gen de la enzima metilentetrahidrofolato reductasa (MTHFR), este mismo genotipo se ha relacionado con una mejor respuesta al tratamiento del CG con 5-FU en una población asiática (28, 29). El papel de esta enzima en la respuesta al 5-FU está dada por su participación en la síntesis de 5-metiltetrahidrofolato a partir de 5,10-metilentetrahidrofolato (5,10-metilenTHF), siendo el primero un metabolito indispensable para la inhibición de la timidilato sintasa por el FdUMP mediante la formación de un complejo ternario. La presencia del polimorfismo 677C>T en el gen de la MTHFR se asocia con una reducida actividad de esta enzima y por consiguiente en la acumulación del 5,10-metilenTHF, incrementando de esta manera el poder inibitorio del 5-FU sobre la enzima TS (30). Otros dos SNPs en el gen MTHFR,el c.1298A>C y el c.1286A>C se han asociado al desarrollo de efectos tóxicos graves y a un peor pronóstico respectivamente, frente al tratamiento con 5-FU (31, 32).
Capecitabina
La capecitabina es un profármaco de tipo carbamato del 5-FU para administración oral, por lo que la conversión en el metabolito activo requiere de la intervención de enzimas hepáticas (carboxilesterasa 2) y tumorales (citidina desaminasa y timidina fosforilasa). Sumado a la ventaja de su adminsitración por vía oral, varios estudios in vitro y en modelos animales han mostrado efectos similares o superiores a los de otras fluoropirimidinas, por lo que en algunos estudios clínicos este fármaco ha venido a reemplazar al 5-FU en la quimioterapia combinada, evidenciando resultados similares (33).
En general se considera un fármaco bien tolerado, siendo el efecto adverso más grave el síndrome mano-pie como resultado de la exposición prolongada a fluoropirimidinas, el cuál puede revertirse con la suspensión de la administración del fármaco y el ajuste de la dosis. Un estudio reciente demostró la presencia de una variante genética consistente en un SNP localizado en el promotor del gen de la enzima citidina desaminasa (rs3215400) asociado al riesgo de desarrollar el síndrome mano-pie tras la adminsitración de capecitabina (34). La presencia de polimorfismos en el promotor del gen tendría impacto directo en la expresión de la enzima, de tal modo que podría generar un fenotipo alterado de metabolismo del profármaco y dar lugar incluso a efectos tóxicos letales como ya se ha reportado por el uso de este fármaco (35). El desarrollo de respuesta tóxica de grado 3 y 4 (NCI-CTCAE) y su asociación con polimorfismos y haplotipos específicos en el gen de la enzima dihidropirimidina deshidrogenasa fueron evaluados en un estudio retrospectivo a partir de la secuencia del gen en una población de pacientes con cáncer colorectal que recibieron tratamiento combinado con capecitabina. Los polimorfismos IVS14+1G> A y 2846A>T se asociaron con toxicidad severa al punto de que los pacientes heterozigotos para estas dos variantes requirieron modificación de la dosis del fármaco (36).
Dado que la capecitabina es un profármaco del 5-FU, debería esperarse que los mismos determinantes genéticos asociados a la respuesta a este último tengan impacto en la eficacia de la capecitabina en el ámbito clínico. A este respecto, el genotipo 3’UTR ins6/ins6 en el gen de la enzima timidilato sintasa parece corresponder con una baja respuesta al tratamiento con capecitabina que se traduce en un peor pronóstico en poblaciones asiáticas. En contraste, el fenotipo tumoral timidina fosforilasa + / b-tubulina III-, se ha asociado con una respuesta favorable al tratamiento combinado de capecitabina y paclitaxel en el CG avanzado (37).
Un aspecto importante de este fármaco, es que debido a sus características farmacocinéticas, la sensibilidad al mismo se correlaciona con la razón de actividad in vitro de las enzimas timidina fosforilasa:dihidropirimidina deshidrogenasa, encargadas de su activación y biotrasnformación respectivamente en las células tumorales. Debido a esto, es posible que las variantes genéticas que comprometen la actividad de estas enzimas tengan un impacto importante en la respuesta al tratamiento con este fármaco, aunque dicho escenario requiere de su validación en un contexto clínico (33, 38).
S-1
El S-1 resulta de la combinación de tres compuestos, el tegafur (FT) un profármaco del 5-FU, el 5-cloro 2,4-dihidroxipirimidina (CDHP, gimeracil) un inhibidor competitivo de la enzima dihidropirimidina deshidrogenasa y el oxonato potásico (oxo, oteracil potásico), un inhibidor de la enzima fosforibosiltransferasa, gracias al cual se logra reducir el efecto tóxico local del fármaco activo en el tracto gastrointestinal. Después de la administración por vía oral de S-1, el tegafur es absorbido a nivel instestinal, transportado al hígado y transformado por la enzima CYP2A6 a 5-FU, el compuesto farmacologicamente activo. La presencia del inhibidor de la enzima dihidropirimidina deshidrogenasa incrementa el tiempo de vida media del metabolito activo y con ello el tiempo de acción del fármaco, con lo cual se reduce la administración del medicamento a una o dos tomas diarias (39). Los efectos secundarios asociados al S-1 están fuertemente asociados a diferencias étnicas, siendo los de tipo gastrointestinal (náusea, diarrea, hiperbilirrubinemia y vómito) los de mayor frecuencia en la población caucásica y los de tipo hematológico los de mayor prevalencia en la población asiática. Precisamente, a nivel clínico se han observado diferencias significativas en la farmacocinética y la farmacodinamia del S-1 entre diferentes grupos étnicos, fenómeno al parecer asociado a las distintas frecuencias alélicas de los polimorfismos del gen CYP2A6 entre las diferentes poblaciones estudiadas (40). A este respecto, un estudio retrospectivo efectuado recientemente reportó la asociación entre los polimorfismos del gen CYP2A6, particularmente en los pacientes heterocigotos, con las variantes alélicas *1/*4 y el polimorfismo ERCC1 19442C>A, que se asociaron con una pobre respuesta clínica al tratamiento del CG con S-1 y cisplatino en una población asiática (41).
DETERMINANTES GENÉTICOS ASOCIADOS A LA RESPUESTA AL CISPLATINO Y AL OXALIPLATINO
El mecanismo de acción de los compuestos de platino en la quimioterapia tumoral se relaciona con la formación de aductos y el rompimiento de las cadenas de ADN, con la subsecuente inducción de apoptosis en la célula tumoral. La resistencia de los tumores al efecto del cisplatino o de su análogo químico de tercera generación, el oxaliplatino, está relacionada con la actividad de las enzimas encargadas de la reparación del ADN y con un incrementado nivel de detoxificación de los aductos de platino-ADN (42). Los sistemas encargados de tales procesos, como la enzima glutatión-s-transferasa tipo 1 (GSTP1) y el sistema de reparación de nucleótidos por escisión (NER), quienes previenen y reparan la formación de aductos en el ADN respectivamente, tienen implicación directa en la respuesta al tratamiento con estos agentes (25).
Respecto al papel que desempeña la expresión de los genes asociados a la reparación de las rupturas en el ADN (ERCC1, ERCC2, XRCC1) en respuesta al tratamiento quimioterapéutico con cisplatino, un estudio mostró evidencia de la asociación entre un bajo nivel de expresión del gen ERCC1 con un elevado nivel de respuesta (RR) en pacientes con CG avanzado que recibieron S-1 y cisplatino (43). La enzima ERCC1 y otras similares están implicadas en los procesos de reparación del daño sobre el ADN ejercido por compuestos citotóxicos, por lo que un incremento en su actividad o en sus niveles de expresión podría resultar en quimiorresistencia al cisplatino o al oxaliplatino. Inversamente, un bajo nivel de expresión podría relacionarse con un mejor pronóstico en la terapia basada en estos agentes. Este último aspecto ha sido evidenciado en la terapia adyuvante del CG con oxaliplatino en una población china (44). Aunque resultados como este son informativos respecto al papel que pueden desempeñar estos genes como marcadores de respuesta al tratamiento del CG con cisplatino, se requieren más estudios en contextos clínicos prospectivos para validar su posible utilidad.
La existencia de polimorfismos en los genes de la enzima GSTP1 y de las enzimas de reparación del ADN (ERCC1, ERCC2, XRCC1) que determinan una función o expresión alterada de las mismas y su asociación con la respuesta al cisplatino en la que son frecuentes los eventos ototóxicos, neurotóxicos y nefrotóxicos (45), propone un desafío aún mayor en la farmacogenómica del CG; dado que la terapia combinada de 5-FU con cisplatino u oxaliplatino es utilizada en muchos países como esquema de tratamiento de primera línea para el CG local avanzado y metastásico. A este respecto, se ha reportado que ciertos genotipos en los genes de la enzima glutatión S-transferasa (GSTP1-105 Val/Val) y de la enzima timidilato sintasa (TS 2R/2R, TS 2R/3RC, TS 3RC/3RC) de manera combinada, se asocian con un mejor pronóstico para el CG avanzado en una población europea bajo tratamiento, proponiéndose de esta forma como biomarcadores putativos en la terapia combinada con 5-FU y cisplatino (46). Un resultado similar también se ha reportado en una población asiática con el mismo esquema terapéutico de tratamiento (47).
Se han establecido las frecuencias alélicas del genotipo homocigoto GSTP1-105 Val/Val en diversas poblaciones (19% americanos-africanos, 7% americanos-europeos, 3% taiwaneses) y dado que esta variante polimórfica le confiere una menor actividad a la enzima GSTP1, esto podría explicar la sensibilidad incrementada al efecto del cisplatino en los pacientes que la portan en estos grupos étnicos (25, 46).
La neurotoxicidad periférica que se presenta en aproximadamente el 50% de los pacientes y la ototoxicidad que desarrollan aproximadamente hasta el 31% de los pacientes que reciben cisplatino son por mucho, los efectos tóxicos más importantes que limitan el uso del cisplatino y del oxaliplatino. Aunque la asociación de estos efectos tóxicos con variantes genéticas específicas de mediadores de la respuesta a estos fármacos aún no ha sido completamente dilucidada, variantes genéticas de ciertas proteínas transportadoras como las proteínas transportadoras de cobre tipo 1 y 2 (Ctr1y 2) y la proteína transportadora de cationes orgánicos (Oct2) que actúan como bombas de influjo/eflujo del fármaco, podrían estar implicadas (48, 49).
EL ENFOQUE FARMACOGENÓMICO EN EL TRATAMIENTO DEL CÁNCER GÁSTRICO
Los fármacos utilizados frecuentemente en la quimioterapia del CG se han asociado bien a efectos tóxicos que obligan generalmente a suspender los tratamientos o a respuestas ineficaces, ambos como posible resultado de la existencia de determinantes genéticos en los pacientes o de diferencias en la sensibilidad del tumor a estos agentes. A este respecto, son conocidos el desarrollo de encefalopatía hiperamonémica, mucositis oral y otros efectos tóxicos asociados a la administración de 5-FU, incluso con resultados fatales (50, 51) y la ototoxicidad inducida por cisplatino (49). La identificación de los determinantes genéticos asociados a tales eventos adversos y su subsecuente validación, parece ser la ruta más efectiva en la búsqueda de una quimioterapia más segura y eficaz, con lo cual la farmacogenómica adquiere un papel relevante en este contexto.
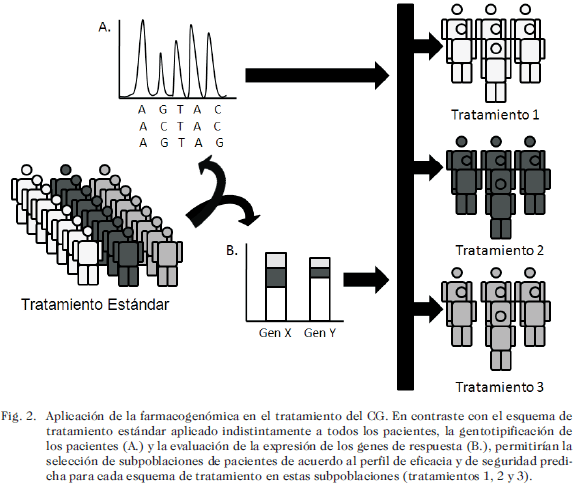
La farmacogenómica ha surgido gracias a la aplicación de las herramientas genómicas que permiten la identificación a gran escala de genes cuya estructura, expresión y actividad puede correlacionarse con un fenotipo determinado en respuesta a un tratamiento farmacológico. Estos genes están asociados a enzimas relacionadas con el transporte, biotransformación y/o eliminación del fármaco u otro tipo de proteínas asociadas a la respuesta farmacológica y pueden servir como biomarcadores genómicos de respuesta a tratamientos específicos. En un contexto práctico, la farmacogenómica puede ser definida como el estudio de la variabilidad en la eficacia y en la seguridad farmacológica usando información genómica de los pacientes. La aplicación de la farmacogenómica en el ámbito clínico es hoy en día un elemento fundamental en el nuevo paradigma de la terapéutica personalizada (52). La farmacogenómica aplicada al tratamiento del CG puede ser utilizada para la identificación y validación de blancos terapéuticos y para la genotipificación de los pacientes de manera previa o concurrente a la instauración de un esquema terapéutico (Fig. 2). Un ejemplo del primer enfoque se relaciona con un estudio efectuado para el análisis de la expresión de genes a escala genómica en muestras de tejido de adenocarcinoma gástrico de dos poblaciones distintas de pacientes, el cual permitió la re-identificación de varios genes conductores en el CG (RAS/RAF/MEK/ERK, PI3K/AKT), la sobreexpresión de receptores tipo tirosina cinasa (EGFR, HER2/NEU, MET, FGFR2) y la identificación de una mutación previamente no descrita en CG del receptor para tirotrofina (TSHR). Resultados como este facilitan la identificación de nuevos blancos farmacológicos potenciales a la espera de ser validados en ensayos clínicos (53, 54). Un estudio enfocado al establecimiento de los mecanismos moleculares de resistencia tumoral adquirida al tratamiento quimioterapéutico combinado de 5-FU y cisplatino ha logrado establecer un patrón de expresión alterado en un conjunto de 72 genes conductores asociados a la resistencia al tratamiento, dentro de los que se incluyen genes asociados a la prevención de apoptosis (TRAP1, CLD3), a la reparación del ADN (RAD23A, DDB1) y de detoxificación celular (GSTP1) (55). Estos trabajos en suma confluyen a la identificación de biomarcadores de respuesta al tratamiento quimioterapéutico sobre la base de los patrones genéticos de comportamiento a nivel de tumor.
Por otro lado, el otro enfoque de la farmacogenómica aplicada al CG está orientado a la identificación de los determinantes genéticos de línea germinal en la respuesta quimioterapéutica. La utilidad clínica de la genotipificación pre-tratamiento de los pacientes sometidos a tratamiento quimioterapéutico ha sido demostrada siguiendo la estrategia del gen candidato en un estudio clínico en el que se identificaron 5 SNPs del gen DPYD, 3 de los cuales se asociaron a efectos tóxicos de clase 3 y 4 (NCI-CTCAE). Está información, junto con el seguimiento clínico de los pacientes, permitió la rápida suspensión de la terapia en algunos casos y el ajuste de la dosis en otros. De acuerdo con los resultados del estudio y las implicaciones clínicas y económicas del mismo, los autores consideran pertinente la genotipificación del gen DPYD para la detección de los polimorfismos identificados y de otros tantos que puedan tener relevancia clínica en un contexto específico de población, dadas las diferencias en los niveles de prevalencia de los polimorfismos entre las diferentes etnias en las que se han reportado (56). Sumado a lo dicho anteriormente, el enfoque farmacogenómico ha demostrado ser una herramienta poderosa para la adecuada estratificación de los pacientes en estudios clínicos, de manera que pueda pre-establecerse la sensibilidad de los pacientes a los diferentes agentes quimioterapéuticos bajo estudio, haciendo más evidente la identificación de respuestas clínicamente significativas. Con este fin, son analizadas muestras sanguíneas para la identificación de polimorfismos de línea germinal y la expresión de genes específicos en el tejido tumoral, para ser usados como marcadores de respuesta farmacológica en estudios clínicos actuales para el CG (57).
CONCLUSIONES
El CG continúa siendo una de las principales causas de muerte a nivel mundial. A pesar de los avances en el establecimiento de terapias farmacológicas efectivas para su tratamiento, la disponibilidad de agentes con evidencia clínica comprobada es escasa y se ve afectada aún más debido al desarrollo de eventos adversos que a menudo obligan a la suspensión del tratamiento. Es así, que la quimioterapia adyuvante actual está basada principalmente en la combinación de una fluoropirimidina y un compuesto de platino, agentes que han demostrado su utilidad clínica, pero que frecuentemente muestran variaciones en la respuesta que se traducen en tratamientos ineficaces o incluso en efectos tóxicos graves. Ante esta situación, diversos estudios se han puesto en marcha con el fin de establecer estrategias para la individualización de la terapia farmacológica. Una de estas estrategias, la farmacogenómica, ha mostrado gran robustez y efectividad en la elucidación de los mecanismos moleculares que subyacen a la respuesta clínica observable.
Las tecnologías genómicas (secuenciación de nueva generación, microarreglos de ADN y de ARN, etc.) han potenciado la aplicación de los principios de la farmacogenómica en la búsqueda de un tratamiento racionalizado (i.e. terapias más seguras y eficaces) del CG. Como resultado hay una lista creciente de biomarcadores genómicos, en su mayoría SNPs, asociados a la eficacia y/o toxicidad del tratamiento quimioterapéutico de primera línea para el CG que se han documentado siguiendo la tendencia de investigar el efecto combinado de múltiples genes en función de la respuesta obtenida, como una estrategia más eficaz y más cercana al escenario real que determina la variación en la respuesta clínica (21). Sin embargo dos aspectos deben confrontarse antes de la evaluación de dichos biomarcadores puedan incluirse en los protocolos de manejo clínico. El primero está relacionado con la frecuencia relativa de las variantes genéticas en poblaciones mestizas en las que se evidencian contribuciones genéticas de otras poblaciones ancestrales (58). Los estudios de asociación por haplotipo, así como la genotipificación directa de los pacientes a partir de la secuenciación de los genes de respuesta al tratamiento, permitirían establecer su prevalencia real en función de las frecuencias genotípicas de dichos biomarcadores genómicos en cada población bajo estudio. El otro aspecto importante a considerar es la validación de tales polimorfismos en el contexto clínico, para lo cual son indispensables los estudios de asociación genotipo-fenotipo en ensayos clínicos prospectivos, para elucidar la relevancia real de dichos biomarcadores genómicos en la respuesta al tratamiento (59). Estos aspectos en conjunto son determinantes al evaluar el factor costo-efectividad de los estudios farmacogenómicos y por lo tanto la viabilidad de su introducción en el ámbito clínico (60).
En correspondencia con lo anterior se ha establecido la iniciativa internacional Human Variome Project (HVP, http://www.humanvariomeproject.org/), en la cual confluyen los esfuerzos de varios grupos de investigación alrededor del mundo, incluido el nuestro, hacia la identificación, análisis y divulgación de las diferentes variantes genéticas presentes en el genoma humano. El producto de esta iniciativa a escala global se constituye como una fuente invaluable de información genómica que facilitará la investigación y transferencia de resultados de la farmacogenómica a la práctica clínica (61).
Por último, se ha proyectado que la aplicación de la farmacogenómica en el tratamiento de enfermedades crónicas prevalentes como el cáncer, puede tener un gran impacto en el balance costo-efectividad para las instituciones de salud, al reducir significativamente la incidencia de reacciones adversas o la ineficacia de los tratamientos y con ello, los costos asociados a la intervención médica necesaria para su manejo (62). Estudios farmacoeconómicos recientes relacionados con el uso de estrategias moleculares para la genotipificación de pacientes con cáncer que reciben agentes como el 5-FU y el cisplatino han corroborado esta hipótesis (63, 64).
REFERENCIAS
1. Nagini S. Carcinoma of the stomach: a review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J Gastrointest Oncol 2012; 4(7):156-469. [ Links ]
2. Tan IB, Ivanova T, Lim KH, Ong CW, Deng N, Lee J, Tan SH, Wu J, Lee MH, Ooi CH, Rha SY, Wong WK, Boussioutas A, Yeoh KG, So J, Yong WP, Tsuburaya A, Grabsch H, Toh HC, Rozen S, Cheong JH, Noh SH, Wan WK, Ajani JA, Lee JS, Salto-Tellez M, Tan P. Intrinsic subtypes of gastric cancer, based on gene expression pattern, predict survival and respond differently to chemotherapy. Gastroenterology 2011; 141(2):476-485.e11. [ Links ]
3. Ezzeldin H, Diasio R. Dihydropyrimidine Dehydrogenase deficiency, a pharmacogenetic Syndrome associated with potentially life-threatening toxicity following 5-Fluorouracil administration. Clin Colorectal Canc 2004; 4(3):181-189. [ Links ]
4. Wong H, Yau T. Targeted therapy in the management of advanced gastric cancer: are we making progress in the era of personalized medicine? Oncologist 2012; 17: 346-358. [ Links ]
5. Lee JH, Kim KM, Cheong JH, Noh SH. Current management and future strategies of gastric cancer. Yonsei Med J 2012; 53(2):248-257. [ Links ]
6. Liu L, Wu N, Li J. Novel targeted agents for gastric cancer. J Hematol Oncol 2012; 5(1):31. [ Links ]
7. Di Francia R, Siesto RS, Valente D, Spart D, Berretta M. Pharmacogenomics panel test for prevention toxicity in patient who receive Fluoropirimidine/Oxaliplatin-based therapy. Eur Rev Med Pharmacol Sci 2012; 16(9):1211-1217. [ Links ]
8. Koch WH. Technology platforms for pharmacogenomic diagnostic assays. Nat Rev Drug Discov 2004; 3(9):749-761. [ Links ]
9. Cervantes A, Roda D, Tarazona N, Roselló S, Pérez-Fidalgo JA. Current questions for the treatment of advanced gastric cancer. Cancer Treat Rev 2013; 39(1):60-67. [ Links ]
10. Sano T. Adjuvant and neoadjuvant therapy of gastric cancer: a comparison of three pivotal studies. Curr Oncol Rep 2008; 10(3):191-198. [ Links ]
11. Wagner AD, Unverzagt S, Grothe W, Kleber G, Grothey A, Haerting J, Fleig WE. Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev 2010 (Issue 3. Art. No.: CD004064):109. [ Links ]
12. Kang H, Kauh JS. Chemotherapy in the treatment of metastatic gastric cancer: is there a global standard? Curr Treat Options Oncol 2011; 12(1):96-106. [ Links ]
13. Noordhuis P, Holwerda U, Van der Wilt CL, Van Groeningen CJ, Smid K, Meijer S, Pinedo HM, Peters GJ. 5-Fluorouracil incorporation into RNA and DNA in relation to thymidylate synthase inhibition of human colorectal cancers. Ann Oncol 2004; 15(7):1025-1032. [ Links ]
14. Pinedo HM, Peters GF. Fluorouracil: biochemistry and pharmacology. J Clin Oncol 1988; 6(10):1653-1664. [ Links ]
15. Nemoto T, Dao TL. 5-Fluorouracil and Cyclophosphamide in disseminated breast cancer. Relationship between chemotherapy and hormonal therapy. New York state J Med 1971; 71(5):554-558. [ Links ]
16. Grem J, Quinn M, Ismail A, Takimoto C, Lush R, Liewehr D, Steinberg S, Balis F, Chen A, Monahan B, Harold N, Corse W, Pang J, Murphy R, Allegra C, Hamilton M. Pharmacokinetics and pharmacodynamic effects of 5-Fluorouracil given as a one-hour intravenous infusion. Cancer Chemother Pharmacol 2001; 47(2):117-125. [ Links ]
17. Del Re M, Di Paolo A, van Schaik RH, Bocci G, Simi P, Falcone A, Danesi R. Dihydropyrimidine Dehydrogenase polymorphisms and fluoropyrimidine toxicity: ready for routine clinical application within personalized medicine? EPMA J 2010; 1(3):495-502. [ Links ]
18. Meta-Analysis Group In Cancer. Toxicity of fluorouracil in patients with advanced colorectal cancer: effect of administration schedule and prognostic factors. J Clin Oncol 1998; 16(11):3537-3541. [ Links ]
19. Toffoli G, Cecchin E. Clinical implications of genetic polymorphisms on stomach cancer drug therapy. Pharmacogenomics J 2007; 7(2):76-80. [ Links ]
20. Diasio RB, Johnson MR. The role of pharmacogenetics and pharmacogenomics in cancer chemotherapy with 5-Fluorouracil. Pharmacology 2000; 61(3):199-203. [ Links ]
21. Nishiyama M, Eguchi H. Pharmacokinetics and pharmacogenomics in gastric cancer chemotherapy. Adv Drug Del Rev 2009; 61(5):402-407. [ Links ]
22. Amstutz U, Farese S, Aebi S, Largiader CR. Dihydropyrimidine Dehydrogenase gene variation and severe 5-Fluorouracil toxicity: a haplotype assessment. Pharmacogenomics 2009; 10(6):931-944. [ Links ]
23. Hewett M, Oliver DE, Rubin DL, Easton KL, Stuart JM, Altman RB, Klein TE. PharmGKB: the pharmacogenetics knowledge base. Nucleic Acids Res 2002; 30(1): 163-165. [ Links ]
24. Keam B, Im SA, Han SW, Ham HS, Kim MA, Oh DY, Lee SH, Kim JH, Kim DW, Kim TY, Heo DS, Kim WH, Bang YJ. Modified FOLFOX-6 chemotherapy in advanced gastric cancer: Results of phase II study and comprehensive analysis of polymorphisms as a predictive and prognostic marker. BMC Cancer 2008; 8:148. [ Links ]
25. Shimoyama S. Pharmacogenetics of Fluoropyrimidine and Cisplatin. A future application to gastric cancer treatment. J Gastroenterol Hepatol 2009; 24(6):970-981. [ Links ]
26. Uchida K, Hayashi K, Kawakami K, Schneider S, Yochim JM, Kuramochi H, Takasaki K, Danenberg KD, Danenberg PV. Loss of heterozygosity at the thymidylate synthase (TS) locus on chromosome 18 affects tumor response and survival in individuals heterozygous for a 28-bp polymorphism in the TS gene. Clin Cancer Res 2004; 10(2):433-439. [ Links ]
27. Toriumi F, Kubota T, Saikawa Y, Yoshida M, Otani Y, Watanabe M, Kumai K, Kitajima M. Thymidylate synthetase (TS) genotype and TS/dihydropyrimidine dehydrogenase mRNA level as an indicator in determining chemosensitivity to 5-Fluorouracil in advanced gastric carcinoma. Anticancer Res 2004; 24(4):2455-2464. [ Links ]
28. Huang ZH, Hua D, Li LH. The polymorphisms of TS and MTHFR predict survival of gastric cancer patients treated with Fluorouracil-based adjuvant chemotherapy in Chinese population. Cancer Chemother Pharmacol 2009; 63(5):911-918. [ Links ]
29. Lacasaña-Navarro M, Galván-Portillo M, Chen J, López-Cervantes M, López-Carrillo L. Methylenetetrahydrofolate reductase 677C>T polymorphism and gastric cancer susceptibility in Mexico. Eur J Cancer 2006; 42(4):528-533. [ Links ]
30. Sohn KJ, Croxford R, Yates Z, Lucock M, Kim YI. Effect of the methylenetetrahydrofolate reductase C677T polymorphism on chemosensitivity of colon and breast cancer cells to 5-fluorouracil and methotrexate. J Natl Cancer Inst 2004; 96(2): 134-144. [ Links ]
31. Thomas F, Motsinger-Reif AA, Hoskins JM, Dvorak A, Roy S, Alyasiri A, Myerson RJ, Fleshman JW, Tan BR, McLeod HL. Methylenetetrahydrofolate reductase genetic polymorphisms and toxicity to 5-FU-based chemoradiation in rectal cancer. Br J Cancer 2011; 105(11):1654-1662. [ Links ]
32. Ott K, Rachakonda PS, Panzram B, Keller G, Lordick F, Becker K, Langer R, Buechler M, Hemminki K, Kumar R. DNA repair gene and MTHFR gene polymorphisms as prognostic markers in locally advanced adenocarcinoma of the esophagus or stomach treated with Cisplatin and 5-Fluorouracil-based neoadjuvant chemotherapy. Ann Surg Oncol 2011; 18(9): 2688-2698. [ Links ]
33. Lee J-L, Kang Y-K. Capecitabine for the treatment of advanced gastric cancer. Future Oncol 2008; 4(2):179-198. [ Links ]
34. Caronia D, Martin M, Sastre J, de la Torre J, Garcia-Saenz JA, Alonso MR, Moreno LT, Pita G, Diaz-Rubio E, Benitez J, Gonzalez-Neira A. A polymorphism in the cytidine deaminase promoter predicts severe capecitabine-induced hand-foot syndrome. Clin Cancer Res 2011; 17(7): 2006-2013. [ Links ]
35. Mercier C, Dupuis C, Blesius A, Fanciullino R, Yang C, Padovani L, Giacometti S, Frances N, Iliadis A, Duffaud F, Ciccolini J. Early severe toxicities after capecitabine intake: possible implication of a cytidine deaminase extensive metabolizer profile. Cancer Chemother Pharmacol 2009; 63(6):1177-1180. [ Links ]
36. Deenen MJ, Tol J, Burylo AM, Doodeman VD, de Boer A, Vincent A, Guchelaar HJ, Smits PH, Beijnen JH, Punt CJ, Schellens JH, Cats A. Relationship between single nucleotide polymorphisms and haplotypes in DPYD and toxicity and efficacy of capecitabine in advanced colorectal cancer. Clin Cancer Res 2011; 17(10):3455-3468. [ Links ]
37. Gao J, He Q, Hua D, Mao Y, Li Y, Shen L. Polymorphism of TS 3’-UTR predicts survival of chinese advanced gastric cancer patients receiving first-line capecitabine plus paclitaxel. Clin Transl Oncol 2012: 1-7. [ Links ]
38. Gieseler F, Rudolph P, Kloeppel G, Foelsch UR. Resistance mechanisms of gastrointestinal cancers: why does conventional chemotherapy fail? Int J Colorectal Dis 2003; 18(6):470-480. [ Links ]
39. Ichikawa W. Prediction of clinical outcome of fluoropyrimidine-based chemotherapy for gastric cancer patients, in terms of the 5-fluorouracil metabolic pathway. Gastric Cancer 2006; 9(3):145-155. [ Links ]
40. Blum MA, Suzuki A, Taketa T, Ajani J. The role of S-1 in the treatment of gastric cancer. Gastroint Cancer Targets Therap 2011; 1:59-67. [ Links ]
41. Park SR, Kong SY, Nam BH, Choi IJ, Kim CG, Lee JY, Cho SJ, Kim YW, Ryu KW, Lee JH, Rhee J, Park YI, Kim NK. CYP2A6 and ERCC1 polymorphisms correlate with efficacy of S-1 plus cisplatin in metastatic gastric cancer patients. Br J Cancer 2011; 104(7):1126-1134. [ Links ]
42. Raymond E, Faivre S, Chaney S, Woynarowski J, Cvitkovic E. Cellular and molecular pharmacology of oxaliplatin. Mol Cancer Ther 2002; 1(3):227-235. [ Links ]
43. Matsubara J, Nishina T, Yamada Y, Moriwaki T, Shimoda T, Kajiwara T, Nakajima TE, Kato K, Hamaguchi T, Shimada Y, Okayama Y, Oka T, Shirao K. Impacts of excision repair cross-complementing gene 1 (ERCC1), dihydropyrimidine dehydrogenase, and epidermal growth factor receptor on the outcomes of patients with advanced gastric cancer. Br J Cancer 2008; 98(4):832-839. [ Links ]
44. Huang ZH, Hua D, Du X, Li LH, Mao Y, Liu ZH, Song MX, Zhou XK. ERCC1 polymorphism, expression and clinical outcome of oxaliplatin-based adjuvant chemotherapy in gastric cancer. World J Gastroenterol 2008; 14(41):6401-6407. [ Links ]
45. Rabik CA, Dolan ME. Molecular mechanisms of resistance and toxicity associated with platinating agents. Cancer Treat Rev. 2007; 33(1):9-23. [ Links ]
46. Goekkurt E, Hoehn S, Wolschke C, Wittmer C, Stueber C, Hossfeld DK, Stoehlmacher J. Polymorphisms of glutathione S-transferases (GST) and thymidylate synthase (TS): novel predictors for response and survival in gastric cancer patients. Br J Cancer 2006; 94(2): 281-286. [ Links ]
47. Li QF, Yao RY, Liu KW, Lv HY, Jiang T, Liang J. Genetic polymorphism of GSTP1: prediction of clinical outcome to oxaliplatin/5-FU-based chemotherapy in advanced gastric cancer. J Korean Med Sci 2010; 25(6):846-852. [ Links ]
48. Amptoulach S, Tsavaris N. Neurotoxicity caused by the treatment with platinum analogues. Chemother Res Pract 2011; 2011: 843019. [ Links ]
49. Waissbluth S, Daniel SJ. Cisplatin-induced ototoxicity: transporters playing a role in cisplatin toxicity. Hear Res 2013; 299:37-45. [ Links ]
50. Steiner M, Seule M, Steiner B, Bauer I, Freund M, Köhne CH, Schuff-Werner P. 5-Fluorouracil/Irinotecan induced lethal toxicity as a result of a combined pharmacogenetic syndrome: report of a case. J Clin Pathol 2005; 58(5):553-555. [ Links ]
51. Kim YA, Chung HC, Choi HJ, Rha SY, Seong JS, Jeung HC. Intermediate dose 5-fluorouracil-induced encephalopathy. Jpn J Clin Oncol 2006; 36(1):55-59. [ Links ]
52. Kalow W. Historical aspects of pharmacogenetics. En: Kalow W, Meyers UA, Tyndale RF, eds. Pharmacogenomics. Boca Raton, FL, USA: Taylor & Francis Group; 2005. p. 1-13. [ Links ]
53. Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Jr., Kinzler KW. Cancer genome landscapes. Science 2013; 339(6127):1546-1558. [ Links ]
54. Holbrook JD, Parker JS, Gallagher KT, Halsey WS, Hughes AM, Weigman VJ, Lebowitz PF, Kumar R. Deep sequencing of gastric carcinoma reveals somatic mutations relevant to personalized medicine. J Transl Med 2011; 9:119. [ Links ]
55. Kim HK, Choi IJ, Kim CG, Kim HS, Oshima A, Michalowski A, Green JE. A gene expression signature of acquired chemoresistance to cisplatin and fluorouracil combination chemotherapy in gastric cancer patients. PloS one 2011; 6(2):e16694. [ Links ]
56. Morel A, Boisdron-Celle M, Fey L, Soulie P, Craipeau MC, Traore S, Gamelin E. Clinical relevance of different dihydropyrimidine dehydrogenase gene single nucleotide polymorphisms on 5-fluorouracil tolerance. Mol Cancer Ther 2006; 5(11): 2895-2904. [ Links ]
57. The Genome Guided Gastric cancer (3G) Trial. National University Hospital, [Internet] Singapore; [Revisado: 15/03/ 2013]; Disponible en: http://clinicaltrialsfeeds.org/clinical-trials/show/NCT01100801. [ Links ]
58. Martinez-Fierro ML, Beuten J, Leach RJ, Parra EJ, Cruz-Lopez M, Rangel-Villalobos H, Riego-Ruiz LR, Ortiz-Lopez R, Martinez-Rodriguez HG, Rojas-Martinez A. Ancestry informative markers and admixture proportions in northeastern Mexico. J Hum Genet 2009; 54(9):504-509. [ Links ]
59. Candelaria M, Taja-chayeb L, Vidal-Millan S, Gutiérrez O, Serrano-Olvera A, Arce-Salinas C, Dueñas-González A. Importancia de la determinación de variantes genéticas que influyen en la eficacia y toxicidad farmacológica en oncología. Cancerología 2006; 1:57-70. [ Links ]
60. Ginsburg GS, Haga SB. Translating genomic biomarkers into clinically useful diagnostics. Exp Rev Mol Diag 2006; 6(2): 179-191. [ Links ]
61. Patrinos GP, Smith TD, Howard H, Al-Mulla F, Chouchane L, Hadjisavvas A, Hamed SA, Li XT, Marafie M, Ramesar RS, Ramos FJ, de Ravel T, El-Ruby MO, Shrestha TR, Sobrido MJ, Tadmouri G, Witsch-Baumgartner M, Zilfalil BA, Auerbach AD, Carpenter K, Cutting GR, Dung VC, Grody W, Hasler J, Jorde L, Kaput J, Macek M, Matsubara Y, Padilla C, Robinson H, Rojas-Martinez A, Taylor GR, Vihinen M, Weber T, Burn J, Qi M, Cotton RG, Rimoin D. Human Variome Project country nodes: documenting genetic information within a country. Hum Mutat 2012; 33(11):1513-1519. [ Links ]
62. Veenstra DL, Higashi MK, Phillips KA. Assessing the cost-effectiveness of pharmacogenomics. AAPS PharmSci 2000; 2(3):E29. [ Links ]
63. Di Francia R, Berretta M, Catapano O, Canzoniero LM, Formisano L. Molecular diagnostics for pharmacogenomic testing of fluoropyrimidine based-therapy: costs, methods and applications. Clin Chem Lab Med 2011; 49(7):1105-1111. [ Links ]
64. Dionne F, Mitton C, Rassekh R, Brooks B, Ross C, Hayden M, Carleton B. Economic impact of a genetic test for cisplatin-induced ototoxicity. Pharmacogenomics J 2012; 12(3):205-213. [ Links ]
65. Okines A, Verheij M, Allum W, Cunningham D, Cervantes A; Group Obot EGW. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2010; 21(suppl 5):v50. [ Links ]
66. Ajani JA, Bentrem DJ, Besh S, D’Amico TA, Das P, Denlinger C, Fakih MG, Fuchs CS, Gerdes H, Glasgow RE, Hayman JA, Hofstetter WL, Ilson DH, Keswani RN, Kleinberg LR, Korn WM, Lockhart AC, Meredith K, Mulcahy MF, Orringer MB, Posey JA, Sasson AR, Scott WJ, Strong VE, Varghese TK Jr, Warren G, Washington MK, Willett C, Wright CD, Mc Millian NR, Sundar H. Gastric Cancer, Version 2.2013. J Natl Comprehens Cancer Net 2013; 11(5):531-546. [ Links ]
67. Secretaria de Salud de México. Diagnóstico y Tratamiento del Adenocarcinoma Gástrico en Pacientes Adultos. [Internet] México D.F, 2009 [Revisado: 04/04/2013]. Disponible en: http://www.cenetec.salud.gob.mx/interior/gpc.html [ Links ]
68. Japanese Gastric Cancer Association. Japanese Gastric Cancer Treatment Guidelines 2010 (ver. 3). Gastric Cancer 2011; 14(2):113-123. [ Links ]
69. Sano T, Aiko T. New Japanese classifications and treatment guidelines for gastric cancer: revision concepts and major revised points. Gastric Cancer 2011; 14(2): 97-100. [ Links ]
70. Morel A, Boisdron-Celle M, Fey L, Laine-Cessac P, Gamelin E. Identification of a novel mutation in the dihydropyrimidine dehydrogenase gene in a patient with a lethal outcome following 5-fluorouracil administration and the determination of its frequency in a population of 500 patients with colorectal carcinoma. Clin Biochem 2007; 40(1-2):11-17. [ Links ]
71. Swen JJ, Nijenhuis M, de Boer A, Grandia L, Maitland-van der Zee AH, Mulder H, Rongen GA, van Schaik RH, Schalekamp T, Touw DJ, van der Weide J, Wilffert B, Deneer VH, Guchelaar HJ. Pharmacogenetics: from bench to byte-an update of guidelines. Clin Pharmacol Ther 2011; 89(5):662-673. [ Links ]
72. Loganayagam A, Arenas-Hernandez M, Fairbanks L, Ross P, Sanderson JD, Marinaki AM. The contribution of deleterious DPYD gene sequence variants to fluoropyrimidine toxicity in British cancer patients. Cancer Chemother Pharmacol 2010; 65(2):403-406. [ Links ]
73. Kleibl Z, Fidlerova J, Kleiblova P, Kormunda S, Bilek M, Bouskova K, Sevcik J, Novotny J. Influence of dihydropyrimidine dehydrogenase gene (DPYD) coding sequence variants on the development of Fluoropyrimidine-related toxicity in patients with high-grade toxicity and patients with excellent tolerance of Fluoropyrimidine-based chemotherapy. Neoplasma 2009; 56(4):303-316. [ Links ]
74. van Kuilenburg AB, Meijer J, Mul AN, Meinsma R, Schmid V, Dobritzsch D, Hennekam RC, Mannens MM, Kiechle M, Etienne-Grimaldi MC, Klumpen HJ, Maring JG, Derleyn VA, Maartense E, Milano G, Vijzelaar R, Gross E. Intragenic deletions and a deep intronic mutation affecting pre-mRNA splicing in the dihydropyrimidine dehydrogenase gene as novel mechanisms causing 5-fluorouracil toxicity. Hum Genet 2010; 128(5):529-538. [ Links ]
75. Van Kuilenburg ABP, Meinsma R, Zonnenberg BA, Zoetekouw L, Baas F, Matsuda K, Tamaki N, van Gennip AH. Dihydropyrimidinase deficiency and severe 5-fluorouracil toxicity. Clin Cancer Res 2003; 9(12):4363-4367. [ Links ]
76. Zarate RN, Arias F, Bandres E, Cubedo E, Malumbres R, Garcia-Foncillas J. Xeroderma Pigmentosum group D 751 polymorphism as a predictive factor in resected gastric cancer treated with chemo-radiotherapy. World J Gastroenterol 2006; 12(37):6032-6036. [ Links ]












 uBio
uBio