Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.58 no.1 Maracaibo mar. 2017
Epidemiología molecular de aislados clínicos de Klebsiella pneumoniae productores de carbapenemasas tipo KPC provenientes de dos hospitales públicos en los estados Carabobo y Zulia, Venezuela.
Molecular epidemiology of KPC-producing Klebsiella pneumoniae isolated from patients in two public hospitals in Carabobo and Zulia states, Venezuela.
Aura Falco 1, 2 , Yotsimar Barrios 2 , Luis Torres 3 , Lisette Sandrea 4 y Howard Takiff 2, 5 .
1 Facultad de Ciencias Básicas, Universidad Santiago de Cali, Cali, Colombia.
2 Laboratorio de Genética Molecular, Centro de Microbiología y Biología Celular, Instituto Venezolano de Investigaciones Científicas, Caracas, Venezuela.
3 Universidad Central de Venezuela, Cátedra de Microbiología, Escuela de Bioanálisis, Caracas, Venezuela.
4 Centro de Referencia Bacteriológica, Servicio Autónomo Hospital Universitario de Maracaibo, Facultad de Medicina, Escuela de Bioanálisis, Universidad del Zulia, Maracaibo, Venezuela.
5 Unité de Génétique Mycobacterienne, Inst. Pasteur, Paris, France.
Autor de Correspondencia: Aura Falco, Facultad de Ciencias Básicas, Universidad Santiago de Cali, Cali, Colombia. Correo electrónico: aura.falco00@usc.edu.co .
Resumen.
Klebsiella pneumoniae productora de carbapenemasas tipo KPC es uno de los principales agentes causante de infecciones nosocomiales a nivel mundial. En Venezuela se han identificado aislados de esta bacteria, sin embargo, se conoce poco sobre su dispersión. El objetivo de este estudio fue realizar la epidemiología molecular de aislados de K. pneumoniae productores de KPC provenientes de dos hospitales públicos ubicados en los estados Carabobo y Zulia. Se seleccionaron 32 aislados de K. pneumoniae clasificados fenotípicamente como productores de KPC, se les realizó la detección del gen bla KPC así como su ubicación en el transposón Tn4401 a través de PCR. El producto de PCR del gen blaKPC se secuenció para identificar los alelos circulantes. El análisis genotípico se realizó empleando las técnicas de amplificación por PCR de las secuencias repetidas extragénicas palindrómicas (rep-PCR) y la secuenciación de múltiples loci (MLST). Mediante ensayos de conjugación, se determinó si los genes bla KPC se encontraban en moléculas plasmídicas.Los resultados indican que los 32 aislados contenían la variante del gen bla KPC-2 asociada a la isoforma Tn4401 b y se distribuyeron en 9 secuencias tipo (ST), siendo una de ellas nueva. Los ensayos de conjugación indican que el 87,5% de los aislados tienen al gen bla KPC en plásmidos movilizables. En estos hospitales el gen bla KPC-2 se está dispersando a través de plásmidos que llevan al transposón Tn4401 b. Las ST más comunes pertenecen a los Complejos Clonales CC258 y CC147, que desempeñan un papel importante en la dispersión de la resistencia a carbapenemes a nivel mundial.
Palabras clave: KPC; Klebsiella pneumoniae ; carbapenemes.
Abstract.
Klebsiella pneumoniae carbapenemase (KPC)-producing bacteria ( K. pneumoniae carbapenemase ) are the most important causative agents of nosocomial infections worldwide. These isolates have been identified in Venezuela, but little is known about their local spread. The aim of this study was to perform molecular epidemiology of KPC-producing K. pneumoniae isolated from two public hospitals in the Carabobo and Zulia states of Venezuela. Thirty-two K. pneumoniaei solates, phenotypically classified as KPC producers were subjected to PCR to detect the presence of bla KPC genes and their location within transposon Tn4401 , and the bla KPC product was sequenced to identify the KPC allele. Genotypic analysis was performed using repeated extragenic palindromic PCR (rep-PCR) and Multi Locus Sequence Typing (MLST). Finally, a conjugation assay determined whether the bla KPC genes were carried on transferable plasmids. The results indicate that the 32 isolates contained the bla KPC-2 variant associated with isoform Tn4401 b, and were distributed in nine sequence types (ST), one of which was new. Conjugation assays indicate that 87.5% of the isolates contain the gene bla KPC on mobilizable plasmids. In these hospitals, the bla KPC-2 gene is spreading through the plasmids carrying the transposon Tn4401 b. The most common ST belongs to Clonal Complexes CC258 and CC147, which play an important role in the dispersion of resistance to carbapenems worldwide.
Keywords: KPC, Klebsiella pneumoniae , carbapenems.
Recibido: 15-11-2015 Aceptado: 24-11-2016
INTRODUCCIÓN
Klebsiella pneumoniae productora de carbapenemasas tipo KPC es uno de los principales patógenos resistente a múltiples antibióticos causante de infecciones nosocomiales a nivel mundial(1-3). Las bacterias que producen carbapenemasas son capaces de hidrolizar todos los β-lactámicos incluyendo a los carbapenemes, que constituyen el tratamiento de elección en las infecciones ocasionadas por bacterias Gram-negativas productoras de β–lactamasas de espectro extendido (BLEE)(3). Las carbapenemasas KPC tienen una alta capacidad de propagación debido a que el gen que las codifica, bla KPC, se encuentra en elementos genéticos móviles como plásmidos conjugativos y el transposón Tn4401 (4,5). En Venezuela, el Programa Venezolano de Vigilancia de la Resistencia a los Antibióticos (PROVENRA, http://www.provenra.org ), ha hecho una evaluación acumulada de la resistencia a carbapenemes y reportan que para aislados de K. pneumoniae fue del 9,4% durante el año 2013. En el país son pocos los estudios que se han realizado acerca de aislados de K. pneumoniae productores de carbapenemasas tipo KPC. El primero de ellos fue hecho por Marcano y col. en el año 2011 (6), en ocho centros de salud ubicados en Caracas. Los resultados obtenidos indican que el 2,1% de los aislados evaluados fenotípicamente eran K. pneumoniae productores de carbapenemasas tipo KPC. Por su parte, Labrador y Araque en el año 2014, describieron un aislado de Klebsiella oxytoca productora de carbapenemasa tipo KPC-2, proveniente de un paciente pediátrico que adquirió una neumonía nosocomial en el Hospital de la Universidad de los Andes en el estado Mérida (7), mientras que Martínez y col. en el año 2015, reportaron un aislado de Enterobacter cloacae co-productor de KPC y VIM proveniente de un paciente de 83 años con infección urinaria severa que ingresó al Hospital de Cumaná (8). Aunque se ha detectado la presencia de aislados de K. pneumoniae productores de KPC en algunos hospitales en Venezuela, no se ha descrito ni su epidemiología ni su impacto clínico. En este estudio se planteó realizar la caracterización molecular de los aislados resistentes circulantes en dos hospitales públicos ubicados en los estados Carabobo y Zulia. Para ello se seleccionaron 32 cepas clasificadas por pruebas fenotípicas como K. pneumoniae productoras de carbapenemasas tipo KPC, las cuales fueron aisladas durante el año 2013. Se determinó su relación genética, se identificaron los alelos del gen bla KPC y su posible ubicación en el transposón Tn4401 , así como si se encuentran en plásmidos con capacidad de transferencia.
MATERIALES Y MÉTODOS
Recolección de aislados clínicos de K. pneumoniae
Se recolectaron aislados clínicos de K. pneumoniae durante los meses de febrero a noviembre del año 2013 provenientes de la Ciudad Hospitalaria Dr. Enrique Tejera (CHET), localizado en la ciudad de Valencia, estado Carabobo, y del Servicio Autónomo Hospital Universitario de Maracaibo (SAHUM), ubicado en el estado Zulia (Fig. 1). Los análisis moleculares se realizaron con el primer aislado bacteriano recuperado de cada paciente, mientras que la información clínica se obtuvo del registro de cada centro hospitalario y se mantuvo en estricta e irreversible confidencialidad. Este estudio con- tó con la aprobación de la Comisión de Bioética del Instituto Venezolano de Investigaciones Científicas (IVIC).
Criterios de selección de los aislados de K. pneumoniae y pruebas de sensibilidad a antibióticos
El criterio de selección de los aislados clínicos de K. pneumoniae fue resistencia o resistencia intermedia a cefalosporinas de tercera generación y a carbapenemes. Los niveles de resistencia fueron determinados mediante el método de Kirby-Bauer siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) del año 2013 (9). Los antibióticos ensayados fueron:ceftazidima (30 μg), ceftriaxona (30 μg), cefotaxima (30 μg), imipenem (10 μg), meropenem (10 μg) y ertapenem (10 μg). A los aislados seleccionados se les realizaron dos pruebas fenotípicas adicionales. La primera de ellas fue el Test de Hodge Modificado (THM), el cual ha sido recomendado por el CLSI, para la detección fenotípica de carbapenemasas en aislados de la Familia Enterobacteriaceae . La segunda prueba que se aplicó fue el test con el ácido 3-aminofenilborónico (AFB), el cual se utilizó para realizar la detección fenotípica de las ß-lactamasas del tipo KPC, debido a que el AFB ejerce un efecto inhibitorio sobre el sitio activo (residuo de serina) de este tipo de enzimas.
Detección del gen bla KPC y determinación de su entorno genético
Se utilizó la reacción en cadena de la polimerasa (PCR) para detectar el gen bla KPC (10) empleando los iniciadores que se observan en la Ta bla I. También se determinó el entorno genético del gen bla KPC utilizando iniciadores específicos para el transposón Tn4401 (11) (Tabla I). Después de la amplificación por PCR de los fragmentos, éstos fueron secuenciados en Macrogen, Corea, empleando los iniciadores delantero y reverso correspondientes. Se compararon las secuencian con las disponibles en la base de datos Lahey ( www.lahey.org/Studies /) y el GenBank® utilizando el Basic Local Alignment Search Tool (BLAST) ( www.ncbi.nlm.gov/blast / ).
Genotipificación molecular
Las relaciones genéticas entre los aislados de K. pneumoniae productores de carbapenemasas tipo KPC fueron determinadas empleando las técnicas de amplificación por PCR de las secuencias repetidas extragénicas palindrómicas (rep-PCR) y la secuenciación de múltiples loci (MLST). El rep-PCR se realizó empleando los iniciadores REP1 y REP2 descritos por Versalovic y col., (12). Los criterios empleados para interpretar los patrones generados por rep-PCR, fueron los establecidos por Tenover y col. en el año 1995 (13), quienes definieron cuatro categorías de relación genética y epidemiológica: a) Indistinguibles: son aislamientos que muestran patrones de bandas iguales por lo que pueden ser considerados clones; b) Estrechamente relacionados: los patrones de bandas difieren en dos o tres bandas; c) Posiblemente relacionados: sus patrones muestran cuatro a seis bandas de diferencia; y d) No relacionados: los patrones de bandas difieren en más de seis. Adicionalmente, los patrones de bandas generados para cada aislado bacteriano se analizaron con el software Bionumerics, versión 7.5 (Applied Maths NV/ Inc.), empleando el coeficiente binario Dice y la media aritmética UPGM (Unweighted Pair Group Method), con ajustes de tolerancia y optimización del 1% para crear el dendograma. La posición de las bandas en cada gel se normalizó empleando el marcador de peso molecular 100 pb Ladder (New England Biolabs® Inc.) como un estándar de referencia externo.
El MLST se realizó de acuerdo a Diancourt y col. (14) (Tabla I). Después de la amplificación por PCR, los fragmentos fueron secuenciados por Macrogen, Corea. Los alelos y las ST fueron asignados por el sitio web del MLST de Klebsiella pneumoniae ( http://www.pasteur.fr/recherche/genopole/PF8/mlst/Kpneumo-niae.html ). Para establecer las relaciones entre las secuencias tipo, se empleó el algoritmo goeBURST (15) implementado en el software PHYLOViZ ( http://goeburst.phyloviz.net/ ) (16). Los Complejos Clonales (CC) fueron definidos a nivel de variantes tanto en un solo locus (SLV) como en dos (DLV) y tres locus (TLV).
Ensayos de conjugación
Se realizaron ensayos de conjugación con el fin de determinar si los genes bla KPC se encuentran en moléculas de ADN plasmídico movilizables. Se emplearon como cepas donantes los aislados de K. pneumoniae productores de carbapenemasas KPC y sensibles a rifampicina, mientras que como cepa receptora se empleó a Escherichia coli J-62 (F ̄, his, pro, trp, lac, RIF R ). Las transconjugantes fueron seleccionadas en placas de agar LB suplementado con ampicilina (100 μg/mL) y rifampicina (50 μg/mL). La presencia del gen bla KPC en las transconjugantes fue confirmada por PCR.
RESULTADOS
Recolección de aislados clínicos
Se seleccionaron 32 aislados clínicos de K. pneumoniae , 10 de ellos provenientes de la Ciudad Hospitalaria Dr. Enrique Tejera (CHET) y 22 del Servicio Autónomo Hospital Universitario de Maracaibo (SAHUM). El servicio de procedencia de las muestras fue variado, 13 (43,3%) provenian de la unidad de terapia intensiva de adultos y 8 (26,7%) de terapia intensiva pediátrica, seguida de 4 (13,4%) de medicina interna, 3 (10%) del servicio neonatal y 1 (3,3%) de observación de adultos y pediatría, respectivamente. Hubo 2 aislados del CHET que no tenían la información correspondiente al servicio de procedencia.
Criterios de selección de los aislados de K. pneumoniae y pruebas de sensibilidad a antibióticos
Todos los aislados fueron resistentes a cefalosporinas de tercera generación y carbapene -mes ensayados. Así mismo, todos los aislados fueron positivos para las pruebas fenotípicas THM y Test AFB, lo cual indica que son presuntos productores de carbapenemasas tipo KPC.
Detección del gen bla KPC y determinación de su entorno genético
El gen bla KPC fue detectado en los 32 aislados evaluados y se pudo determinar que el alelo circulante fue KPC-2 para todos ellos. Con respecto al entorno genético de los genes, se detectó en los 32 aislados un producto de PCR de 703 pb, el cual ha sido asociado con la variante b del transposón Tn4401 . La secuencia de inserción IS Kpn6 y el gen tnp A también fueron amplificados en los 32 aislados. Sin embargo, para ninguno de ellos se obtuvieron los amplificados correspondientes a las secuencias repetidas invertidas del Tn4401 descritos por Naas y col. (5,17).
Genotipificación molecular
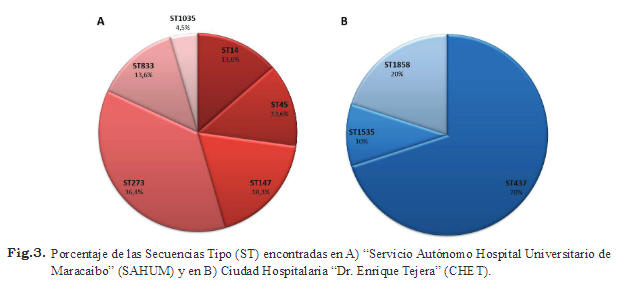
El análisis de los perfiles generados por repPCR reveló que los aislados de K. pneumoniae productores de carbapenemasas tipo KPC evaluados tienen diferentes genotipos (Fig. 2), esta tendencia también se pudo apreciar cuando se realizó el análisis por MLST. Aunque se reportan 9 secuencias tipo diferentes, ninguna se encontró en ambos hospitales. Así tenemos que en el SAHUM se localizaron los siguientes genotipos: ST14 en los servicios de neonatal y terapia intensiva, ST45 en terapia intensiva de adultos y pediátrica, ST147 en los servicios de neonatal y terapia intensiva de adultos, ST273 en neonatal, pediatría y terapia intensiva pediátrica, ST833 en terapia intensiva y ST1035 en el servicio de terapia intensiva pediátrica (Figs. 2 y 3). Mientras que en el CHET se identificaron los siguientes genotipos: ST437 localizado en los servicios terapia intensiva y medicina interna, ST1535 y una secuencia tipo nueva, ST1858, que fue depositada en la base de datos de K. pneumoniae, y se encontraba en el servicio de terapia intensiva de adultos (Figs.2 y 3).
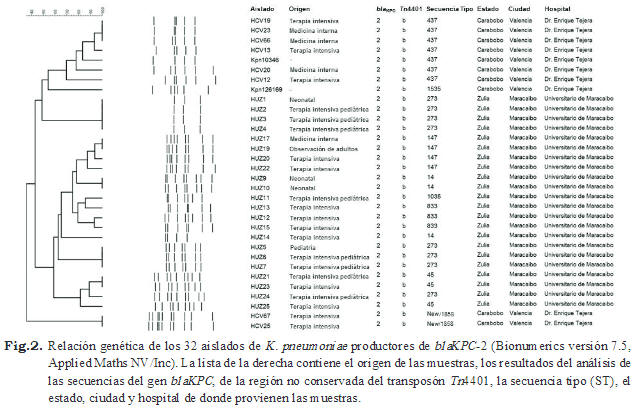
Con respecto a los perfiles generados por repPCR para los aislados procedentes del CHET, se pudo determinar que hay 3 grupos, y en dos de ellos, sus miembros mantienen una relación genética clonal. El primero está conformado por los aislados HCV25 y HCV67, mientras que el segundo por los aislados HCV13, HCV19, HCV23 y HCV66 (Fig. 2). Estos hallazgos fueron confirmados usando la técnica MLST, cuyos resultados indican que los aislados de cada uno de los grupos comparten la misma secuencia tipo, siendo para el primer grupo, la ST1858, mientras que para el segundo, la ST437 (Fig. 3). Finalmente, se pudo comprobar que los aislados HCV12, HCV20, Kpn10346 y Kpn126169 se pueden considerar estrechamente relacionados (Fig. 2). En este caso, los resultados del MLST indican que tres de estos cuatro aislados comparten la misma secuencia tipo, la ST437, mientras que Kpn126169, es portador de la ST1535 (Fig. 3). Con respecto a los perfiles generados por rep-PCR para los aislados procedentes del SAHUM, se pudo determinar que hay 6 grupos, 5 de los cuales mantienen una relación clonal entre sus miembros. El grupo 1 está constituido por los aislados HUZ1, HUZ2, HUZ3 y HUZ4; el grupo 2 por las muestras HUZ5, HUZ6 y HUZ7; el grupo 3 por los aislados HUZ9 y HUZ10; el grupo 4 por las muestras HUZ17, HUZ19, HUZ20 y HUZ22; y el grupo 5 por los aislados HUZ21, HUZ23, HUZ24 y HUZ25 (Fig. 2). Los resultados obtenidos por rep-PCR indican que los grupos 1 y 2 están posiblemente relacionados, mientras que los grupos 2, 3, 4 y 5 están estrechamente relacionados. Sin embargo, los resultados del MLST indican que todos los aislados que forman parte del grupo 1 y 2 tienen la ST273, mientras que los aislados que forman parte del grupo 3 y 4, tienen la ST14 y ST147, respectivamente. En el grupo 5, aun cuando los aislados pueden ser considerados clones por repPCR, difieren en la secuencia tipo. Las muestras HUZ21, HUZ23 y HUZ25 pertenecen al ST45, mientras que la HUZ24 a la ST273. Finalmente, el grupo 6 está constituido por los aislados HUZ11, HUZ12, HUZ13 y HUZ15, que están estrechamente relacionados entre sí y pertenecen a la ST833; y la muestra HUZ14, que tiene un perfil único y pertenece al ST14 (Fig. 3).
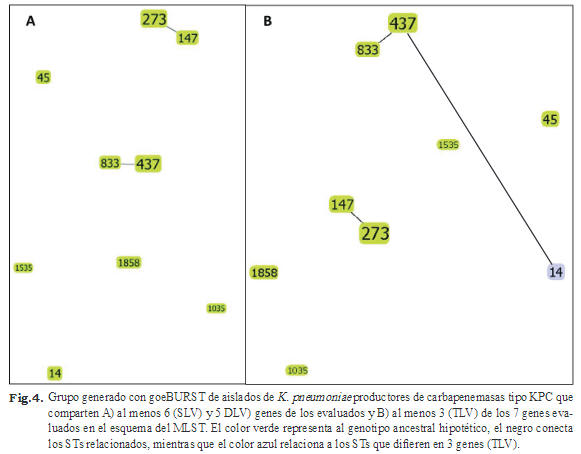
Los resultados obtenidos aplicando el algoritmo goeBURST indican que, al evaluar los perfiles alélicos usando como parámetros que los STs compartan 6 (SLV) o 5 (DSV) de los 7 genes con al menos otro miembro del grupo, se observa que tanto los STs 273 y 147 (ambos ubicados en el SAHUM) como los STs 437 y 833 (ubicados en CHET y SAHUM, respectivamente), se agrupan en un mismo CC, mientras que el resto de los STs permanecen sin agruparse (singletons) (Fig. 4A). Al usar como parámetro que los STs en el mismo grupo compartan al menos 4 de los 7 genes (TLV) con al menos otro miembro del grupo, se encontraron los mismos CC mencionados previamente, pero además se puede observar que el ST14, aislado en el SAHUM, es un TLV del ST437, aislado en el CHET (Fig. 4B).
Ensayos de conjugación
Veintiocho de los 32 aislados (87,5%) de K. pneumoniae productores de carbapenemasas tipo KPC fueron capaces de transferir el gen bla KPC a la cepa receptora E. coli . J-62, mientras que cuatro aislados (12,5%) no lo hicieron bajo las condiciones ensayadas. La presencia del gen bla KPC fue confirmada por PCR en todos los transconjugantes, lo que indica que los genes se encuentran en plásmidos conjugativos. Los aislados provenientes del SAHUM que no conjugaron fueron HUZ2 y HUZ4. Ambos pertenecen a la misma secuencia tipo (ST273) y proceden del servicio de terapia intensiva pediátrica. Del CHET, los aislados que no conjugaron fueron la muestra HCV67, con la secuencia tipo ST1858 y localizada en la sala de terapia intensiva de adultos, y Kpn10346 con ST437, de la cual no se obtuvo información acerca de su ubicación.
DISCUSIÓN
Los carbapenemes han sido el tratamiento de elección para las infecciones causadas por enterobacterias productoras de β–lactamasas de espectro extendido (BLEE), sin embargo, su uso ha traído como consecuencia la selección de bacterias resistentes (18). Aunque la resistencia a carbapenemes en enterobacterias es todavía poco común en Venezuela, es importante destacar que generalmente el gen bla KPC se localiza en elementos genéticos móviles como transposones y plásmidos que tienen capacidad de transmitirse de forma horizontal entre bacterias (5). Por este motivo, es muy importante tomar medidas de control eficaces que permitan la detección rápida de bacterias portadoras del gen bla KPC con el fin de evitar su diseminación a nivel hospitalario. En este estudio se integran los datos clínicos y moleculares de aislados de K. pneumoniae provenientes de dos hospitales públicos ubicados en los estados Carabobo y Zulia, y en el que además, se pudo determinar la presencia de los alelos bla KPC y de los genotipos circulantes.
Un total de 21 de los 32 (70%) aislados de K. pneumoniae carbapenemes resistentes provienen de terapia intensiva de adultos y niños, mientras que el 30% restante fueron aislados de las áreas de medicina interna, servicio neonatal, observación de adultos y pediatría, lo cual significa que estas bacterias se encuentran ampliamente distribuidas en diferentes servicios de ambos hospitales, que son considerados centros de alta complejidad debido a que están clasificados dentro del sistema de salud venezolano como tipo IV.
Se han descrito 23 variantes del gen bla KPC (desde KPC-2 hasta KPC-24) ( http://www.lahey.org/studies/other.asp#table1 ),y en este estudio se pudo determinar que los 32 aislados evaluados eran portadores del alelo KPC-2, uno de los más distribuidos a nivel mundial (19,20)incluyendo países de América del Sur como Colombia (21-23), Brasil (24-27), Argentina (28,29) y Venezuela (7). Con respecto al ambiente genético que rodea al gen bla KPC, se ha descrito a nivel mundial que este gen generalmente se encuentra asociado al elemento móvil Tn4401 , el cual también está compuesto por los genes que codifican para una transposasa y una resolvasa y dos secuencias de inserción ( IS Kpn6 y IS Kpn7) (5). Hasta el momento, se han descrito 5 isoformas del transposón (a-e), que se diferencian por polimorfismos localizados hacia el extremo 5 ́ del gen bla KPC. En este estudio se encontró que el gen bla KPC-2 está asociado con la isoforma b del transposón Tn4401 en los 32 aislados estudiados, la cual se ha descrito en diversos países como EUA (20), Grecia (30), Colombia (11)y Brasil (4). En este estudio no se obtuvieron los amplificados correspondientes a las secuencias repetidas invertidas de las regiones que flanquean al transposón Tn4401 , al igual que lo han reportado Pereira y col. (17), lo que sugiere que los sitios de inserción del elemento móvil podrían ser diferentes a los descritos en el aislado de K. pneumoniae mencionados por Naas y col. (5).
Con respecto a la genotipificación molecular de los aislados de K. pneumoniae a través del rep-PCR y MLST, se pudo evidenciar que hay una diversidad de genotipos circulando en ambos hospitales (Figs. 2 y 3). Sin embargo, aunque rep-PCR es una técnica sencilla, rápida, de relativo bajo costo con excelente reproducibilidad, tiene la desventaja de poseer una versatilidad y poder de resolución menor que el MLST (31,32). Es por este motivo, que esta técnica suele utilizarse como primer paso ante un estudio epidemiológico y se debe complementar con otra técnica que tenga un poder de discriminación mayor como el MLST(33). Los resultados de este estudio indican que las secuencias tipo obtenidas a través de MLST y los perfiles de bandas por rep-PCR, se correlacionan en gran medida. Sin embargo, hay aislados que por repPCR se encuentran estrechamente relacionados pues tienen patrones de bandas que varían en 2 bandas, pero tienen la misma secuencia tipo, como por ejemplo HCV13 y HCV20. Esto puede deberse a que en el genoma de estas bacterias ocurrió algún cambio, como una inserción o una deleción, lo cual provocó una variación en el patrón de bandas pero no afectó ninguno de los 7 genes secuenciados en el esquema de MLST para K. pneumoniae . Los resultados indican que el SAHUM fue el que mostró una mayor diversidad genética debido, muy probablemente, a que había un mayor número de aislados procedentes del mencionado hospital. Entre los 32 aislados de K. pneumoniae portadores del gen bla KPC-2, se encontraron 9 STs establecidos por MLST (Figs. 2 y 3) y 7 perfiles indistinguibles por rep-PCR (Fig. 2). El 66,6% de los genotipos se encontró en el SAHUM, mientras que el 33,3% restante en el CHET y ninguna de las secuencias tipo se encontraron de forma compartida entre ambos hospitales (Tabla II). La ST437 ubicada en los servicios de terapia intensiva y medicina interna de adultos del CHET, y la ST833(34) localizados en el servicio de terapia intensiva de adultos del SAHUM, representan el 31,25% (n = 10/32) de los aislados y forman parte del mismo CC (Fig. 4). Ambos genotipos son variantes en un locus ( ton B) de las secuencias tipo ST258, que a su vez forman parte del Grupo Clonal 258 (GC258), que incluye los genotipos más exitosos para dispersar los genes bla KPC a nivel mundial. Mientras que en Venezuela es la primera vez que se reporta la presencia de GC258, éste ha sido reportado en países como: China (35), Corea (36,37),Hungría (38), Polonia (39), Brasil (4,40,41), Grecia (30) España (42) e Inglaterra (43). La ST437 se ha conseguido en Brasil, tanto en aislados clínicos (4,40,41,44-46) como en aislados procedentes de ríos urbanos ubicados al sureste de ese país (47). La secuencia tipo ST833 se ha reportado principalmente en Israel (34), pero también se ha conseguido en Italia (48), específicamente en un aislado clínico de K. pneumoniae productor de carbapenemasa tipo KPC-2 proveniente de un hemocultivo de un paciente de tres años de edad procedente de Venezuela que fue admitido en el Hospital Pediátrico de Trieste para someterse a un trasplante de médula. Es importante mencionar que el estudio epidemiológico de aislados clínicos de K. pneumoniae productores de carbapenemasas tipo KPC que estamos desarrollando en Venezuela, ha permitido evidenciar la presencia del ST833 en otros 2 estados diferentes: Distrito Capital (datos no publicados) y Anzoátegui (49) (Tabla II).

El segundo ST más común en este estudio es el ST273, el cual representa el 25% (n = 8/32) de los aislados y es variante en un locus (tonB) de la secuencia tipo ST147, que a su vez está representada por 4 aislados (12,5%). Ambos genotipos se encuentran en el SAHUM (Tabla II) y forman parte del mismo Complejo Clonal (Fig. 4), el CC147, el cual ha sido encontrado principalmente en Israel (34) y ha sido asociado a la producción de diferentes tipos de carbapenemasas como: VIM (50-52), NDM (53,54) y KPC. Precisamente, se ha reportado el ST147 en aislados de K. pneumoniae productores de carbapenemasas tipo KPC-2 en Grecia (30) e Italia (55). Por su parte, el genotipo ST273, ha sido asociado previamente con aislados productores de CTX-M-15 en países como Hungría (56), Italia (57), España (58) y Tunes (59). Además se ha encontrado este ST en países como Noruega e Italia (60), asociados a la producción de β– lactamasas como VIM, SHV y TEM, así como productores de carbapenemasa tipo KPC-2 en Rusia (61) y tipo KPC-3 en Italia (62) (Tabla II).
El Grupo Clonal 15 (GC15), compuesto por las secuencias tipo ST14/15, ha sido reportado de forma frecuente como productor de BLEE y otras β–lactamasas a nivel mundial (34,53,56,63-66). Específicamente, la ST14 se ha relacionado frecuentemente como portadora de genes del tipo bla CTX-M grupo 1 (53), bla NDM-1, bla OXA-48, bla SHV, bla OXA-1 y bla OXA-181 (53,67-70). Sin embargo, hasta la fecha este genotipo, localizado en el SAHUM, no había sido asociado con la producción de carbapenemasas tipo KPC-2, como se hace en este estudio (Tabla II). Por su parte, la secuencia tipo ST45 ha sido reportada en tres países: Brasil (71), Japón (72) e Irlanda (70). En todos los casos ha sido relacionada con la producción de β-lactamasas como: CTX-M-15, SHV-1 y OXA1 pero este también nunca antes como productora de carbapenemasas tipo KPC-2 (Tabla II). Otros genotipos observados durante la realización de este trabajo, como ST1035 y ST1535, no han sido reportados previamente, por lo tanto, no se han relacionado con la producción de carbapenemasas tipo KPC. Sin embargo, en la base de datos del Instituto Pasteur que maneja el MLST de K. pneumoniae , se puede evidenciar que la ST1035 ha sido detectada en Rio ras que la ST1535 ha sido aislada en Kyoto, Japón. Adicionalmente, en este estudio reportamos una secuencia tipo nueva, ST1858, que fue depositada en la base de datos de K. pneumoniae (Tabla II).
Los resultados obtenidos usando el algoritmo goeBURST indican que hay 2 complejos clonales formados por los STs 273/147 y 437/833, que comparten 6 de los 7 genes evaluados por MLST (Fig. 4). Sin embargo, debido a la presencia de 5 STs que permanecen sin agruparse en CC y debido a que el número de STs es tan pequeño y tan variable entre sus loci, la herramienta no puede diferenciar un genotipo ancestral hipotético. En general, los resultados de genotipificación obtenidos en este estudio sugieren que la diseminación de los genes blaKPC-2 en ambos hospitales ocurre a través de genotipos que forman parte de clones epidémicos como: GC258, CC147 y GC15, los cuales representan el 66,6% (n = 6/9) de los genotipos en este estudio, y que además se han descrito como exitosos para propagar los genes blaKPC a nivel mundial.
Los ensayos de conjugación realizados usando como cepas donantes los aislados de K. pneumoniae portadores del gen blaKPC, indican que el 87,5% contenían el gen en plásmidos que eran transferibles horizontalmente a través del proceso de conjugación. En conjunto, estos resultados indican que aun cuando los aislados compartan o no una secuencia tipo, lo que está contribuyendo a la resistencia a carbapenemes mediada por el gen bla KPC es el ADN plasmídico de cada una de las muestras, por lo que sería importante aislarlos y evaluar su perfil. Estos resultados ponen de manifiesto la importancia de los plásmidos en la diseminación del gen bla KPC en las diferentes salas de un hospital y a su vez resalta la necesidad de tomar las medidas de control que eviten su diseminación a nivel intra e interhospitalario.
Conocer la epidemiología molecular de aislados clínicos de K. pneumoniae productoras de carbapenemasas tipo KPC es un paso importante hacia el desarrollo de estrategias específicas para prevenir la propagación de este patógeno resistente a múltiples drogas en nuestro país. Hay evidencia de que en Venezuela la expansión del gen bla KPC-2 se produce a través de la dispersión del transposón Tn 4401b, que se localiza generalmente en plásmidos conjugativos. En este trabajo se han descrito 9 genotipos circulantes en dos hospitales públicos del país. El 66,6% (n = 6/9) de los genotipos pertenecen a clones epidémicos como: GC258, CC147 y GC15, los cuales se han descrito como exitosos en la dispersión de los genes bla KPC a nivel mundial. Esto podría significar que en Venezuela, la propagación de los genes que codifican para carbapenemasas tipo KPC puede estar favorecida por su localización en plásmidos y transposones, y también por clones eficientes.
AGRADECIMIENTOS
Al equipo de curadores que manejan la base de datos del MLST y del genoma de Klebsiella pneumoniae del Instituto Pasteur por incorporar la nueva secuencia tipo reportada en este trabajo y ponerla a disposición del público a través del enlace en http://bigsdb.web.pasteur.fr/ . La realización de este trabajo fue financiada por el Instituto Venezolano de Investigaciones Científicas, bajo el número de proyecto 1237.
REFERENCIAS
1. Nordmann P. Carbapenemase-producing Enterobacteriaceae : overview of a major public health challenge. Med Mal Infect 2014; 44(2): 51-56. [ Links ]
2. Nordmann P, Naas T, Poirel L. Global spread of Carbapenemase-producing Enterobacteriaceae. Emerg Infect Dis 2011; 17(10): 1791-1798. [ Links ]
3. Nordmann P, Cuzon G, Naas T. The real threat of Klebsiella pneumoniae carbapenemase-producing bacteria. Lancet Infect Dis 2009; 9(4): 228-236. [ Links ]
4. Pereira PS, de Araujo Cf , Seki LM, Zahner V, Carvalho-Assef AP, Asensi MD. Update of the molecular epidemiology of KPC-2-producing Klebsiella pneumoniae in Brazil: spread of clonal complex 11 (ST11, ST437 and ST340). J Antimicrob Chemother 2013; 68(2): 312-316. [ Links ]
5. Naas T, Cuzon G, Villegas MV, Lartigue Mf , Quinn JP, Nordmann P. Genetic structures at the origin of acquisition of the beta-lactamase bla KPC gene. Antimicrob Agents Chemother 2008; 52(4): 12571263. [ Links ]
6. Marcano D, De Jesus A, Hernandez L, Torres L. Frequency of enzymes associated with reduced sensitivity to beta-lactam antibiotics in enterobacteria isolates, Caracas, Venezuela. Rev Panam Salud Pública 2011; 30(6): 529-534. [ Links ]
7. Labrador I, Araque M. First description of KPC-2-producing Klebsiella oxytoca Isolated from a pediatric patient with nosocomial pneumonia in Venezuela. Case Rep Infect Dis 2014; 2014: 434987. [ Links ]
8. Martínez D, Marcano D, Rodulfo H, Salgado N, Cuaical N, Rodriguez L, Caña L, Medina B, Guzman M, De Donato M. KPC and VIM producing Enterobacter cloacae strain from a hospital in northeastern Venezuela. Invest Clin 2015; 56(2): 182-187. [ Links ]
9. CLSI. Performance standards for antimicrobial susceptibility testing. 22nd International Supplement M100-S22, Clinical and Laboratory Standards Institute. Wayne, PA: CLSI; 2012. p. 52-61.
10. Bradford PA, Bratu S, Urban C, Visalli M, Mariano N, Landman D, Rahal JJ, Brooks S, Cebular S, Quale J. Emergence of carbapenem-resistant Klebsiella species possessing the class A carbapenem-hydrolyzing KPC-2 and inhibitor-resistant TEM-30 beta-lactamases in New York City. Clin Infect Dis 2004; 39(1): 55-60.
11. Cuzon G, Naas T, Truong H, Villegas MV, Wisell KT, Carmeli Y, Gales AC, Venezia SN, Quinn JP, Nordmann P. Worldwide diversity of Klebsiella pneumoniae that produce beta-lactamase blaKPC -2 gene. Emerg Infect Dis 2010; 16(9): 1349-1356.
12. Versalovic J, Koeuth T, Lupski JR. Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes. Nucleic Acids Res 1991; 19(24): 6823-6831.
13. Tenover fC, Arbeit RD, Goering RV, Mickelsen PA, Murray BE, Persing DH, Swaminathan B. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing. J Clin Microbiol 1995; 33(9): 2233-2239.
14. Diancourt L, Passet V, Verhoef J, Grimont PA, Brisse S. Multilocus sequence typing of Klebsiella pneumoniae nosocomial isolates. J Clin Microbiol 2005; 43(8): 4178-4182.
15. francisco AP, Bugalho M, Ramirez M, Carrico JA. Global optimal eBURST analysis of multilocus typing data using a graphic matroid approach. BMC Bioinformatics 2009; 10: 152. [ Links ]
16. francisco AP, Vaz C, Monteiro PT, Melo-Cristino J, Ramirez M, Carrico JA. PHYLOViZ: phylogenetic inference and data visualization for sequence based typing methods. BMC Bioinformatics 2012; 13: 87.
17. Pereira CA, Marra AR, Camargo LF , Pignatari AC, Sukiennik T, Behar PR, Medeiros EA, Ribeiro J, Girão E, Correa L, Guerra C, Carneiro I, Brites C, Reis M, De Souza MA, Tranchesi R, Barata CU, Edmond MB; Brazilian SCOPE Study Group. Nosocomial bloodstream infections in Brazilian pediatric patients: microbiology, epidemiology, and clinical features. PLoS One 2013; 8(7): e68144. [ Links ]
18. Guzman-Blanco M, Labarca JA, Villegas MV, Gotuzzo E, Latin America Working Group on Bacterial Resistance. Extended spectrum beta-lactamase producers among nosocomial Enterobacteriaceae in Latin America. Braz J Infect Dis 2014; 18(4): 421-433. [ Links ]
19. Munoz-Price LS, Poirel L, Bonomo RA, Schwaber MJ, Daikos GL, Cormican M, Cornaglia G, Garau J, Gniadkowski M, Hayden MK, Kumarasamy K, Livermore DM, Maya JJ, Nordmann P, Patel JB, Paterson DL, Pitout J, Villegas MV, Wang H, Woodford N, Quinn JP. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases. Lancet Infect Dis 2013; 13(9): 785-796. [ Links ]
20. Kitchel B, Rasheed JK, Patel JB, Srinivasan A, Navon-Venezia S, Carmeli Y, Brolund A, Giske CG. Molecular epidemiology of KPC-producing Klebsiella pneumoniae isolates in the United States: clonal expansion of multilocus sequence type 258. Antimicrob Agents Chemother 2009; 53(8): 3365-3370. [ Links ]
21. Mojica Mf , Correa A, Vargas DA, Maya JJ, Montealegre MC, Rojas LJ, Ruiz SJ, Quinn JP, Villegas MV; Colombian Nosocomial Bacterial Resistance Study Group. Molecular correlates of the spread of KPC-producing Enterobacteriaceae in Colombia. Int J Antimicrob Agents 2012; 40(3): 277-279.
22. Villegas MV, Lolans K, Correa A, Suarez CJ, Lopez JA, Vallejo M, Quinn JP; Colombian Nosocomial Resistance Study Group. First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates of Klebsiella pneumoniae from South America. Antimicrob Agents Chemother 2006; 50(8): 2880-2882.
23. Lopez JA, Correa A, Navon-Venezia S, Correa AL, Torres JA, Briceño DF , Montealegre MC, Quinn JP, Carmeli Y, Villegas MV. Intercontinental spread from Israel to Colombia of a KPC-3-producing Klebsiella pneumoniae strain. Clin Microbiol Infect 2011; 17(1): 52-56. [ Links ]
24. Gales AC, Castanheira M, Jones RN, Sader HS. Antimicrobial resistance among Gram-negative bacilli isolated from Latin America: results from SENTRY Antimicrobial Surveillance Program (Latin America, 2008-2010). Diagn Microbiol Infect Dis 2012; 73(4): 354-360. [ Links ]
25. Monteiro J, Santos AF , Asensi MD, Peirano G, Gales AC. First report of KPC-2-producing Klebsiella pneumoniae strains in Brazil. Antimicrob Agents Chemother 2009; 53(1): 333-334. [ Links ]
26. Seki LM1, Pereira PS, De Souza Conceição M, Souza MJ, Marques EA, Carballido JM, De Carvalho ME, Assef AP, Asensi MD. Molecular epidemiology of CTX-M producing Enterobacteriaceae isolated from bloodstream infections in Rio de Janeiro, Brazil: emergence of CTX-M-15. Braz J Infect Dis 2013; 17(6): 640-646. [ Links ]
27. Chagas TP, Seki LM, da Silva DM, Asensi MD. Occurrence of KPC-2-producing Klebsiella pneumoniae strains in hospital wastewater. J Hosp Infect 2011; 77(3): 281.
28. Pasteran FG, Otaegui L, Guerriero L, Radice G, Maggiora R, Rapoport M, Faccone D, Di Martino A, Galas M. Klebsiella pneumoniae Carbapenemase-2, Buenos Aires, Argentina. Emerg Infect Dis 2008; 14(7): 1178-1180. [ Links ]
29. Gomez SA, Pasteran FG, faccone D, Tijet N, Rapoport M, Lucero C, Lastovets-ka O, Albornoz E, Galas M; KPC Group, Melano RG, Corso A, Petroni A. Clonal dissemination of Klebsiella pneumoniae ST258 harbouring KPC-2 in Argentina. Clin Microbiol Infect 2011; 17(10): 15201524. [ Links ]
30. Giakkoupi P, Papagiannitsis CC, Miriagou V, Pappa O, Polemis M, Tryfinopoulou K, Tzouvelekis LS, Vatopoulos AC. An update of the evolving epidemic of blaKPC -2-carrying Klebsiella pneumoniae in Greece (2009-10). J Antimicrob Chemother 2011; 66(7): 1510-1513. [ Links ]
31. Vilchez G, Alonso G. Alcances y limitaciones de los métodos de epidemiología molecular basados en el análisis de ácidos nucleicos. Rev Soc Venez Microbiol 2009; 29: 6-12. [ Links ]
32. Fernández F. Aplicaciones de las técnicas de PCR a la epidemiología molecular de las enfermedades infecciosas. Enferm Infecc Microbiol Clin 2004; 22(6): 355-360.
33. Coll P, Coque M, Domínguez M, Vázquez J, Vila J. Métodos moleculares de tipificación epidemiológica en Bacteriología. Enferm Infecc Microbiol Clin 2005; 18: 1-68.
34. Baraniak A, Izdebski R, Fiett J, Sadowy E, Adler A, Kazma M, Salomon J, Lawrence C, Rossini A, Salvia A, Vidal Samso J, fierro J, Paul M, Lerman Y, Malhotra-Kumar S, Lammens C, Goossens H, Hryniewicz W, Brun-Buisson C, Carmeli Y, Gniadkowski M; MOSAR WP2 and WP5 Study Groups. Comparative population analysis of Klebsiella pneumoniae strains with extended-spectrum beta-lactamases colonizing patients in rehabilitation centers in four countries. Antimicrob Agents Chemother 2013; 57(4): 1992-1997. [ Links ]
35. Qi Y, Wei Z, Ji S, Du X, Shen P, Yu Y. ST11, the dominant clone of KPC-producing Klebsiella pneumoniae in China. J Antimicrob Chemother 2011; 66(2): 307-312. [ Links ]
36. Ko KS, Lee JY, Baek JY, Suh JY, Lee MY, Choi JY, Yeom JS, Kim YS, Jung SI, Shin SY, Heo ST, Kwon KT, Son JS, Kim SW, Chang HH, Ki HK, Chung DR, Peck KR, Song JH. Predominance of an ST11 extended-spectrum beta-lactamase-producing Klebsiella pneumoniae clone causing bacteraemia and urinary tract infections in Korea. J Med Microbiol 2010; 59(Pt 7): 822-828.
37. Rhee JY, Park YK, Shin JY, Choi JY, Lee MY, Peck KR, Song JH, Ko KS. KPC-producing extreme drug-resistant Klebsiella pneumoniae isolate from a patient with diabetes mellitus and chronic renal failure on hemodialysis in South Korea. Antimicrob Agents Chemother 2010; 54(5): 2278-2279.
38. Tóth A, Damjanova I, Puskás E, Jánvári L, Farkas M, Dobák A, Böröcz K, Pászti J. Emergence of a colistin-resistant KPC-2-producing Klebsiella pneumoniae ST258 clone in Hungary. Eur J Clin Microbiol Infect Dis 2010; 29(7): 765-769.
39. Baraniak A, Izdebski R, Herda M, fiett J, Hryniewicz W, Gniadkowski M, Kern-Zdanowicz I, Filczak K, Łopaciuk U. Emergence of Klebsiella pneumoniae ST258 with KPC-2 in Poland. Antimicrob Agents Chemother 2009; 53(10): 45654567. [ Links ]
40. Seki LM, Pereira PS, de Souza Mda P, Conceição Mde S, Marques EA, Porto CO, Colnago EM, Alves Cde F , Gomes D, Assef AP, Samuelsen Ø, Asensi MD. Molecular epidemiology of KPC-2- producing Klebsiella pneumoniae isolates in Brazil: the predominance of sequence type 437. Diagn Microbiol Infect Dis 2011; 70(2): 274-277. [ Links ]
41. Andrade LN, Curiao T, ferreira JC, Longo JM, Clímaco EC, Martinez R, Bellissimo-Rodrigues F, Basile-Filho A, Evaristo MA, Del Peloso Pf , Ribeiro VB, Barth AL, Paula MC, Baquero F , Cantón R, Darini AL, Coque TM. Dissemination of blaKPC -2 by the spread of Klebsiella pneumoniae clonal complex 258 clones (ST258, ST11, ST437) and plasmids (IncFII, IncN, IncL/M) among Enterobacteriaceae species in Brazil. Antimicrob Agents Chemother 2011; 55(7): 3579-3583. [ Links ]
42. Pena I, Picazo JJ, Rodriguez-Avial C, Rodriguez-Avial I. Carbapenemase-producing Enterobacteriaceae in a tertiary hospital in Madrid, Spain: high percentage of colistin resistance among VIM-1-producing Klebsiella pneumoniae ST11 isolates. Int J Antimicrob Agents 2014; 43(5): 460464. [ Links ]
43. Virgincar N, Iyer S, Stacey A, Maharjan S, Pike R, Perry C, Wyeth J, Woodford N. Klebsiella pneumoniae producing KPC carbapenemase in a district general hospital in the UK. J Hosp Infect 2011; 78(4): 293-296. [ Links ]
44. Castanheira M, Costello AJ, Deshpande LM, Jones RN. Expansion of clonal complex 258 KPC-2-producing Klebsiella pneumoniae in Latin American hospitals: report of the SENTRY Antimicrobial Surveillance Program. Antimicrob Agents Chemother 2012; 56(3): 1668-1669; author reply 1670-1671.
45. fehlberg LC, Carvalho AM, Campana EH, Gontijo-filho PP, Gales AC. Emergence of Klebsiella pneumoniae -producing KPC-2 carbapenemase in Paraiba, Northeastern Brazil. Braz J Infect Dis 2012; 16(6): 577-580.
46. Nicoletti AG, fehlberg LC, Picao RC, Machado Ade O, Gales AC. Clonal complex 258, the most frequently found multilocus sequence type complex in KPC-2-producing Klebsiella pneumoniae isolated in Brazilian hospitals. Antimicrob Agents Chemother 2012; 56(8): 45634564; author reply 4565.
47. Oliveira S, Moura RA, Silva KC, Pavez M, McCulloch JA, Dropa M, Matté MH, Mamizuka EM, Sato MI, Pestana de Castro Af , Lincopan N. Isolation of KPC-2-producing Klebsiella pneumoniae strains belonging to the high-risk multiresistant clonal complex 11 (ST437 and ST340) in urban rivers. J Antimicrob Chemother 2014; 69(3): 849-852. [ Links ]
48. Garbari L, Busetti M, Dolzani L, Petix V, Knezevich A, Bressan R, Gionechetti f , Tonin EA, Lagatolla C. pKBuS13, a KPC-2 encoding plasmid from Klebsiella pneumoniae Sequence Type 833, carrying Tn4401 b inserted into a Xer site-specific recombination locus. Antimicrob Agents Chemother 2015; 59(9): 5226-5231. [ Links ]
49. falco A, Ramos Y, franco E, Guzman A, Takiff H. A cluster of KPC-2 and VIM-2-producing Klebsiella pneumoniae ST833 isolates from the pediatric service of a Venezuelan Hospital. BMC Infect Dis 2016; 16(1): 595.
50. Samuelsen Ø, Toleman MA, Hasseltvedt V, fuursted K, Leegaard TM, Walsh TR, Sundsfjord A, Giske CG. Molecular characterization of VIM-producing Klebsiella pneumoniae from Scandinavia reveals genetic relatedness with international clonal complexes encoding transferable multidrug resistance. Clin Microbiol Infect 2011; 17(12): 1811-1816. [ Links ]
51. Papagiannitsis CC, Kotsakis SD, Petinaki E, Vatopoulos AC, Tzelepi E, Miriagou V, Tzouvelekis LS. Characterization of metallo-beta-lactamase VIM-27, an A57S mutant of VIM-1 associated with Klebsiella pneumoniae ST147. Antimicrob Agents Chemother 2011; 55(7): 3570-3572. [ Links ]
52. Hasan CM, Turlej-Rogacka A, Vatopoulos AC, Giakkoupi P, Maatallah M, Giske CG. Dissemination of blaVIM in Greece at the peak of the epidemic of 2005-2006: clonal expansion of Klebsiella pneumoniae clonal complex 147. Clin Microbiol Infect 2014; 20(1): 34-37. [ Links ]
53. Giske CG, Fröding I, Hasan CM, Turlej-Rogacka A, Toleman M, Livermore D, Woodford N, Walsh TR. Diverse sequence types of Klebsiella pneumoniae contribute to the dissemination of blaNDM-1 in India, Sweden, and the United Kingdom. Antimicrob Agents Chemother 2012; 56(5): 2735-2738.
54. Peirano G, Pillai DR, Pitondo-Silva A, Richardson D, Pitout JD. The characteristics of NDM-producing Klebsiella pneumoniae from Canada. Diagn Microbiol Infect Dis 2011; 71(2): 106-109. [ Links ]
55. Richter SN, Frasson I, Franchin E, Bergo C, Lavezzo E, Barzon L, Cavallaro A, Palù G. KPC-mediated resistance in Klebsiella pneumoniae in two hospitals in Padua, Italy, June 2009-December 2011: massive spreading of a KPC-3-encoding plasmid and involvement of non-intensive care units. Gut Pathog 2012; 4(1): 7. [ Links ]
56. Damjanova I, Tóth A, Pászti J, Hajbel-Vékony G, Jakab M, Berta J, Milch H, füzi M. Expansion and countrywide dissemination of ST11, ST15 and ST147 ciprofloxacin-resistant CTX-M-15-type beta-lactamase-producing Klebsiella pneumoniae epidemic clones in Hungary in 2005--the new MRSAs? J Antimicrob Chemother 2008; 62(5): 978-985. [ Links ]
57. Mammina C, Aleo A, Bonura C, Calà C, DeglInnocenti R, Conti A, Pecile P, Pesavento G, Nastasi A. Multiclonal emergence of carbapenem-resistant Klebsiella pneumoniae in Tuscany, Italy. Int J Antimicrob Agents 2010; 36(6): 576-578.
58. Coelho A, Mirelis B, Alonso-Tarrés C, Nieves Larrosa M, Miró E, Clivillé Abad R, Bartolomé RM, Castañer M, Prats G, Johnson JR, Navarro F , González-López JJ. Detection of three stable genetic clones of CTX-M-15-producing Klebsiella pneumoniae in the Barcelona metropolitan area, Spain. J Antimicrob Chemother 2009; 64(4): 862-864. [ Links ]
59. Elhani D, Bakir L, Aouni M, Passet V, Arlet G, Brisse S, Weill fX. Molecular epidemiology of extended-spectrum beta-lactamase-producing Klebsiella pneumoniae strains in a university hospital in Tunis, Tunisia, 1999-2005. Clin Microbiol Infect 2010; 16(2): 157-164.
60. Mammina C, Bonura C, Di Bernardo F , Aleo A, fasciana T, Sodano C, Saporito MA, Verde MS, Tetamo R, Palma DM. Ongoing spread of colistin-resistant Klebsiella pneumoniae in different wards of an acute general hospital, Italy, June to December 2011. Euro Surveill 2012; 17(33). pii: 20248.
61. Ageevets VA, Partina IV, Lisitsyna ES, Ilina EN, Lobzin YV, Shlyapnikov SA, Sidorenko SV. Emergence of carbapenemase-producing Gram-negative bacteria in Saint Petersburg, Russia. Int J Antimicrob Agents 2014; 44(2): 152-155. [ Links ]
62. Bonura C, Giuffrè M1, Aleo A, fasciana T, Di Bernardo f , Stampone T, Giammanco A; MDR-GN Working Group, Palma DM, Mammina C. An update of the evolving epidemic of blaKPC carrying Klebsiella pneumoniae in Sicily, Italy, 2014: Emergence of multiple non-ST258 clones. PLoS One 2015; 10(7): e0132936. [ Links ]
63. Lee MY, Ko KS, Kang CI, Chung DR, Peck KR, Song JH. High prevalence of CTX-M-15-producing Klebsiella pneumoniae isolates in Asian countries: diverse clones and clonal dissemination. Int J Anti20 Investigación Clínica 58(1): 2017 Falco y col. microb Agents 2011; 38(2): 160-163. [ Links ]
64. Breurec S, Guessennd N, Timinouni M, Le TA, Cao V, Ngandjio A, Randrianirina f , Thiberge JM, Kinana A, Dufougeray A, Perrier-Gros-Claude JD, Boisier P, Garin B, Brisse S. Klebsiella pneumoniae resistant to third-generation cephalosporins in five African and two Vietnamese major towns: multiclonal population structure with two major international clonal groups, CG15 and CG258. Clin Microbiol Infect 2013; 19(4): 349-355. [ Links ]
65. Nielsen JB, Skov MN, Jorgensen RL, Heltberg O, Hansen DS, Schonning K. Identification of CTX-M15-, SHV-28-producing Klebsiella pneumoniae ST15 as an epidemic clone in the Copenhagen area using a semi-automated Rep-PCR typing assay. Eur J Clin Microbiol Infect Dis 2011; 30(6): 773-778. [ Links ]
66. Hrabák J, Empel J, Bergerová T, fajfrlík K, Urbásková P, Kern-Zdanowicz I, Hryniewicz W, Gniadkowski M. International clones of Klebsiella pneumoniae and Escherichia coli with extended-spectrum beta-lactamases in a Czech hospital. J Clin Microbiol 2009; 47(10): 3353-3357. [ Links ]
67. Osterblad M, Kirveskari J, Hakanen AJ, Tissari P, Vaara M, Jalava J. Carbapenemase-producing Enterobacteriaceae in Finland: the first years (2008-11). J Antimicrob Chemother 2012; 67(12): 2860-2864.
68. Jayol A, Poirel L, Brink A, Villegas MV, Yilmaz M, Nordmann P. Resistance to colistin associated with a single amino acid change in protein PmrB among Klebsiella pneumoniae isolates of worldwide origin. Antimicrob Agents Chemother 2014; 58(8): 4762-4766. [ Links ]
69. Sonnevend Á, Ghazawi AA, Hashmey R, Jamal W, Rotimi VO, Shibl AM, Al-Jardani A, Al-Abri SS, Tariq WU, Weber S, Pál T. Characterization of carbapenem-resistant Enterobacteriaceae with high rate of autochthonous transmission in the Arabian Peninsula. PLoS One 2015; 10(6): e0131372. [ Links ]
70. Morris D, OConnor M, Izdebski R, Corcoran M, Ludden CE, McGrath E, Buckley V, Cryan B, Gniadkowski M, Cormican M. Dissemination of clonally related multidrug-resistant Klebsiella pneumoniae in Ireland. Epidemiol Infect 2015; 144(2): 443-448. [ Links ]
71. Novais A, Rodrigues C, Branquinho R, Antunes P, Grosso F, Boaventura L, Ribeiro G, Peixe L. Spread of an OmpK36-modified ST15 Klebsiella pneumoniae variant during an outbreak involving multiple carbapenem-resistant Enterobacteriaceae species and clones. Eur J Clin Microbiol Infect Dis 2012; 31(11): 30573063.
72. Matsumura Y, Tanaka M, Yamamoto M, Nagao M, Machida K, Ito Y, Takakura S, Ogawa K, Yoshizawa A, fujimoto Y, Okamoto S, Uemoto S, Ichiyama S. High prevalence of carbapenem resistance among plasmid-mediated AmpC beta-lactamase-producing Klebsiella pneumoniae during outbreaks in liver transplantation units. Int J Antimicrob Agents 2015; 45(1): 33-40. [ Links ]












 uBio
uBio 
