Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.58 no.2 Maracaibo jun. 2017
Estudio metabolómico de la enfermedad renal crónica: del modelo experimental al humano.
Marlene Marisol Perales-Quintana1, Paula Cordero-Pérez2, Noemí H. Waksman-Minsky3, Edelmiro Pérez-Rodríguez1, Juan Ricardo Lucio-Gutiérrez3 y Alma Leticia Saucedo-Yáñez3.
1 Servicio de Trasplantes, Hospital Universitario Dr. José Eleuterio González Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México.
2 Unidad de Hígado, Hospital Universitario Dr. José Eleuterio González Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México.
3 Departamento de Química Analítica, Facultad de Medicina, Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México
Autor de Correspondencia: Alma Leticia Saucedo-Yáñez. Departamento de Química Analítica, Facultad de Medicina, Universidad Autónoma de Nuevo León, Monterrey, Nuevo León, México. Tel: +52 81 83 29 40 50 Ext. 2744. Correo electronico: allesaya@gmail.com
Resumen. Con una prevalencia global reportada de entre 11-13%, la enfermedad renal crónica (ERC) ha sido reconocida como un gran desafío para los sistemas de salud por sus implicaciones económicas y sociales. Al tratarse de una enfermedad crónica e irreversible, el tratamiento está dirigido a disminuir su progresión. La cuantificación de creatinina sérica es el método de elección para su diagnóstico y clasificación; sin embargo, es conocido que esta prueba tiene una sensibilidad clínica limitada, lo que ha conducido a la búsqueda de nuevos marcadores que permitan un diagnóstico y monitoreo oportuno. Desde esta perspectiva, el empleo de la metabolómica y de modelos animales ha permitido la identificación y estudio de nuevos metabolitos, candidatos a ser utilizados como futuros biomarcadores en la práctica clínica. La presente revisión tuvo como objetivo hacer una análisis de los perfiles metabolómicos reportados para la ERC, tanto en modelos experimentales como en estudios realizados en seres humanos. De acuerdo a los datos obtenidos, los metabolitos implicados en las rutas metabólicas de aminas cuaternarias y aminoácidos como el TMNO, el indoxilsulfato y derivados de la dimetilarginina representan una alternativa prometedora para la identificación, clasificación y pronóstico de la ERC.
Palabras clave: enfermedad renal crónica; metabolómica; resonancia magnética nuclear y espectroscopia de masas; metabolitos; modelo experimental.
Metabolomics in chronic kidney disease: from experimental model to human disease.
Abstract. Chronic kidney disease (CKD) high global prevalence, estimated between 11 to 13%, has been recognized as a mayor health challenge for healthcare systems due to its relevant economic and social implications. Main medical intervention strategies are directed to delay the progression of CKD and prevent outcomes. Serum creatinine concentration has been used to classify CKD and define its progression stage; however, it is well known the low sensitivity shown by this test. This fact has conducted to the search for new markers in order to improve the disease diagnosis, monitoring and treatment. In this context, metabolomics science and animal models have allowed identification of new metabolites that can be used as future biomarkers into clinical practice. This review aims to summarize the metabolomics profiles reported in different experimental models and clinical research on CKD. According with the data obtained, metabolites related with quaternary amines and aminoacid metabolic pathways like TMNO, indoxyl sulfate and dimethylarginine, suggest a promising alternative for identification, classification and prognosis of CKD.
Keywords: chronic kidney disease; metabolomics; nuclear magnetic resonance; mass spectroscopy; metabolites; experimental model.
Recibido: 02-11-2016 Aceptado: 23-03-2017
INTRODUCCIÓN
La enfermedad renal crónica (ERC) es causada por una gran diversidad de etiologías, cuya vía en común es un daño gradual y permanente de la función renal, lo cual conducirá a una variedad de complicaciones por desequilibrio homeostático, que van desde la acumulación de sustancias de desecho (1), desbalance de líquidos y electrolitos (2), hasta deficiencias cardiovasculares(3, 4) y endocrinas (5-7).
Actualmente, la ERC es considerada por la Organización Mundial de la Salud (OMS) y la Organización Panamericana de la Salud (OPS) como un problema de salud pública a nivel global (8), relacionado de manera directa con la diabetes, hipertensión y edad avanzada (9); su distribución resulta heterogénea entre las diversas regiones geográficas, aunque de manera reciente un meta-análisis indicó una prevalencia global estimada entre un 11-13% (10), observándose una mayor incidencia en los países en desarrollo (11). De acuerdo a estadísticas de la Sociedad Latinoamericana de Nefrología e Hipertensión (SLANH), México ocupa el tercer lugar con la mayor incidencia anual de enfermedad renal crónica terminal (ERC-T) con un número estimado en más de 350 casos por millón de habitantes, mientras que el Instituto Nacional de Estadística y Geografía (INEGI), ubica a la insuficiencia renal como la 11ª causa de muerte (12).
La ERC es clasificada en 5 estadios de acuerdo a las nuevas guías internacionales del consorcio Kidney Disease: Improving Global Outcomes (KDIGO)(13); su principal tratamiento consiste en enlentecer la progresión para reducir las posibles complicaciones y comorbilidades que pudieran existir y, al mismo tiempo, evitar un estado de insuficiencia renal terminal en el cual la única solución sea la terapia renal de reemplazo (diálisis o trasplante) (14). En el 2010 cerca de 4,9 millones de personas en el mundo requerían una terapia renal de reemplazo y solamente 2,3 millones tuvieron acceso a ésta. Se proyecta que para el 2030, el número de personas aumentará hasta 5,4 millones (11).
La creatinina, urea, proteinuria y el cálculo de la tasa de filtración glomerular (TFG) son frecuentemente empleadas en el laboratorio clínico de rutina para evaluar la función renal (15); sin embargo, es conocido que estas pruebas tienen desventajas que limitan su sensibilidad clínica, lo que ha conducido a los grupos de investigación a identificar nuevos biomarcadores que permitan un diagnóstico en etapas tempranas y/o un pronóstico acertado para un mejor tratamiento (16).
Desde esta perspectiva, han surgido nuevas estrategias analíticas basadas en las ciencias ómicas (genómica, proteómica, transcriptómica y metabolómica) como herramientas potenciales, que permiten una compresión integral de los procesos biológicos (17). Los marcadores ómicos pueden mejorar la predicción de la aparición de la ERC más allá de los marcadores tradicionales, e inclusive permitir el desarrollo de una terapia personalizada (18).
En la ERC, la genómica ha permitido conocer una gran cantidad de locus y de polimorfismos de un solo nucleótido (SNP) que están fuertemente asociados al desarrollo de la nefropatía (19-23) o a la aparición de comorbilidades (24, 25). Mediante el empleo de microarreglos en la transcriptómica se ha podido vincular la desregulación mitocondrial y el estrés oxidativo con patrones asociados al desarrollo de la enfermedad (26, 27). Mientras que los hallazgos en la proteómica han sugerido distintos marcadores tales como la molécula-1 de lesión renal (kidneyinjury molecule-1: KIM-1)(28-30), lipocalina asociada con la gelatinasa de neutrófilos (neutrophil gelatinase associated lipocalin: NGAL)(31-33) y la cistatina C (34-36), que reportan altas asociaciones para el diagnóstico de daño renal, aunque no de manera exclusiva para la ERC, por lo cual hasta el momento aún existen dificultades para su aplicación en la clínica de rutina (37). Por otra parte, la metabolómica ha mostrado distintas vías metabólicas que se expresan en la ERC, y es que mediante el estudio en distintas matrices biológicas (38) y el empleo de plataformas analíticas como espectroscopia de masas (MS) y resonancia magnética nuclear protónica (1H-RMN) se ha observado que las variaciones en las concentraciones de metabolitos como el N-óxido de trimetilamina (TMNO) (39), el indoxilsulfato (40) y derivados de la dimetilarginina (41), entre muchos otros, pueden ayudar a diagnosticar o predecir el desarrollo de la ERC.
En esta revisión, de manera breve se describen los distintos modelos experimentales en rata empleados para el estudio de la metabolómica de la ERC, así como la comparación de algunos metabolitos reportados tanto en la investigación clínica como experimental, que intentan ofrecer biomarcardores de utilidad clínica.
Modelos experimentales empleados en la metabolómica de la ERC
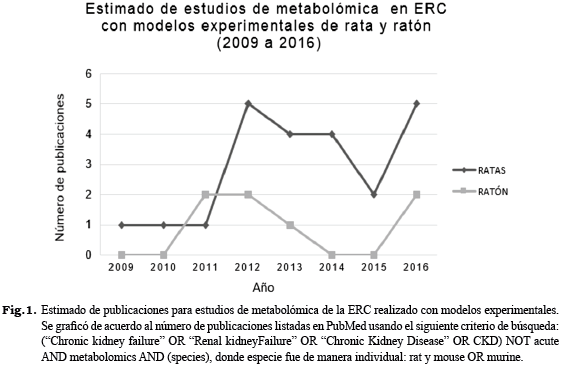
Históricamente, el empleo de animales de experimentación para emular la ERC ha permitido examinar, en un marco de tiempo acelerado, las condiciones patofisiológicas de la enfermedad humana, cuando normalmente debe transcurrir un tiempo considerable entre el daño al órgano y las manifestaciones clínicas (42). Tradicionalmente, los modelos más empleados en el estudio de la ERC han sido la rata y el ratón (Fig. 1), debido a su tamaño pequeño y a los costos relativamente bajos para su mantenimiento (43). Sin embargo, en muchos estudios el mayor tamaño de las ratas ha hecho que sea el modelo de elección, ya que facilita su manipulación en caso de procedimientos quirúrgicos y la obtención de una mayor cantidad de tejido, sangre y orina en comparación con el ratón, lo que permite realizar un mayor número de pruebas (42, 44).
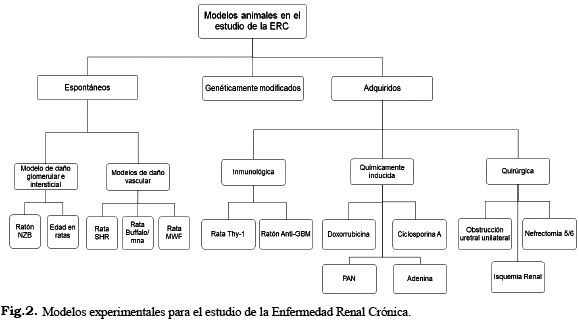
Se han desarrollado diversos modelos animales con ciertas características homólogas a la condición humana de la ERC. Los procedimientos de inducción de la ERC en el modelo de rata pueden clasificarse en aquellos en los que la patología se produce de forma espontánea debido al envejecimiento (45) y la hipertensión (46), a las características genéticas (48) como en el caso de la cepa Buffalo/Mna (47), a intervención quirúrgica (nefrectomía 5/6 (49), obstrucción uretral unilateral (50), isquemia renal (51) y los que se apoyan en la administración de alguna sustancia con capacidad nefrotóxica (doxorrubicina, aminonucleósidos de puromicina, adenina, ciclosporina y antibióticos aminoglucósidos) (52), (Fig. 2).
En lo que respecta a los estudios metabolómicos de la ERC, los modelos más empleados en las especies Sprague-Dawley y Wistar de ratas han sido el desarrollo de la enfermedad mediante adenina, obstrucción uretral unilateral (OUU) o nefrectomía 5/6 (Tabla I).
La OUU es una técnica quirúrgica en la cual se ocluye o bloquea uno de los uréteres mediante el empleo de dos suturas, una cerca del riñón y otra más distal (50). De esta manera, se genera una obstrucción urinaria, que conduce al aumento de la presión hidrostática del riñón afectado iniciando así la destrucción de las nefronas, que terminará produciendo un daño renal irreversible (53). Aunque este modelo es empleado para el estudio de la enfermedad túbulointersticial, es importante mencionar que la obstrucción uretral no es una causa común que desencadene la ERC en el hombre. Las principales ventajas de este modelo son su reproducibilidad y sencillez, así como el corto lapso de tiempo en el que se empieza a observar el fenómeno patológico. Sin embargo, se ha descrito que los cambios en los parámetros de laboratorio son muy sutiles (42).
La nefrectomía 5/6 ha representado un modelo excelente para reproducir la glomeruloesclerosis focal segmental del humano; se trata de una técnica quirúrgica en la que se extirpa un riñón en su totalidad y una semana después al riñón remanente se le impide la función de dos terceras partes, bien mediante la ligadura de ramas arteriales o por la resección de los polos, de tal manera que solo se permite la función del tercio central del riñón, lo que desencadenará de manera inmediata una glomeruloesclerosis y daño túbulointersticial progresivo hasta llegar a la uremia (54). A pesar de que este método suena sencillo, la reproducibilidad ha sido complicada, ya que es necesario asegurarse que los dos tercios eliminados tengan una proporción parecida en todos los animales de experimentación (43, 55).
El modelo más frecuentemente empleado en los estudios de metabolómica de la ERC es el daño con adenina. Se trata de un método sencillo, en el cual por lo menos durante cuatro semanas la rata es alimentada con adenina (56).
Se ha descrito que la adenina dentro del organismo precipita en forma de cristales de 2,8-dihidroxiadenina en el túbulo proximal, causando su degeneración, infiltrado inflamatorio y fibrosis. Los valores de laboratorio tienden a ser característicamente elevados, y resulta muy útil para el estudio de la falla renal a largo plazo (57, 58).
Independiente a la técnica de inducción de la ERC, la mayor parte de los estudios se llevan a cabo en ratas macho (43). Diversos estudios sugieren que los estrógenos tienen un efecto protector contra el daño oxidativo generado en modelos de OUU, nefrectomía 5/6 y adenina (44, 59-61).
Metabolómica aplicada en modelos experimentales
Matriz biológica suero/plasma
Mediante el empleo de la nefrectomía 5/6 y 1H-RMN, se analizaron muestras de plasma de ratas con 4 y 8 semanas posteriores a la intervención quirúrgica.
A las 4 semanas se elevaron significativamente los niveles de citrato, lactato, formato, alanina, glutamina y glutamato, mientras que a las 8 semanas los niveles elevados de acetoacetato, citrato, acetato, β-hidroxibutirato y alanina, contribuyeron de manera significativa para la clasificación de ERC y grupo sham (62). En otro estudio con el mismo modelo experimental, pero con un análisis mediante MS se reportó que las ratas con daño renal mostraban valores alterados de 4-oxopentanoato, hipurato, alantoína y citosina, mismos que ya han sido identificados previamente en pacientes con ERC (63).
Se ha reportado el modelo de OUU con análisis mediante 1H-RMN, en el que los cambios metabolómicos son evaluados a los 3, 7 y 28 días posteriores a la intervención quirúrgica, destacando la elevación de las N-acetil glicoproteínas y glicerol a partir del tercer día; sin embargo, este último metabolito disminuye conforme progresa la enfermedad; por otra parte, la concentración de aminoácidos no se ve afectada hasta la primera semana, cuando los niveles de isoleucina, leucina, valina, alanina y acetato aumentan, con disminución de glicina (64). Este mismo modelo ha sido empleado en otros estudios, pero utilizando MS, en los cuales se han reportado modificaciones en el metabolismo de los glicerofosfolípidos, biosíntesis de ácidos grasos y ácidos araquidónicos, además de niveles aumentados de ornitina, ácido cítrico y colesterol, ácido taurocólico, ácido eicosapentaenoico, ácido docosapentanoico y AMPc, con disminución de galactosa, ADP-manosa, ácido docosahexanoico y ácido araquidónico en las ratas con ERC (65, 66).
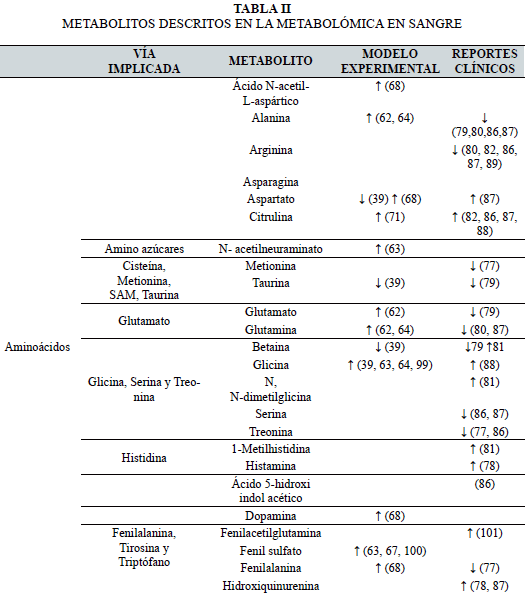
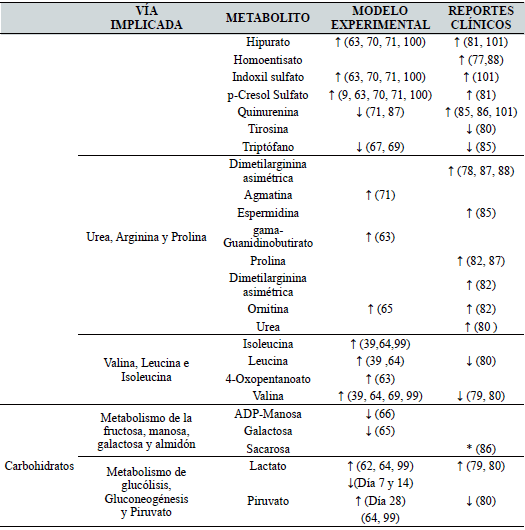
De igual manera, se han llevado acabo perfiles metabolómicos en modelos con adenina en la plataforma de MS. En un estudio se analizó el plasma de manera semanal hasta los 28 días; se encontró que los niveles de la N6-succinil- adenosina y la quinurenina se elevaron de manera considerable al inicio del daño (día 7), mientras que otros metabolitos como indoxil sulfato, p-cresol sulfato y fenilacetil glicina se fueron elevando de manera paulatina, conforme la hipofunción renal iba aumentando (67). En otros estudios, en los que se buscaba probar la actividad de productos naturales reportaron que la elevación de metabolitos como citrato, β-hidroxibutarato, lactato, acetato, acetoacetato, formato, alanina y glutamina, así como la disminución del triptófano y ácido glicólico son característicos en ratas con ERC previa administración del producto natural (68-71). El análisis de los principales metabolitos reportados en estudios de aproximación metabolómica en suero/plasma de rata como modelo experimental se muestran en la Tabla II.

Matriz biológica orina
El análisis por MS, fue empleado para investigar alteraciones metabolómicas en ratas con daño renal inducido por adenina. Se identificaron 12 metabolitos relacionados con el metabolismo de aminoácidos, fosfolípidos y creatinina como biomarcadores potenciales. De manera específica las ratas inducidas por adenina mostraron niveles elevados de fitoesfingosina, adrenosterona, triptófano, 2,8-dihidroxiadenina, creatinina y dihidroesfingosina, mientras que los valores de N-acetil-leucina, 3-O-metil-DOPA, etil-N2-acetil-L-argininato, dopamina, fenilalanina y ácido quinurénico se observaron disminuidos (72).
Diversos estudios han empleado la metabolómica por MS para dilucidar perfiles metabolómicos nefroprotectores de la medicina tradicional china (MTC) en la ERC utilizando modelos de daño con adenina; en los que se ha reportado en las ratas con el daño renal, previo a la administración de la MTC, niveles elevados de adenina, 2,8-dihidroxiadenina, L-acetil carnitina, 8-hidroxiadenina, hipoxantina, creatinina, metionina, fitoesfingosina, indoxil sulfato, indol-3-acetamida, 2-cetoglutarato, ácido cítrico, acetato, deoxiadenosina, etil-N2-acetil-L-arginato, homocisteína, indol-3-acetaminida, además de bajos niveles de ácido indol-3-carboxílico, 3-metildioxindol, etil-N2-acetil-L-argininato, 3-O-metil-DOPA, ácido xanurénico, ácido úrico y fenilalanina, agmatina, metilxantina, ácido hipúrico, S-adenosil-L-homocisteína, N-2-acetilguanina, ácido N-acetil-L-glutámico, citidina, AMPc, 7-metilguanina, 2-deoxiribosa-5-fosfato, ácido glicérico, ácido glioxílico, ácido hidroxipirúvico, ácido homovanílico sulfatado, antipirina N-desmetilada, fenilacetilglicina, hipotaurina, homocisteína, isoxanopterina (71, 73, 74).
En otro estudio, usando el modelo de OUU con 1H-RMN, se generaron perfiles metabólicos de muestras de orina 7, 14, 21 y 28 días después de la intervención quirúrgica. Al analizar los resultados entre grupos se observó que fueron constantes los valores disminuidos de N-acetil glicina, taurina, relación creatinina/creatina y el aumento en la concentración de indoxil sulfato. De manera específica a los 7 y 14 días se observó la disminución de la relación isoleucina/leucina; al día 21 fue característico el aumento en el lactato y acetato junto con una disminución del hipurato y la niacinamida y fue hasta el día 28 cuando los valores del 2-cetoglutarato, citrato y succinato aumentaron, mientras que la 1-metilnicotinamida y la alantoina disminuyeron. De esta manera, los autores concluyeron que los metabolitos del ciclo del ácido tricarboxílico (ATC), glucólisis anaerobia y aminoácidos tienen una relación directa en el inicio y desarrollo de la fibrosis renal (75). Sin embargo, otro estudio que utilizó el mismo modelo, pero realizando la detección de metabolitos con MS relacionó el desarrollo de la fibrosis renal con vías metabólicas de los glicerofosfolípidos, ácidos grasos, riboflavina y tirosina (66).
Por otra parte, se ha reproducido un modelo de nefropatía diabética en ratas con estreptozotocina, en el cual -mediante el empleo de 1H-RMN- se reportaron metabolitos de distintas vías metabólicas energéticas que podrían potencialmente ser útiles como biomarcadores para predecir la enfermedad renal en pacientes con diabetes, entre estos se encontraron lactato, alantoína, succinato, citrato, dimetilarginina, creatinina, alantoina e hipurato (76).
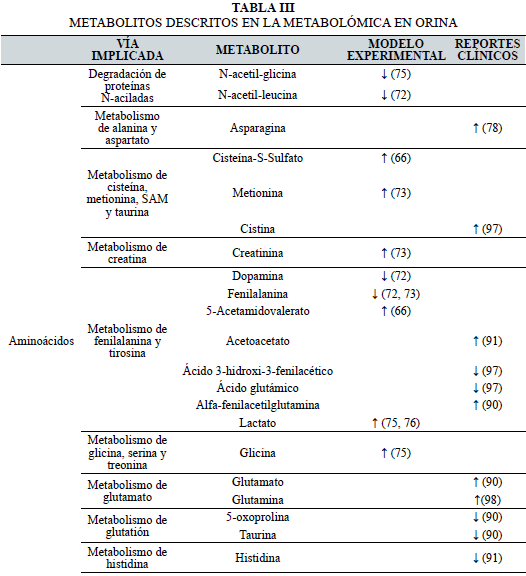
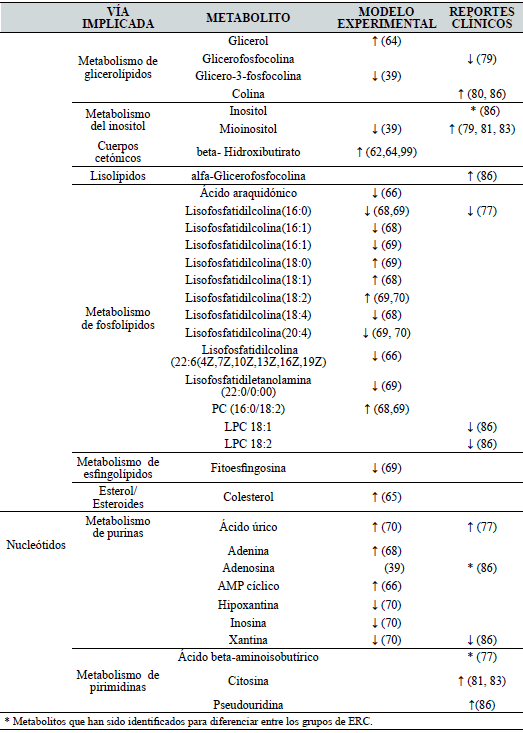
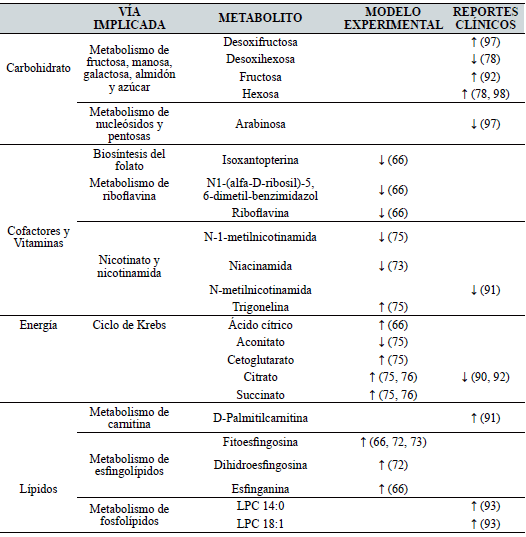
El análisis de los principales metabolitos reportados en estudios de aproximación metabolómica en orina de rata como modelo experimental, se muestran en la Tabla III.


Metabolómica en reportes clínicos
Matriz biológica suero/plasma
Se han reportado diversos análisis metabolómicos en pacientes con distintas etapas de la ERC, en los cuales metabolitos como el ácido úrico, glucuronato, 4-hidroximandelato, 3-metiladipato/pimerato, citosina, homogentisato, treonina, metionina, fenilalanina, arginina (77), sulfóxido de metionina, dimetilarginina asimétrica (ADMA), histamina, hidoxiquinurenina (78), glucosa, lactato, valina, alanina, glutamato, glicina, betaina, mioinositol, taurina, glicerilfosforilcolina (79) y N-óxido de trimetilamina (80) mostraron diferencias significativas cuando se compararon con sus respectivos controles sanos. El citrato fue sugestivo de mal pronóstico en la progresión de la ERC (80). Por otra parte, los pacientes en etapas avanzadas mostraron una acumulación significativa de 3-metilhistidina, mioinositol, p-cresol sulfato, ácido hipúrico (81), y metabolitos derivados de la arginina (82).
En la búsqueda de biomarcadores predictivos para el diagnóstico temprano de la ERC, diversos estudios prospectivos han evaluado los metabolitos que aparecen en muestras de sangre basales. En un estudio realizado con individuos de una cohorte del estudio KORA F4 y de la base de datos Twins UK que tuvo un seguimiento de 7,1 años, observaron que metabolitos como pseudouridina y el C-manosil-triptófano tienen una asociación positiva con la TFG, teniendo además la ventaja de ser independientes al género del paciente y sugirieron otros marcadores como N-acetilalanina, eritronato, mioinositol, N-acetilcarnosina y o-sulfo-L-tirosina (83). En una cohorte de población afroamericana, con un intervalo de estudio de 19 años, se reportaron de manera específica valores aumentados de 5-oxoprolina y 1,5-anhidroglucitol con una mayor probabilidad de desarrollar la ERC (84). En otro estudio en Alemania se reportó una asociación significativa de la TFG con metabolitos como la espermidina, la relación quinurenina/triptófano y la relación de diacilfosfatidilcolina C42:5/acilalquilfosfatidilcolina C36:0 (85).
Mientras que un estudio en EUA sugirió metabolitos independientes a la función de filtración renal, como ácido quinurénino, quinurenina, citrulina, colina, xantosina, ácido β-amino isobutírico, aconitato, isocitrato y ácido 5-hidroxi indolacético que correlacionan en mayor grado con la secreción renal en los pacientes que desarrollaron la ERC (86).
Entre las múltiples actividades homeostáticas del riñón, se ha observado el impacto en la regulación de los aminoácidos (84). Algunos estudios han reportado valores disminuidos de alanina, arginina, glutamina, leucina, metionina, serina, valina, tirosina y treonina (80, 87), con incremento de aspartato, citrulina y prolina, y ADMA e hidroquinurenina, ambos productos del metabolismo proteínico (87). Además se ha sugerido que concentraciones disminuidas de treonina, metionina y arginina correlacionan con un rápido avance hacia la falla renal en los pacientes con enfermedad renal. Por otra parte, un estudio metabolómico dirigido en pacientes pediátricos con ERC propuso como posibles marcadores glicina, citrulina, ADMA y dimetilarginina simétrica, las cuales se elevaron de manera significativa (88). Recientemente se ha reportado un estudio metabolómico dirigido a los D-aminoácidos, los cuales han sido asociados a la disfunción renal (D-serina, D-alanina, D-prolina y D-asparagina), ERC con edad avanzada (D-alanina, D-prolina) y ERC y diabetes (D-ácido aspártico y D-prolina) (89).
Bajo el principio que las vías metabólicas pueden modificarse en base a la enfermedad subyacente que genera el daño inicial en el riñón, se ha evaluado la diferencia de la expresión metabólica entre pacientes con ERC con y sin diabetes mellitus. Se ha observado que metabolitos como arginina, N-acetil-glicoproteína y la relación de lipoproteínas de muy baja densidad / lipoproteínas de baja densidad están presentes en pacientes con ambas enfermedades (80).
El análisis de los principales metabolitos reportados en estudios de aproximación metabolómico en sangre se muestran en la Tabla II.
Matriz biológica orina
En un estudio clínico mediante 1H-RMN de muestras de orina de pacientes con ERC, se identificó un panel de 29 metabolitos, de los cuales la 5-oxoprolina, glutamato, guanidoacetato, α-fenil-acetil-glutamina, taurina, citrato y el óxido de trimetilamina, parecen contribuir de manera significativa en la etiología de la ERC (90). En estudios por 1H-RMN y MS, se han empleado muestras de orina para establecer el diagnóstico de distintas nefropatías de origen primario, tales como la glomeruloesclerosis focal y segmentaria, la glomerulonefritis membranosa y la enfermedad de cambios mínimos; entre los distintos metabolitos reportados, coinciden como marcadores de diagnóstico: citrato, hipurato, piruvato, taurina, valina, dimetilarginina, mononucleótido de nicotinamida y óxido de trimetilamina (TMO) (91-95).
En otro estudio se evaluó el perfil metabolómico mediante MS en muestras de orina de pacientes con distintas fases de ERC a quienes se les dió seguimiento durante 2,8±0,8 años; se encontró una huella del perfil metabólico conformado por 23 metabolitos de distintas vías, de los cuales únicamente la ADMA correlacionó, de manera significativa, con la pérdida de la función renal, por lo que se propuso como un posible biomarcador pronóstico de la ERC (78). En la búsqueda de marcadores pronósticos de la nefropatía diabética, una de las primeras causas de reemplazo renal (96), se han realizado estudios prospectivos que reportan concentraciones alteradas de ácido hipúrico, S-3-oxododecanoilcisteinamina y carnitina (97), así como la disminución en las concentraciones de hexosa, glutamina y tirosina (98) en orina, que son predictores de desarrollo de la enfermedad renal en pacientes diabéticos tipo I y tipo II, respectivamente.
El análisis de los principales metabolitos reportados en estudios de aproximación metabolómica en orina se muestran en la Tabla III.
CONCLUSIÓN
Los modelos animales han sido clave en la comprensión de diversas condiciones patofisiológicas, así como para el desarrollo de terapias farmacológicas. Y aunque resulte controvertida la extrapolación de los resultados en los modelos animales, gracias a éstos se tiene la oportunidad de obtener una primera aproximación de la ERC en un marco de tiempo acelerado.
La ERC es una enfermedad compleja, con una gran diversidad de etiologías, por lo que encontrar un marcador que ayude a predecir el desarrollo y progresión de la enfermedad sin importar el daño inicial que desencadena la misma, sería de gran utilidad para su diagnóstico, pronóstico y tratamiento. De acuerdo con los datos obtenidos de la presente revisión, los metabolitos implicados en las rutas metabólicas de aminas cuaternarias y aminoácidos como el TMNO, el indoxilsulfato y derivados de la dimetilarginina han sido ampliamente estudiados por su relación con la progresión de la ERC por lo que representan una aplicación potencial en la práctica clínica.
Por otra parte, existen variables que afectan la expresión de los metabolitos reportadas en los diversos estudios. Dentro de estas variables, la fase pre-analítica se ve impactada por la recolección, preparación y almacenamiento de la muestra, por lo que es de vital importancia estandarizar los procedimientos operativos, de tal manera que los resultados sean reproducibles tanto intra como inter laboratorio. Además, dentro de la fase analítica es de considerar la sensibilidad de la plataforma analítica (RMN y MS) para conducir a la adecuada identificación de diversos metabolitos.
Adicionalmente, es importante mencionar que los diversos biomarcadores propuestos recientemente por su asociación con el daño renal, tales como cistatina C, KIM-1 y NGAL, no han demostrado ser exclusivos a la ERC. De allí que los estudios de aproximación metabolómica, aplicados a modelos experimentales, constituyen una herramienta potencial para la correlación de metabolitos útiles en la detección y el pronóstico de la ERC, representando parte de una estrategia integral para ofrecer una acción terapéutica oportuna.
Referencias
1. Toyohara T, Akiyama Y, Suzuki T, Takeuchi Y, Mishima E, Tanemoto M, Momose A, Toki N, Sato H, Nakayama M, Hozawa A, Tsuji I, Ito S, Soga T, Abe T. Metabolomic profiling of uremic solutes in CKD patients. Hypertens Res 2010; 33:944-952. [ Links ]
2. Mitch WE, Wilcox CS. Disorders of body fluids, sodium and potassium in chronic renal failure. Am J Med 1982; 72:536-550. [ Links ]
3. Mallat SG, Al Kattar S, Tanios BY, Jurjus A. Hyperuricemia, hypertension, and chronic kidney disease: an emerging association. Curr Hyperten Rep 2016; 18: 74. [ Links ]
4. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu C-Y. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004; 351:1296-1305. [ Links ]
5. Rhee CM, Kalantar-Zadeh K, Streja E, Carrero JJ, Ma JZ, Lu JL, Kovesdy CP. The relationship between thyroid function and estimated glomerular filtration rate in patients with chronic kidney disease. Nephrol Dial Transplant 2015; 30:282-287. [ Links ]
6. Marchelek-Mysliwiec M, Cichocka E, Dziedziejko V, Dutkiewicz GZ, Stepniewska J, Safranow K, Budkowska M, Salata D, Syrenicz A, Machalinski B, Ciechanowski K. Insulin resistance and brain-derived neurotrophic factor levels in chronic kidney disease. Ann Clin Biochem 2015; 52:213-219. [ Links ]
7. Bahlmann F, Kielstein J, Haller H, Fliser D. Erythropoietin and progression of CKD. Kidney Int (Suppl) 2007;72:S21-S25. [ Links ]
8. Organización Panamerica de la Salud, Organización Mundial de la Salud.Oficina Regional para las Américas, 2014.Renal Failure and Chronic Kidney Disease (CKD) mortality visualization. URL:http://www.paho.org/hq/index.php?option=com_content & view=article & id=9402%3A2014-renal-failure-chronic-kidney-disease-ckd-mortality-visualization & catid=2390%3Aregional-health-observatory-themes & Itemid=2391 & lang=es. [ Links ]
9. Levey AS, Inker LA, Coresh J. Chronic kidney disease in older people. JAMA 2015;314:557-558. [ Links ]
10. Hill NR, Fatoba ST, Oke JL, Hirst JA, OCallaghan CA, Lasserson DS, Hobbs FD. Global Prevalence of Chronic Kidney Disease - A Systematic review and meta-analysis. PloS One 2016;11:e0158765. [ Links ]
11. Garcia-Garcia G, Jha V. Nephrology in the developing world. Chronic kidney disease in disadvantaged populations. Nat Rev Nephrol 2015; 11:128-129. [ Links ]
12. Institute for Health Metrics and Evaluation. IHME, 2015. URL: http://vizhub.healthdata.org/le/. [ Links ]
13. Kidney Disease | Improving Global Outcomes. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int (Suppl) 2013;3: 1-150. [ Links ]
14. Kidney Disease | Improving Global Outcomes. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Summary of Recommendation Statements. Kidney Inter (Suppl) 2013; 3: 5-14. [ Links ]
15. Henry JB. Laboratorio en el diagnóstico clínico.Edición homenaje a Todd-Sanford & Davidsohn. Marbán (España); 2007, p 165-166. [ Links ]
16. Breit M, Weinberger KM. Metabolic biomarkers for chronic kidney disease. Arch Biochem Biophys 2016;589:62-80. [ Links ]
17. Guillemin N, Horvatic A, Kules J, Galan A, Mrljak V, Bhide M. Omics approaches to probe markers of disease resistance in animal sciences. Mol Biosyst 2016; 12:2036-2046. [ Links ]
18. Cisek K, Krochmal M, Klein J, Mischak H. The application of multi-omics and systems biology to identify therapeutic targets in chronic kidney disease. Nephrol Dial Transplant 2016;31:2003-2011. [ Links ]
19. OSeaghdha CM, Parekh RS, Hwang SJ, Li M, Kottgen A, Coresh J, Yang Q, Fox CS, Kao WH. The MYH9/APOL1 region and chronic kidney disease in European-Americans. Hum Mol Genet 2011;20:2450-2456. [ Links ]
20. Robertson CC, Gillies CE, Putler RK, Ng D, Reidy KJ, Crawford B, Sampson MG. An investigation of APOL1 risk genotypes and preterm birth in African American population cohorts. Nephrol Dial Transplant 2016;gfw317 (doi: 10.1093/ndt/gfw317). [ Links ]
21. Gorski M, Tin A, Garnaas M, McMahon GM, Chu AY, Tayo BO, Pattaro C, Teumer A, Chasman DI, Chalmers J, Hamet P, Tremblay J, Woodward M, Aspelund T, Eiriksdottir G, Gudnason V, Harris TB, Launer LJ, Smith AV, Mitchell BD, OConnell JR, Shuldiner AR, Coresh J, Li M, Freudenberger P, Hofer E, Schmidt H, Schmidt R, Holliday EG, Mitchell P, Wang JJ, de Boer IH, Li G, Siscovick DS, Kutalik Z, Corre T, Vollenweider P, Waeber G, Gupta J, Kanetsky PA, Hwang SJ, Olden M, Yang Q, de Andrade M, Atkinson EJ, Kardia SL, Turner ST, Stafford JM, Ding J, Liu Y, Barlassina C, Cusi D, Salvi E, Staessen JA, Ridker PM, Grallert H, Meisinger C, Müller-Nurasyid M, Krämer BK, Kramer H, Rosas SE, Nolte IM, Penninx BW, Snieder H, Fabiola Del Greco M, Franke A, Nöthlings U, Lieb W, Bakker SJ, Gansevoort RT, van der Harst P, Dehghan A, Franco OH, Hofman A, Rivadeneira F, Sedaghat S, Uitterlinden AG, Coassin S, Haun M, Kollerits B, Kronenberg F, Paulweber B, Aumann N, Endlich K, Pietzner M, Völker U, Rettig R, Chouraki V, Helmer C, Lambert JC, Metzger M, Stengel B, Lehtimäki T, Lyytikäinen LP, Raitakari O, Johnson A, Parsa A, Bochud M, Heid IM, Goessling W, Köttgen A, Kao WH, Fox CS, Böger CA. Genome-wide association study of kidney function decline in individuals of European descent. Kidney Int 2015; 87: 1017-1029. [ Links ]
22. Sekula P, Li Y, Stanescu HC, Wuttke M, Ekici AB, Bockenhauer D, Walz G, Powis SH, Kielstein JT, Brenchley P, GCKD Investigators, Eckardt KU, Kronenberg F, Kleta R, Köttgen A. Genetic risk variants for membranous nephropathy: extension of and association with other chronic kidney disease aetiologies. Nephrol Dial Transplant 2017; 32: 325-332. [ Links ]
23. Bullich G, Ballarin J, Oliver A, Ayasreh N, Silva I, Santin S, Díaz-Encarnación MM, Torra R, Ars E. HLA-DQA1 and PLA2R1 polymorphisms and risk of idiopathic membranous nephropathy. Clin J Am Soc Nephrol 2014;9: 335-343. [ Links ]
24. Olden M, Teumer A, Bochud M, Pattaro C, Köttgen A, Turner ST, Rettig R, Chen MH, Dehghan A, Bastardot F, Schmidt R, Vollenweider P, Schunkert H, Reilly MP, Fornage M, Launer LJ, Verwoert GC, Mitchell GF, Bis JC, ODonnell CJ, Cheng CY, Sim X, Siscovick DS, Coresh J, Kao WH, Fox CS, OSeaghdha CM; AortaGen, CARDIoGRAM, CHARGE Eye, CHARGE IMT, ICBP, NeuroCHARGE, and CKDGen Consortia. Overlap between common genetic polymorphisms underpinning kidney traits and cardiovascular disease phenotypes: the CKDGen consortium. Am J Kidney Dis 2013; 61:889-898. [ Links ]
25. McMahon GM, OSeaghdha CM, Hwang SJ, Meigs JB, Fox CS. The association of a single-nucleotide polymorphism in CUBN and the risk of albuminuria and cardiovascular disease. Nephrol Dial Transplant 2014; 29:342-347. [ Links ]
26. Granata S, Dalla Gassa A, Bellin G, Lupo A, Zaza G. Transcriptomics: A step behind the comprehension of the polygenic influence on oxidative stress, immune deregulation, and mitochondrial dysfunction in chronic. Biomed Res Int 2016; 9290857 (doi: 10.1155/2016/9290857). [ Links ]
27. Gugliucci A, Menini T. The axis AGE-RAGE-soluble RAGE and oxidative stress in chronic kidney disease. Adv Exp Med Biol 2014; 824: 191-208. [ Links ]
28. Han WK, Bailly V, Abichandani R, Thadhani R, Bonventre JV. Kidney Injury Molecule-1 (KIM-1): a novel biomarker for human renal proximal tubule injury. Kidney Int 2002; 62:237-244. [ Links ]
29. Sabbisetti VS, Waikar SS, Antoine DJ, Smiles A, Wang C, Ravisankar A, Ito K, Sharma S, Ramadesikan S, Lee M, Briskin R, De Jager PL, Ngo TT, Radinski M, Dear JW, Park KB, Betensky R, Krolewski AS, Bonventre JV. Blood kidney injury molecule-1 is a biomarker of acute and chronic kidney injury and predicts progression to ESRD in type I diabetes. J Am Soc Nephrol 2014; 25:2177-2186. [ Links ]
30. van Timmeren MM, van den Heuvel MC, Bailly V, Bakker SJ, van Goor H, Stegeman CA. Tubular kidney injury molecule-1 (KIM-1) in human renal disease. J Pathol 2007; 212:209-217. [ Links ]
31. Bolignano D, Donato V, Coppolino G, Campo S, Buemi A, Lacquaniti A, Buemi M. Neutrophil gelatinase–associated lipocalin (NGAL) as a marker of kidney damage. Am J Kidney Dis 2008;52:595-605. [ Links ]
32. Devarajan P. Neutrophil gelatinase-associated lipocalin (NGAL): A new marker of kidney disease. Scand J Clin Lab Invest 2008;68:89-94. [ Links ]
33. Bolignano D, Lacquaniti A, Coppolino G, Donato V, Campo S, Fazio MR, Nicocia G, Buemi M. Neutrophil gelatinase-associated lipocalin (NGAL) and progression of chronic kidney disease. Clin J Am Soc Nephrol 2009;4:337-344. [ Links ]
34. Stevens LA, Coresh J, Schmid CH, Feldman HI, Froissart M, Kusek J, Rossert J, Van Lente F, Bruce RD, Zhang YL, Greene T, Levey AS. Estimating GFR using serum cystatin C alone and in combination with serum creatinine: a pooled analysis of 3,418 individuals with CKD. Am J Kidney Dis 2008;51:395-406. [ Links ]
35. Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis. Am J Kidney Dis 2002;40:221-226. [ Links ]
36. Peralta CA, Shlipak MG, Judd S, Cushman M, McClellan W, Zakai NA, Safford MM, Zhang X, Muntner P, Warnock D. Detection of chronic kidney disease with creatinine, cystatin C, and urine albumin-to-creatinine ratio and association with progression to end-stage renal disease and mortality. JAMA 2011;305:1545-1552. [ Links ]
37. Devarajan P. The use of targeted biomarkers for chronic kidney disease. Adv Chronic Kidney Dis 2010; 17:469-479. [ Links ]
38. Barrios C, Spector TD, Menni C. Blood, urine and faecal metabolite profiles in the study of adult renal disease. Arch Biochem Biophys 2016;589:81-92. [ Links ]
39. Missailidis C, Hallqvist J, Qureshi AR, Barany P, Heimburger O, Lindholm B, Stenvinkel P, Bergman P. Serum trimethylamine-N-oxide Is strongly related to renal function and predicts outcome in chronic kidney disease. PloS One 2016; 11: e0141738. [ Links ]
40. Tan X, Cao X, Zou J, Shen B, Zhang X, Liu Z, Lv W, Teng J, Ding X. Indoxyl sulfate, a valuable biomaker in chronic kidney disease and dialysis. Hemodial Int 2016; DOI: 10.1111/hdi.12483. [ Links ]
41. Asmarawati TP, Widodo Thaha M, Aditiawardana Mardiana N, Ardhany AR, Tjempakasari A, Santoso D, Pranawa Irwanadi C. Comparison of asymmetric dimethylarginine levels between stages three, four, and five non-dialysis of chronic kidney disease. Acta Med Indones 2016;48:28-34. [ Links ]
42. Becker GJ, Hewitson TD. Animal models of chronic kidney disease: useful but not perfect. Nephrol Dial Transplant 2013;28:2432-2438. [ Links ]
43. Hewitson TD, Ono T, Becker GJ. Small animal models of kidney disease: a review. Methods Mol Biol 2009;466:41-57. [ Links ]
44. Pereira Wde F, Brito-Melo GE, de Almeida CA, Moreira LL, Cordeiro CW, Carvalho TG, Matea Ec, Simões E, Silva AC. The experimental model of nephrotic syndrome induced by doxorubicin in rodents: an update. Inflamm Res 2015;64:287-301. [ Links ]
45. Reckelhoff JF, Zhang H, Granger JP. Decline in renal hemodynamic function in aging SHR: role of androgens. Hypertension 1997; 30:677-681. [ Links ]
46. Ofstad J, Iversen BM. Glomerular and tubular damage in normotensive and hypertensive rats. Am J Physiol Renal Physiol 2005;288:F665-F672. [ Links ]
47. Nakamura T, Oite T, Shimizu F, Matsuyama M, Kazama T, Koda Y, Arakawa M. Sclerotic lesions in the glomeruli of Buffalo/Mna rats. Nephron 1986; 43:50-55. [ Links ]
48. Fassi A, Sangalli F, Maffi R, Colombi F, Mohamed EI, Brenner BM, Remuzzi G, Remuzzi A. Progressive glomerular injury in the MWF rat is predicted by inborn nephron deficit. Clin J Am Soc Nephrol 1998;9:1399-1406. [ Links ]
49. Fleck C, Appenroth D, Jonas P, Koch M, Kundt G, Nizze H, Stein G. Suitability of 5/6 nephrectomy (5/6NX) for the induction of interstitial renal fibrosis in rats – Influence of sex, strain, and surgical procedure. Exp Toxicol Pathol 2006;57:195-205. [ Links ]
50. Chevalier RL, Forbes MS, Thornhill BA. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney Int 2009;75:1145-1152. [ Links ]
51. Le Clef N, Verhulst A, DHaese PC, Vervaet BA. Unilateral renal ischemia-reperfusion as a robust model for acute to chronic kidney injury in mice. PloS One 2016; 11: e0152153. [ Links ]
52. Yang HC, Zuo Y, Fogo AB. Models of chronic kidney disease. Drug Discov Today Dis Models 2010; 7: 13-19. [ Links ]
53. Ucero AC, Benito-Martin A, Izquierdo MC, Sanchez-Nino MD, Sanz AB, Ramos AM, Berzal S, Ruiz-Ortega M, Egidio J, Ortiz A. Unilateral ureteral obstruction: beyond obstruction. Int Urol Nephrol 2014;46:765-776. [ Links ]
54. Shimamura T, Morrison AB. A progressive glomerulosclerosis occurring in partial five-sixths nephrectomized rats. Am J Pathol 1975;79:95-106. [ Links ]
55. Kliem V, Johnson RJ, Alpers CE, Yoshimura A, Couser WG, Koch KM, Floege J. Mechanisms involved in the pathogenesis of tubulointerstitial fibrosis in 5/6-nephrectomized rats. Kidney Int 1996;49:666-678. [ Links ]
56. Tamura M, Aizawa R, Hori M, Ozaki H. Progressive renal dysfunction and macrophage infiltration in interstitial fibrosis in an adenine-induced tubulointerstitial nephritis mouse model. Histochem Cell Biol 2009; 131:483-490. [ Links ]
57. Okada H, Kaneko Y, Yawata T, Uyama H, Ozono S, Motomiya Y, Hirao Y. Reversibility of adenine-induced renal failure in rats. Exp Nephrol 1999;3:82-88. [ Links ]
58. Jia T, Olauson H, Lindberg K, Amin R, Edvardsson K, Lindholm B, Andersson G, Wernerson A, Sabbagh Y, Schiavi S, Larsson TE. A novel model of adenine-induced tubulointerstitial nephropathy in mice. BMC Nephrol 2013;14:1-8. [ Links ]
59. Mao S, Xu H, Zou L, Xu G, Wu Z, Ding Q, Jiang H. Estrogen preserves split renal function in a chronic complete unilateral ureteral obstruction animal model. Exp Ther Med 2014;7:1555-1562. [ Links ]
60. Kasimay O, Sener G, Cakir B, Yuksel M, Cetinel S, Contuk G, Yeğen BC. Estrogen protects against oxidative multiorgan damage in rats with chronic renal failure. Ren Fail 2009;31:711-725. [ Links ]
61. Diwan V, Small D, Kauter K, Gobe GC, Brown L. Gender differences in adenine-induced chronic kidney disease and cardiovascular complications in rats. Am J Physiol Renal Physiol 2014;307:F1169-F1178. [ Links ]
62. Kim JA, Choi HJ, Kwon YK, Ryu DH, Kwon TH, Hwang GS. 1H NMR-based metabolite profiling of plasma in a rat model of chronic kidney disease. PloS One 2016; 9: e85445. [ Links ]
63. Akiyama Y, Takeuchi Y, Kikuchi K, Mishima E, Yamamoto Y, Suzuki C, Hozawa A, Ito S, Soga T, Abe T. A metabolomic approach to clarifying the effect of AST-120 on 5/6 nephrectomized rats by capillary electrophoresis with mass spectrometry (CE-MS). Toxins 2012; 4:1309-1322. [ Links ]
64. Zhang H, Jia J, Cheng J, Ye F, Li X, Gao H. 1H NMR-based metabonomics study on serum of renal interstitial fibrosis rats induced by unilateral ureteral obstruction. Mol biosyst 2012;8:595-601. [ Links ]
65. Liu S, Liu JS, Luo RN, Xu H, Zhang WR, Meng J, Liang YZ, Tao LJ. Application of GC-MS coupled with chemometrics for scanning serum metabolic biomarkers from renal fibrosis rat. Biochem Biophys Res Commun 2015;461:186-192. [ Links ]
66. Xiang Z, Sun H, Cai X, Chen D. The study on serum and urine of renal interstitial fibrosis rats induced by unilateral ureteral obstruction based on metabonomics and network analysis methods. Anal Bioanal Chem 2016;408:2607-2619. [ Links ]
67. Kobayashi T, Matsumura Y, Ozawa T, Yanai H, Iwasawa A, Kamachi T, Fujiwara K, Tanaka N, Kohno M. Exploration of novel predictive markers in rat plasma of the early stages of chronic renal failure. Anal Bioanal Chem 2014;406:1365-1376. [ Links ]
68. Zhao YY, Cheng XL, Cui JH, Yan XR, Wei F, Bai X, Lin RC. Effect of ergosta-4,6,8(14),22-tetraen-3-one (ergone) on adenine-induced chronic renal failure rat: a serum metabonomic study based on ultra performance liquid chromatography/high-sensitivity mass spectrometry coupled with MassLynx i-FIT algorithm. Clin Chim Acta 2012;413:1438-1445. [ Links ]
69. Zhao YY, Feng YL, Bai X, Tan XJ, Lin RC, Mei Q. Ultra performance liquid chromatography-based metabonomic study of therapeutic effect of the surface layer of Poria cocos on adenine-induced chronic kidney disease provides new insight into anti-fibrosis mechanism. PloS One 2013; 8: e59617. [ Links ]
70. Zhao YY, Lei P, Chen DQ, Feng YL, Bai X. Renal metabolic profiling of early renal injury and renoprotective effects of Poria cocos epidermis using UPLC Q-TOF/HSMS/MSE. J Pharm Biomed Anal 2013; 81-82: 202-209. [ Links ]
71. Li YH, Tan YF, Cai HD, Zhang JQ. Metabonomic study of the fruits of Alpinia oxyphylla as an effective treatment for chronic renal injury in rats. J Pharm Biomed Anal 2016;124:236-245. [ Links ]
72. Zhao YY, Liu J, Cheng XL, Bai X, Lin RC. Urinary metabonomics study on biochemical changes in an experimental model of chronic renal failure by adenine based on UPLC Q-TOF/MS. Clin Chim Acta 2012;413:642-649. [ Links ]
73. Zhao YY, Li HT, Feng YL, Bai X, Lin RC. Urinary metabolomic study of the surface layer of Poria cocos as an effective treatment for chronic renal injury in rats. J Ethnopharmacol 2013;148:403-410. [ Links ]
74. Zhang ZH, Wei F, Vaziri ND, Cheng XL, Bai X, Lin RC, Zhao YYl. Metabolomics insights into chronic kidney disease and modulatory effect of rhubarb against tubulointerstitial fibrosis. Sci Rep 2015; 5: 14472. [ Links ]
75. Zhao L, Dong M, Liao S, Du Y, Zhou Q, Zheng H, Chen M, Ji J, Gao H. Identification of key metabolic changes in renal. Sci Rep 2016; 6: 27194. [ Links ]
76. Zhao L, Gao H, Lian F, Liu X, Zhao Y, Lin D. (1)H-NMR-based metabonomic analysis of metabolic profiling in diabetic nephropathy rats induced by streptozotocin. Am J Physiol Renal Physiol 2011;300:F947-F956. [ Links ]
77. Rhee EP, Clish CB, Wenger J, Roy J, Elmariah S, Pierce KA, Bullock K, Anderson AH, Gerszten RE, Feldman HI. Metabolomics of chronic kidney disease pogression: a case-control analysis in the Chronic Renal Insufficiency Cohort Study. Am J Nephrol 2016;43:366-374. [ Links ]
78. Nkuipou-Kenfack E, Duranton F, Gayrard N, Argiles A, Lundin U, Weinberger KM, Dakna M, Delles C, Mullen W, Husi H, Klein J, Koeck T, Zürbig O, Mischak H. Assessment of metabolomic and proteomic biomarkers in detection and prognosis of progression of renal function in chronic kidney disease. PloS One 2014; 9: e96955. [ Links ]
79. Qi S, Ouyang X, Wang L, Peng W, Wen J, Dai Y. A pilot metabolic profiling study in serum of patients with chronic kidney disease based on (1) H-NMR-spectroscopy. Clin Transl Sci 2012;5:379-385. [ Links ]
80. Lee J, Choi JY, Kwon YK, Lee D, Jung HY, Ryu HM, Kim YL, Hwang GS. Changes in serum metabolites with the stage of chronic kidney disease: Comparison of diabetes and non-diabetes. Clin Chim Acta 2016;459:123-131. [ Links ]
81. Mutsaers HA, Engelke UF, Wilmer MJ, Wetzels JF, Wevers RA, van den Heuvel LP, Hoenderop JG, Masereeuw R. Optimized metabolomic approach to identify uremic solutes in plasma of stage 3-4 chronic kidney disease patients. PloS One 2013; 8: e71199. [ Links ]
82. Shah VO, Townsend RR, Feldman HI, Pappan KL, Kensicki E, Vander Jagt DL. Plasma metabolomic profiles in different stages of CKD. Clin J Am Soc Nephrol 2013;8:363-370. [ Links ]
83. Sekula P, Goek ON, Quaye L, Barrios C, Levey AS, Römisch-Margl W, Menni C, Yet I, Gieger C, Inker LA, Adamski J, Gronwald W, Illig T, Dettmer K, Krumsiek J, Oefner PJ, Valdes AM, Meisinger C, Coresh J, Spector TD, Mohney RP, Suhre K, Kastenmüller G, Köttgen A. A metabolome-wide association study of kidney function and disease in the general population. Clin J Am Soc Nephrol 2016;27:1175-1188. [ Links ]
84. Yu B, Zheng Y, Nettleton JA, Alexander D, Coresh J, Boerwinkle E. Serum metabolomic profiling and incident CKD among African Americans. Clin J Am Soc Nephrol 2014;9:1410-1417. [ Links ]
85. Goek ON, Prehn C, Sekula P, Romisch-Margl W, Doring A, Gieger C, Heier M, Koenig W, Wang-Sattler R, Illig T, Suhre K, Adamski J, Köttgen A, Meisinger C. Metabolites associate with kidney function decline and incident chronic kidney disease in the general population. Nephrol Dial Transplant 2013;28:2131-2138. [ Links ]
86. Rhee EP1, Clish CB, Ghorbani A, Larson MG, Elmariah S, McCabe E, Yang Q, Cheng S, Pierce K, Deik A, Souza AL, Farrell L, Domos C, Yeh RW, Palacios I, Rosenfield K, Vasan RS, Florez JC, Wang TJ, Fox CS, Gerszten RE. A combined epidemiologic and metabolomic approach improves CKD prediction. Clin J Am Soc Nephrol 2013;24:1330-1338. [ Links ]
87. Duranton F, Lundin U, Gayrard N, Mischak H, Aparicio M, Mourad G, Daurès JP, Weinberger KM, Argilés A. Plasma and urinary amino acid metabolomic profiling in patients with different levels of kidney function. Clin J Am Soc Nephrol 2014;9:37-45. [ Links ]
88. Benito S, Sanchez A, Unceta N, Andrade F, Aldamiz-Echevarria L, Goicolea MA, Barrio RJ. LC-QTOF-MS-based targeted metabolomics of arginine-creatine metabolic pathway-related compounds in plasma: application to identify potential biomarkers in pediatric chronic kidney disease. Anal Bioanal Chem 2016;408:747-760. [ Links ]
89. Kimura T, Hamase K, Miyoshi Y, Yamamoto R, Yasuda K, Mita M, Rakugi H, Hayashi T, Isaka Y. Chiral amino acid metabolomics for novel biomarker screening in the prognosis of chronic kidney disease. Sci Rep 2016; 6: 26137. [ Links ]
90. Posada-Ayala M, Zubiri I, Martin-Lorenzo M, Sanz-Maroto A, Molero D, Gonzalez-Calero L, Fernandez-Fernandez B, de la Cuesta F, Laborde CM, Barderas MG, Ortiz A, Vivanco F, Alvarez-Llamas G. Identification of a urine metabolomic signature in patients with advanced-stage chronic kidney disease. Kidney Int 2014;85:103-111. [ Links ]
91. Kalantari S, Nafar M, Samavat S, Parvin M, Nobakht M.Gh BF, Barzi F. 1H NMR-based metabolomics exploring urinary biomarkers correlated with proteinuria in focal segmental glomerulosclerosis: a pilot study. Magn Reson Chem 2016;54:821-826. [ Links ]
92. Lee JE, Lee YH, Kim SY, Kim YG, Moon JY, Jeong KH, Lee TW, Ihm CG, Kim S, Kim KH, Kim DK, Kim YS, Kim CD, Park CW, Lee do Y, Lee SH. Systematic biomarker discovery and coordinative validation for different primary nephrotic syndromes using gas chromatography-mass spectrometry. J Chromatogr A 2016;1453:105-115. [ Links ]
93. Erkan E, Zhao X, Setchell K, Devarajan P. Distinct urinary lipid profile in children with focal segmental glomerulosclerosis. Pediatr Nephrol 2016;31:581-588. [ Links ]
94. Hao X, Liu X, Wang W, Ren H, Xie J, Shen P, Lin D, Chen N. Distinct metabolic profile of primary focal segmental glomerulosclerosis revealed by NMR-based metabolomics. PloS One 2013; 8: e78531. [ Links ]
95. Romick-Rosendale LE, Brunner HI, Bennett MR, Mina R, Nelson S, Petri M, Kiani A, Devarajan P, Kennedy MA. Identification of urinary metabolites that distinguish membranous lupus nephritis from proliferative lupus nephritis and focal segmental glomerulosclerosis. Arthritis Res Ther 2011; 13: R199. [ Links ]
96. Bell S, Fletcher EH, Brady I, Looker HC, Levin D, Joss N, Traynor JP, Metcalfe W, Conway B, Livingstone S, Leese G, Philip S, Wild S, Halbesma N, Sattar N, Lindsay RS, McKnight J, Pearson D, Colhoun HM; Scottish Diabetes Research Network and Scottish Renal Registry. End-stage renal disease and survival in people with diabetes: a national database linkage study. QJM 2015;108:127-134. [ Links ]
97. van der Kloet FM, Tempels FW, Ismail N, van der Heijden R, Kasper PT, Rojas-Cherto M, van Doorn R, Spijksma G, Koek M, van der Greef J, Mäkinen VP, Forsblom C, Holthöfer H, Groop PH, Reijmers TH, Hankemeier T. Discovery of early-stage biomarkers for diabetic kidney disease using ms-based metabolomics (FinnDiane study). Metabolomics 2012;8:109-119. [ Links ]
98. Pena MJ, Lambers Heerspink HJ, Hellemons ME, Friedrich T, Dallmann G, Lajer M, Bakker SJ, Gansevoort RT, Rossing P, de Zeeuw D, Roscioni SS. Urine and plasma metabolites predict the development of diabetic nephropathy in individuals with Type 2 diabetes mellitus. Diabet Med 2014;31:1138-1147. [ Links ]
99. Zhao L, Zhang H, Yang Y, Zheng Y, Dong M, Wang Y, Bai G, Ye X, Yan Z, Gao H. Serum metabonomic analysis of protective effects of Curcuma aromatica oil on renal fibrosis rats. PloS One 2014; 9: e108678. [ Links ]
100. Velenosi TJ, Hennop A, Feere DA, Tieu A, Kucey AS, Kyriacou P, McCuaiq LE, Nevison SE, Kerr MA, Urquhart BL. Untargeted plasma and tissue metabolomics in rats with chronic kidney disease given AST-120. Sci Rep 2016;6:22526. [ Links ]
101. Kobayashi T, Yoshida T, Fujisawa T, Matsumura Y, Ozawa T, Yanai H, Iwasawa A, Kamachi T, Fujiwara K, Kohno M, Tanaka N. A metabolomics-based approach for predicting stages of chronic kidney disease. Biochem Biophys Res Commun 2014;445:412-416. [ Links ]












 uBio
uBio