Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR v.38 n.2 Caracas dic. 2007
Producción de biomasa de Saccharomyces cerevisiae y Candida utilis usando residuos de pulpa de Coffea arabica L.
María J Gualtieri A1, Carolina Villalta R1, Lorena E Díaz T1, Gerardo Medina2 Elisa Lapenna2, María E Rondón3
1Laboratorio de Investigación de Medicamentos Orgánicos.
2Sección de Biotecnología, Instituto de Investigaciones.
3Laboratorio de Productos Naturales, Instituto de Investigaciones. Facultad de Farmacia y Bioanálisis. Universidad de Los Andes. Mérida 5101-A. Venezuela. gualtier@ula.ve.
RESUMEN
Los avances en biotecnología industrial ofrecen oportunidades potenciales para la utilización económica de residuos agro-industriales tales como la pulpa de café, material mucilaginoso, fibroso (producto secundario) obtenido durante el proceso húmedo o seco del beneficio de las cerezas de café. El propósito de este trabajo fue utilizar los residuos de la pulpa de café, rico en materia orgánica, como sustrato para la producción de biomasa de levaduras por procesos de fermentación aeróbica. Los residuos de café se sometieron a hidrólisis con una solución de ácido sulfúrico al 2%, en una relación 10:1 (líquido:sólido), con un tamaño de partícula ≤ 2 mm., operando a presión atmosférica, ebullición a reflujo, durante 4 horas. El extracto ácido se filtró y se ajustó a pH 4,5 y luego se esterilizó a 120 ºC por 15 minutos. La fermentación se realizó con Saccharomyces cerevisiae y Candida utilis, medio de producción extracto de café enriquecido con sales nutritivas. Se formularon diferentes medios de producción (1,2,3 y 4), siendo el N°3, enriquecido con extracto de café hidrolizado, 1L; urea, 3g/L; fosfato ácido de potasio, 2g/L; extracto de malta, 1,3g/L y melaza, 30g/L, el cual aportó los mejores resultados. El tiempo total de fermentación fue de 8 horas. Se obtuvo 10g/L de biomasa con un incremento proteico de 7,39 a 42,5%. Se puede concluir que la pulpa de café constituye un sustrato adecuado para obtener biomasa o proteína unicelular, que podría ser destinada como suplemento en formulaciones para alimentación animal.
Palabras clave: Biomasa, proteína unicelular, pulpa de café, Saccharomyces cerevisiae, Candida utilis. fermentación aeróbica.
ABSTRACT
The advances in industrial biotechnology offer potential opportunities for the economic use of agro-industrial remainders such as the coffee pulp, mucilagenous, fibrous material (secondary product) obtained during the humid or dry process of the benefit of the coffee cherries. The intention of this work was to use the remainders of the pulp of coffee, rich in organic matter, like substrate for the production of biomass of leavenings by processes of aerobic fermentation. The coffee remainders were put under hydrolysis with a sulfuric acid solution to 2%, in a 10:1 relation (liquid: solid), with a size of particle ≤ 2 mm, operating to atmospheric pressure, boiling to ebb tide, during 4 hours. The acid extract filtered and it adjusted to pH 4,5 and then it sterilize to 120 ºC by 15 minutes. The fermentation was made with Saccharomyces cerevisiae and Candida utilis, the production means: extract of coffee enriched with nutritious salts. Different means from production were formulated (1,2,3 and 4), being the N°3, enriched with extract of hydrolyzed coffee, 1L; urea, 3g/L; acid potassium phosphate, 2g/L; extract of Malta, 1,3g/L and molasses, 30g/L, which contributed the best results. The total time of fermentation was of 8 hours. 10g/L of biomass with a protein increase from 7.39 to 42.5% was obtained. It is possible to be concluded that the coffee pulp constitutes an suitable substrate to obtain biomass or unicellular protein, that could be destined like supplement in formulations for feeding animal.
Keywords: Biomass, single cell protein, coffee pulp, Saccharomyces cerevisiae, Candida utilis, aerobic fermentation.
INTRODUCCIÓN
La pulpa de café es el principal residuo sólido del beneficio húmedo del grano de café y constituye aproximadamente el 41% del peso húmedo del grano de café (1). Para 1996, la producción mundial de residuos de café se estimó cerca de 22 millones de toneladas métricas (TM) de pulpa de café, 2,4 millones TM de mucílago y 8,6 de pergamino (2). Estas cantidades fluctúan cada año de acuerdo a las variaciones en las técnicas usadas en el procesamiento y producción del café. El problema de disposición de los residuos del café, sin embargo, es enorme y representa una contaminación potencial en los países productores.
Los esfuerzos para reciclar los residuos de café envuelve actividades tales como: compostaje, alimentos para animales, producción de fertilizantes orgánicos, proteína unicelular y biogas (3,4,5). El mejoramiento de los valores nutricionales de la pulpa de café por tratamientos biológicos incluye procesos aeróbicos y anaeróbicos empleando microorganismos tales como levaduras, bacterias y mohos, (ensilado, descomposición aeróbica, fermentación natural, fermentación sólido-estática, proteína unicelular (6,7,8,9). Se conocen alternativas bien estudiadas en el tratamiento combinado con hongos filamentosos y levaduras. El proceso involucra un consorcio de microorganismos que son típicamente usados para la bioconversión de residuos lignocelulósicos; Thrichoderma viride y Aspergillus niger y levaduras como; Saccharomyces cereviseae, Candida. utilis y Candida. tropicales, en diferentes combinaciones. Los hongos filamentosos inicialmente degradan la celulosa y hemicelulosa presente en la fibra y, subsecuentemente las levaduras fermentan los azúcares libres producidos (10). Estos pueden también mejorar los valores alimentarios de otros residuos agroindustriales (11). Dentro de los cultivos no convencionales, el café es uno de los más prometedores para la obtención de proteína unicelular o biomasa en nuestro país, debido a su alto contenido de hidratos de carbono fácilmente hidrolizables. Dentro de éste contexto se sitúa la presente investigación que se inclina al aprovechamiento del recurso agrícola, pulpa del café, como fuente energética en el aprovechamiento de los productos intermedios del bioproceso como son la proteína unicelular o biomasa.
Café, es el nombre común de un género de plantas de la familia de las Rubiáceas y también de sus semillas y de la bebida que con ellas se prepara. De la treintena de especies que comprende el género Coffea sólo son importantes tres: arabica, canephora y liberica. El arbusto, de 4,6 a 6 m de altura en la madurez, tiene hojas aovadas, lustrosas, verdes, que se mantienen durante tres a cinco años y flores blancas, fragantes, que sólo permanecen abiertas durante unos pocos días (12).
En general, de acuerdo a la composición del residuo de la pulpa de café: materia seca, 90,64%; proteína cruda, 7,39%; grasa, 1,06%; fibra cruda, 10,63%; cenizas, 6,20% y carbohidratos 74,42% (13), éste debería ser usado principalmente como una fuente de energía para alimentación animal. Sin embargo, el uso de residuos de café está restringido por el alto contenido de fibra y por la presencia de sustancias antinutricionales, tales como polifenoles, taninos y cafeína. Ellos pueden interferir con los productos de su alimentación y con la absorción de nutrientes (14,15). Los niveles recomendados máximos de residuos de café en las dietas y la cantidad correspondiente de cafeína, taninos y fibra varían dependiendo de la especie animal a ser alimentada. Para animales monogástricos, estos niveles de inclusión de residuos de café varían desde 16% en ración para cerdos (16), 10% en dietas para pollos y 8% para dietas de crecimiento/engorde de conejos (17). Para peces, sin embargo, los niveles de inclusión máxima dependen también del sistema de cultivo usado, hasta 20% para cachamas (Colossoma sp) (18) y 6-26% para tilapia (Oreochromis aureus) en sistemas de acuarios (19).
En Venezuela los residuos del beneficio del café representan un subproducto poco aprovechado y en algunos casos problemático para su transformación, se ha estimado una disponibilidad de 1,05-1,07 x 105 toneladas de este residuo, obtenidos en centrales de beneficio húmedo, los cuales representan 77% de la producción nacional de café (20). Sin embargo, actualmente estos residuos causan serios problemas de contaminación ambiental, los cuales podrían ser utilizados como materia prima en la producción de combustibles, abono orgánico, suplementos alimenticios para animales y extractos de levaduras para la industria farmacéutica y cosmética, entre otros.
Este residuo se ha utilizado directamente aplicándolo al suelo como abono, pero parece que de esta manera disminuye la suculencia de los tejidos y disminuyen en las hojas los contenidos de fósforo, calcio y magnesio (21). La hidrólisis de la pulpa de café con ácido sulfúrico diluido fue estudiado a temperatura de ebullición con reflujo, a una relación líquido a sólido de 10:1 y a un tamaño de partícula £1.00 mm. Además, la pulpa de café fue tratada usando distintas concentraciones de ácido y tiempos de retención. La solución de H2SO4 al 2% a temperatura de ebullición, con reflujo durante 240 minutos, fue el método eficaz para solubilizar la mayor cantidad de azúcares totales presentes en este residuo lignocelulósico, siendo la glucosa el azúcar que tiene el mayor rendimiento, con 5,65g/L (20).
Este estudio persigue el aprovechamiento biotecnológico de los residuos de la pulpa de café, previo tratamiento químico mediante hidrólisis con ácido, para la producción de biomasa proveniente del cultivo aeróbico de levaduras del tipo S. cerevisiae y C. utilis, utilizando como sustrato o fuente de carbono el extracto ácido del exocarpio, endocarpio y mesocarpio (pulpa) del café.
MATERIALES Y METODOS
Material Vegetal: Se recolectaron 4 Kg. de café variedad caturra rojo en el sector El Amparo, Vía Los Chorros de Milla, Mérida-Venezuela. Los granos de café se dejaron en maceración con agua por 18 horas a temperatura ambiente, se despulpó y este residuo se secó en estufa a 45 ºC durante 48 horas hasta peso constante de 1.500g de residuos de pulpa de café. Se molieron a ≤2mm de diámetro. Las muestras así procesadas fueron conservadas en un frasco de vidrio cerrado herméticamente a temperatura ambiente. La miel de melaza fue suministrada por el Central Azucarero El Tocuyo, Lara-Venezuela.
Microorganismos: Saccharomyces cerevisiae, var. cerevisiae, producidas por Levospark TM (22) y Candida utilis ATCC 9226.Las cepas liofilizadas de S. cerevisiae se reactivaron en una solución de sacarosa al 0,1% a 30ºC por 24 horas y mantenidas en cuñas de agar saboraud a 5 ºC. Las cepas de Candida utilis fueron mantenidas en cuñas de agar saboraud a 5 ºC. Las cepas se preadaptaron repicando durante 3 días consecutivos en cuñas de agar saboraud al cual se le adicionó 0,2% de pulpa de café seca, e incubadas a 25 ºC durante 24 horas, con el objetivo de adaptar las levaduras en el substrato y lograr el máximo crecimiento (12). La presencia de cafeína en la pulpa de café seco se determinó cualitativamente con diferentes métodos: Dragendor, Wagner y Mayer (23).
Extracto de pulpa de café sin hidrolizar: Se preparó en una relación 1/10 (peso de pulpa seca/ácido), en un equipo Sohlext a la temperatura de 96 °C durante 4 horas.
Extracto ácido de pulpa de café hidrolizado: El extracto ácido de la pulpa de café se realizó con soluciones diluidas de ácido sulfúrico al 1, 2 y 3% en una relación 1/10 (peso de pulpa seca/volumen de ácido diluido); operando a presión atmosférica con ebullición a reflujo, durante un tiempo prefijado 120, 180 y 240 minutos, respectivamente. El hidrolizado ácido obtenido se centrifugó a 2890g, a 0 ºC por 15 minutos. El sobrenadante se ajustó a pH 4,5 con NaOH al 33% y se esterilizó a una presión de15 psi (121 ºC), durante 15 minutos. Este extracto fue empleado para preparar los medios de producción, como fuente de carbono.
Condiciones de cultivo aeróbico: Se prepararon cuatro medios de cultivos diferentes, a partir de extracto ácido de la pulpa de café. Medio de cultivo 1, se preparó con el extracto ácido de café líquido y 3g/L de urea. Medio de cultivo 2, se preparó agregándole al extracto ácido, 3g/L de urea, 2g/L de K2HPO4. Medio de cultivo 3, se preparó agregándole al extracto ácido, 3g/L de urea; 2g/L de K2HPO4 y 1.3g/L de extracto de malta líquido. Medio de cultivo 4 (Control), se preparó con extracto ácido, sin nutrientes (24). El pie de cuba de cada uno de los cultivos aeróbicos representó 10% del volumen final del medio de cultivo (1L) y se realizó en fiolas de 2 litros provistas con tapón de goma. Las condiciones del cultivo aeróbico: temperatura de 30 ºC, agitación rotatoria de 90 g y se suministró oxígeno al medio durante todo el proceso mediante bomba de acuario (Power 500, Aquarium Air Pump) con una tasa de volumen de aire de 90 litros por hora, pH 4,5. El tiempo del cultivo aeróbico fue de 8 horas. Los análisis físico-químicos permitieron cuantificar: nitrógeno y proteína (25), azúcares totales por duplicado por el Método de Fenol-Acido Sulfúrico (26), cenizas (27), fibra cruda (28), pH (29), humedad (30) y grasa (31). La toma de muestras de los medios de cultivos se realizó cada hora y se retiraron del cultivo 5 mL de muestra, se centrifugaron durante 10 minutos a 6.000 rpm. El sedimento fue suspendido y lavado dos veces con 5 mL de agua destilada. Los distintos sobrenadantes obtenidos de la fermentación fueron diluidos en 1/500, 1/1000 y 1/2000 para determinar azúcares totales por el método de fenol/ácido. El crecimiento celular se cuantificó por el método de contaje en la cámara de Neubauer. La biomasa o proteína unicelular obtenida se filtró y se secó en estufa a 45 ºC hasta peso constante. Se realizaron cinéticas de crecimiento durante la fermentación y se determinó el peso de la biomasa obtenida.
RESULTADOS Y DISCUSIÓN
La tabla 1 muestra la concentración azúcares obtenidos, luego de realizada la hidrólisis con ácido sulfúrico al 1, 2 y 3%, a 120, 180 y 240 minutos respectivamente a la temperatura de 96 °C, observándose que hubo un incremento en la concentración de azúcares reductores, a medida que aumentaba el tiempo de hidrólisis. La mayor concentración fue obtenida cuando se utilizó una concentración de H2SO4 al 2%. Así mismo, se no se detectó la presencia de alcaloides en el extracto ácido de la pulpa del café.
Tabla 1. Efecto de la hidrólisis ácida de la pulpa de café con producción de azúcares fermentescibles
| Temperatura °C | Tiempo de Hidrólisis (min) |
Azúcares (g/L) |
Identificación de alcaloides Métodos | ||||
|
|
| 1% H2SO4
| 2% H2SO4 | 3% H2SO4 | Dragendor | Wagner | Mayer |
| 96 | 120 | 10,0 | 17,2 | 14,0 | Negativo | Negativo | Negativo |
|
| 180 | 11,2 | 17,0 | 14,0 | Negativo | Negativo | Negativo |
|
| 240 | 11,3 | 18,3 | 15,0 | Negativo | Negativo | Negativo |
Cada valor representa la media de tres ensayos.
Con la finalidad de enriquecer el medio de cultivo se determinó el efecto de sales nutritivas, empleándose las siguientes concentraciones: urea, 3g/L; fosfato ácido de potasio, 2g/L; y extracto de malta líquido, 3g/L (33). En la tabla 2 se pueden observar los resultados obtenidos. El mayor crecimiento de la levadura S. cerevisiae se obtuvo a las 8 horas de crecimiento celular en el medio 3 el cual estaba constituido por urea, fosfato ácido de potasio y el extracto de malta, este último constituye el agregado que incrementa la multiplicación celular de levaduras, valores confirmados por experiencias anteriores a este trabajo. Se alcanzó una población final de 4,9x105 Células/mL. El medio de cultivo 4 (Control), constituido solamente por el extracto ácido de café, mostró un crecimiento bajo de células levaduras, 9x104 Células/mL al cabo de 8 horas de crecimiento celular. Estos resultados permiten afirmar que la pulpa de café es un sustrato que debe ser enriquecido con sales nutritivas que aporten los elementos necesarios para incrementar el crecimiento celular de S. cerevisiae.
Tabla 2. Efecto de las sales nutritivas sobre el crecimiento celular de S. cerevisiae
|
| Medios de cultivos y nutrientes Células x 103/mL | |||
| Tiempo/ Fermentación (horas) | 1 | 2 | 3 | 4 (Control) |
| 0 | 85 | 93 | 213 | 40 |
| 2 | 95 | 140 | 240 | 45 |
| 4 | 105 | 179 | 250 | 60 |
| 6 | 165 | 190 | 380 | 80 |
| 8 | 185 | 215 | 490 | 90 |
Medio de cultivo 1: Extracto ácido de café, 1L; urea, 3g/L. Medio de cultivo 2: Extracto ácido de café, 1L; urea, 3g/L; K2HPO4, 2g/L. Medio de cultivo 3: Extracto ácido de café, 1L; urea, 3g/L; K2HPO4, 2g/L; extracto de malta líquido (3g/L). Medio de cultivo 4: Extracto ácido de café, 1L. Condiciones experimentales: pH 4,5; 30 °C; con un flujo de aire de 90 litros/hora y un tiempo de fermentación de 8 horas. Cada valor representa la media de tres ensayos.
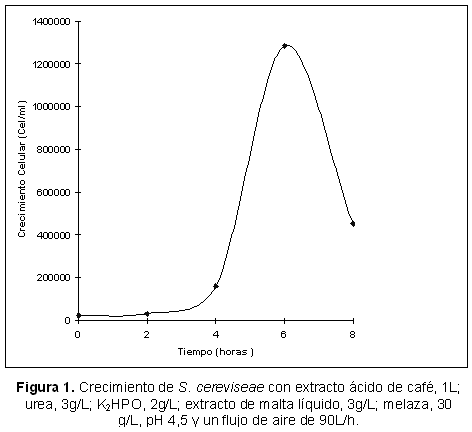
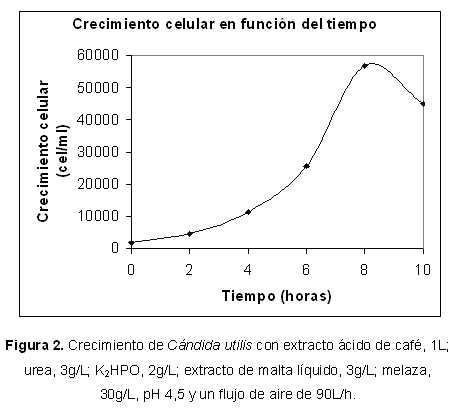
Con el objetivo de estudiar el crecimiento de las levaduras S. cerevisiae y C. utilis sobre el residuo de la pulpa de café, se realizaron fermentaciones aeróbicas, empleando el Medio de cultivo 3 y adicionándole melaza de caña de azúcar, 30g/L. Se mantuvieron las condiciones de temperatura, pH, y flujo de aire de los ensayos anteriores. Los resultados obtenidos (Tabla 1), durante los cultivos aeróbicos con melaza, muestran un crecimiento celular a las 8 horas con S. cerevisiae, de 1,4x106 Cel/mL (Tabla 3 y Figura 1), y una concentración en proteínas de 40,6% (Figura 1). En cambio, cuando se realizó el cultivo aeróbico empleando C. utilis, se obtuvo un crecimiento celular a las 8 horas de 5,9x104 Cel/mL y una concentración proteica de 21.8% (Tabla 3 y Figura 2). Por lo que se presume que la melaza constituye un sustrato adecuado para el crecimiento celular de S. cerevisiae y en consecuencia, para la obtención de biomasa de alto nivel proteico.
Tabla 3. Cultivos aeróbicos utilizando el Medio 3 y melaza (3g/L)
| S. cerevisiae | C. utilis | ||
| Crecimiento Celular (Cel/mL) | Proteína (%) | Crecimiento celular (Cel/mL) | Proteína (%) |
| 1,4x106 | 40,6 | 5,9x104 | 21,8 |
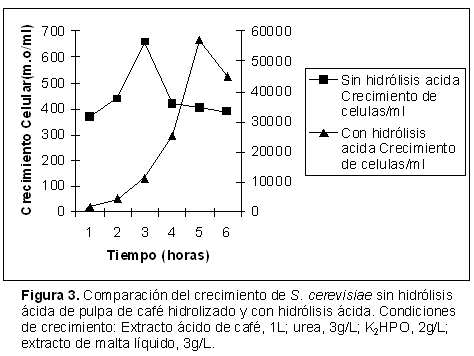
Así mismo, se compararon fermentaciones realizadas con extracto ácido de la pulpa de café hidrolizado y con extracto sin hidrólisis, observándose que en el medio de cultivo con el extracto no hidrolizado se alcanzó una población de 6,6x102 cel/mL, debido que la presencia de la celulosa y hemicelulosa, polisacáridos de alto peso molecular que no son fermentados por la S. cerevisiae. La composición química de la biomasa obtenida fue: materia seca: 94,65%; proteína cruda: 13,47%; grasa: 0,31%; fibra cruda: 0,36%; cenizas: 4,22% y carbohidratos: 67,01%. Mientras que, el medio de cultivo con extracto de la pulpa de café hidrolizado con ácido sulfúrico al 2%, se obtuvo un mayor crecimiento celular de S. cerevisiae, 5,7x104 cel/ml, debido a que se obtuvieron mono y disacáridos fácilmente degradables por esta levadura. Así mismo, la composición química de la biomasa obtenida con el residuo de la pulpa de café hidrolizado fue: materia seca: 94,68%; proteína cruda: 41,5%; grasa: 0,51%; fibra cruda: 0,48%; cenizas: 5,53% y carbohidratos: 52,35% (Figura 3 y Tabla 4).
Tabla 4. Composición química de la biomasa obtenida por cultivos aeróbicos con Saccharomyces cerevisiae
|
| Extracto de café no hidrolizado | Extracto de café hidrolizado con H2SO4 al 2% | Norma aplicada |
| Característica |
|
| |
| Crecimiento celular (Cel/mL) | 6,6x102 | 5,7x104 | - |
| Materia seca (%) | 94,65 | 94,68 | COVENIN1553-80 |
| Proteína (%) | 13,47 | 41,5 | COVENIN 1595-80 |
| Grasa (%) | 0,31 | 0,51 | COVENIN |
| Fibra cruda (%) | 0,36 | 0,48 | COVENIN 1194-79 |
| Cenizas (%) | 4,22 | 5,53 | COVENIN 1783-81 |
| Carbohidratos (%) | 67,01 | 52,35 | - |
| Biomasa (g/L) | 3 | 10 | - |
En este estudio se demostró que S. cerevisiae, tiene la habilidad de utilizar los residuos de la pulpa de café hidrolizados y constituyen un excelente medio de cultivo con abundante crecimiento celular, con un alto contenido proteico. Además de ser una alternativa para el aprovechamiento de estos residuos, ya que a partir de ellos, que industrialmente son considerados desechos, permite obtener grandes cantidades de proteínas para consumo humano y animal, de la pulpa de café. Estos resultados no pueden ser comparados con otros, por cuanto en la revisión realizada no se consiguen trabajos similares.
CONCLUSIONES
La hidrólisis química del residuo de la pulpa de café con ácido sulfúrico al 2% permite obtener azúcares fermentables por la S. cerevisiae y Candida utilis. Se obtuvo biomasa de levaduras, con rendimientos y productividades comparables con valores reportados en la literatura, útil en principio como aporte proteico para dietas de animales. Los resultados obtenidos permiten ofrecer una tecnología para disponer de un residuo agroindustrial contaminante y proporcionar una solución ecológica con un beneficio económico.
AGRADECIMIENTOS
Agradecemos al Consejo de Desarrollo Científico, Humanístico y Tecnológico de la Universidad de Los Andes, Proyecto Nº FA-292-02-01-C, por el soporte financiero a esta investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Montero M. Producción de abono orgánico de pulpa de café. CICAFE (Centro de investigaciones del café), ICAFE (Instituto del Café de Costa Rica); 1992. p. 15. [ Links ]
2. Food and Agricultural Organization (FAO). Producción Yearbook. Rome, Italy. Vol. 50. FAO Statistics Series Nº 165. p.172. [ Links ]
3. Rolz C, Menchú J, Calzada F, de León R, García R. Biotechnology in washed coffee processing. Process Biochemistry. 1982; 17 (8-10): 22. [ Links ]
4. Adams M, Dougan J. Biological management of coffee processing wastes. Tropical Science. 1981; 23: 177-197. [ Links ]
5. Pulgarin C, Schwitzguebel J, Tabacchi R. Comment blanchir les résidus du café noir?. Biofutur. 1991;102: 43-50. [ Links ]
6. Murillo B. Coffee-pulp silage. En: Braham, J. and Bressani, R., Editors. Coffee pulp. Composition, technology and utilization, International Development Research Centre (IDRC), Ottawa; 1979. p. 55-62. [ Links ]
7. Rolz C, de León R, de Arriola C. Biological pretreatment of coffee pulp. Biological. Wastes. 1988; 26: 97–114. [ Links ]
8. López E, Pabón M. Mejoramiento nutricional de la pulpa de café. Noticias Químicas. 1986; 42: 23-36. [ Links ]
9. Tauk S. Estudo da decomposicao da polpa de café a 45ºC a través do uso de microorganismos isolados da polpa. Turrialba. 1986; 36: 271-280. [ Links ]
10. Villas-Bóas S, Espósito E, Mitchell D. Microbial conversión of lignocellulosic residues for production of animal feeds. Animal Feed Science and Technology. 2002; 98: 1-12. [ Links ]
11. Amato S. Caracterización de las exoenzimas de 100 cultivos bacterianos nativos de Costa Rica. Informe final de Proyecto. Heredia, Costa Rica: Escuela de Química, Universidad Nacional; 1999. [Mimeografiado]. [ Links ]
12. Aubert L. Producción de enzimas pépticas de A. niger CH4 sobre pulpa de café por fermentación en medio sólido. Tesis de maestría para optar al título de Magíster Scientiae en Biotecnología de Microorganismos. Mérida, Venezuela: Universidad de los Andes; 1996. [ Links ]
13. Laboratorio de Nutrición. Departamento de Nutrición Animal y Forrajicultura. Muestras analizadas bajo el Nº 014-2004. Decanato de Ciencias Veterinarias. Universidad Centroccidental Lisandro Alvarado (UCLA); 2004. [ Links ]
14. López E, Pabón M. Mejoramiento nutricional de la pulpa de café. Noticias Químicas. 1986; 42: 23-36. [ Links ]
15. Mehansho H, Butler L, Carlson D. Dictary yannins and proline-rich proteins: Interactions, induction and defense mechanisms. Annual Review of Nutrition. 1987; 7: 423-440. [ Links ]
16. Jarquín R. Coffee pulp in swine feeding. En: Braham, J. Bressani R. Editors, Coffee pulp: Composition, Technology, and Utilization, International Development Research Centre (IDRC). Ottawa ; 1979. p. 39–49. [ Links ]
17. Bautista E, Molina N, Rodríguez Z. Pulpa de café ensilada en la alimentación cunícola. En: Ramírez, J., Editor. Pulpa de café ensilada. Producción, caracterización y utilización en alimentación animal. Venezuela; 1999. p. 75-90. [ Links ]
18. Bautista E, Usecha M, Pérez F, Linares F. Utilización de la pulpa de café ensilada y deshidratada en la alimentación de Cachamay (Colossoma x Piaractus). En: Pulpa de café ensilada. Producción, caracterización y utilización en alimentación animal. Estado Táchira, Venezuela; 1999. p. 109-135. [ Links ]
19. Ulloa J, Verreth J. Growth of Oreochromis aureus fed with diets containing graded levels of coffee pulp and reared in two culture systems. Aquaculture. 2003; 217: 275-283. [ Links ]
20. Urbaneja G, Ferrer J, Arenas L, Páez G, Colina G, Sandoval L. Hidrólisis ácida y caracterización de carbohidratos de la pulpa de café. Rev. Fac. Agron. (LUZ). 1997; 14: 265-275. [ Links ]
21. Avallone S, Guiraud, J-P, Guyot B, Olguin E, Brillouet J-M. Polysaccharide constituentes of Coffee-Bean Mucilage. J Food Sci. 2000; 65 (8): 1308-1310. [ Links ]
22. Tecnofood Italia. SNC. Vía Begoglio, 21 – 27047 S. MARÍA DELLA VERSA (Pavía) Italia. [ Links ]
23. Jack J, Moss M. Clarke´s Isolation and identification of drugs. 2º Ed. London: The Pharmaceutical Press; 1986. [ Links ]
24. Gualtieri M. Producción fermentativa de biomasa de Candida utilis, Saccharomyces cerevisiae y Schwanniomyces castelli utilizando como sustrato desechos de harina de maíz precocida. Tesis de Maestría para optar al título de Magíster Scientiae en Biotecnología de Microorganismos. Mérida, Venezuela: Universidad de los Andes; 2001. [ Links ]
25. Norma Venezolana COVENIN 1195:80. Determinación de nitrógeno total por Kjeldahl. Alimentos para animales. Caracas, Venezuela: FONDONORMA. [ Links ]
26. Dubois M, Gilles K, Hamilton J, Rebers P, Smith F. Colorimetric method for determination of sugar relates substances. Anal. Chem. 1956; 28(3): 350-356. [ Links ]
27. Norma Venezolana COVENIN 1783:81. Determinación de cenizas. Alimentos para animales. Caracas, Venezuela: FONDONORMA. [ Links ]
28. Norma Venezolana COVENIN 1194:79. Determinación de fibra cruda. Alimentos para animales. Caracas, Venezuela: FONDONORMA. [ Links ]
29. Norma Venezolana COVENIN 1315:79. Determinación de pH (acidez iónica). Caracas, Venezuela: FONDONORMA. [ Links ]
30. Norma Venezolana COVENIN 1553:80. Determinación de humedad. Alimentos para animales. Caracas, Venezuela: FONDONORMA. [ Links ]
31. Norma Venezolana COVENIN 1785:81. Determinación de grasa cruda. Alimentos para animales. Caracas, Venezuela: FONDONORMA [ Links ]












 uBio
uBio