Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.17 n.2 Maracaibo abr. 2007
Influencia de la actividad del agua, pH y temperatura en el crecimiento de aspergillus penicillioides y a. Terreus aislados de la carne seca y salada de atún listado (katsuwonus pelamis).
Influence of Water Activity, pH, and Temperature on Growth of Aspergillus penicillioides and A. terreus, Isolated From Dry and Salted Skipjack Tuna (Katsuwonus pelamis) Meat.
Crucita Graü, Dalmiro Sánchez, Aracelys Zerpa y Nicomedes García
Ministerio de Ciencia y Tecnología, Instituto Nacional de Investigaciones Agrícolas. Sucre / Nueva Esparta. Av. Carúpano – Caigüire. Apdo. 236. Edo. Sucre, Venezuela. E-mail: cgrau@inia.gov.ve
RESUMEN
La carne del atún seca y salada es consumida comúnmente en el este de Venezuela., siendo procesada artesanalmente a una concentración de 19% de NaCl y almacenada por largos períodos. Durante el almacenamiento, los hongos xerófilos pueden invadir diferentes sustratos, no siendo la excepción el pescado seco-salado. En este estudio es evaluado el efecto combinado de la actividad de agua (aw), pH y temperatura en el crecimiento de Aspergillus penicillioides y A.terreus. La relación de estos parámetros sobre la fase lag ( FL) y velocidad radial de crecimiento(VRC) fue determinada usando un medio de cultivo suplementado preparado a partir del Agar Extracto de Malta (MEA, Merck) con adición de NaCl a las concentraciones de 10; 15; 20 y 30%. El medio se ajustó a valores de pH 6,7 y 7,3 y se incubó a dos temperaturas (25 y 30°C) por un período de 210 horas. Los resultados indican que A. penicillioides disminuyó su VRC a medida que aumentó la concentración de NaCl en el medio. A la concentración de 10% de NaCl, la VRC fue de 0,24 mm/h, mientras que a la concentración de 30% alcanzó un valor de 0,069 mm/h. Los lags fueron de 18 a 70 horas respectivamente. La VRC de A.terreus fluctuó de 0,23 mm/h al 10% de NaCl, a 0,077 mm/h al 30%. A las respectivas concentraciones los lags extremos fueron de 16 a 68 h. A los valores de pH y temperaturas del ensayo no se obtuvieron diferencias significativas con respecto a FL y VRC. Se concluye que A. penicillioides y A. terreus desarrollaron mecanismos de adaptabilidad en condiciones estresantes cuando son expuestos a aw reducidas, incrementando la fase lag, reduciendo la tasa de crecimiento y la producción de biomasa fungal.
Palabras clave: Hongos xerófilos, crecimiento, aw, pH, temperatura, carne seca-salada de atún.
ABSTRACT
Dry and salted tuna meat is commonly consumed in eastern Venezuela, being usually artisanally processed with 19% NaCl, and stored for prolonged periods. During storage, xerophile fungi can invade numerous substrates, even dry salted fish. In this study the combined effect of water activity (aw), pH and temperature on growth of Aspergillus penicillioides and A. terreus is evaluated. The relationship of these parameters to the lag phase (LP) and the velocity of radial growth (RGV) was determined, using a supplemented culture mean prepared from Malt Extract Agar (MEA, Merck) with addition of NaCl at concentrations of 10; 15; 20 and 30%. The culture media was adjusted to pH values of 6.7 and 7.3, and was incubated at two temperatures (25°C and 30°C) for 210 h. Results indicated that A. penicillioides decreased its RGV as the concentration of NaCl increased in the culture media. At 10% concentration, the RGV was 0.24 mm/h, while at 30% the RGV reached 0.069 mm/h. The extreme LP was from 18 to 70 h, at the aforementioned concentrations, respectively. Aspergillus terreus fluctuated its RGV from 0.23 mm/h at 10% NaCl, to 0.077 mm/h at 30%. The extreme LP was from 16 to 68 h at the respective concentrations. There were no significant differences of the LP and RGV at the tested values of pH and temperature. It is concluded that A. penicillioides and A. terreus adapted to stressing conditions of exposure to reduced aw by increasing the lag phase, and decreasing the growth rate and the production of fungal biomass.
Key words: Xerophile fungi, growth, aw, pH, temperature, dry-salted tuna meat.
Recibido: 05 / 09 / 2005 Aceptado: 25 / 11 / 2006.
INTRODUCCIÓN
El pescado es uno de los alimentos más perecederos y para mantener las características nutritivas y sanitarias se somete a numerosas tecnologías siendo el salado y secado el método de conservación más antiguo, y a pesar de que éste es considerado como una técnica artesanal y de arraigo tradicional, tiene una vital importancia a nivel mundial. En los países tropicales como Venezuela, el secado y salado del pescado constituye hoy en día, una de las técnicas alternativas de preservación del producto que no se vende como fresco [13]. Su vida útil probable depende de la concentración de la sal, contenido de humedad y condiciones de almacenamiento [17,18].
El efecto preservador de la sal está limitado por su real incorporación a la carne del pescado y en consecuencia, al alcance de valores de la actividad de agua (aw) que impiden el desarrollo de ciertos microorganismos, así como la de bloquear reacciones químicas paralelas [17]. La estabilidad de este producto se logra inhibiendo la acción de los microorganismos y enzimas mediante una alta concentración salina y una deshidratación considerable que acompaña siempre al proceso [5,18].
En el deterioro del pescado seco-salado, el crecimiento de microorganismos está relacionado directamente con la actividad del agua. Durante el procesamiento del pescado, la sal agregada disminuye la actividad de agua del sistema, reduciendo la posibilidad de vida de los microorganismos [13]. Sin embargo, es necesario hacer mención que el valor del aw de una solución saturada de Cloruro de Sodio es de 0,75, lo que determina el hecho de que el pescado, aún cuando sea salado a elevadas concentraciones de NaCl, alcance en su carne valores de la aw más altos de lo esperado. De acuerdo a este criterio, es fácilmente comprensible el por que, el pescado salado está sujeto al deterioro [14]. Al respecto, cierto grupo de microorganismo que pueden desarrollarse a aw por debajo de 0,75 han sido señalados como agentes causales del deterioro [5,13,17]. Investigaciones realizadas por varios autores [3,13,15,25], en pescados seco-salados procesados artesanalmente en Venezuela reportan alteraciones de las propiedades físico-químicas, microbiológicas y organolépticas, aunadas a la pérdida del valor nutricional del producto ocasionadas por el crecimiento de microorganismos halotolerantes, predominando entre ellos los hongos, caracterizados por ser mohos filamentosos xerotolerantes, pertenecientes al género Aspergillus, identificados como A. penicillioides y A. terreus [13]. Especies señaladas como patógenos oportunistas termotolerantes, invasoras de tejidos y de las defensas del huésped [16]. Aún cuando son considerados como hongos toxigénicos se descarta la producción de metabolitos secundarios o sustancias micotoxigénicas a valores de aw tan bajos en el pescado seco-salado [11,13,23]. Sin embargo, representan un riesgo para la salud pública, siendo el mejor de los ejemplos, la variedad de procesos pulmonares en humanos ocasionados por la inhalación de esporas [16].
Aspergillus terreus es habitante común en suelos y alimentos, particularmente almacenados. Es probablemente termofílico y se conoce muy poco sobre su fisiología. Aspergillus penicillioides, se reporta como habitante común en productos como especias, frutas secas y ambientes interiores [23].
Es importante hacer mención que el desarrollo fúngico solo ocurre en condiciones favorables, ya que necesitan de varios nutrientes para hacer frente a sus requerimientos energéticos y para formar macromoléculas tales como proteínas y ADN. Son incapaces de sintetizar carbohidratos. Sí bien se desarrollan en sustratos ricos en proteínas como es el caso del pescado seco-salado, la colonización del mismo y el efecto de deterioro producido por los mohos está acondicionado a parámetros tales como aw, pH, temperatura, disponibilidad de oxígeno y potencial redox [4,21, 22].
Por otra parte, los hongos ocasionan pérdidas económicas importantes en la comercialización de los alimentos debido al rechazo del consumidor al conferirle un aspecto mohoso, cambios en la textura, desarrollo de olores y sabores fuertes [9,11]. Estas perdidas tienen una elevada incidencia en los países tropicales como es el caso de Venezuela, en donde se tienen factores ambientales como temperaturas y humedades relativas elevadas que favorecen el desarrollo de los hongos, unida a las deficientes condiciones de almacenamiento y de transporte de los productos alimenticios [13].
Dado que el efecto particular de los tratamientos tecnológicos en la preservación de los alimentos radica en lograr su estabilidad físico-química y microbiológica , éstos se aplican hoy en día como alternativa de procesamientos, el llamado efecto barrera, que no es más que el efecto combinado de sustancias preservantes y/o las interacciones de dos o más factores de estrés, los cuales al actuar sobre los microorganismos alteran su crecimiento, ejerciendo en algunos casos un efecto antagónico o sinérgico. En tal sentido el objetivo de este trabajo consistió en evaluar el efecto combinado de los parámetros: aw, pH y temperatura sobre el crecimiento de Aspergillus penicillioides y A. terreus, mohos de almacenamiento aislados de la carne seca-salada del atún listado (Katsuwonus pelamis).
MATERIALES Y MÉTODOS
Para la realización del presente estudio se utilizaron dos especies de hongos pertenecientes al género Aspergillus, identificados como A.penicillioides y A.terreus, aislados por Graü y col [13] en el período entre agosto 2003 a marzo 2004, ambos mohos fueron seleccionadas por su predominancia y efecto de deterioro en la carne seco-salada del atún listado (Katsuwonus pelamis), producto elaborado artesanalmente en la región nororiental del estado Sucre, Venezuela. Para su aislamiento se emplearon como medio de cultivo el agar MEA (Malt Estract Agar, Merck) con 20% de sacarosa y NaCl (5%) y Potato Dextrosa Agar (PDA, Merck) acidificado con 2 gotas de ácido tartárico al 10% [21]. A todos los medios se le determinó la aw, empleándose un medidor del punto de rocio (Decagon, cx-2) previamente calibrado con una batería de soluciones salinas saturadas [19].
Identificación de los hongos
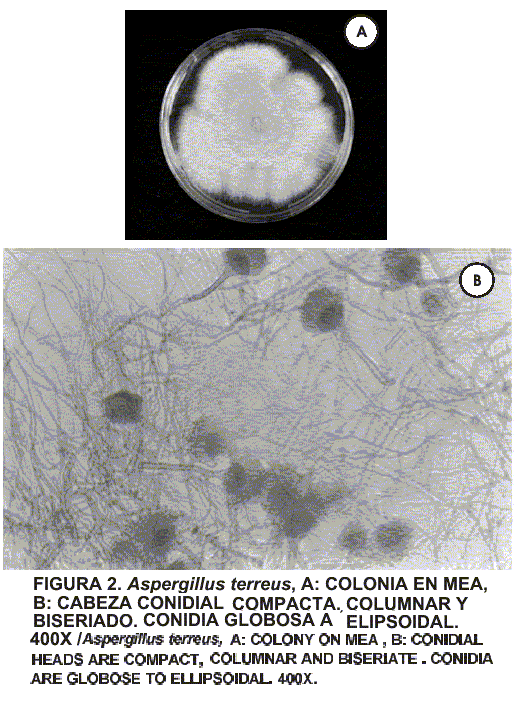
Se efectuó a partir de cultivos puros, utilizándose como medios Agar Czapek, Agar DG 18 (Dichloran 18% Glicerol Agar, para especies xerofílicas) y PDA acidificado. Se realizaron montajes húmedos y microcultivos [13, 16, 23]. Para la identificación hasta el nivel de especie se consideraron en forma minuciosa las características macroscópicas y microscópicas de cada uno de los hongos, empleándose para ello las descripciones de Fassatiova [9]; Koneman [16], y Samson y col. [23]. En las FIGS. 1 y 2 se presentan las especies de hongos utilizadas para la realización del estudio.
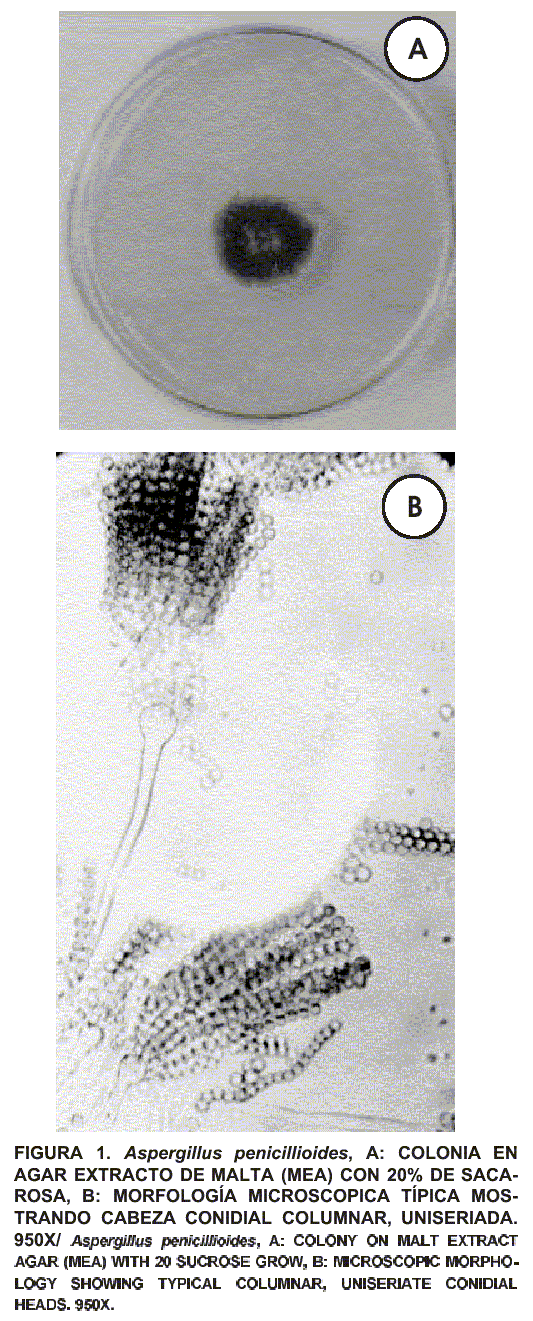
Conservación de las cepas aisladas
Las cepas de mohos aisladas se resembraron en tubos de ensayos con el medio PDA inclinado con adición de 20% de sacarosa y NaCl al 5%. Se incubaron a 25°/± 1°C hasta la aparición de colonias bien formadas y se conservaron en refrigeración a 5°/± 1°C hasta su posterior utilización.
Diseño experimental
Para determinar la relación de ciertos parámetros como la aw, pH y temperatura con relación a la fase lag y velocidad de crecimiento de A. penicillioides y A. terreus, se siguió el siguiente procedimiento:
Siguiendo la metodología empleada en trabajos previos [8, 13,25], los hongos aislados se sembraron por separados en placas de Petri contentivas de un medio de cultivo suplementado preparado a partir del Agar Extracto de Malta (MEA, Merck) y como diluyente del medio, se sustituyó el agua destilada por un caldo base nutritivo [8].
El caldo base nutritivo se preparó a partir de un hidrolizado de pescado [8,13], el cual se realizó homogenizando 100g de carne de atún listado seca-salada en 300 ml de agua destilada. Posteriormente, el caldo base se calentó en un baño maría (Memmert WB7, Alemania Occidental) a 50°C ± 0,1°C por 10 minutos y luego se filtró empleándose para ello, papel Whatman de 11,0 cm. Después de filtrado se le adicionó al medio MEA en la proporción de 48 g/l.
El Agar Extracto de Malta suplementado fue vertido en fiolas de 250 ml de capacidad y se le ajustó el pH (Corning 220, Massachussets, EUA) a valores de 6,7 y 7,3 utilizando NaOH 0,1N y la aw (Decagon C-2x) a valores de 0,938; 0,916; 0,850 y 0,778, siguiendo la metodología recomendada por Favetto y Chirife [10], utilizándose NaCl (% p/p) al 10; 15; 20 y 30% como soluto depresor de la aw. Posteriormente se esterilizó a 121 ± 0,1°C por 10 minutos. Una vez ajustado y esterilizado el agar a las diferentes aw y pH se distribuyó en placas de microcultivos y se sembraron individualmente con cepas de A. penicillioides y A. terreus, mediante la técnica de punción central [23].
Con el objeto de crear una cámara húmeda, las placas sembradas se colocaron en recipientes de vidrios de doble fondo, colocándose en la parte superior de los envases, las placas inoculadas y en la inferior, una solución de salmuera sobresaturada. Los recipientes con las placas sembradas se incubaron a las temperaturas de 25°/± 0, 1°C y 30/± 0,1°C. Se observaron diariamente hasta completar 210 horas. Para cada microorganismo se estableció el lag (horas).Como parámetro de crecimiento se utilizó la velocidad radial de crecimiento fúngico, realizándose la medición de la longitud del radio de colonia en el medio de cultivo en función del tiempo [7]. Se representó la velocidad de crecimiento (mm/horas).
RESULTADOS Y DISCUSIÓN
En las FIGS. 3 y 4, se presentan los resultados del crecimiento de Aspergillus penicillioides en Agar Extracto de Malta (MEA) suplementado con un caldo base de pescado a diferentes valores de aw, pH y temperatura.
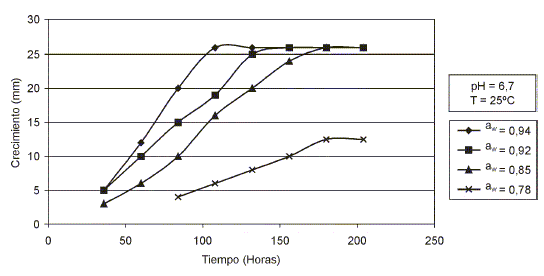
FIGURA 3 . EFECTOS DE LA aw, pH Y TEMPERATURA EN EL CRECIMIENTO DE aspergillus penicilliodes/ EFFECTS OF WATER ACTIVITY, pH AND TEMPERATURE ON GROW OF aspergillus penicilliodes.
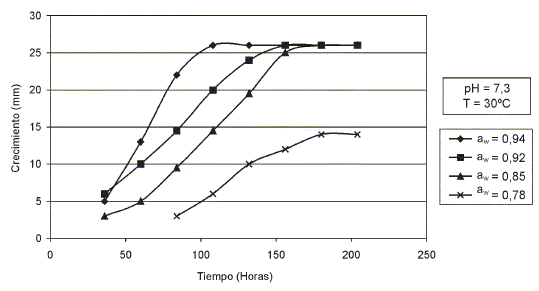
FIGURA 4 . EFECTOS DE LA aw, pH Y TEMPERATURA EN EL CRECIMIENTO DE aspergillus penicilliodes/ EFFECTS OF WATER ACTIVITY, pH AND TEMPERATURE ON GROW OF aspergillus penicilliodes.
os resultados revelaron que A. penicillioides disminuyó su velocidad radial de crecimiento a medida que decreció la actividad de agua en el medio MEA, ajustado a los valores de pH 6,7 y 7,3 y de aw 0,94; 0,92; 0,85; 0,78 y a las temperaturas de incubación de 25 ± 0,1°C y 30°± 0,1°C. A un valor de aw 0,94, la velocidad radial de crecimiento fue de 0,200 mm/h, mientras que al valor de aw 0,78, la velocidad radial alcanzó un valor de 0,088 mm/horas. Siendo los lags extremos de 40 – 100 horas a los valores de aw antes mencionados. La aw óptima para su crecimiento se ubicó entre los valores de 0,94 y 0,92. La aw mínima para su crecimiento fue de 0,78 correspondiente a la concentración de NaCl de 30% en el medio. Los valores de pH, cercanos a la neutralidad y temperaturas de incubación, no afectaron el crecimiento del microorganismo (FIGS. 3 y 4).
En las FIGS. 5 y 6, se presentan los resultados del crecimiento de A. terreus en el Agar Extracto de Malta (MEA) suplementado, ajustado a diferentes valores de aw, pH y temperatura. Utilizándose como soluto depresor de la actividad de agua el NaCl.

FIGURA 5. EFECTOS DE LA aw, pH Y TEMPERATURA EN EL CRECIMIENTO DE Aspergillus terreus/ EFFECTS OF WATER ACTIVITY, pH AND TEMPERATURE ON GROW OF Aspergillus terreus.
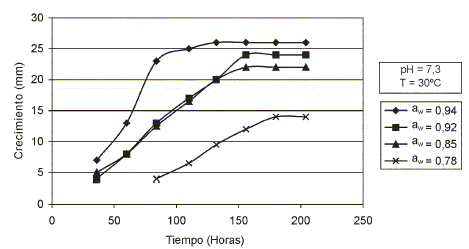
FIGURA 6. EFECTOS DE LA aw, pH Y TEMPERATURA EN EL CRECIMIENTO DE Aspergillus terreus/ EFFECTS OF WATER ACTIVITY, pH AND TEMPERATURE ON GROW OF Aspergillus terreus.
Aspergillus terreus varió su velocidad radial de crecimiento de 0,235 mm/horas a 0,166 mm/horas cuando la aw del medio osciló de 0,94 a 0,78. Sus lags extremos se ubicaron entre 30 – 100 horas. El valor óptimo de la actividad de agua para su crecimiento al igual que para A. penicillioides, se ubicó entre los valores de 0,94 y 0,92. La aw mínima para el crecimiento de A. terreus se estableció a un valor de 0,78 siendo su velocidad radial de crecimiento igual a 0,166 mm/horas. De manera similar al Aspergillus penicillioides, el pH y la temperatura de incubación no afectó el crecimiento del A. terreus (FIGS. 3 y 4). Cabe destacar que al considerar las distintas fases de las curvas de crecimiento de las especies estudiadas, éstas no evidencian una marcada diferencia en los períodos de preparación (lag). Después de alcanzar el máximo crecimiento entran en una fase estacionaria. Es importante señalar que el crecimiento de los hongos filamentosos es un fenómeno muy complejo que involucra cambios morfológicos, moleculares y celulares, que dependen en gran parte de las condiciones ambientales [16, 23] Sin embargo, en las especies estudiadas no se observaron cambios en las estructuras celulares (FIGS. 1 y 2).
Los resultados obtenidos confirman el carácter xerófilo de A. penicillioides y A. terreus, ambos mohos demostraron su capacidad de crecer a un valor de aw mínimo de 0,78 coincidiendo con lo informado por Frisvad y Samson [11], quienes reportan valores de aw mínimos para el crecimiento de A. penicillioides de 0,77 y para A. terreus de 0,78 en medios ajustados con NaCl, temperaturas mínimas de crecimiento en un rango de 25 – 30°C y temperaturas máximas de 37 – 45°C.
Por otra parte, estudios realizados por Gock y col. [12], sobre el efecto combinado de la actividad de agua, pH y temperatura en la germinación y crecimiento de siete especies de hongos xerófilos importantes en la contaminación de productos horneados y confitados, identificados como: Eurotium rubrum, E. repens, Wallemia sebi, Aspergillus penicillioides, Penicillium roqueforti, Chrysosporium xerophilum y Xeromyces bisporus, reportan que A. penicillioides germinó a valores de 25; 30 y 37°C, pH 4,5; 5,5; 6,5 y 7,5 y aw 0,92 a 0,70 en un medio en el que la actividad de agua se controló con una mezcla de partes iguales de glucosa y fructosa. El crecimiento óptimo ocurrió a la temperatura de 30°C. Sin embargo, la temperatura y la aw mínima afectó la germinación de otras especies como por ejemplo, P. roqueforti germinó a valores de aw 0,82 y de temperatura, 25°C y aw 0,86, 30°C pero no germinó a 37°C. E. repens germinó al valor de aw 0,70 y a la temperatura de incubación de 30°C, pero no a 25°C y 37°C. Todas las especies de hongos crecieron bajo la condición de pH ácidos y neutros [12].
La aw retarda el crecimiento de mohos y levaduras. Sin embargo, pocos hongos son capaces de crecer en ambientes con actividades de agua bajas [6, 26,27], tal es el caso de Eurotium amstelodami, moho contaminante del pescado seco de Indonesia, aislado a un valor de actividad de agua de 0,77. La aw mínima reportada para su germinación en medios ajustados con NaCl o con una mezcla de glucosa y fructosa es de 0,735 [27].
La germinación de esporas fúngicas no siempre pueden ser seguidas por un crecimiento micelial, especialmente bajo condiciones extremas de temperaturas y condiciones de nutrientes suboptimas [21,22,24,26]. Al respecto, los estudios realizados sobre la fisiología de Botryodiplodia theobromae, hongo relacionado con la putrefacción de las frutas confirman la marcada influencia de la complejidad del medio sobre el crecimiento del micelio y, por tanto en su velocidad de crecimiento y producción de biomasa [7]. Ayerst [1] observó que la germinación de conidióforos de Aspergillus frecuentemente ocurría a valores cercanos a la temperatura máxima para su crecimiento y actividades de agua reducidas. Se ha sugerido que la actividad de agua mínima para el desarrollo de conidias es más elevada que para el crecimiento micelial [20], estas observaciones no son muy claras pero se cree en la posibilidad de que sean funciones de una tasa de crecimiento lenta [2].
CONCLUSIONES
Los resultados obtenidos en el estudio revelaron el carácter xerófilo de A. penicillioides y A. terreus, ambos mohos demostraron su capacidad de crecer a un valor de aw mínimo de 0,78 en un medio ajustado con NaCl y a valores de pH cercanos a la neutralidad.
A. penicillioides y A. terreus desarrollaron mecanismos de adaptabilidad en condiciones estresantes cuando fueron expuestos a aw reducidas, incrementando la fase lag, reduciendo la tasa de crecimiento y la producción de biomasa fungal. El tiempo de generación no sobrepasó las 100 horas.
Los datos aportados proveen una matriz de información que puede ser utilizada para el desarrollo de modelos matemáticos predictivos del comportamiento de estos mohos en productos salados ya que su fisiología es poco conocida.
RECOMENDACIONES
Profundizar las investigaciones sobre la fisiología de los hongos xerotolerantes ya que existen muchas interrogantes sobre su comportamiento fisiológico.
Estudiar la incidencia de mohos filamentosos en productos pesqueros secos-salados y evaluar los efectos combinados de solutos y preservativos sobre la tasa de inactivación de las esporas o células vegetativas.
AGRADECIMIENTO
Al Instituto Nacional de Investigaciones Agrícolas (INIA) por el financiamiento y apoyo en la realización de esta investigación y al Postgrado de Biología Aplicada de la Universidad de Oriente (UDO), Núcleo de Sucre.
REFERENCIAS BIBLIOGRÁFICAS
1. AYERST, G. The effects of moisture and temperature on growth and spore germination of some Fungi. J. Stored Prod. Res. (5):127-141. 1969. [ Links ]
2. BEUCHAT, L.R.; HOCKING, A.D. Some considerations when analyzing foods for the presence of xerophilic fungi. J. Food. Protect. (53): 984-989. 1990. [ Links ]
3. BELLO, R.A.; GRANADOS, A. Evaluación y mejoramiento del pescado salado. Act Científ Venez. 45. Suplemento (1): 310. 1994. [ Links ]
4. CHRISTOPHER, E.N. Strategies of mold control in dairy feeds. J Dairy Sci. (76): 898-902. 1992. [ Links ]
5. CHRISTIAM, J.H.B.; GIBBSON, J. The physological basic salt tolerance in halophilic bacteria. J. Microbiol. 3: 249. 1957. [ Links ]
6. CUPPERS, H.G.; OOMES, S.; BRUL, S. A model for the combined effects of temperature and salt concentration on growth rate of food spoilage molds. Appl Environ Microbiol. 63(10): 3764-3769. 1997. [ Links ]
7. ENG, F.; ROJAS, M.G.; TORRES, E.F. Efecto de la temperatura y el pH en el crecimiento de Botryodiplodia theobromaeRC1. Rev Iberoam Micol. 20: 172-175. 2003. [ Links ]
8. ELGUEZABAL, L.; DAYLE, M.; NAVARRO, P.; GREIGE, M. Obstáculo y comportamiento microbiano en productos artesanales cárnicos y marinos . Act Científ Venez. 47. Suplemento (1): 318. 1997. [ Links ]
9. FASSATIOVA, O. Mould filamentous fungi in Technical microbiology. Progress in industrial microbiology. Vol. 22. Elservier Science Publisher. (Ed). Amsterdam. Netherlands. 233 pp. 1986. [ Links ]
10. FAVETTO, G.J.; CHRIRIFE, J. Simplified method for prediction of water activity in binary and aqueous solutions. Food Tecnol. 16: 31-38. 1986. [ Links ]
11. FRISVAD, J.C.; SAMSON, R.A. Filamentous fungi in foods an feeds. Ecology, Spoilage and Mycotoxin. In: Handbook of Applied Mycology. Vol. 3. Foods and Feeds. Arora, D.K, Mukerji, K. G. and Marth, E. H. (Eds) New York: Marcel Dekker. 31-68 pp. 1991. [ Links ]
12. GOCK, M.A.; HOCKING, A.D.; PITT, J.I.; POULOS, P.G. Influence of temperature, water activity and pH on growth of some xerophilic fungi. J. Food. Microbiol. 81: 11-19. 2003. [ Links ]
13. GRAÜ, C.; ELGUEZABAL, L.; VALLENILLA, O.; ZERPA, A. Evaluación de la flora microbiana halófila contaminante del pescado-salado elaborado en el estado Sucre. Rev. Cient. FCV-LUZ. XIII(4): 319-325. 2003. [ Links ]
14. INGRAM, M.; KITCHELL, A. Salt as preservation for foods. Food Technol. 2:1- 15. 1967. [ Links ]
15. IRIARTE, M.M.; GONZÁLEZ, C. Características químicas y microbiológicas de la Raya seca-salada (Dasyatis americana). Mem. Soc. Cienc. Nat. La Salle. Suplemento. 1: 111-124. 1988. [ Links ]
16. KONEMAN, E.W.; ROBERTA, D.G. Micología. 3era. Ed. Médica Panamericana. Buenos Aires. Argentina. 220 pp. 1992. [ Links ]
17. LUPIN, H.M. Principies of salting and drying hake. Technical consultation on the latin american hake industry. FAO. Fisheries report. F 11 V/R 203 suppl. 1: 161-176. 1978. [ Links ]
18. LUPIN, H.M.; BOERI, R.L.; MOSCHAIR, S.M. Water activity and salt content relationship in moisted salted fish products. J. Food. Technol. 16: 31-38. 1981. [ Links ]
19. OFFICIAL METHODS OF ANALYSIS OF THE AOAC. Water activity. 13th Ed. 1055pp. 1980. [ Links ]
20. PANASENKO, V.T. Ecology of microfungi Bot. Rev. 33: 189-215. 1967. [ Links ]
21. PARRA, R.; MAGAN, N. Modeling the effects of temperature and water activity on growth of Apergillus niger strains and applications for food spoilage moulds. J. Appl Microbiol. 97(2): 429-438. 2004. [ Links ]
22. PLUMRIDGE, A.; HESSE, E. J.; WATSON, A.J.; LOWE, K.C.; STRATFORD, M.A; ARCHER, D.B. The weak acid preservative sorbic acid inhibits conidial germination and mycelial growth of Aspergillus niger through intracellular acidification. Appl. Microbiol. 70(6):3506-3511. 2004. [ Links ]
23. SAMSON, R.A.; HOEKSTRA, E.S.; FRISVAD, J.C.; FILTENBORG, O. Introduction to food – borne fungi. 4th Ed. Centralbureau Voor Schimmelcultures, Baarn, DELFT. The Netherlands. 322pp. 1995. [ Links ]
24. SAUTOUR, M.; SOARES, M.C.; DIVIES, C.; BENSOUSSAN, M.; DANTIGNY, P. Comparison of the effects of temperature and water activity on growth rate of food spoilage moulds. J Ind Microbiol Biotechnol. 28(6): 311-315. 2002. [ Links ]
25. VILLALOBOS DE B, L.B.; GRAÜ DE M., C. Análisis microbiológico y químico del pescado seco-salado comercializado en el Edo. Sucre, Venezuela. Bol. Inst. Oceanogr. Venezuela, Univ. Oriente. 34: 25-32. 1995. [ Links ]
26. VINDELØV, J.; ARNEBORG, N. Effects of temperature, water activity, and syrup film composition on the growth of Wallemia sebi: Development and assessment of model predicting growth lags in syrup agar and crystalline sugar. Appl Environ Microbiol. 68(4): 1652-1657. 2002. [ Links ]
27. WHEELER, K.A.; HOCKING, A.D. Water relations of Paecilomyces variotii, Eurotium amstelodami, Aspergillus candidus and Aspergillus sydowii, xerophilic fungi isolated from Indonesian dried fish. Int J Food Microbiol. 7(1): 73-78. 1988. [ Links ]












 uBio
uBio 
