Revista Científica
versión impresa ISSN 0798-2259
Rev. Cient. (Maracaibo) v.17 n.3 Maracaibo mayo 2007
Aislamiento, Identificación y Caracterización
de Bacterias Ácido Lácticas de un Queso
Venezolano Ahumado Andino Artesanal.
Su Uso Como Cultivo Iniciador.
Carmen Alvarado Rivas, Zarack Chacón Rueda, Julio Otoniel Rojas,
Balmore Guerrero Cárdenas y Guillermo López Corcuera
Laboratorio de Biotecnología de Microorganismos, Dpto. de Biología, Facultad de Ciencias,
Universidad de Los Andes, Mérida, Venezuela. E-mail: chzarack@ula.ve
RESUMEN
Veinte cepas de microorganismos, aisladas a partir de una muestra de queso venezolano ahumado andino artesanal, se sometieron a pruebas bioquímicas clásicas y morfológicas para determinar su género. En este trabajo sólo se tomó en cuenta los géneros Lactococcus, Lactobacillus y Leuconostoc que son los más utilizados en la Industria Quesera como cultivos iniciadores. De las veinte, ocho pertenecían al género Lactococcus y dos al género Lactobacillus, con ellas se realizaron pruebas como: capacidad acidificadora de la leche, resistencia a antibióticos, resistencia a productos de limpieza de uso industrial y compatibilidad entre cepas. De acuerdo a sus características de aptitud tecnológica se seleccionaron cuatro cepas: dos lactococos y dos lactobacilos. Las cepas selecionadas se emplearon como cultivos iniciadores en la fabricación de quesos ahumados experimentales utilizando leche pasteurizada. Estos quesos se sometieron a una evaluación sensorial en la que también se incluyeron dos controles: un queso elaborado con leche cruda (sin cultivo iniciador) y el artesanal que dió origen a las cepas. Los resultados obtenidos en la degustación se analizaron con un análisis de varianza, que demostró que los quesos elaborados con las cepas seleccionadas, son equivalentes al artesanal y al fabricado con leche cruda.
Palabras clave: Queso ahumado andino, Lactococcus, Lactobacillus , cultivo iniciador.
Isolation, Identification and Characterization of Lactic Acid Bacterias
from Venezuelan Artisanal Andino Smoked Cheese. Their Use as Starter.
ABSTRACT
Twenty strains of microorganisms isolated from a sample of venezuelan artisanal andino smoked cheese were subjected to several biochemical and morphological tests in order to determine their genera. In this work it was only considered the genus Lactococcus, Lactobacillus and Leuconostoc that are those more used in the cheesemaker industry. From the twenty strains, eight belonged to the genus Lactococcus and two to the genus Lactobacillus, all ten strains were tested for selection as starter cultures and were carried out tests like: acidification activity, antibiotic resistance, detergent resistance and strains compatibility. Four strains (two lactobacilli and two lactococci) were selected according to their technological aptitude characteristics. The selected strains were used as the starters in order to produce experimental smoked cheeses using pasteurized milk. The experimental cheeses were subject to sensory analysis, for comparison two cheeses were included in the sensory analysis: an experimental cheese produced from raw milk (without starters) and the artisanal cheese. The sensory analysis results were subjected to a variance analysis, which showed no significant differences between the experimental cheeses and the control cheeses.
Key words: Andean smoked cheese, Lactococcus, Lactobacillus, starters.
Recibido: 28 / 11 / 2005. Aceptado: 17 / 01 / 2007.
INTRODUCCIÓN
El queso ahumado andino es un queso fresco elaborado con leche de vaca con un sabor ligeramente ahumado y poco ácido. A nivel artesanal este queso se elabora a partir de leche cruda sin la adición de cultivos iniciadores y la fermentación ocurre por un proceso natural, el ahumado se realiza por fogón de leña. Se manufactura principalmente en las zonas altas de las montañas de Los Andes venezolanos, y a pesar de no elaborarse de manera industrial es muy consumido, sobre todo en el occidente de Venezuela. Poco o nada se conoce de la flora microbiana presente en el queso ahumado andino, en ocasiones debido a los procedimientos poco higiénicos utilizados en la fabricación y al empleo de leche cruda de calidad microbiológica poco aceptable, se obtienen productos no uniformes y con una calidad higiénica inapropiada.
La mayoría de los quesos artesanales se elaboran con leche cruda sin la adición de cepas iniciadoras y por ello en ocasiones se presentan problemas para la salud. Para promover los quesos artesanales es necesario tener prácticas de manufactura estandarizadas y conocer las características finales del producto que se pueden lograr sólo después de una comprensiva e integrada caracterización de los perfiles químicos, microbiológicos y sensoriales [24].
Este trabajo constituye el primer paso para la elaboración de un cultivo iniciador a partir de la flora autóctona de los quesos ahumados andinos que permitirá la fabricación de este producto con leche pasteurizada y con una flora microbiana controlada.
Los cultivos iniciadores se definen como preparaciones que contienen microorganismos vivos aplicados con el objeto de hacer uso de su metabolismo microbiano [26]. Estos cultivos están constituidos por bacterias ácido lácticas (BAL) y principalmente pertenecientes a los géneros Lactococcus, Lactobacillus y Leuconostoc. La primera y principal función de éstos es la formación de ácidos orgánicos, principalmente ácido láctico [13, 30].
Las bacterias lácticas también tienen la capacidad de producir sustancias con actividad antimicrobiana [40]. El espectro de actividad de estos antimicrobianos es muy amplio, incluyendo a varias especies pertenecientes al grupo de las BAL, por ello, es muy importante determinar la compatibilidad entre cepas que formen parte de un cultivo iniciador.
Otro factor capaz de afectar la actividad de los cultivos iniciadores es la presencia en la leche de pequeñas cantidades de antibióticos [28], una posible solución a este problema podría ser la utilización de cepas iniciadoras menos sensibles a estos antibióticos.
Otros contaminantes externos de la leche son cantidades residuales de productos de limpieza utilizados en la industria láctea [19], esto constituye un problema, dado que mantienen actividad en leche por algún tiempo [18]. El cloro activo también constituye un compuesto importante en los desinfectantes utilizados, la actividad acidificadora de Lactococcus lactis y Lactobacillus casei L116-40 se vio fuertemente afectada en presencia de 12 mg/L de cloro activo [39].
En las dos últimas décadas, las BAL han recibido mucha atención, particularmente los géneros utilizados como cultivos iniciadores, debido a su gran importancia comercial. Las investigaciones se enfocan en aislar nuevas cepas con el fin de estudiar sus potencialidades como fermentos iniciadores. Es un hecho que las cepas iniciadoras influyen notablemente en los cambios químicos, bioquímicos y sensoriales que ocurren durante la maduración de los quesos y el uso de diferentes bacterias iniciadoras produce diferencias significativas en la calidad de los quesos [27]. Una fuente inagotable de cepas la constituye los productos artesanales, en especial los quesos [27]. Algunas investigaciones se han realizado en queso Palmita [22], con El-Khila [5], con Afuega´l pitu [14], con quesos duros argentinos [42], con Tenerife [4], en Manchego [44], con queso Comté [6] y en leche cruda [8], entre otros.
La pasteurización de la leche juega un papel fundamental en el control de bacterias patógenas, pero provoca una reducción importante de las poblaciones bacterianas naturales involucradas en la producción de quesos. Sin embargo, muchos productos tradicionales se elaboran con leche cruda y empleando las cepas iniciadoras naturales, lo que produce un amplio rango de productos con diferentes sabores, consistencias y calidades microbiológicas [11]. Estos productos son considerados como premium debido a sus características organolépticas, sin embargo, el uso de cultivos iniciadores selectos, necesario para favorecer las fabricaciones usualmente disminuye las características únicas del producto original [7].
La búsqueda y obtención de cepas que posean características tecnológicas interesantes, tales como buena actividad acidificante o proteolítica, y que puedan sobrevivir en productos lácteos, quesos, suero, podría permitir el desarrollo de los procesos de fabricación manteniendo las características organolépticas de los quesos y otros productos lácteos fermentados [2].
En este trabajo se pretende aislar e identificar bacterias lácticas del queso ahumado andino, caracterizar y seleccionar aquellas que posean aptitudes de cultivo iniciador, y con ellas crear mezclas de cepas para fabricar un queso ahumado andino pero empleando leche pasteurizada.
MATERIALES Y MÉTODOS
Análisis microbiológicos
El queso utilizado para el muestreo elaborado con leche cruda provino de la población de Pueblo Llano en el estado Mérida, Venezuela. De la parte central del queso se tomaron 10 g, se homogenizado en 99 mL de agua fisiológica estéril. Diluciones seriadas hasta 10–8 del homogenado, se sembraron por duplicado en placas de Petri conteniendo medios selectivos para bacterias ácido lácticas: agar MRS de Man, Rogosa y Sharpe (Merck) para Lactobacilos [16], agar Elliker (HiMedia) para Lactococos [20] y agar MSE de Mayeux, Sandine y Elliker (Biokar) para Leuconostoc [35]. Estas placas fueron incubadas en condiciones de microaerofília durante 48 h a 37°C, las colonias seleccionadas fueron crecidas en caldo Elliker o MRS y conservadas a –20°C en el mismo caldo con 30% de glicerol haciendo el papel de crioprotector. Los preinóculos de las cepas de interés seleccionadas para ensayos posteriores, se incubaron en caldo MRS o Elliker a 37°C durante toda una noche.
Identificación de los géneros
Las cepas purificadas fueron identificadas de acuerdo a los criterios del Manual Bergey [25, 29, 36], y de Dellaglio y col. [15]. Las pruebas de identificación fueron hechas principalmente para bacterias ácido lácticas (géneros Lactobacillus, Lactococcus y Leuconostoc) ya que estos microorganismos son los que se utilizan como fuente de cepas iniciadoras.
Caracterización de las cepas aisladas. Capacidad acidificadora de la leche
200 mL de leche descremada y estéril UHT fueron inoculados con 2 mL de cultivo de las cepas a evaluar, se incubaron a 37°C y se siguió el descenso del pH hasta las ocho horas.
Resistencia a antibióticos
Los antibióticos utilizados fueron: Penicilina G 1.000.000 U I (Valmorca), Kanamicina 25 mg/mL (Bristol) y Cloxacilina 25 mg/mL (Beechman Research Laboratories), el ensayo se realizó mediante el método del disco [3] con algunas modificaciones. Las cepas a ensayar se incubaron en caldos adecuados para cada una de ellas y luego dependiendo del género a usar, la suspensión bacteriana fue sembrada en cajas de Petri contentivas de agar Elliker o MRS, en la superficie se colocaron discos de papel de filtro (con diámetro de 5 mm) impregnados con soluciones de diferentes concentraciones de los antibióticos (5; 25; 50; 75; 100 µg/mL), para la penicilina se consideró que 800.000 U I son equivalentes a 500 mg. Después de una incubación por 12 horas a 37°C se observó la aparición de halos de inhibición alrededor del disco, halos con diámetro menor o igual a 5 mm indican resistencia de la cepa.
Resistencia a productos de limpieza y desinfección
Se determinó la resistencia de las bacterias aisladas a productos como detergente clorinado (Viactor) y a un producto ácido y detergente (Diversey Lever). En estas pruebas se utilizó el método del disco mencionado anteriormente. Las concentraciones utilizadas de detergente clorinado fueron 3; 6; 9 y 12 mg/L. Para el caso del ácido y detergente se tomó un Erlenmeyer estéril de 250 mL de capacidad al cual se agregó una solución del producto de limpieza preparado según recomendación del fabricante (ácido 2 ml/L y detergente 0,15 ml/L), se descartó la solución y se enjuagó una vez con agua. Se eliminó el contenido y se agregó 100 mL de agua estéril, se agitó y con esta última solución se impregnaron los discos para realizar las pruebas.
Capacidad acidificadora de la leche en presencia de antibióticos o productos de limpieza
Para la prueba de acidificación de la leche con antibióticos, 200 mL de leche descremada y estéril conteniendo antibióticos (Penicilina G, 25 µg/mL; Kanamicina, 100 µg/mL o Cloxacilina, 100 µg/mL) fueron inoculados con 2% v/v de un cultivo de las cepas seleccionadas, se incubaron a 37°C y se midió el descenso del pH hasta las ocho horas.
Para la acidificación de la leche conteniendo productos de limpieza y desinfección, la concentración de producto clorinado fue 12 mg/L. Para el caso del detergente y ácido los Erlenmeyers que contenían la leche para el ensayo, se trataron como se indicó anteriormente. La leche se inoculó con 2% v/v de un cultivo de las cepas a evaluar, se incubaron a 37°C y se siguió el descenso del pH hasta las ocho horas.
Compatibilidad entre cepas
Para evidenciar la compatibilidad entre las cepas seleccionadas se utilizó el método de difusión en agar [12]. Cajas de agar MRS fueron sembradas con cultivos de las cepas crecidas durante 24 horas, luego de una preincubación de 1 hora a 30°C se hicieron pocillos en el agar de las placas y se llenaron con 50 µL del sobrenadante libre de células del cultivo de las cepas a ensayar. Las placas fueron incubadas por 24 horas a 37°C y se observó la presencia o ausencia de halos de inhibición alrededor de los pocillos.
Preparación de los cultivos iniciadores
Para elaborar los cultivos iniciadores a ser empleados en la fabricación de los quesos, cada cepa se cultivó independientemente en un volumen de leche durante 12 horas a 37°C, al día siguiente se prepararon las mezclas de cepas compatibles tomando volúmenes iguales de cada uno de los cultivos. Las cepas seleccionadas se combinaron en pares y también se creó una mezcla de todas ellas.
Elaboración de los quesos ahumados
Con las diferentes mezclas preparadas en el punto anterior se elaboraron quesos ahumados utilizando leche pasteurizada y el mismo procedimiento del queso artesanal. La metodología fue la siguiente:
Pasteurización de la leche por calentamiento a 65°C por 30 minutos seguido de enfriamiento. Cuando la leche tenía una temperatura entre 35 y 37°C se añadió 0,05% p/v de CaCl2 y 2% v/v del cultivo iniciador (cada una de las mezclas de cepas). Se añadió una cantidad de cuajo (Giber) necesaria para obtener una floculación en 20 minutos. Al transcurrir una hora la cuajada se cortó, se sacó y fue colocada en un colador para drenar el resto de suero retenido. La cuajada fue amasada con sal (30 g/Kg de cuajada) por cinco minutos, colocada en moldes de 6 pulgadas de diámetro, con volteos a los 15 min, 1 h y 3 h después de haberse moldeado. Al día siguiente, los quesos fueron desmoldados y se sumergieron en agua caliente por un minuto. Se dejaron escurrir durante unas 12 h y posteriormente fueron tratados con aroma natural de humo (Smokey, 15171L, ADICÓN) siguiendo las recomendaciones del fabricante. Se conservaron a 4°C hasta su posterior uso.
Análisis sensorial de los quesos
El análisis de los diferentes quesos se realizó por un grupo de 5 personas expertas, entrenadas en ese tipo de actividad y familiarizadas con el queso ahumado andino. Los quesos se evaluaron en 2 repeticiones y se consideraron atributos como: características externas (forma del queso, consistencia, textura y color de la corteza), características de la pasta (textura y color), aroma, sabor y aceptabilidad general. La máxima puntuación para un queso era 20 puntos repartidos de la siguiente manera: características externas 3 puntos, características de la pasta 5 puntos, aroma 3 puntos, sabor 6 puntos y aceptabilidad general 3 puntos. Los resultados se calificaron mediante una prueba de puntos o calificación ya que esta es la prueba que frecuentemente se emplea en los paneles sensoriales [34]. Posteriormente se aplicó un análisis de varianza para detectar las diferencias entre los diferentes tipos de queso.
RESULTADOS Y DISCUSIÓN
Identificación y capacidad acidificadora de las cepas
En el medio MRS se obtuvieron 10 cepas que se designaron M1, M2, M3, M4, M5, M6, M7, M8, M9 y M10. En el medio Elliker se obtuvieron 12 cepas que se denominaron E1, E2, E3, E4, E5, E6, E7, E8, E9 E10, E11 y E12. En el medio MSE no se obtuvo ninguna colonia con características de Leuconostoc. Las pruebas confirmatorias para los géneros sólo permitieron ubicar M2 y M10 en el género Lactobacillus y M6, M7, M8, M9, E4, E7, E8 y E10 en el género Lactococcus.
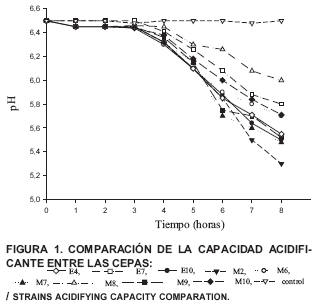
Todas las cepas escogidas (salvo la designada como E8) acidificaron lentamente la leche a 37°C siendo las más acidificadoras las cepas M2, M7 y E10 respectivamente (FIG. 1).
Cuando se compara la capacidad acidificadora de estas cepas con la presente por ejemplo en cepas comerciales Lacto-Labo, se nota que el comportamiento es similar, además la acidez producida por las cepas en los quesos elaborados en el laboratorio (pH 5,07) es equivalente a la acidez del queso artesanal (pH 5,0) lo que indicaría que estas cepas son adecuadas desde ese punto de vista para ser utilizadas en un proceso de fabricación de quesos frescos [41].
Sensibilidad a antibióticos
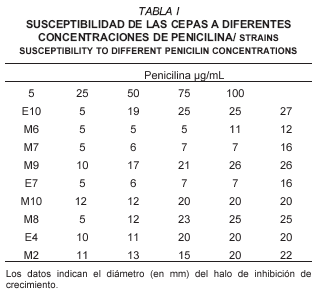
Todas las cepas mostraron resistencia a las concentraciones probadas de Kanamicina. En el ensayo con la Cloxacilina, sólo M6 y M7 mostraron sensibilidad moderada a concentraciones de 100 µg/mL del antibiótico. Mientras que para la penicilina, la mayoría presentaron gran sensibilidad (TABLA I). Al igual que en el presente trabajo, Bayer y col. [1], en un estudio realizado con 40 cepas de Lactobacillus encontraron que todas eran sensibles a la penicilina con una concentración mínima inhibitoria tan baja como 0,48 µg/mL. Charteris y col. [9], trabajando con 46 cepas de Lactobacillus de origen humano y de productos lácteos y ensayando con 44 antibióticos, encontraron tal y como en el caso reportado en el presente trabajo, que todas las cepas fueron resistentes a la Kanamicina (30 µg/mL) pero sensibles a la penicilina, salvo 4 de ellas 3 de origen humano y 1 de origen lácteo que mostraron una resistencia atípica a 10 µg/mL. Estas resistencias podrían haber sido adquiridas debido a exposiciones in vivo, aunque se carece de una evidencia conclusiva. En otros reportes sobre la susceptibilidad de las BAL a los antibióticos se encontró que ante la penicilina y otros antibióticos que afectan la síntesis de la pared bacteriana, la mayoría de los representantes de los géneros Lactococcus y Lactobacillus probados fueron sensibles a concentraciones entre 0,06 y 16 µg/mL [23].
Los niveles de sensibilidad de las cepas utilizadas como cultivos iniciadores dependen mucho de cada cepa [21, 46] y, la capacidad de resistir ciertas concentraciones de antibióticos está relacionada con la presencia de algunos plásmidos en estos microorganismos, aunque también hay evidencias que esas resistencias pueden deberse a propiedades particulares de la pared y membrana de esos microorganismos que los hacen impermeables a los antibióticos La adquisición de estos plásmidos depende de la presión selectiva a la que hayan sido sometidas las bacterias debido a la presencia de los antibióticos en su hábitat (leche) [9].
Las bacterias ácido lácticas requieren de condiciones y medios especiales para crecer, por ello el uso de medios convencionales como Mueller-Hinton para determinar la susceptibilidad hacia los antibióticos pueden no ser los más adecuados, esto es algo a considerar cuando se hacen los ensayos con BAL y que podría explicar muchos resultados contradictorios [32]. Siempre genera controversia el escoger una cepa iniciadora entre otras cosas, por su resistencia a los antibióticos de uso común en la ganadería y la industria láctea, cada día se encuentran más cepas de bacterias ácido lácticas que muestran resistencia a los antimicrobianos y hay quien justifica este tipo de estudio para evitar incluir cepas resistentes en los cultivos iniciadores, ya que mucha de estas resistencias pueden ser transmisibles [23]. 30 años atrás no se encontraba resistencia a los antibióticos entre las BAL [10, 31, 37], probablemente el amplio uso en la actualidad de los antibióticos, en la medicina veterinaria y la agricultura, contribuiría a la diseminación de resistencias en nichos ecológicos relacionados con el queso.
Las concentraciones de antibióticos ensayadas en este trabajo fueron muy altas con relación a las concentraciones que normalmente se consideran permisivas en leche [43], así en países como Estados Unidos, al menos para la penicilina se considera como permitida una concentración tan baja como 0,01 µg/mL, para la mayoría del resto de los antibióticos no se ha determinado cuales son los niveles permisivos en leche. Sin embargo, se probaron concentraciones mayores ya que luego de administrar en forma parenteral antibióticos a las vacas, el 0,3% de la dosis suministrada puede detectarse en leche, con frecuencia los antibióticos se suministran directamente en las mamas pudiéndose en ese caso detectar en leche casi el 100% de la dosis suministrada [43]. Dada la variedad de antibióticos y concentraciones que pueden ser suministrados al ganado y las diversas formas en que puede hacerse es difícil determinar con precisión las cantidades residuales de estos compuestos en la leche.
Es posible que la baja sensibilidad sobre todo ante la penicilina de las cepas aisladas en este estudio, se debe por un lado a las altas concentraciones que se emplearon y por otro a la falta de una fuerza selectiva debido a la carencia de antibióticos en la leche, esta suposición fue confirmada por comunicación personal del dueño del ganado que produce la leche para la elaboración de el queso artesanal de donde provienen las cepas aisladas en este estudio, quien indicó que casi nunca utiliza antibióticos para tratar sus animales.
Sensibilidad a productos de limpieza de uso industrial
En la industria de alimentos y por supuesto en la industria láctea, sobre mesones y utensilios tienden a crearse biofilms que son un problema serio debido al potencial que representan como contaminantes de los productos alimenticios, lo cual puede llevar a una disminución de la calidad de los alimentos y constituir un riesgo para la salud. Es por ello que se emplean detergentes, desengrasantes, tratamientos ácidos, tratamientos alcalinos, productos de amonio cuaternario entre otros, a fin de obtener la mejor limpieza posible y disminuir todos esos riesgos [18, 19, 33, 45]. Sin embargo, muchas veces quedan restos de esos compuestos que pueden afectar la viabilidad y desempeño de las cepas iniciadoras.
Todas las cepas aisladas en este trabajo fueron tolerantes a las concentraciones de los productos de limpieza probadas. Sólo M7 fue muy sensible al producto clorinado. Es de destacar que las cepas fueron resistentes incluso a 12 µg/L del compuesto clorinado, concentración de cloro en la cual se ha encontrado sensibilidad en cepas de Lactococcus y Lactobacillus [39]. Sin embargo, en muchos casos los tratamientos se realizan a concentraciones mayores que las aquí empleadas. Los tratamientos de limpieza con detergentes y combinaciones de ácidos y cloro son frecuentes para eliminar biofilms en la industria láctea, así en Nueva Zelandia en un ensayo a nivel de laboratorio que reproducía las condiciones de una planta de productos lácteos, se encontró que un tratamiento ácido-alcalino (ácido nítrico al 0,8% y cloro 200 ppm) reducía la población bacteriana hasta en 2 unidades logarítmicas [17]. Estos resultados deben interpretarse con cuidado, ya que hay autores que reportan que la eficiencia de los tratamientos depende del estado en que se encuentren los microorganismos. Así, Peng y col. [38] reportan que B. cereus, una bacteria común en utensilios y mesones empleados en la industria láctea, es más resistente a un tratamiento con 25 ppm de cloro seguido de 100 ppm de un compuesto de amonio cuaternario cuando se encuentra como biofilm (donde hay poco efecto sobre la viabilidad) que cuando está en un estado plactónico donde luego de apenas 15 segundos de tratamiento se provoca una reducción de más de 5,0 log CFU/ml.
Selección de cepas
Las cepas seleccionadas fueron aquellas que cumplían los requisitos siguientes: buena capacidad acidificadora, resistencia a los antibióticos ensayados y a los productos de limpieza. Ellas fueron M2, M6, M10 y E7, en el caso de M2 y M10 a pesar de que se encuentran entre las más sensibles a la penicilina, las mismas se seleccionaron ya que fueron los únicos Lactobacilos que se lograron aislar. Es conveniente aclarar que aunque E10, M9, E4 y M7 se encuentran entre las mejores acidificadoras, no se escogieron ya que las tres primeras mostraron mucha sensibilidad ante la penicilina y M7 fue totalmente sensible al detergente clorinado.
Con las cepas seleccionadas se repitieron las pruebas de sensibilidad pero esta vez determinando cómo los diferentes productos afectaban la capacidad acidificadora de las cepas en leche. De nuevo se constató que la Penicilina produjo la mayor inhibición impidiendo la acidificación de la leche. Con los otros dos antibióticos se produjo menos inhibición lográndose disminuir el pH de la leche de 6,5 a 6,3. En esta prueba la inhibición del crecimiento y por ende de la acidificación de la leche por los antibióticos, es mucho mayor que la evidenciada utilizando el método del disco, la causa de esta diferencia podría ser que en el método del disco la difusión del antibiótico a través del agar no es efectiva lo que causa una falsa apreciación de la inhibición del crecimiento de las cepas.
En relación al efecto de los productos de limpieza sobre la capacidad acidificadora de las cepas, en las condiciones de ensayo no causaron efecto inhibitorio, datos que concuerdan con los resultados obtenidos en la prueba de susceptibilidad de las cepas a estos agentes mediante la prueba del disco.
Compatibilidad entre cepas y elaboración de mezclas de cepas
Al determinar la compatibilidad entre las cepas que podrían integrar un cultivo iniciador, se encontró que todas son compatibles entre sí por lo que no habría problemas al mezclarlas. Se prepararon cuatro mezclas de cepas; una que incluyó las cuatro cepas (M2-M6-M10-E7) y tres mezclas formadas por pares entre M2 que fue la mejor acidificadora y el resto de las cepas, es decir las mezclas: M2-M6, M2-E7 y M2-M10.
Análisis Sensorial de los quesos
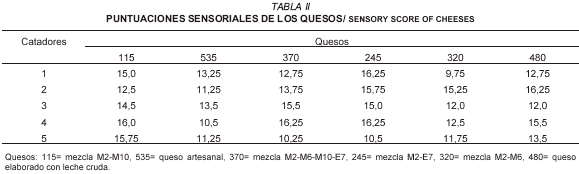
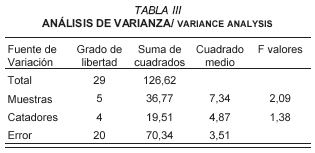
Con las cepas aisladas y seleccionadas como iniciadoras se elaboraron quesos ahumados. Luego los quesos se sometieron a una evaluación sensorial. En esa evaluación y a manera de control se incluyeron dos quesos: uno elaborado con leche cruda y sin adición de cepas exógenas y el artesanal elaborado por el productor de Pueblo Llano. Los resultados obtenidos en la degustación (TABLA II) se trataron estadísticamente por medio de un análisis de varianza con un nivel de significancia de un 0,5% (TABLA III) el cual mostró que no existen diferencias significativas entre los quesos elaborados en el laboratorio y los quesos control.
Este resultado es interesante ya que los quesos experimentales elaborados con leche pasteurizada y con las cepas aisladas en este trabajo demostraron ser equivalentes al elaborado con leche cruda. Es bien conocido en el ámbito mundial que los mejores quesos se elaboran con leche cruda de alta calidad, lo que se explica entre otras cosas por la presencia en ella de una compleja flora de microorganismos que se encuentran perfectamente adaptados a la leche y que con su actividad fermentativa proporcionan a esos quesos sus extraordinarias características organolépticas [7, 11].
Por otro lado, el hecho de que el queso experimental sea equivalente al artesanal que dio origen a las cepas de este estudio, indica que las mismas tienen un gran potencial para su uso a escala industrial con leche pasteurizada. La adición controlada de nuestras cepas permitió obtener un producto similar al artesanal. Al parecer los géneros Lactobacillus y Lactococcus escogidos para elaborar el cultivo iniciador son los responsables más importantes en proporcionar las características particulares del queso en estudio. De todas formas este es apenas un estudio preliminar y es necesario continuar ampliándolo a fin de caracterizar con más precisión, la flora responsable de proporcionar las características organolépticas del queso andino ahumado, y buscar nuevas cepas con mayor capacidad acidificadora y mayor resistencia a los antibióticos.
CONCLUSIONES
La metodología de aislamiento de la flora láctica utilizada en este trabajo parece indicar que en el queso ahumado andino ésta está formada principalmente por los géneros Lactococcus y Lactobacillus.
Todas las cepas acidificaron lentamente la leche. Sin embargo, la acidez alcanzada en los ensayos es equivalente a la presente en el queso objeto de este estudio, lo que parece indicar que, desde este punto de vista son apropiadas para su fabricación.
Las cepas presentaron sensibilidad moderada a las concentraciones probadas de Kanamicina y Cloxacilina, en tanto que los niveles de sensibilidad a la penicilina son muy altos.
Las concentraciones empleadas de los productos de limpieza ensayados, no causaron inhibición sobre la capacidad acidificadora de las cepas en estudio.
Los quesos elaborados en el laboratorio son equivalentes al artesanal en cuanto a sabor, aroma y aceptabilidad general, por lo tanto las mezclas de cepas aisladas son adecuadas para producir el queso ahumado andino utilizando leche pasteurizada.
REFERENCIAS BIBLIOGRÁFICAS
1. BAYER, A.S.; CHOW, A. W.; CONCEPCIÓN, N.; GUZE, L.B. Susceptibility of 40 Lactobacilli to six antimicrobial agents with broad gram-positive anaerobic spectra. Antimicrob. Agents Chemother. 14: 720-722. 1978. [ Links ]
2. BARUZZI, F.; MATARANE, A.; MOREA, M.; COCCONCELLI, P. S. Microbial community dynamics during the Scamorza Altamurana cheese natural fermentation. J. Dairy Sci. 85: 1390-1397. 2002. [ Links ]
3. BAUER, A.; KIRBY, M.; SHERRIS, J.; TURCK, M. Antibiotic susceptibility testing by a standardized single disk method. Am. J. Clin. Pathol. 45: 493-496. 1966. [ Links ]
4. BELDA, F.; ZARTATE, V.; CARDELL, E. Caracterización del queso de leche de cabra de Tenerife elaborado industrialmente. Alimentación, Equipos y Tecnología. Julio-Agosto: 77-79pp. 1997. [ Links ]
5. BOUBEKRI, K.; OTHA, B. Identification of lactic acid bacteria from Algerian traditional cheese, EL-Klila. Sci. Food Agr. 70: 501-505. 1996. [ Links ]
6. BOUTON, Y.; GRAPPIN, R. Preliminari characterization of microflora on Comté cheese. J. Appl. Microbiol. 85: 123-131. 1998. [ Links ]
7. CAPLICE, E.; FITGERALD, G. F. Food fermentations: role of microorganisms in food production and preservation. Int. J. Food Microbiol. 50: 131-149. 1999. [ Links ]
8. CHACÓN, Z.; LÓPEZ-CORCUERA, G. Evaluación de cepas de Lactococcus como cultivos iniciadores en la elaboración de quesos de pasta pensada. Rev Científ, FCV-LUZ. X(5): 423-428. 2000. [ Links ]
9. CHARTERIS, W.P.; KELLY, P.M.; MORELLI, L.; COLLINS, J.K. Antibiotic susceptibility of potentially probiotic Lactobacillus species. J. Food Prot. 61: 1636-1643. 1998. [ Links ]
10. COGAN, T.M. Susceptibility of cheese and yogurt starter bacteria to antibiotics. Appl. Environ. Microbiol. 23: 960-965. 1972. [ Links ]
11. COGAN, T.M.; BARBOSA, M.; BEUVIER, E.; BIANCHI-SALVADORI, B.; COCCONCELLI, P.S.; FERNANDES, I.; GÓMEZ, J.; GÓMEZ, R.; KALANTZOPOULOS,G. Characterization of the lactic acid bacteria in artisanal dairy products. J. Dairy Res. 64: 409-421. 1997. [ Links ]
12. COLLINS, C.; LYNE, P.; GRANZ, J. Antimicrobial susceptibility and assay test. In: Microbial Methods. 6th Ed. Butterworth-Heinemann, Oxford. 151-168pp. 1991. [ Links ]
13. COX, W. Characteristics and use of starters cultures in manufacture and use of starters for the dairy industry. J. Soc. Dairy Technol. 30: 5-8. 1977. [ Links ]
14. CUESTA, E. Desarrollo de un cultivo iniciador para el queso artesanal Afuega´l Pitu. Universidad de Oviedo, España. Tesis Doctoral. 84 pp. 1996. [ Links ]
15. DELLAGLIO, F.; DE ROISSART, H.; TORRIANI, S.; CURK, M.C.; JANSSENS, D. Caractéristiques générales des bactéries lactiques. En: Bactéries Lactiques. Vol. I. Lorica, Chemin de Saint Georges. 25-116 pp. 1994. [ Links ]
16. DE MAN, J.; SHARPE, M. A medium for the cultivation of Lactobacilli. J. Appl. Bact. 23: 130-135. 1960. [ Links ]
17. DUFOUR, M.; SIMMONDS, R.S.; BREMER, P. J. Development of a laboratory scale-clean-in place system to test the effectiveness of natural antimicrobials against dairy biofilms. J. Food Prot. 67: 1438-1443. 2004. [ Links ]
18. DUNSMORE, D. Effect of 5 desinfections in milk on acid production by strains used for Cheddar chessemaking and on organoleptic properties of the cheese. J. Dairy Res. 52: 287-294. 1985. [ Links ]
19. DUNSMORE, D. The incidence and implications of residues of detergents and sanitizers in dairy products. Resid Rev. 86: 63-67. 1993. [ Links ]
20. ELLIKER, P.; ANDERSON, A.; HANNESSON, G. An agar culture medium for lactic acid streptococci and lactobacilli. J. Dairy Sci. 39: 1611-1612. 1956. [ Links ]
21. ELLIOT, J.A.; FACKLAM, R. R. Antimicrobial susceptibilities of Lactococcus lactis and Lactococcus garviae and a proposed method to discriminate between them. J. Clin. Microbiol. 34: 1296-1298. 1996. [ Links ]
22. FERRER, A.; URDANETA, D.; RINCÓN, Z. Microflora isolated from venezuelan Palmita-Tipe cheese. J. Food Prot. 54: 856-860. 1991. [ Links ]
23. FLÓREZ, A. B.; DELGADO, S.; MAYO, B. Antimicrobial susceptibility of lactic acid bacteria isolated from a cheese environment. Can J. Microbiol. 51: 51-58. 2005. [ Links ]
24. FREITAS, C.; MALCATA, F. X. Microbiology and biochemistry of cheeses with appellation d´origine protegée and manufactured in the Iberian Peninsula from ovine and caprine milks. J. Dairy Sci. 83: 584-602. 2000. [ Links ]
25. GARVIE, E. Genus Leuconostoc. En: Bergey´s Manual of Systematic Bacteriology. Vol. 2. Williams and Wilkins, Baltimore: 1071-1079 pp. 1986. [ Links ]
26. HAMMES, W. Bacterial starter cultures in food production. Food Biotechnol. 4: 389-397. 1990. [ Links ]
27. HAYALOGLU, A.A.; GUVEN, M.; FOX, P.F.; McSWEENEY, P. L. H. Influence of starters on chemical, biochemical, and sensory changes in turkish White-Brined cheese during ripening. J. Dairy Sci. 88: 3460-3474 pp. 2005. [ Links ]
28. JUÁREZ, M. Nuevas técnicas para el análisis de la leche y productos lácteos. Materiales, equipos y tecnología. Edit. Alción S.A. Madrid España. Marzo-abril: 19-25. 1982. [ Links ]
29. KANDLER, O.; WEISS, N. Genus Lactobacilli. En: Bergey´s Manual of Systematic Bacteriology. Vol. 2. Williams and Wilkins, Baltimore: 1209-1234 pp. 1986. [ Links ]
30. KASHET, E. Bioenergetics of lactic acid bacteria: Cytoplasmic pH and osmotolerance. FEMS Microbiol. Rev. 46: 223-244. 1987. [ Links ]
31. KATLA, A. K.; KRUSE, H.; JOHNSEN, G.; HERIKSTAD, H. Antimicrobial susceptibility of starter culture bacteria used in Norwegian dairy products. Int. J. Food Microbiol. 67: 147-152. 2001. [ Links ]
32. KLARE, I.; KONSTABEL, C.; MÜLLER-BERTLING, S.; REISSBRODT, R.; HUYS, G.; VANCANNEYT, M.; SWINGS, J.; GOOSSENS, H.; WITTE, W. Evaluation of new broth media for microdilution antibiotic susceptibility testing of Lactobacilli, Pediococci, Lactococci and Bifidobacteria. Appl. Envirom. Microbiol. 71: 8982-8986. 2005. [ Links ]
33. LAOPAIBOON, L.; HALL, S. J.; SMITH, R. N. The effect of a quaternary ammonium biocide on the performance and characteristics of laboratory-scale rotating biological contactors. J Appl Microbiol. 93:1051-1058. 2002. [ Links ]
34. MACKEY, A.; FLORES, M.; SOSA, M. Prueba de puntos o calificación. En: Evaluación sensorial de los alimentos. 2da Ed. Ediciones CIEPE, Serie Manuales Nº 2. 93 pp. 1984. [ Links ]
35. MAYEUX, J.; SANDINE, W.; ELLIKER, R. A selective medium for detecting Leuconostoc organism in mixed–strain starter cultures. J. Dairy Sci. 45: 655-656. 1962. [ Links ]
36. MUNDT, O. Lactic acid Streptococci. In: Bergey´s Manual of Systematic Bacteriology. Vol. 2. Williams and Wilkins, Baltimore: 1065-1066 pp. 1986. [ Links ]
37. ORBERG, P. K.; SANDINE, W. E. Survey of antimicrobial resistance in lactic streptococci. Appl. Environ. Microbiol. 49: 538-542. 1985. [ Links ]
38. PENG, J. S.; TSAI, W. C.; CHOU, C. C. Inactivation and removal of Bacillus cereus by sanitizer and detergent. Int. J. Food Microbiol. 77: 8-11. 2002. [ Links ]
39. PETROVA, N.; DIMITROV, N. Effect of alkaline combined reagent on the activity of bacterial starters. Food Res. Int. 26: 327-332. 1993. [ Links ]
40. PIARD, J.; DESMAZEAUD, M. Inhibiting factors produced by lactic acid bacteria 1. Oxygen metabolites and catabolism end-products. Le Lait. 72: 525-541. 1991. [ Links ]
41. POINTURIER, H. Les Fromages. En: Laits et produits laitires. Vache, brebis et chevre.Vol. 2. Technique et Documentation (Lavoisier), Paris. 95-268 pp. 1985. [ Links ]
42. REINHEIMER, J.; QUIBERONI, A.; TAILLIEZ, P.; BINETTI, G.; SUAREZ, B. The lactic acid microflora of natural whey starters used in Argentina for hard cheese production. Int. Dairy J. 6: 869-879. 1996. [ Links ]
43. RYSER, E. Public health concerns. In: Applied Dairy Microbiology. Marcel Dekker, Inc., New York. 263-404 pp. 1998. [ Links ]
44. SERRANO, C.; GARCÍA, C. Identificación de la flora fúngica presente en el queso Manchego artesanal con denominación de origen. Alimentación, Equipos y Tecnología. Edit. Alción. S.A. Madrid, España. Julio-Agosto: 67-69 pp. 1997. [ Links ]
45. SOMERS, E. B.; WONG, A. C. Efficacy of two cleaning and sanitizing combinations on Listeria monocytogenes biofilms formed at low temperature on a variety of materials in the presence of ready-to-eat meat residue. J. Food Product. 10: 2218-2229. 2004. [ Links ]
46. TAMINE, A. ROBINSON, R. Yogurt: Science and technology. Pergamon Press, Oxford: 421 pp. 1985. [ Links ]












 uBio
uBio