Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ingeniería Universidad Central de Venezuela
versión impresa ISSN 0798-4065
Rev. Fac. Ing. UCV v.22 n.3 Caracas 2007
Evaluación de la capacidad de adsorción de desechos agroindustriales para la remoción de ácido acético
ROSÁNGELES HERNÁNDEZ 1, PEDRO CARRASCO 1, ROSA MUJICA 2, MARÍA ESPÍNOLA 1
1 Departamento de Ingeniería Química, Universidad Nacional Experimental Politécnica «Antonio José de Sucre», Vice-Rectorado Barquisimeto, Apdo. 3001 Barquisimeto, Venezuela. cananehp@yahoo.es; pedro_carrasco@cantv.net; mariaadelaida73@gmail.com
2 Escuela de Ingeniería Agroindustrial, Universidad Centro-Occidental «Lisandro Alvarado», Apdo. 3001 Barquisimeto, Venezuela. rmujica@ucla.edu.ve
RESUMEN
Se evaluó la utilización de desechos agroindustriales: la cascarilla de arroz y el pergamino de café como adsorbentes alternativos para la remoción de ácido acético. Para ello se realizó su caracterización determinando la cantidad de humedad y cenizas, índice de acidez, y el análisis a través de espectrometría de absorción en el infrarrojo y la difracción de rayos X. Se construyeron las isotermas de adsorción de ácido acético sobre cascarilla de arroz, pergamino de café y carbón activado como referencia, mediante el contacto en agitación de soluciones de ácido acético a diferentes concentraciones, realizándose 8 experiencias en las cuales se variaron los factores: tamaño de partícula de los adsorbentes, tratamiento de los materiales adsorbentes, tiempo de agitación y rango de concentraciones de ácido acético. Las isotermas de cascarilla de arroz y pergamino de café se ajustaron al modelo de Langmuir a un rango de concentración de ácido acético entre 0,03 y 0,25 mol/L, 1 hora de agitación y lavados del adsorbente con agua a 70 ºC y bicarbonato de sodio al 5% a 70 ºC. Se concluyó que la adsorción del ácido acético sobre cascarilla de arroz y pergamino de café ocurre mediante la formación de enlaces de hidrógeno entre el ácido y la superficie de estosmateriales gracias a la presencia de celulosa, hemicelulosa, lignina y óxido de silicio en su estructura, alcanzando entre un 40% y 70% de los rendimientos obtenidos con el carbón activado.
Palabras clave: Adsorción, Ácido Acético, Carbón Activado, Cascarilla de Arroz, Pergamino de Café.
Evaluation of the adsorption capacity of agro-industrial waste for acetic acid removal
ABSTRACT
The use of agro-industrial waste was evaluated; namely, rice husks and coffee parchment as alternative adsorbents for acetic acid removal. To this end, material characterization was carried out determining the amount of humidity and ashes, the acid value, and by absorption spectrometry analysis in infrared and x-ray diffraction. Isotherms of acetic acid adsorption on rice husks, coffee parchment and activated charcoal as a reference, were constructed, by means of contact in agitation of different concentrations of solutions of acetic acid. Eight experiments were made in which the factors were varied:adsorbents particle size, adsorbent materials treatment, agitation time and rank of acetic acid concentrations. The rice husk isotherms and coffee parchment adjusted to the Langmuir model within a rank of acetic acid concentration between 0.03 and 0.25 mol/L, 1 hour of agitation and water and 5% sodium bicarbonate washings at 70 ºC. It was concluded that adsorption of acetic acid on rice husks and coffee parchment occurs through hydrogen bond formation between the acid and the surface of these materials because of the presence of cellulose, hemicelluloses, lignin and silicon oxide in its structure, reaching between 40% and 70% of the yields obtained with the activated charcoal.
Keywords: Adsorption, Acetic Acid, Activated Charcoal, Rice Husks, Coffee Parchment.
Recibido: noviembre de 2006 Revisado: agosto de 2007
INTRODUCCIÓN
La contaminación puede definirse como la introducción de agentes biológicos, químicos o físicos a un medio al que no pertenecen. Desde hace siglos el hombre ha contribuido ala contaminación del ambiente, pero ha sido a partir de laRevolución Industrial, con la industrialización y el desarrolloeconómico, que este problema se ha ido expandiendo hasta alcanzar niveles alarmantes.
Bajo este contexto es importante resaltar que a medida queaumenta el poder del hombre sobre la naturaleza y aparecen nuevas necesidades, como consecuencia de la vida ensociedad, el medio ambiente se deteriora cada vez más. Mientras que los demás seres vivos se adaptan al medio ambiente para sobrevivir, el hombre lo adapta y modifica según sus necesidades. Esta modificación denominadacontaminación ambiental corresponde a uno de los problemas más complejos que afectan al medio ambiente físico, biológico y social.
En este orden de consideraciones, se tienen entre las principales fuentes de contaminación del medio ambiente las emanaciones en forma de humo o polvo y los efluentes industriales, causando un efecto negativo en el ciclo biológico del hombre y los animales.
En los procesos industriales, especialmente en la industria química, textil, de tratamiento de pieles y otras, se generan efluentes líquidos con una gran cantidad de agentes contaminantes entre los cuales se encuentran los ácidos orgánicos. Uno de estos ácidos es el ácido acético, queademás de provenir directamente de los efluentes de las industrias, también es generado a partir de compuestos orgánicos que reaccionan en el ambiente por procesos de oxidación.
La contaminación del medio ambiente constituye uno de los problemas más críticos en el mundo y es por ello que ha surgido la necesidad de la toma de conciencia y la búsqueda de alternativas para su solución. Una posible solución es elaprovechamiento de los desechos agroindustriales, los cuales por sí mismos constituyen un problema de contaminación debido a sus altos índices de producción y a su poco uso. Estos materiales tienen un gran potencial que no es explotado adecuadamente.
Por lo que se propone la separación de este ácido mediante el proceso de adsorción, un fenómeno físico – químico muyimportante a nivel industrial y de laboratorio debido a su participación en muchos procesos, tales como catálisis heterogénea, tratamiento de aguas, purificación de gases, entre otros. Este proceso ocurre cuando las moléculas de un fluido son atraídas por los átomos de un sólido poroso yadheridas a su superficie, haciendo posible la separaciónde los componentes de soluciones gaseosas o líquidas. Elcompuesto adsorbido se denomina adsorbato, y el sólido es llamado adsorbente (Tubert y Talanquer, 1997).
En este sentido, esta investigación tuvo como objetivo laevaluación de la capacidad de adsorción de desechosagroindustriales, como la cascarilla de arroz y el pergaminode café, para la remoción de contaminantes en corrienteslíquidas, la cual ofrece alternativas sencillas y económicaspara coadyuvar en la solución de algunos de los problemas de contaminación.
MÉTODOS
Caracterización de las muestras de cascarilla de arroz y pergamino de café
Humedad
Se determinó secando las muestras en la estufa a 130 ºC hasta obtener un peso constante. Este método está estandarizado para determinar el contenido de humedad en cereales, leguminosas y sus subproductos en la Norma COVENIN 1553-80.
Contenido de Cenizas
Para el análisis de contenido de cenizas, una cantidad conocida de sólidos secos fueron calentados en una mufla a 550 ºC hasta obtener cenizas de un color gris claro o hasta peso constante. El peso de las cenizas remanentes,expresadas en función de la cantidad inicial del sólido, es el contenido de cenizas de los sólidos. Este método está estandarizado para la determinación de cenizas por incineración de cereales y leguminosas en la Norma COVENIN 1783-81.
Índice de acidez
Es la cantidad de ácido presente en las muestras, expresadas como porcentaje de ácido sulfúrico, y se obtiene mediantetitulación directa con NaOH luego de dejar en contacto 5 gde muestra con 25mL de etanol al 90% durante 24 horas. Este método está estandarizado para la determinación deacidez en productos de cereales y leguminosas en la Norma COVENIN 1787-81.
Área Superficial Específica
Es el área de la superficie total de una unidad de masa de partículas, se encuentra relacionada con el diámetropromedio volumen – superficie (Ds)1 y se determinó a través de un análisis por tamizado aplicando el método diferencial (McCabe, Smith y Harriott, 2003).
Determinación del espectro infrarrojo de las muestras de cascarilla de arroz y pergamino de café
Se determinó midiendo la transmitancia en el infrarrojo de una pastilla de 0,3 mm de espesor elaborada con la muestra y KBr en una proporción aproximada de 1 mg por cada 100 mg de KBr, analizando los picos significativos del espectro (Skoog et al. 2001).
Obtención de las isotermas de adsorción sobre carbón activado, cascarilla de arroz y pergamino de café
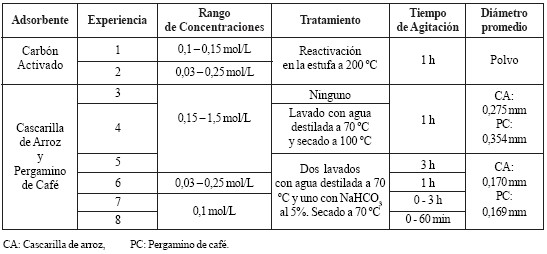
En la tabla 1 se resumen las condiciones experimentales de cada experiencia realizada para la construcción de lasisotermas de adsorción en sistema líquido – sólido utilizando como adsorbato ácido acético y adsorbente carbón activado, cascarilla de arroz y pergamino de café.
Tabla 1. Condiciones Experimentales. CA: Cascarilla de arroz, PC: Pergamino de café.
RESULTADOS Y DISCUSIÓN
Caracterización de las muestras de cascarilla de arroz y pergamino de café
Humedad y Cenizas
En la tabla 2 se presentan los resultados obtenidos de las pruebas realizadas de contenido de humedad y cenizas a las muestras de cascarilla de arroz y pergamino de café, conforme con las normas COVENIN 1553-80 y 1783-81, respectivamente.
Tabla 2. Humedad y Cenizas de Cascarilla de Arroz y Pergamino de Café.
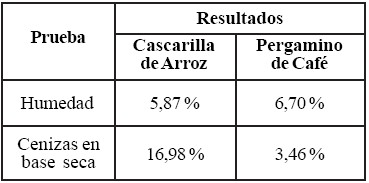
En este sentido, los resultados de las pruebas de caracterización indican que el pergamino de café posee unamayor cantidad de humedad con respecto a la cascarilla dearroz, mientras que esta última presenta un porcentaje de cenizas mucho mayor que el pergamino de café. La cantidad de cenizas se corresponde a la cantidad de materia inorgánicapresente en la composición de los materiales, por lo que elpergamino de café contiene menor cantidad de materia inorgánica que la cascarilla de arroz.
Tabla 3. Índices de Acidez de la Cascarilla de Arroz y el Pergamino de Café.
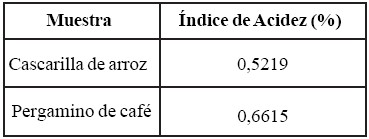
Índice de acidez
Es la cantidad de ácido presente en las muestras, expresadas como porcentaje de ácido sulfúrico, y se obtiene mediante titulación directa con NaOH luego de dejar en contacto 5 g de muestra con 25mL de etanol al 90% durante 24 horas. Este método está estandarizado para la determinación de acidez en productos de cereales y leguminosas en la Norma COVENIN 1787-81.
Área Superficial Especifica
A fines de determinar el área superficial por unidad de masa (Aw) de la cascarilla de arroz y el pergamino de café, se aproximó el factor de esfericidad (ϕs) de estos materiales al de la arena de roca (0,65) reportada por Mc Cabe et al. 2003. Por medio de la aplicación del método diferencial, se determinó que el diámetro volumen superficie (Ds) de lamuestra de cascarilla de arroz es 0,275 mm y su área superficialpor unidad de masa (Aw) es de 360 cm2/g. De maneraanáloga, para el pergamino de café se determinó que su diámetro volumen superficie (Ds) es 0,354 mm, y su área superficial por unidad de masa (Aw) es de 249 cm2/g.
Debido a la influencia del tamaño de las partículas sobre la capacidad de adsorción de estos materiales, en las experiencias 5, 6, 7 y 8 se trabajó con partículas cuyosdiámetros promedio oscilan entre 0,125 y 0,25 mm, con lafinalidad de aumentar el área específica por unidad másica de adsorbente y favorecer la adsorción. De igual manera, serealizó el análisis diferencial para las fracciones de cascarillade arroz y pergamino de café mencionadas anteriormente(aquéllas con diámetros comprendidos entre 0,125 y 0,25mm). Se determinó que para la cascarilla de arroz el diámetrovolumen superficie (Ds) es 0,170 mm y el área superficial porunidad de masa (Aw) es de 590 cm2/g, y para el pergaminode café el diámetro volumen superficie (Ds) es 0,169 mm y el área superficial por unidad de masa (Aw) es de 541 cm2/g. De esta forma, al comparar las muestras de cascarilla de arroz y pergamino de café, se observa que las muestrasseleccionadas de menor diámetro (entre 0,125 y 0,25 mm), presentan mayor área superficial que las de diámetro mayor (muestras completas).
Espectrometría de Infrarrojo
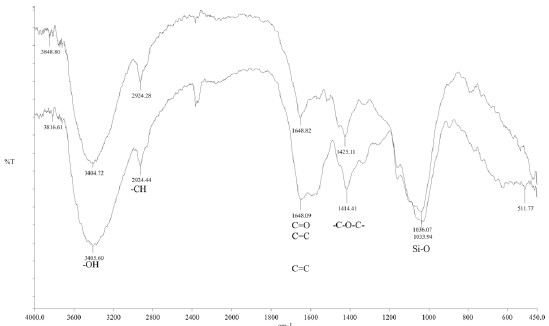
Como se puede observar en el espectro (figura 1), la presencia de grupos OH en la estructura de ambas muestras se confirma por una banda amplia entre 3000 y 3750 cm-1, así como la aparición de bandas alrededor de 2920 cm-1correspondientes a enlaces C-H, entre 1550 – 1650 cm-1 aenlaces C=O, y alrededor de 1420 cm-1 se evidencia lapresencia del grupo -C-O-C-, característicos de materiales orgánicos como celulosa, hemicelulosa y lignina. Cabedestacar que la presencia de grupos carbonilos enmascara la señal correspondiente al grupo C=C debido a su amplitud. Por otra parte, se aprecia la presencia de las bandas del enlace Si-O alrededor de 1035 cm-1, tanto para la cascarilla de arroz como para el pergamino de café. La semejanza entre ambos espectros, aporta información acerca de la similitudde los materiales estudiados, como era de esperarse por ser tejidos de origen vegetal que tienen la función de rodear algrano (bien sea de arroz o de café) a efectos de protegerlo, con lo que en consecuencia sus composiciones resultan similares.
Figura 1. Espectro infrarrojo de cascarilla de arroz (arriba) y pergamino de café (abajo).
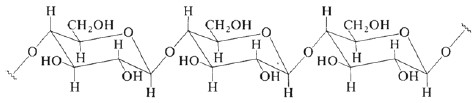
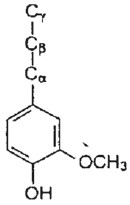
La adsorción de ácido acético sobre la superficie de estos materiales de origen vegetal toma lugar debido a la formación de enlaces de hidrógeno entre el ácido y los grupos activos(capaces de formar enlaces o puentes de hidrógeno, como –OH y los oxígenos) presentes en la estructura de la ligninay la celulosa (figuras 2 y 3), así como con el oxígeno presenteen el óxido de silicio (sílice), que se encuentra en mayorcantidad en la cascarilla de arroz, pero está presente en ambos materiales.
Figura 2. Estructura química de la celulosa.
Figura 3. Estructura química de la lignina.
Difracción de Rayos X
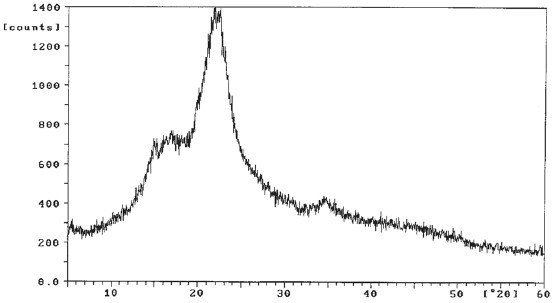
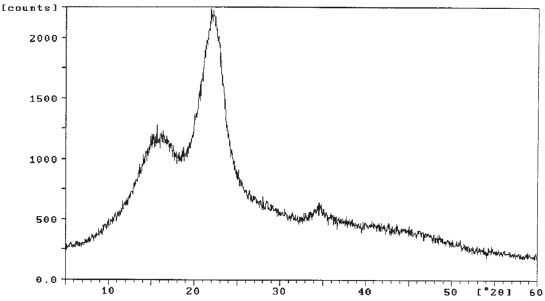
Los difractogramas obtenidos (figuras 4 y 5), indican la presencia de sílica amorfa o vítrea en ambas muestras, evidenciada por la aparición de un patrón entre los ángulos de difracción 15º y 35º. Esta falta de cristalinidad lleva a que el sólido posea una energía de activación baja, puesto que las estructuras amorfas se exhiben debido a la presencia de distribuciones y tamaños de poros no uniformes y/o intersticios poco homogéneos. Las estructuras desordenadas poseen niveles energéticos elevados y poco estables que se encuentran cercanos a los valores de las energías de activación, lo que caracteriza a las sustancias reactivas.
Figura 4. Espectro de difracción de rayos x de cascarilla de arroz para valores de 2è entre 5º y 60º.
Figura 5. Espectro de difracción de rayos x de pergamino de café para valores de 2è entre 5º y 60º.
Obtención de las isotermas de adsorción de ácido acético sobre carbón activado
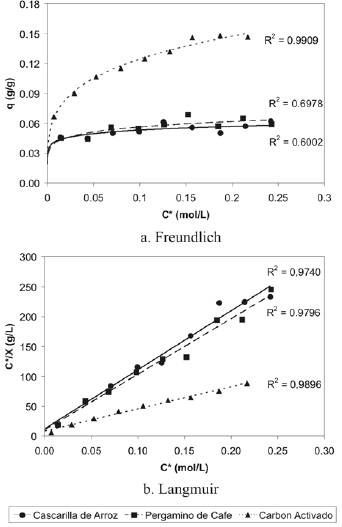
Antes de realizar las isotermas de adsorción de ácido acético sobre las muestras de cascarilla de arroz y pergamino de café es necesario disponer de un patrón de comparación,representado en este caso por el carbón activado y así lograruna evaluación efectiva del proceso investigado. En la figura 6 se muestran las isotermas de Langmuir y de Freundlich construidas para el carbón activado, a partir de los resultados obtenidos con las condiciones experimentales mencionadas anteriormente para la experiencia 1 (tabla 1).
Figura 6. Isotermas de adsorción de ácido acético sobre carbón activado (experiencia 1).
En la tabla 4 se muestran los valores de los parámetros de adsorción de Freundlich y de Langmuir calculados a partir de la construcción de las isotermas de adsorción ajustadas a estos modelos. Al observar las isotermas obtenidas, se visualiza que en esta primera experiencia la isoterma de Freundlich reportó resultados con una correlación de 0,9587 y una tendencia asintótica horizontal, característica de una isoterma tipo I. Este tipo de isoterma es mostrada por sólidos microporosos. Por otro lado, la isoterma de Langmuir linealizada presenta una correlación de 0,9728 que sugiere que el comportamiento de este sistema se ajusta mejor al modelo descrito por Langmuir, lo que se verifica al elaborar el gráfico de los parámetros linealizados de su ecuación (figura 6.b).
Tabla 4. Parámetros de Adsorción.
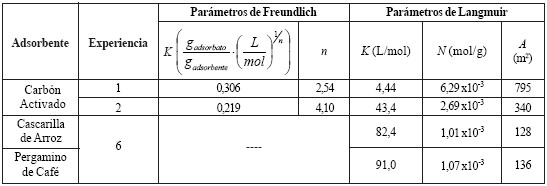
Cabe destacar que los parámetros K para el modelo de Freundlich y el modelo de Langmuir (tabla 4) no son iguales,en vista de que para la ecuación de Langmuir el valor de K representa la constante de equilibrio para el sistema adsortivo estudiado, mientras que en la ecuación de Freundlich tanto K como n son constantes empíricas que permiten modelar y ajustar los datos a una ecuación del tipo q = K ⋅C1/ n (ecuación de Freundlich).
Se efectuó una segunda experiencia con el carbón activado para realizar una comparación más efectiva de las isotermas de adsorción sobre los otros adsorbentes, ya que su estudio abarca dos rangos de concentraciones: medias y bajas. Esta vez se trabajó con concentraciones más bajas que en la experiencia 1, como se muestra en la tabla 1. En las figuras 7.a y 7.b se puede observar un comportamiento asintótico característico de la isoterma tipo I, más pronunciado. Los coeficientes de correlación son mayores de 0.98, ajustándosemucho más a la linealización de los parámetros de Langmuir gracias al rango menor de concentraciones, recordando que sus planteamientos son válidos para bajas concentraciones.
Figura 7. Isotermas de adsorción de ácido acético sobre carbón activado (experiencia 2).
El área superficial del adsorbente calculada en esta experiencia resultó menor que en la experiencia anterior (tabla 4), a pesar de haber utilizado el mismo carbón activado. Esto se explica tomando en cuenta que al aumentar la concentración, una vez que se ha formado la monocapa comienza a ocurrir el fenómeno de adsorción en multicapas,y los cálculos del área superficial a partir de la ecuación deLangmuir se realizan suponiendo que se ha adsorbido una monocapa completa. Es decir, si está ocurriendo la adsorciónpor multicapas entonces el área calculada va a ser mayor que la real debido a que se toma en cuenta el área ocupada por las moléculas adsorbidas en multicapas.
Obtención de las isotermas de adsorción de ácido acético sobre cascarilla de arroz y pergamino de café
Como se describió con anterioridad, se realizaron cuatro experiencias de adsorción de ácido acético sobre cascarillade arroz y pergamino de café, realizando variaciones en lascondiciones de cada experiencia en búsqueda de observarel comportamiento del proceso de adsorción frente a estoscambios, analizar sus causas y determinar las condicionesóptimas para utilizar dichos sólidos como adsorbentes. En la experiencia 3, se realizó el proceso de adsorción sobremuestras de cascarilla de arroz y pergamino de café sin ningún tratamiento previo, con un diámetro promedio de partículas de 0,275 y 0,354 mm para la cascarilla de arroz y el pergamino de café, respectivamente, como lo arrojó la caracterización.
Los resultados de la mencionada experiencia tanto para la cascarilla de arroz como para el pergamino de café arrojaronuna tendencia en la que las concentraciones finales fueron mayores luego del proceso de adsorción que las iniciales. En razón de lo anterior se realizó un análisis de acidez al blanco del experimento, el cual reportó cierta concentración de ácido (0,001 mol/L, expresado como concentración de H+), en concordancia con los resultados obtenidos para la determinación del índice de acidez de los materiales adsorbentes de origen vegetal (tabla 3), realizada en la fase de caracterización. Esto puede explicarse en función de que las muestras no adsorbieron el ácido acético, sino que desprendieron una pequeña cantidad de un compuesto de carácter ácido a las soluciones, incrementando así la concentración final de la mayoría de las muestras respecto a sus valores iniciales.
En vista de estos resultados se procedió a someter las muestras a un lavado con agua destilada a 70 ºC antes de pasar a la siguiente fase de la metodología experimental, en la cual se construyeron isotermas de adsorción para los mismos materiales. En los resultados de esta fase, al igualque en la experiencia previa, no se aprecia adsorción del ácido acético por parte de los desechos, en consecuenciano se pueden identificar las isotermas obtenidas según las clasificaciones de Brunauer (1945) y de IUPAC (1985), por lo que no se pueden reportar parámetros de adsorción.
En vista de que la presencia de una sustancia ácida en la cascarilla de arroz y el pergamino de café impide la adsorción de ácido acético sobre la superficie de los mismos, se puede estimar que esta sustancia ocupa los lugares disponibles en estos materiales; y además esta acidez no se elimina por completo mediante el lavado con agua destilada (lo que indica que se trata de un ácido orgánico) por lo que se realizaron tres lavados: dos con agua destilada a 70 ºC para eliminar las impurezas hidrosolubles y un lavado consolución de NaHCO3 al 5% para eliminar la acidez presente en las muestras. Como consecuencia de este lavado se logró eliminar el carácter ácido de las muestras, de esta forma se incrementó el potencial de la cascarilla de arroz y el pergamino de café para adsorber ácido acético u otro compuesto orgánico de características similares.
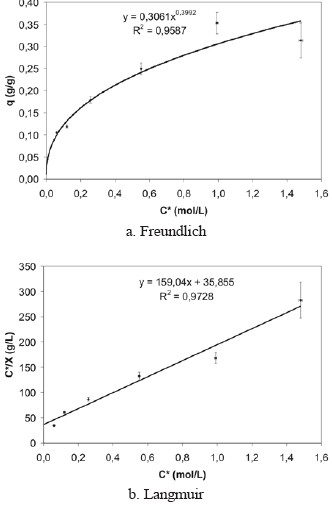
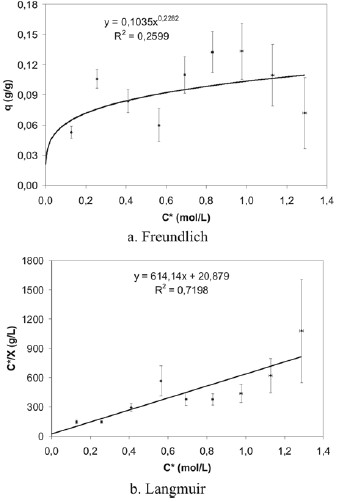
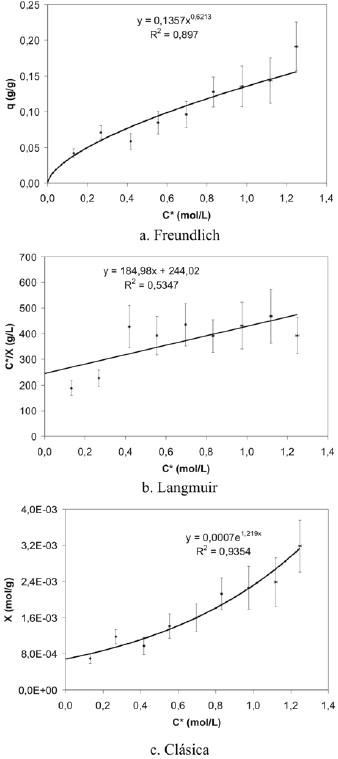
Seguidamente, en la quinta fase de la investigación, se trabajó con partículas que poseen un diámetro promedio de0,170 y 0,169 mm, para la cascarilla de arroz y el pergaminode café, respectivamente y se prolongó el tiempo de contactoa 3 horas, como se puede observar en la tabla 1. Debido a labaja correlación obtenida para la isoterma de Freundlich de0,2599 (figura 8), a estas condiciones experimentales sededuce que el sistema no se ajusta al modelo de Freundlich. Por otro lado, al hacer el ajuste de los datos a los parámetrosde Langmuir, se obtuvo una isoterma con una correlaciónde 0,7198. Esta correlación también se consideró baja, por locual el sistema estudiado en esta experiencia tampoco se ajusta al modelo de Langmuir.
Figura 8. Isotermas de adsorción de ácido acético sobre cascarilla de arroz (experiencia 5)
En la figura 9 se representan las isotermas de adsorción de ácido acético sobre pergamino de café que se construyeronal trabajar en un rango de concentraciones de 0,15 mol/L a 1,3 mol/L. Esta isoterma no obedece al modelo de Langmuir, ya que su correlación es de 0,5347. Sin embargo la forma de la isoterma clásica en la figura 9.a posee una correlación de0,9354 y se ajusta según la clasificación de Brunauer (1945) y de IUPAC (1985) a las isotermas de tipo III que están asociadas a fenómenos de adsorción multicapas y se han observado en sólidos poco o no porosos.
Figura 9. Isotermas de adsorción de ácido acético sobre pergamino de café (experiencia 5).
El proceso de adsorción en multicapas descrito por la isoterma tipo III en el gráfico 6.a se puede explicar en términos de que inicialmente las moléculas de ácido acético seadsorben en el material orgánico en cantidad suficiente para completar la monocapa, sin embargo dado el grupo funcional que posee el ácido acético ![]() esta molécula tiene la capacidad de formar dos puentes de hidrógeno de forma simultánea, por lo que es factible que interaccionesadicionales se generen entre las moléculas adsorbidas y las que posteriormente van a dar paso a la formación de multicapas. Esto ocurre frecuentemente cuando las concentraciones del adsorbato son altas, ya que aconcentraciones bajas no hay suficientes moléculas paraque se formen multicapas, y sólo se observa la formación de monocapas tal como en el proceso descrito por Langmuir.
esta molécula tiene la capacidad de formar dos puentes de hidrógeno de forma simultánea, por lo que es factible que interaccionesadicionales se generen entre las moléculas adsorbidas y las que posteriormente van a dar paso a la formación de multicapas. Esto ocurre frecuentemente cuando las concentraciones del adsorbato son altas, ya que aconcentraciones bajas no hay suficientes moléculas paraque se formen multicapas, y sólo se observa la formación de monocapas tal como en el proceso descrito por Langmuir.
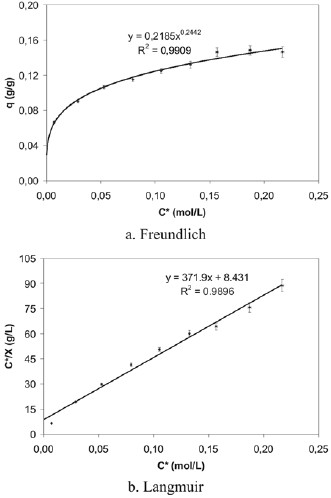
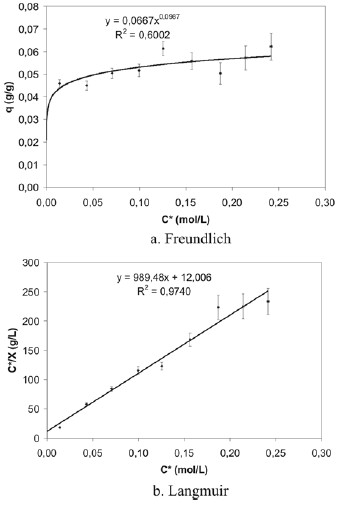
En la sexta experiencia se procedió a estudiar la adsorción en un rango menor de concentraciones y un tiempo deagitación de una hora, buscando ajustar mejor los resultadosa un modelo de adsorción que permitiera determinar los valores reales de los parámetros de adsorción. Con los datos obtenidos experimentalmente para la cascarilla de arroz, seconstruyeron las isotermas de adsorción conforme a losmodelos de Freundlich y de Langmuir, las cuales sepresentan en la figura 10. En la tabla 4 se muestran los valores de los parámetros de adsorción de Langmuir calculados a partir de la construcción de la isoterma de adsorción ajustada a este modelo.
Figura 10. Isotermas de adsorción de ácido acético sobre cascarilla de arroz (experiencia 6).
En este rango menor de concentraciones, se observa que la adsorción del ácido acético mostró isotermas tipo I, conuna asíntota horizontal bastante pronunciada pero que sealeja del modelo descrito por Freundlich al reportar unacorrelación baja (0,6002). Estas isotermas tipo I soncaracterísticas del modelo de Langmuir, ya que se aprecia la formación de una monocapa de adsorbato sobre la superficie del adsorbente, lo que se corrobora al analizar la isoterma de Langmuir linealizada, cuya correlación es de 0,9740.
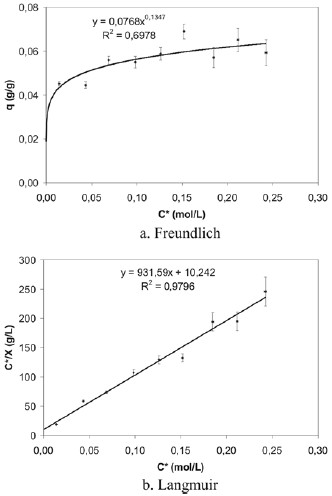
Análogamente, se construyeron las isotermas de Langmuir y Freundlich para el pergamino de café, mostradas en la figura 11. En la tabla 4 se muestran los valores de losparámetros de adsorción de Langmuir calculados a partir de la construcción de la isoterma de adsorción ajustada a este modelo. Al comparar las isotermas de Freundlich y de Langmuir para el pergamino de café, a las condiciones de tiempo de agitación y rango de concentración de ácido acético de esta experiencia, el proceso de adsorción se ajusta al modelo descrito por Langmuir, hecho evidenciado por la correlación obtenida en la isoterma de Freundlich (0,6978) frente a la correlación de la isoterma de Langmuir (0,9796). A partir de los resultados de esta experiencia para la cascarilla de arroz y el pergamino de café, se tiene, respectivamente, un factor de correlación de 0,9740 y 0,9796, muy buenos indicios que los parámetros de adsorción A, N y K son verdaderos.
Figura 11. Isotermas de adsorción de ácido acético sobre pergamino de café (experiencia 6).
Para realizar una comparación del área superficial de la cascarilla de arroz y pergamino de café determinada a través del análisis por tamizado y del área superficial obtenida a partir de las isotermas de Langmuir, en la tabla 5 se muestran los resultados de ambos métodos. Es notable que las áreassuperficiales de estos materiales determinadas a través de la ecuación de Langmuir son mucho mayores que las áreassuperficiales determinadas mediante el análisis por tamizado, y en consecuencia se puede deducir que tanto la cascarilla de arroz como el pergamino de café son materiales porosos, puesto que la diferencia es demasiado significativa como para adjudicarla a la aproximación del factor de esfericidad al de arena de roca.
Tabla 5. Área Superficial de Cascarilla de Arroz y Pergamino de Café.
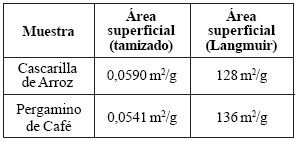
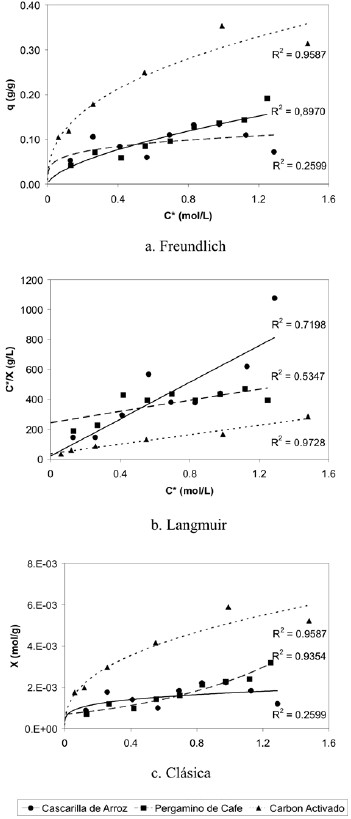
Las figuras 12 y 13 muestran las isotermas de adsorción de los tres adsorbentes estudiados en los dos rangos deconcentración con los que se trabajó. En el estudio de rangode concentración 0,1 mol/L a 1,5 mol/L, se logra observar que la mayor adsorción está dada por el carbón activado, seguida por los materiales de origen vegetal, el primero representado por una isoterma tipo I y estos últimos por una isoterma tipo I (cascarilla de arroz) y tipo III (pergaminode café), marcándose la diferencia entre el comportamiento descrito por Langmuir (isoterma tipo I), una adsorción enmonocapas que generalmente es observada en adsorbentesmicroporosos tales como el carbón vegetal y la sílica gel; yel de la isoterma tipo III, relativamente rara, observada ensólidos poco o no porosos y sugiere la formación de multicapas, sin embargo es importante recordar que a estas condiciones los adsorbentes de origen vegetal arrojaron factores de correlación bajos.
Figura 12. Isotermas de adsorción de ácido acético sobre: carbón activado, cascarilla de arroz y pergamino de café (experiencias 1 y 5).
Figura 13. Isotermas de adsorción de ácido acético sobre: carbón activado, cascarilla de arroz y pergamino de café (experiencias 2 y 6).
El estudio a concentraciones comprendidas entre 0,03 mol/ L y 0,25 mol/L marca un poco más la diferencia entre lascapacidades adsortivas del carbón activado y los otros sólidos, sin embargo en este caso tanto la cascarilla de arroz como el pergamino de café exhiben isotermas tipo Icaracterizadas por una aproximación monótona hasta unacapacidad de adsorción límite donde ocurre la formación deuna monocapa completa. Al analizar los datos de la ecuación de Langmuir linealizada (figuras 12.b y 13.b), se observa que su comportamiento se ajusta mejor a la ecuación de una recta en el rango de concentraciones de ácido acético 0,03 – 0,25 mol/L (figura 13.b), en comparación con las regresiones lineales de los datos obtenidos en el rango 0,15 – 1,5 mol/L.
Debido a su estructura altamente organizada, el carbón tiene una energía de activación más alta, y las moléculas de adsorbato se adsorben sobre la superficie del mismo de una manera ordenada. Esto, aunado a la gran área superficial que exhibe el carbón activado, deriva en una mayor capacidadde adsorción del carbón en comparación con la cascarilla dearroz y el pergamino de café. Por otro lado, las capacidadesde adsorción de la cascarilla de arroz y del pergamino de café son muy similares, como era de esperarse ya que, a través de la caracterización de ambos materiales se determinó que tanto la cascarilla de arroz como el pergamino de café poseen una composición química muy parecida constituidaprincipalmente por celulosa, lignina y hemicelulosa, hecho evidenciado a través del espectro infrarrojo realizado a estos desechos de origen vegetal, que arrojó la presencia de los mismos grupos funcionales en ambas muestras, la mayoría de los cuales son responsables de la formación de enlaces o puentes de hidrógeno entre la superficie de estos adsorbentes y el ácido acético, permitiendo así la adsorción.
Además de esto, a través de la difracción de rayos X efectuada a la cascarilla de arroz y al pergamino de café sereveló que ambos materiales contienen sílica amorfa en sucomposición, que también es capaz de establecer puentesde hidrógeno con el adsorbato estudiado. Por ende, lo antesexpuesto explica la similitud de las capacidades de adsorción de la cascarilla de arroz y el pergamino de café.
En la tabla 4 se presentan los valores de los parámetros de Langmuir obtenidos para el carbón activado, la cascarilla dearroz y el pergamino de café en el rango de concentración 0,03 – 0,25 mol/L y una hora de agitación. Los valores de laconstante de adsorción K para la cascarilla de arroz y el pergamino de café son superiores al valor de K para el carbónactivado, indicando que existe una mayor afinidad entre el adsorbato y la superficie de estos adsorbentes de origen vegetal que entre el adsorbato y el carbón activado,en vista que el valor de K señala la relación entre la constantede adsorción y la constante de desorción, lo que se puedeexplicar en términos de que a diferencia del carbón activado,tanto la cascarilla de arroz como el pergamino de café son capaces de formar enlaces o puentes de hidrógeno con el ácido acético.
Por otro lado, el área superficial del carbón activado resultó mayor que el área superficial del pergamino de café y lacascarilla de arroz, y en consecuencia el número de molesnecesarios para la formación de una monocapa de adsorbato( N ) sobre el carbón activado es superior en comparación ala cascarilla de arroz. El hecho de que el área superficial delcarbón activado sea mayor que el área de los adsorbentesde origen vegetal estudiados es lógico, ya que el carbónactivado es un adsorbente que se caracteriza por sermicroporoso y poseer una gran área superficial, sin embargocabe destacar que la cascarilla de arroz y el pergamino de café poseen un área superficial relativamente grande.
Determinación del tiempo de equilibrio de adsorción para la cascarilla de arroz y el pergamino de café
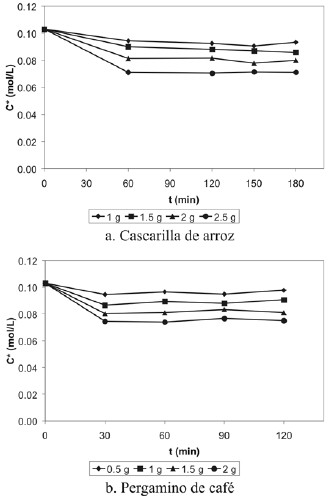
Por último, se realizó un estudio (experiencia 7) para determinar el tiempo en que el proceso de adsorción sobrela cascarilla de arroz y el pergamino alcanza el equilibrio, yasí validar el tiempo de agitación utilizado en las experiencias anteriores para los adsorbentes de origen vegetal. La figura 14 muestra la concentración de ácido acético en función del tiempo para diferentes cantidades de los sólidos adsorbentes de origen vegetal. Tanto para la cascarilla de arroz como para el pergamino de café se observa la mayordisminución en la concentración de ácido acético durante laprimera hora de contacto en agitación, permaneciendo prácticamente constante de ahí en adelante.
Figura 14. Concentración de ácido acético en función del tiempo para diferentes cantidades de adsorbente a una misma concentración inicial.
Con esto se validó el tiempo de agitación de una hora escogido para la realización de las experiencias que, aunadoal rango de concentraciones iniciales de ácido acético entre0,03 – 0,25 mol/L, son las condiciones de operaciónadecuadas para el proceso de adsorción de ácido acéticosobre cascarilla de arroz y pergamino de café. Esto se vereflejado en las isotermas de adsorción elaboradas a estascondiciones de operación, donde el ajuste a la ecuaciónde Langmuir linealizada presentó correlaciones considerablemente altas.
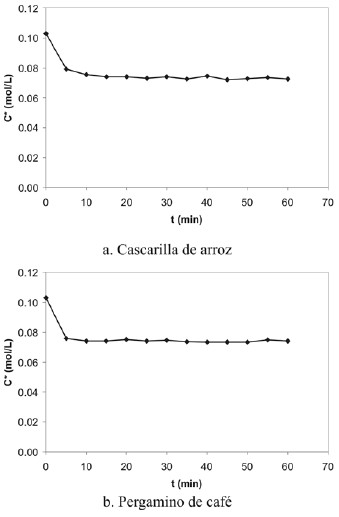
En vista de que el proceso de adsorción alcanza el equilibrio en la primera hora, se realizó el estudio del mismo en esaprimera hora de adsorción a intervalos más cortos (cada 5minutos, experiencia 8) y con una cantidad de adsorbentede 2,5 g, esto con la finalidad de obtener un mayor rango dedisminución de la concentración de ácido acético (figura14), lo que facilita la apreciación de la disminución de la concentración. En la figura 15 se presentan los resultadosde esta experiencia. Como se observa en las figuras 15.a y 15.b, la mayor disminución de la concentración para ambas muestras se observa en los primeros 5 minutos de contacto entre las fases, alcanzando el equilibrio en los primeros 15 minutos para la cascarilla de arroz y a los 10 minutos para el pergamino de café. El hecho de que estos adsorbentes permitan que se alcance el equilibrio de adsorción rápidamente, posibilita su uso en torres de adsorción ya que estos equipos se caracterizan por un tiempo espacial bajo en comparación con equipos de adsorción por tanques de agitación tipo batch.
Figura 15. Concentración de ácido acético en función del tiempo a intervalos de 5 min a una misma concentración inicial y 2 g de adsorbente.
Luego de lo antes expuesto, es necesario destacar que apesar de que el carbón activado arroja los mayores índicesde adsorción de ácido acético, no se descarta la utilización de la cascarilla de arroz y el pergamino de café como adsorbentes de este ácido y en un futuro estudio deadsorción de otros compuestos orgánicos sobre estos sólidos. Esto debido principalmente a la procedencia de los materiales, gracias a que son materiales de desechos de origen vegetal producidos a escala industrial y que en algunos casos representan riesgo de contaminación por lasgigantescas cantidades en que se producen.
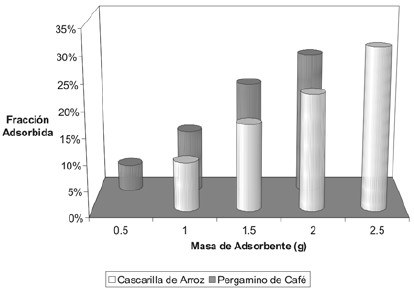
Se puede concluir que será mucho más económico emplear una mayor cantidad de los adsorbentes de origen vegetalen lugar de carbón activado, con lo que se puedenincrementar sus rendimientos, ya que este estudio permitiódeterminar que al aumentar la cantidad de adsorbente deorigen vegetal, se incrementa la cantidad de ácido acético adsorbida, tal y como se muestra en la figura 16, en la que seobserva que las cantidades adsorbidas sobre la cascarillade arroz y el pergamino de café aumentan proporcionalmente al aumentar la masa de adsorbente.
Figura 16. Porcentaje de adsorción para diferentes cantidades de adsorbente a una misma concentración inicial.
Luego de determinar que el comportamiento de los sistemas adsorbente – adsorbato estudiados se comportan conforme al modelo de Langmuir, estos pueden ser descritos ycontrolados a través del conocimiento de las constantes dedicho modelo (K y N) y sus variables (C y X), para cadasistema. Para un sistema discontinuo tipo tanque de agitación, el modelo representativo se obtiene al sustituir la ecuación 2 en la ecuación 1 (modelo de Langmuir):
donde:
Cf : Concentración (mol/L) final de CH3COOH.
Ci : Concentración (mol/L) inicial de CH3COOH.
M : Masa (g) de adsorbato.
Vs : Volumen (L) de solución.
K : Constante del equilibrio de adsorción (mol/L).
N : numero de moles que forman la monocapa de adsorbente (mol/g).
Resultando una ecuación de dos constantes propias de cada sistema ( K y N ), y cuatro variables involucradas en elproceso de adsorción (Cf , Ci , M, Vs). Basta conocer las constantes y fijar tres variables a conveniencia paradeterminar la concentración final o inicial, la masa de adsorbato o el volumen de la solución a tratar.
Dicho modelo se validó con los datos obtenidos en las experiencias 2 y 6 bajo las cuales fue deducido, al sustituir los valores de K y N en la ecuación 3 para cada sistema ydeterminando la concentración final (en el equilibrio:Cf), para cada punto de la isoterma, obteniendo la diferencia entre el valor real y el calculado en forma de un errorporcentual. Este error muestra la desviación del valorcalculado con respecto al determinado en las experiencias (valor real), y en consecuencia indica lo alejado que seencuentra el modelo matemático del proceso de adsorción estudiado.
Como resultado, se obtuvieron errores promedio de 1,7%, 2,1% y 3,1% para los sistemas de carbón activado, pergamino de café y cascarilla de arroz, respectivamente, recordandoque el primero arrojó mejores correlaciones en el modelo de Langmuir frente a la cascarilla de arroz y el pergamino de café, por lo que el error cometido al calcular las variables aplicando el modelo matemático es menor en comparación a los otros adsorbentes estudiados. Sin embargo, este modelo representa el proceso con un margen de error lo suficientemente bajo, por ello es posible considerar sus resultados confiables para su aplicación.
CONCLUSIONES
Se logró la caracterización de las muestras de cascarilla de arroz y pergamino de café obteniéndose como resultados: diámetro promedio de 0,275 mm para la cascarilla de arroz y 0,354 mm para el pergamino de café; humedad: 5,87% y 6,70% respectivamente, porcentaje de cenizas: 16,98% en lacascarilla de arroz y 3,460% en el pergamino de café, índice de acidez: 0,52% para cascarilla de arroz y 0,66% para pergamino de café. El análisis por espectrometría deabsorción en el infrarrojo arrojó la presencia de grupos funcionales -OH, -CH, C=O y -C-O-C- característicos de los materiales orgánicos como celulosa, hemicelulosa y lignina, así como del grupo SiO. Por medio del análisis de difracción de rayos X se determinó la existencia de sílica no cristalizada tanto en la cascarilla de arroz como en el pergamino de café.
Se elaboraron las isotermas de adsorción para el carbón activado como referencia, determinando que el proceso de adsorción se ajusta tanto al modelo descrito por Langmuir como al modelo de Freundlich. La ecuación de la isoterma de Freundlich obtenida es q = 0,219 ⋅C0,224 , con un factor de correlación de 0,9909; y la ecuación de la isoterma de Langmuir es ![]() , con un factor de correlación de 0,9896.
, con un factor de correlación de 0,9896.
Se construyeron las isotermas de adsorción para la cascarilla de arroz, determinando que el proceso de adsorción se ajusta al modelo de Langmuir bajo las siguientes condiciones:rango de concentración de ácido acético entre 0,03 y 0,25mol/L, tiempo de contacto de 1 hora y dos lavados deladsorbente con agua destilada a 70 ºC y uno con bicarbonatode sodio al 5%. La ecuación que describe el proceso de adsorción de ácido acético sobre cascarilla de arroz es ![]() , con un factor de correlación de 0,974.
, con un factor de correlación de 0,974.
Se elaboraron las isotermas de adsorción para el pergamino de café, determinando que el proceso de adsorción se ajustaal modelo de Langmuir bajo las siguientes condiciones:rango de concentración de ácido acético entre 0,03 y 0,25 mol/L, tiempo de contacto de 1 hora y dos lavados del adsorbente con agua destilada a 70 ºC y uno con bicarbonatode sodio al 5%. La ecuación que describe el proceso de adsorción de ácido acético sobre pergamino de café es ![]() , con un factor de correlación de 0,9796.
, con un factor de correlación de 0,9796.
Por medio de la ecuación de la isoterma de Langmuir elaborada para cada adsorbente se calculó el área superficialde los mismos, obteniendo que el carbón activado posee unárea superficial de 340 m2/g, la cascarilla de arroz tiene unárea superficial de 128 m2/g y el pergamino de café tiene un área superficial de 136 m2/g. Por otro lado, se calculó el áreasuperficial por unidad de masa (Aw) para la cascarilla de arroz y el pergamino de café por medio del análisis por tamizado, determinando que el área superficial de estos materiales es 0,0590 m2/g y 0,0541 cm2/g, respectivamente.
Al comparar los porcentajes de adsorción de ácido acético de la cascarilla de arroz y el pergamino de café con respectoal carbón activado, se determinó que en un rango deconcentraciones de ácido acético entre 0,03 y 0,25 mol/L, lacascarilla de arroz y el pergamino de café adsorben entre el40% y el 70% de la cantidad de ácido acético adsorbida por el carbón activado, por lo que es factible aumentar la masa de cascarilla de arroz y pergamino de café en un proceso deadsorción de ácido acético para alcanzar los mismos rendimientos que el carbón activado.
Se realizó un estudio de adsorción de ácido acético a través del tiempo para la cascarilla de arroz y el pergamino de café, en el cual se evidenció que se alcanza el equilibrio deadsorción a los 15 minutos de contacto en agitación entre eladsorbato y el adsorbente, razón por la cual es factible su utilización en torres de adsorción.
Se elaboró un modelo matemático representativo de los sistemas estudiados, el cual fue validado con los datos experimentales, obteniendo errores relativos de 1,7%, 2,1%y 3,1% para el carbón activado, pergamino de café y cascarilla de arroz, respectivamente.
AGRADECIMIENTOS
Queremos expresar nuestro mas sincero agradecimiento a todas las instituciones que con su colaboración hicieron posible la realización de este proyecto: Universidad Nacional Experimental Politécnica «Antonio José de Sucre» Vice-Rectorado de Barquisimeto; Universidad Centro Occidental«Lisandro Alvarado»; Universidad Pedagógica Experimental Libertador, Instituto Pedagógico de Barquisimeto «Luis Beltrán Prieto Figueroa»; INTEVEP.
REFERENCIAS
1. ENCICLOPEDIA MICROSOFT ENCARTA. (2001). Contaminación del Agua. [ Links ]
2. FREITES, L., MELEÁN, E. Y MUJICA, R. (2005). Análisis Comparativo de las Capacidades Adsortivas del Pergamino de Café y de la Sílica Gel. Informe de Pasantía (No Publicado). Decanato Agronomía, Universidad Centroccidental «Lisandro Alvarado» (UCLA). Barquisimeto, Venezuela. [ Links ]
3. GACETA OFICIAL DE LA REPÚBLICA DE VENEZUELA. (1995). Nº 5.021. Caracas, Venezuela. [ Links ]
4. GARCÍA, M. Y PÉREZ, A. (2002). Evaluación de La Reacción de Desnitrificación de Aguas Sintéticas en un Reactor Biológico Provisto de un Lecho de Contacto de Celulosa. Trabajo Especial de Grado (No Publicado). Departamentode Ingeniería Química, Universidad Nacional Experimental Politécnica «Antonio José de Sucre» (UNEXPO). Barquisimeto, Venezuela. [ Links ]
5. HINES, A. Y MADDOX, R. (1987). Transferencia de masa. Fundamentos y aplicaciones. Editorial Prentice-Hall Hispanoamericana. Naucalpan de Juárez, México. p 600. [ Links ]
6. LEVINE, I. (2004). Fisicoquímica. Volumen 1. Quinta Edición. Editorial Mc Graw-Hill. Madrid, España, p 432. [ Links ]
7. MCCABE, W., SMITH, J. Y HARRIOTT, P. (2003). Operaciones Unitarias en Ingeniería Química. Sexta Edición. Editorial McGraw-Hill. México, D. F., México, p 1112. [ Links ]
8. MUJICA, R. (2005). Caracterización de Adsorbentes Comerciales y de Material Recuperable de Origen Vegetal. Trabajo de Ascenso (No Publicado). Universidad Centroccidental «Lisandro Alvarado» (UCLA). Barquisimeto, Venezuela. [ Links ]
9. NOLL, K., GOUNARIS, V. Y HOU, W. (1992). Adsorption Technology for Air and Water Pollution Control. Lewis Publishers, INC. Chelsea, U. S. A. p 347. [ Links ]
10. NORMAS COVENIN. (1980). Productos de cereales y leguminosas. Determinación de humedad. Nº 1553-80. Venezuela [ Links ]
11. NORMAS COVENIN. (1981). Productos de cereales y leguminosas. Determinación de cenizas. Nº 1783-81. Venezuela. [ Links ]
12. NORMAS COVENIN. (1981). Productos de cereales y leguminosas. Índice de acidez. Nº 1787-81. Venezuela. [ Links ]
13. PEREIRA, C. Y SALDIVIA, L. (2002). Caracterización de la Adsorción del Flujo de Nutrientes en los Sustratos de un Cultivo Hidropónico. Trabajo Especial de Grado (No Publicado). Departamento de Ingeniería Química, Universidad Nacional Experimental Politécnica «Antonio José de Sucre» (UNEXPO). Barquisimeto, Venezuela. [ Links ]
14. SKOOG, D., HOLLER, J. Y NIEMAN, T. (2001). Principios de Análisis Instrumental. Quinta Edición. Editorial McGraw- Hill. Madrid, España, p 1056. [ Links ]
15. TUBERT, I. Y TALANQUER, V. (1997). Sobre Adsorción. Disponible en: www.fquim.unam.mx/sitio/edquim/84/8- saber.pdf. Consultado en: Diciembre, 2004. [ Links ]
16. WADE, L. (1993). Química Orgánica. Segunda Edición. Editorial Pearson Educación. Naucalpan de Juárez, México, p 1312.