Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. v.29 n.3 Maracay sep. 2011
Elementos traza detectados por plasma inductivamente acoplado (ICP) en pepitonas, Arca zebra (Mollusca, Arcidae) de dos localidades costeras del estado Sucre, Venezuela
Vilma Lanza1,2*, Ildemaro Martínez3, Osmicar Vallenilla1, Julia Márquez1, Arquímedes González1, Jesús Gamboa1,2 y José Alió1
1 Instituto Nacional de Investigaciones Agrícolas (INIA), Sucre-Nueva Esparta, Apartado Postal 236, Cumaná Edo. Sucre 6101. Venezuela. * Correo electrónico: vlanza@inia.gob.ve.
2 Universidad de Oriente (UDO), Instituto Oceanográfico de Venezuela, Postgrado de Ciencias Marinas. Apartado Postal 245. Cumaná Edo. Sucre 6101, Venezuela.
3 Instituto Universitario de Tecnología Cumaná, extensión Cariaco. Venezuela.
RESUMEN
Los metales pesados juegan un papel importante en la dinámica de los procesos químicos y ambientales en las zonas costeras. Estos provienen de aportes naturales y antropogénicos y pueden ser bioacumulados en organismos acuáticos, en los que se encuentran como elementos traza, y tienen potenciales efectos tóxicos a quienes los consuman, principalmente al hombre como último eslabón de la cadena alimenticia. La gravedad del daño depende del grado y el tiempo de exposición a dichos elementos. Se determinó la concentración de metales pesados (Mg, Cu, Mn, Mo, Ni y Fe) por Plasma Inductivamente Acoplado (ICP) en la pepitona, Arca zebra (Mollusca, Bivalvia, Arcidae), provenientes de las inmediaciones de Caimancito y Chacopata (municipio Cruz Salmerón Acosta, estado Sucre, Venezuela). En Caimancito, las mayores concentraciones de casi todos los metales se detectaron en septiembre, a excepción del Mg que fue observada en febrero. En Chacopata, las concentraciones más elevadas se observaron en el mes de octubre (Mg, Mn y Ni), septiembre (Cu), diciembre (Fe) y en enero (Mo). No se encontraron diferencias significativas entre las localidades, mientras que existen diferencias significativas entre meses. Al momento no existen normas o regulaciones venezolanas que establezcan límites máximos de concentración de los metales analizados en moluscos bivalvos procesados o frescos, que permitan establecer comparaciones con los resultados obtenidos. Sin embargo, en base a normas internacionales, las concentraciones medidas de metales pesados en pepitonas no rebasaron los límites permitidos para consumo humano.
Palabras clave: Chacopata, Caimancito, metales pesados, Bivalvia.
Trace elements detected by Inductively Coupled Plasma (ICP) in Turkey wing, Arca zebra (Mollusca, Arcidae) from two coastal locations of Sucre State, Venezuela.
ABSTRACT
Heavy metals play an important role in the dynamics of chemical and environmental processes in the coastal zones. They originate from natural and anthropogenic sources and can be bioaccumulated in aquatic organisms, where they are found as trace elements, and have potential toxic effects to those who consume them, mainly to humans as the last link in the food chain. The severity of damage depends on the degree and time of exposure to these elements. The concentration of heavy metals (Mg, Cu, Mn, Mo, Ni and Fe) was estimated by Inductivelly Coupled Plasma (ICP) in the Turkey wing, Arca zebra (Mollusca, Bivalvia, Arcidae), from the vicinity to Caimancito and Chacopata (Municipality Cruz Salmerón Acosta, Sucre state, Venezuela). In Caimancito, higher concentrations of almost all metals were detected in September, except for Mg which was registered in February. In Chacopata, the highest concentrations were observed in October (Mg, Mn and Ni), September (Cu), December (Fe) and January (Mo). No significant differences were found between localities, while there were significant differences among months. At present there are not Venezuelan norms or regulations establishing the maximum concentration limits for the analyzed heavy metals in fresh or processed bivalve mollusks, which may enable comparisons with the obtained results. However, based upon international norms, the measured concentrations of heavy metals in Turkey wing apparently do not represent a threat for human consumption.
Keywords: Chacopata, Caimancito, heavy metals, Bivalvia.
Recibido: 28/03/11 Aceptado: 03/08/11
INTRODUCCIÓN
Los metales pesados son elementos con densidad específica superior a 5,0 g/cm3. Pueden ser relativamente tóxicos a bajas concentraciones, como ocurre con el plomo, cadmio, cobre, zinc y mercurio (Elith y Garwood, 2001). Suelen ser contaminantes persistentes ya que no son eliminados por procesos de cocción o incineración y tampoco son biodegradables (Abd-Allah y Abdallah, 2006).
Por consiguiente, a bajas concentraciones pueden producir efectos subletales en los organismos acuáticos, tales como cambios histológicos o morfológicos en los tejidos, o alteraciones fisiológicas, como la supresión de crecimiento y el desarrollo, cambios de motilidad, en el comportamiento y la reproducción (Widianarko et al., 2000). La exposición crónica en dosis subletales, permite la bioacumulación y amplificación de la concentración de estos elementos a través de la cadena alimentaria hasta llegar inadvertidamente al hombre y afectar su salud (França et al., 2005); también pueden causar efectos carcinogénicos, reproductivos y en el desarrollo (WHO/UNEP, 1997).
Sim embargo, la toxicidad de los metales pesados sobre los organismos depende también de otros factores, como la presencia de otros metales con los que pueden ocasionar sinergismo (Accornero et al., 2004) o antagonismo, de las características físicoquímicas del agua (temperatura, pH, potencial redox, oxígeno disuelto, salinidad, luz, materia orgánica), así como también de factores biológicos, como la especie afectada, sexo, tamaño, edad, actividad física, estadio de vida y habitat (WHO/UNEP, 1997).
Cada metal tiene una forma química específica (especiación), las cuales son determinadas por su solubilidad en agua de mar, por su biodisponibilidad y bioaccesibilidad; consecuentemente por su capacidad para incorporarse dentro de los sistemas biológicos (WHO/UNEP, 1997; Semple et al., 2004; Vignati et al., 2005). En tal sentido, los bivalvos se adaptarán a los hábitats pudiendo exhibir cantidades variables de contenidos elementales en sus tejidos (Yusof et al., 2004; Acosta y Lodeiros, 2004; Bervoets et al., 2005; Liehr et al., 2005; Galgani et al
., 2005; Aubry y Elliott, 2006; Ng y Wang, 2007).En la actualidad, Venezuela es el país pesquero más importante del área del Caribe Atlántico con una producción anual de aproximadamente 400.000 toneladas. Los abundantes recursos pesqueros de la región nororiental del país contribuyen con más del 70% de la producción nacional, el subsector marítimo artesanal contribuye con un 86,1% de las capturas totales, en su mayor proporción constituidas por el recurso pepitona, lo cual representa desembarques del orden de las 70.963 toneladas anuales, equivalente al 35,88% de las principales especies de la pesca marítimas (INSOPESCA, 2008).
La costa del estado Sucre al norte de las penínsulas de Paria y Araya, es particularmente rica en fauna marina, producto de una amplia plataforma con fuertes y frecuentes vientos, los cuales proven la materia prima (plancton) para una abundante fuente de alimentación a organismos
filtradores, con aguas de temperaturas superiores a los 25ºC, alta y constante salinidad y baja turbidez del agua. El aporte de nutrientes a la columna de agua deriva mayormente de surgencias desde el fondo marino, inducidas por el viento.En tal sentido, se desea determinar la concentración de metales pesados por la técnica de plasma inductivamente acoplado (ICP) en la pepitona
Arca zebra en las poblaciones Caimancito y Chacopata, al norte del estado Sucre, dichas localidades son zonas de gran actividad extractiva de moluscos bivalvos en Venezuela, pues de los bancos localizados en sus cercanías proviene aproximadamente, el 97% de la pepitona que se consume en Venezuela (Arias et al., 2002), discutir sobre las probables fuentes antropogénicas y naturales de los resultados obtenidos, y de algún modo sentar un precedente sobre el nivel de riesgo del consumo de este molusco por contaminación con metales pesados, con base a normas sanitarias internacionales en otros moluscos bivalvos de consumo.MATERIALES Y MÉTODOS
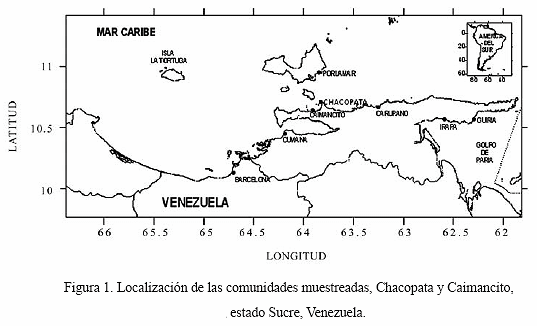
Se recogieron de 8 a 14 muestras mensuales de pepitona entre septiembre 2007 hasta abril 2008, en las poblaciones de Chacopata (63° 49 W 10° 40 N) y Caimancito (63° 54 W, 10° 38 N) al norte de la península de Araya, estado Sucre, Venezuela (Figura 1). Las muestras provinieron de los arrastres de los pescadores artesanales en el banco de Chacopata, y fueron conservadas en hielo a una temperatura de 5ºC y trasladadas hasta el Instituto Nacional de Investigaciones Agrícolas en Cumaná para ser procesadas.
En el laboratorio se extrajo el tejido blando de las pepitonas (5 a 8 g) y se procesaron por duplicado de acuerdo al siguiente procedimiento. Se homogeneizaron; se secaron en una estufa marca Fisher Isotemp a 100°C por 24 h; se calentaron en una cocinilla por 2 h y posteriormente se incineraron a 550ºC en una mu
fla eléctrica marca Thermoline modelo 1400 durante 4 horas hasta obtener cenizas y se dejaron enfriar en un desecador.Se agregó 5 ml de ácido nítrico y 2,5 ml de ácido sulfúrico, ambos concentrados al 95 – 97%; se calentaron a 60ºC por 20 minutos, luego se dejaron enfriar; se les adicionaron 2,5 ml de ácido nítrico concentrado, y se calentaron a 150ºC. Seguidamente, se dejó enfriar y se agregó peróxido de hidrógeno de uso analítico al 35% para eliminar la materia orgánica remanente y concluir con la clari
ficación. El resultado de la digestión se filtró con papel filtro Whatman Nº 42, se enrazó con agua destilada – desionizada. La concentración de metales pesados en las muestras se evaluaron mediante espectrometría de emisión óptica de plasma inductivamente acoplado en un equipo Perkin Elmer, modelo Óptima 5300DV en el Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas de la Universidad de Oriente, Cumaná.Las concentraciones de Fe
, Cu, Mo, Mg, Mn y Ni se determinaron a longitudes de onda de 238.204, 327.393, 202.03, 285.213, 257.610 y 231.604 nm, respectivamente. La variación en la concentración de cada metal pesado entre localidades y durante el año fue evaluada mediante una prueba de análisis de varianza de dos vías. Los datos fueron transformados a logaritmo decimal cuando la varianzas fueron heterogéneas. Cuando no se pudo corregir la heterocedastocidad con la transformación de los datos, se usó una prueba no paramétrica de Kruskal-Wallis (Zar, 1998), y un análisis a posteriori (Conover, 1980).RESULTADOS Y DISCUSIÓN
No se encontraron diferencias signi
ficativas en la concentración de los metales pesados evaluados en la pulpa de pepitona proveniente de Chacopata y Caimancito (Cu, P= 0,9917; Fe, P= 0,7313; Mg, P= 0,4490; Mo, P= 0,2122; Mn, P= 0,3420; y Ni, P= 0,0547). Por este motivo, en los análisis de la variación de la concentración de metales pesados durante el año las muestras de ambas localidades fueron agrupadas.Debido a que la transformación logarítmica de los datos no alcanzó a homogeneizar las varianzas en la concentración de metales durante el año, para este análisis se utilizó la prueba no parámetrica de Kruskal-Wallis. Se registraron diferencias altamente signi
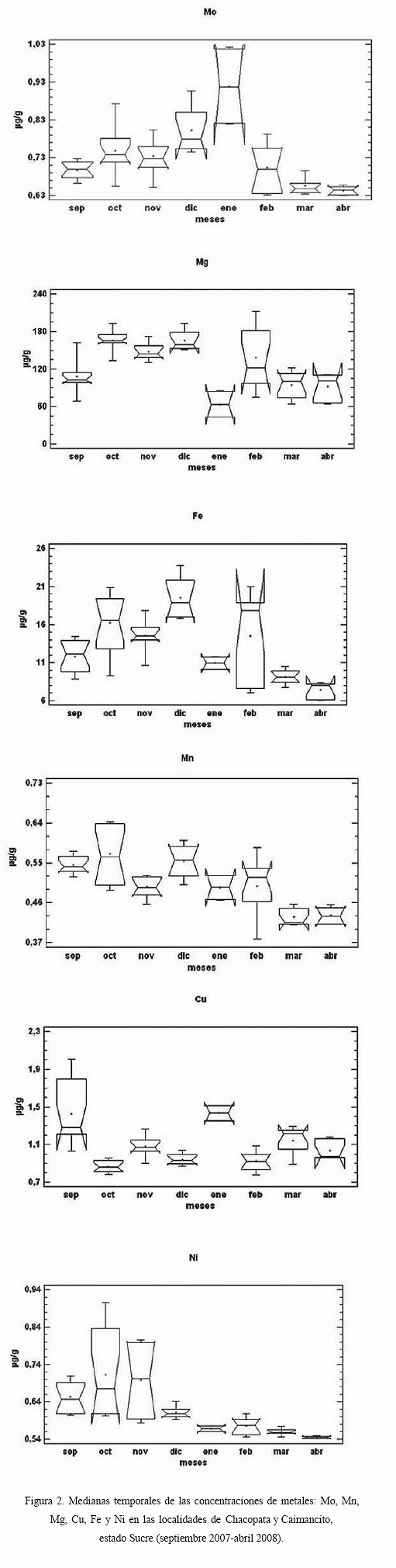
ficativas en la variación del contenido de los seis metales durante el año (Fe, P= 0,0007; Cu, P= 0,0075; Mo, P= 0,00009; Mg, P= 0,0027; Mn, P= 0,00005) y Ni, P= 0,0001). El análisis, a posteriori, reveló grupos de meses cuya concentración de metales pesados difería significativamente entre ellos. En este sentido, la concentración de Cu fue significativamente más elevada en enero y mayo en comparación con el resto del año (Figura 2).De manera similar, la concentración de Mg fue signifi
cativamente más elevada de febrero a abril y junio, en comparación con el resto del año. La concentración de Mn fue más elevada entre enero, febrero y abril, intermedia entre marzo, mayo y junio, observándose los niveles más bajos en julio y agosto. Por su parte, la concentración de Ni fue mayor de enero a marzo, intermedia en abril y mínima entre mayo y agosto. La concentración de Mo fue máxima entre abril y mayo, seguida de la concentración entre febrero y marzo, y entre enero y junio, con valores mínimos en julio y agosto.Finalmente, las variaciones en la concentración de Fe no pudieron ser diferenciadas a lo largo del año con la prueba
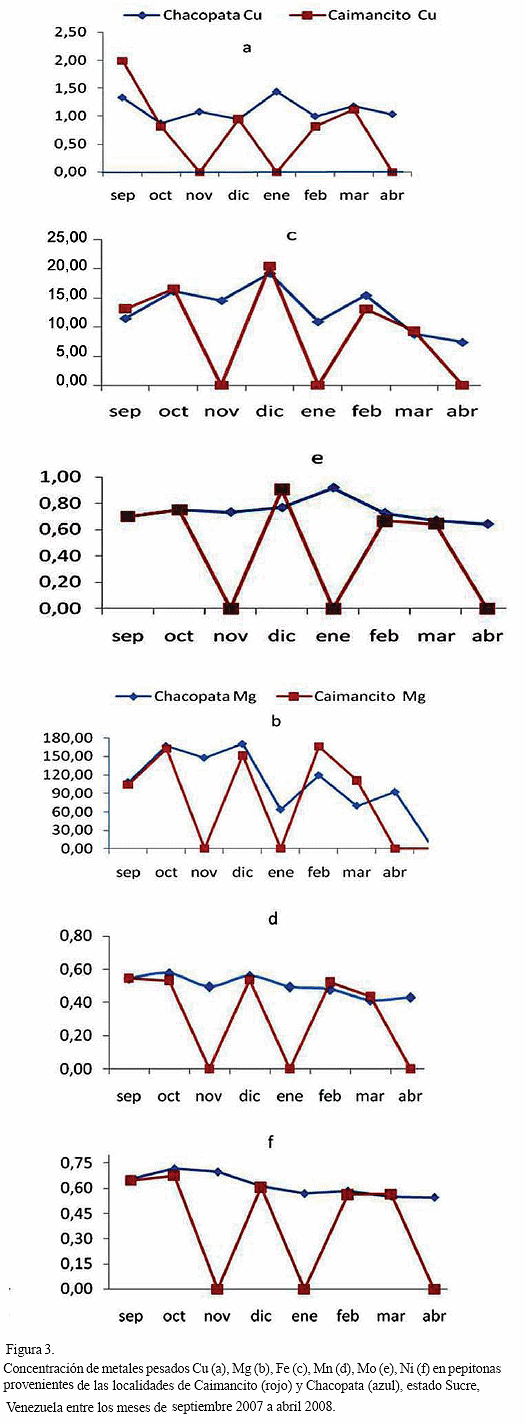
a posteriori. Sin embargo, los datos parecen indicar que la concentración máxima se registra en los meses de febrero a abril y junio, con niveles intermedios en enero y mayo, y las mínimas concentraciones en julio y agosto.Las concentraciones de cada metal en los organismos provenientes de ambas localidades presentaron discrepancias. En Chacopata, las concentraciones más elevadas se observaron en el mes de octubre para Mg (193,200
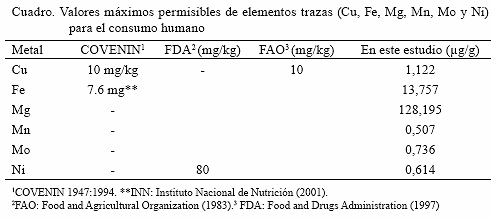
μg /g), Mn (0,642 μg /g) y Ni (0,905 μg /g), y para el Cu (1,801 μg /g), Fe (23,505 μg /g) y en Mo (1,018 μg /g) en los meses de septiembre, diciembre y enero, respectivamente. En Caimancito, las mayores concentraciones de casi todos los metales se detectaron en el mes de septiembre (Cu 1,987; Fe 18,625; Mn 0,582; Mo 0,699 Ni 0,577 μg /g) y en el mes de febrero (Mg 211,05 μg /g) (Figura 3), en tal sentido, los resultados obtenidos en el presente estudio para Cu, Fe y Ni están por debajo de los valores de referencia existentes (Cuadro); es de resaltar que las concentraciones obtenidas son bajas al compararlas con las obtenidas por Alfonso et al., (2005), quienes analizaron muestras de Tivela mactroides en diferentes localidades de las región centro-costera venezolana.Bajo este contexto Boada et al., (2007), recomiendan que al no existir normas venezolanas que establezcan los límites permitidos de algunos elementos traza es menester contribuir con dichos resultados como referencia para normas posteriores, pues en la actualidad sólo se reportan las normas COVENIN para determinación de plomo (COVENIN, 1978a), cadmio (COVENIN, 1978b) en alimentos, así como normas industriales para pepitonas en conserva (COVENIN, 1994), atún en conserva (COVENIN, 1995) y sardinas en conserva (COVENIN, 1998). Los valores de hierro registrados en el presente estudio son inferiores a los obtenidos por Yap et al., (2008) quienes observaron que las concentraciones de metales en los tejidos blandos del Argopecten granosa variaron desde 0.80-16.15 μ
g /g para el Ni, 455,91-1.125,5 μg /g para el Fe y de 5.41 a 7.39 μg /g para el Cu.El hierro es tal vez el más bioactivo de los metales traza en el océano, pero su química es muy compleja y difícil de entender (Hunter y Boyd, 1999; Bruland
et al., 1991; Wells et al., 1995). Se ha encontrado que el hierro particulado varía en la columna de agua, siendo menor a nivel de la superficie con respecto la profundidad; sin embargo, en algunas regiones se ha evidenciado en la superficie la influencia del hierro atmosférico en la termoclina (Bruland et al., 1991).Del mismo modo, se ha hecho evidente que el a
floramiento de las aguas subterráneas al igual que las aguas de surgencia son fuente importante de hierro (de Baar et al., 1995; Coale et al., 1996). Los trabajos de Johnson et al., (1997, 1999), señalaron la distribución de concentración de Fe disuelto en los océanos del mundo, argumentando que esta distribución es notablemente uniforme, con valores muy bajos (<0,2 nM) en las aguas superficiales y un promedio de 0,76 nM en aguas profundas, lo cual indica que en la superficie existe la captación de Fe seguida de la regeneración de aguas profundas así como oxidación de la materia orgánica biogénica (Keith-Hunter et al., 1999).Las fuentes de hierro pueden ser los e
fluentes industriales, drenajes ácidos de minas y fundiciones, entre otros (AMAP, 2001). No se evidenció la influencia de dichos factores en la zona de extracción de los moluscos. Las diferencias significativas encontradas, probablemente, están asociadas a variaciones en los tipos de sedimentos, la química del agua, el transporte y los procesos de sedimentación, la disponibilidad de materia orgánica, usos del suelo circundante y las fuentes de contaminación en las zonas de estudio, tomando en cuenta lo determinado por Elith y Garwood (2001), quienes demostraron que había una fuerte relación entre cada uno de estos factores y las concentraciones de metales pesados.Salazar (2011), encontró que la lluvia y la escorrentía eran fuentes importantes de metales pesados en la región costera de la península de Araya, registrando una fuerte correlación entre las variaciones de pluviosidad y las concentraciones de metales pesados (esenciales Fe, Cu, Zn y Mn, y no esenciales: Ni, Pb, Cd y Hg) en el isópodo
Tylos wegeneri y en el sedimento donde habitaba. Con respecto al cobre, Fuge et al., (1993), analizaron las concentraciones de este metal en el bivalvoPatella spp, obteniendo valores entre 1 a 10 mg/kg. Las concentraciones medias de cobre en el molusco Spisula subtruncata fueron de 2,5 mg/kg (Vyncke et al., 1999), valores inferiores a los límites legalmente autorizados en Noruega (10 mg/kg), en el Reino Unido y España donde se permite un máximo de contenido de cobre de 20 mg/kg (FAO, 1989).
La toxicidad o la deficiencia del cobre (Cu) en los animales depende de las interacciones con otros elementos traza como molibdeno (Mo) y zinc (Zn), sin los cuales el Cu no actúa en el metabolismo ni aumenta su efecto tóxico (Yap et al., 2003). En este sentido, Sunda y Lewis (1978), establecieron que la biodisponibilidad y toxicidad del cobre en las algas, camarones, cangrejos, moluscos bivalvos y peces, puede ser reducida tanto por la presencia de iones inorgánicos como por los quelantes orgánicos hallados en aguas naturales que forman complejos con el cobre o quelantes inorgánicos agregados al agua.
Con relación al cobre, su especiación es particularmente importante en las regiones costeras y de estuarios, ya que estas zonas generalmente tienen elevadas concentraciones del metal total disuelto por aportes antropogénicos (Buck y Bruland, 2005). Las concentraciones elevadas de cobre pueden ser afectadas por los efluentes industriales (textiles, productos eléctricos, pinturas antiincrustantes) y cañerías de cobre. Por su parte, el hierro y el manganeso son abundantes en la naturaleza, también coexisten en el metabolismo de los seres vivos, en general, no parecen ser tóxicos.
Ahora bien, la acumulación de estos metales en los organismos puede ser reflejo del contenido de dichos metales en los sedimentos, ya que los animales bentónicos con hábitos filtradores, al consumir detritus también ingieren material fino del sedimento, y por ello aumenta la concentracion de los metales en las diferentes partes del organismo (Elith y Garwood, 2001).
El manganeso es un elemento menor en el agua de mar; sin embargo, está presente en cantidades apreciables en los sedimentos marinos. Este se encuentra en más de un estado de oxidación además del carácter reactivo del metal en los ecosistemas acuáticos. Esto último afecta el equilibrio de los metales trazas en tres formas: a) adsorción de metales en la superficie de los óxidos de manganeso; b) coprecipitación de metales trazas y c) por las
reacciones redox. Muchas investigaciones asocian la presencia del manganeso con las concentraciones de otros elementos como es el caso de cobalto y níquel (Sadiq, 1992).Por otra parte, Didyk
et al., (1978), explicaron que en condiciones de sedimentación anóxica la concentraciones de Mo, Cu, Pb y U son altas y podrían relacionarse con la productividad biológica, la surgencia y con la dinámica de las masas de aguas (Legeleuk et al., 1994).En este sentido, Malcolm (1985) y Pedersen
et al., (1988), explicaron el comportamiento del Mo en sedimentos marinos y plantearon que los sedimentos con una línea redox poco profunda pero bien definida, acumulan Mo en la capa superficial oxidativa al formarse complejos con óxidos de Mn. Valdés y Ortlieb (2001), plantean que en los sedimentos más profundos, el óxido de Mn es reducido y el Mo es liberado en el agua intersticial, donde precipita nuevamente al formar un complejo insoluble con sulfuros.Además, manifestaron estos autores que en aguas anóxicas, el Cd y el Mo se inmovilizan en los sedimentos, mientras esta condición se mantenga, no son afectados por procesos postdepositacionales. Del mismo modo, plantearon que el principal mecanismo de acumulación de Cd y Mo en los sedimentos es la formación de compuestos insolubles en aguas adyacentes al piso marino, de manera que estos metales constituyen un indicio de las condiciones anóxicas/hipóxicas del ambiente de fondo.
Dentro de este contexto, la pobreza de oxígeno en el sedimento marino permite suponer que uno de los principales mecanismos de incorporación de Cd y Mo es la formación de compuestos insolubles en el agua del fondo. En general, el aumento de la concentración de Cd y Mo hacia el sedimento super
ficial indicaría una intensificación de la condición de mínima de oxígeno del ambiente de fondo (Valdés y Ortlieb, 2001).Hay varios factores (tales como la evolución de los organismos, la temperatura del ambiente y el tamaño del animal) que pueden interferir con las concentraciones de metales esenciales (Cu, Mn y Zn), pero no hay correlación entre sus concentraciones en los tejidos y los niveles ambientales en agua de mar o sedimentos.
Por el contrario, algunos metales (Cd, Pb y Hg) son acumulados por animales migratorios, de tal manera que los niveles de metales en el tejido no serían resultado de condiciones ambientales en los sitios de muestreo (Ju and Harvey, 2002); en este sentido, Lemus
et al., (2010), indicaron que la mayor concentración de cobre se observó en los etapa de desove del mejillón Perna viridis, de este modo afirmaron que los niveles de concentración de este elemento estuvo asociado a los tejidos somáticos más que al reproductivo; lo que les permitió inferir que la gran cantidad de masa gonadal liberada, disminuye, significativamente, la masa total del organismo y por ende los niveles de cobre son superiores en este período.Además, se evidenció que las hembras presentaron la mayor concentración de Cu, Cd y Ni. Por su parte, Yap
et al., (2008), sugieren que la concha del bivalvo Perna viridis puede actuar como un almacenador de mezclas de metales pesados, la cual es resistente a los mecanismos de desintoxicación de los tejidos blandos del organismo. Por otro lado, la presencia de metales depositados en la concha de los bivalvos podría explicarse por la incorporación mediante la sustitución de los iones de calcio o son asociados con la mezcla orgánica de la concha (Yap et al., 2003).Es así, como la contaminación en productos del mar, causada por la industrialización y otras actividades antropogénicas en las proximidades de la zonas costeras, siempre está asociada positivamente con niveles elevados de Cu, Zn, Ni y Cd en algunos organismos, como es el caso de Argopecten granosa, en los cuales las concentraciones de Ni pueden estar relacionadas a varias formas de aleación en maquinarias pesadas, tales como turbinas, así como su variedad de usos como catalizador industrial (Yap
et al., 2008).Asímismo, las propiedades redox y la química de coordinación del Fe pueden hacerlo tóxico cuando su homeostasis es perturbada, principalmente, como consecuencia de su capacidad para generar especies de oxígeno reactivo (Frank y Gerstmann, 2007). No obstante, Sobrino
et al., (2007), sugieren que algunas especies como Argopecten ventricosus son más sensibles a la acumulación de ciertos metales en comparación con otras especies de bivalvos (por ejemplo A. irradians, Mytillus edulis, Crassostrea virginica).En consecuencia, es importante analizar estos parámetros en términos de tamaño y edad, aún cuando a menudo se a
firma que el crecimiento podría ser el resultado de un sexo específico, de las diferencias geográficas, edad, la disponibilidad de alimento y habitat (WHO/UNEP, 1997; Leipe et al., 2005).Yap
et al., (2008), demostraron que las diferencias en la abundancia de metales entre los tejidos puede deberse a la depuración y la capacidad de unión de metales a los tejidos, ya que en los tejidos blandos, los metales están enlazados a metalotioneína, que juega un papel importante en la eliminación de los metales.En este sentido, Arias
et al., (2001), indicaron que las diferencias entre las concentraciones de metales presentes en los ejemplares de una misma familia pudieran ser discutidas en base a la posibilidad de efectos genotípicos en la misma especie y su relación con la contaminación de la zona, va a depender también de la capacidad de los diferentes organismos para biodegradar o eliminar los elementos tóxicos, además de los efectos nocivos sobre la salud humana a través de la cadena alimenticiaCONCLUSIONES
Hasta el momento, no existen normas sanitarias en Venezuela que establezcan los valores máximos permitidos para los metales estudiados en el presente trabajo, sin embargo, se pudo observar que los mismos se encuentran dentro límites permitidos por normas internacionales para otros moluscos bivalvos de consumo.
Se desconocen las fuentes de los metales pesados estudiados en las zonas de extracción de Chacopata y Caimancito. Para conocer el origen, en estudios futuros, será indispensable realizar estudios de sedimentos, agua y organismos en diferentes etapas de desarrollo con un seguimiento de las variables ambientales.
AGRADECIMIENTOS
Al Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas de la Universidad de Oriente (IIBCAUDO) por los análisis de metales en el ICP, y a Fundacite Sucre por el apoyo con reactivos. Este trabajo fue parcialmente fi
nanciado por el proyecto LOCTI 73/18/106/698.LITERATURA CITADA
1. Abd-Allah, M. and M. Abdallah. 2006. Effect of cooking on metal content of freshwater crayfish Procambarus clarkii. Chemistry and Ecology, 22 (4): 329–334. [ Links ]
2. Accornero, A., L. Manfra, A. Salluzzo and F. Modestia. 2004. Trace metal pollution in surface marine waters: nearshore concentrations along Apulia and Albania. Chemistry and Ecology, 20 (3) Suplemento 1: 195 – 203. [ Links ]
3. Acosta, V. y C. Lodeiros. 2004. Metales pesados en la almeja Tivela mactroides Born, 1778 (Bivalvia: Veneridae) en localidades costeras con diferentes grados de contaminación en Venezuela. Ciencias Marinas, 30(2): 323–333. [ Links ]
4. Alfonso, J., J. Azócar, J. LaBrecque, Z. Benzo, E. Marcano, C. Gómez and M. Quintal. 2005. Temporal and spatial variation of trace metals in clam Tivela mactroides along the Venezuelan coast. Marine Pollution Bulletin, 5: 1713–1744. [ Links ]
5. Arctic Monitoring and Assessment Programme (AMAP). 2001. Heavy metals. Fact sheet N°3. http://www.amap.no/?main=http%3A www.amap.no/mapsgraphics/go/searchRegion/regionid/global/page/22 [ Links ]
6. Arias, A., N. Gamboa and J. García. 2001. Vanadium levels in gonads of white mullet (Mugil curema) in the Cariaco Gulf, Venezuela. Zootecnia Tropical, 19 (2): 165-172. [ Links ]
7. Arias, A., R. Guzmán, R. Jiménez y R. Molinet. 2002. La pesquería de la pepitona, Arca zebra, en Chacopata, estado Sucre, Venezuela: Un análisis bioeconómico. Zootecnia Tropical, 20 (1): 49-67. [ Links ]
8. Aubry, A. and M. Elliott. 2006. The use of environmental integrative indicators to assess seabed disturbance in estuaries and coasts: Application to the Humber Estuary, UK. Marine Pollution Bulletin, 53:175–185. [ Links ]
9. Bervoets, L., J. Voets, R. Smolders and R. Blust. 2005. Metal accumulation and condition of transplanted zebra mussel (Dreissena polymorpha) in metal polluted rivers. Aquatic Ecosystem Health and Management, 8 (4): 451– 460. [ Links ]
10. Boada, M., M. Moreno, H. Gil, J. Marcano y J. Maza. 2007. Metales pesados (Cu2+, Cd2+, Pb2+, Zn2+) en músculo y cefalotórax de camarones silvestres Litopenaeus schmitii, Farfantepenaeus subtilis, F. notialis y F. brasiliensis de la región oriental de Venezuela. Rev. Cient. Fac. Cienc. Vet, Universidad del Zulia, 17 (2): 186-192. [ Links ]
11. Bruland, K., J. Donat and D. Hutchins. 1991. Interactive influences of bioactive trace metals on biological production in oceanic waters. Limnology and Oceanography, 36: 1555-1577. [ Links ]
12. Buck, K. and K. Bruland. 2005. Copper speciation in San Francisco Bay: a novel approach using multiple analytical windows. Marine Chemistry, 96: 185– 198. [ Links ]
13. Coale, K., S. Fitzwater, R. Gordon, K. Johnson and R. Barber. 1996. Control of community growth and export production by upwelled iron in the equatorial Pacific Ocean. Nature, 379: 621-624. [ Links ]
14. Comisión Venezolana de Normas Industriales (COVENIN). 1978a. Alimentos. Determinación de plomo. Norma 1335:78. Caracas, Venezuela (consultada 10 enero 2010). Disponible en: http://www.sencamer.gob.ve/sencamer/action/normas-find. [ Links ]
15. Comisión Venezolana de Normas Industriales (COVENIN). 1978b. Alimentos. Determinación de cadmio. Norma 1336:78. Caracas, Venezuela (consultada 10 enero 2010). Disponible en: http://www.sencamer.gob.ve/sencamer/action/normas-find. [ Links ]
16. Comisión Venezolana de Normas Industriales (COVENIN). 1994. Pepitonas en conserva. Norma 1947:1994. Caracas, Venezuela (consultada 10 enero 2010). Disponible en: http://www.sencamer.gob.ve/sencamer/action/normas-find. [ Links ]
17. Comisión Venezolana de Normas Industriales (COVENIN). 1995. Atún en conserva. Norma 1766:95. Caracas, Venezuela (consultada 10 enero 2010). Disponible en: http://www.sencamer.gob.ve/sencamer/action/normas-find. [ Links ]
18. Comisión Venezolana de Normas Industriales (COVENIN). 1998. Sardinas en conserva. Norma 1087:98. Caracas, Venezuela (consultada 10 enero 2010). Disponible en: http://www.sencamer.gob.ve/sencamer/action/normas-find. [ Links ]
19. Conover W.J. 1980. Practical nonparametric statistics. 2da.. Ed. John Wiley, NY. 493 p. [ Links ]
20. De Baar, H., J. de Joeng, D. Bakker, B. Loscher, C. Veth, U. Bathmann and V. Smetacek.1995. Importance of iron for plankton blooms and carbon dioxide drawdown in the Southern Ocean. Nature, 373: 412: 415. [ Links ]
21. Didyk, B., B. Simoneit, S. Brassell and G. Eglinton. 1978. Organic geochemical indicators of paleoenvironmental conditions of sedimentation. Nature, 272 (5660): 216-222. [ Links ]
22. Elith, M. and S. Garwood. 2001. Investigation into the levels of heavy metals in manly dam catchment. In: Freshwater Ecology Report of 2001, Department of Environmental Sciences, University of Technology, Sydney. [ Links ]
23. Food and Agriculture Organization of the United Nations (FAO). 1983. Compilation of legal limits for hazardous substance in fish and fishery products. FAO Fisheries circular Nº 764. 102 p. [ Links ]
24. Food and Agriculture Organization of the United Nations (FAO). 1989. Food safety regulations applied to by the major importing countries. FAO Fisheries Circular No. 825 (Rome: FAO), 107 p. [ Links ]
25. Food and Drugs Administration (FDA). 1997. HACCP Guidelines. US Department of Health and Human Services, Public Health Service, FDA. [ Links ]
26. França, S., C. Vinagre, I. Caçador and H. Cabral. 2005. Heavy metal concentrations in sediment, benthic invertebrates and fish in three salt marsh areas subjected to different pollution loads in the Tagus Estuary (Portugal). Marine Pollution Bulletin, 50: 993–1018. [ Links ]
27. Frank, H. and S. Gerstmann. 2007. Declining populations of freshwater pearl mussels (Margaritifera margaritifera
) are burdened with heavy metals and DDT/DDE. Ambio, 36 (7): 571-574. [ Links ]28. Fuge, R., T. Palmer, N. Pearce y W. Perkins. 1993. Minor and trace element chemistry of modern shells-a LA-ICP-MS study. Applied Geochemistry, 1: 111–116. [ Links ]
29. Galgani, F., J. Chiffoleau, P. Le-Gall, Y. Pichot, B. Andral and C. Martin. 2005. Deep-sea caging of the mussel
Mytilus galloprovincialis: Potential application in ecotoxicological studies. Chemistry and Ecology, 21(2): 133–141 [ Links ]30. García-Hernandez, J., L.Garc
ıa-Rico, M. Jara-Marini, R. Barraza-Guardado and A. Hudson. 2005. Concentrations of heavy metals in sediment and organisms during a harmful algal bloom (HAB) at Kun Kaak Bay, Sonora, Mexico. Marine Pollution Bulletin, 50: 733-739. [ Links ]31. Hunter, K. and P. Boyd. 1999. Biogeochemistry of trace metals in the ocean. Marine and. Freshwater Research, 50: 739-753. [ Links ]
32. Instituto Socialista de Pesca y Acuicultura (INSOPESCA). 2011. Estadística pesquera marinas de Venezuela 2010. Ministerio del Poder Popular para la Agricultura y Tierras, Instituto Socialista de la Pesca y la Acuiculktura, Caracas, Venezuela. [ Links ]
33. Instituto Nacional de Nutrición. 2001. Tabla de Composición de Alimentos para Uso Práctico. División de Investigaciones en Alimentos, Publicación No 54, Serie Cuadernos Azules, Caracas. Revisión 1999. 78 p. [ Links ]
34. Johnson, K., R. Gordon and K. Coale. 1997. What controls dissolved iron concentrations in the world ocean? Marine Chemistry, 57: 137-61. [ Links ]
35. Johnson, K., F. Chavez and G. Friederich. 1999. Continental-shelf sediment as a primary source of iron for coastal phytoplankton. Nature, 398: 697-9. [ Links ]
36. Ju, S. and H. Harvey. 2002. Effects of temperature and heavy metals on extractable lipofuscin in the blue crab,
Callinectes sapidus. Journal of the Korean Society of Oceanography, 37: 1–10. [ Links ]37. Keith-Hunter, A., J. Kim and R. Malcolm. 1999. Factors in
fluencing the inorganic speciation of trace metal cations in fresh waters Mar. Freshwater Res., 50: 367-72. [ Links ]38. Legeleuk, F., J. Reyss, P. Bonte and C. Organo. 1994. Concomitant enrichments of uranium, molybdenum and arsenic in suboxic continental margin sediments. Oceanology Acta, 17(4): 417-430. [ Links ]
39. Leipe, T., M. Kersten, S. Heise, C. Pohl, G. Witt, G. Liehr, M. Zettler and F. Tauber. 2005. Ecotoxicity assessment of natural attenuation effects at a historical dumping site in the western Baltic Sea. Marine Pollution Bulletin, 50: 446–459. [ Links ]
40. Lemus, M., C. Laurent, A. Acagua, M. Cabrera, A. Aponte y K. Chung. 2010. Variación estacional de metales pesados en
Perna viridis, de la localidad de Guayacán, península de Araya, estado Sucre, Venezuela. The Biologist (Lima) 8 (2): 126-138. [ Links ]41. Liehr, G., M. Zettler, T. Leipe and G. Witt. 2005. The ocean quahog
Arctica islandica L.: a bioindicator for contaminated sediments. Marine Biology, 147: 671–679. [ Links ]42. Malcolm, S. 1985. Early diagenesis of molybdenum in estuarine sediments. Marine Chemitry, 16: 213-225. [ Links ]
43. Ng, T. and Wang W. 2007. Interactions of silver, cadmium, and copper accumulation in green mussels (
Perna viridis). Environmental Toxicology and Chemistry, 26 (8): 1764–1769. [ Links ]44. Pedersen, T., M. Pickering, J. Vogel, J. Southon and D. Erle. 1988. The response of benthic foraminifera to productivity cycles in the eastern equatorial paci
fic: faunal and geochemical constraints on glacial bottom water oxygen levels. Paleoceanography, 3(2): 157-168. [ Links ]45. Salazar, C., J.J. 2011. Variación temporal de metales pesados esenciales y no esenciales en el isópodo litoral Tylos wegeneri
(Vandel, 1952) en Guayacán, estado Sucre, Venezuela. Trabajo especial de Grado, Universidad de Oriente, Departamento de Biología, Cumaná. 26 p. [ Links ]46. Sadiq, M. 1992. Toxic Metal Chemistry in Marine Environments. Marcel Dekker Inc., New York, 389. p. [ Links ]
47. Semple, K., K. Doick, K. Jones, P. Burauel, A. Craven and H. Harms. 2004. De
fining bioavailability and bioaccessibility of contaminated soil and sediments is complicated. Environmental Science and Technology, 38: 228–231A. [ Links ]48. Seregin, I. y A. Kozhevnikova. 2006. Physiological role of nickel and its toxic effects on higher plants. Russian Journal of Plant Physiology, 53 (2): 257–277. [ Links ]
49. Sobrino, A., C. Caceres, A. Botello and G. Nuñez. 2007. Effect of cadmium, chromium, lead and metal mixtures on survival and growth of juveniles of the scallop
Argopecten ventricosus (Sowerby II, 1842). Journal of Environmental Science and Health, 42A: 1443–1447. [ Links ]50. Sunda, W. and G. Lewis. 1978. Effect of complexation by natural organic ligands on the toxicity of copper to a unicellular algae
Monochrysis lutheri. Limnology and Oceanography, 23(5): 870-876. [ Links ]51. Valdés, J. y L. Ortlieb. 2001. Paleoxigenación subsuper
ficial de la columna de agua en la bahía Mejillones del sur (23oS): Indicadores geoquímicos en testigos de sedimento marino. Investigaciones Marinas, Valparaíso, 29(1): 25-35. [ Links ]52. Vignati, D., M. Camusso and J. Dominik. 2005. Estimation of the truly dissolved concentrations of Cd, Cu, Ni, and Zn in contrasting aquatic environments with a simple empirical model. Ecological Modelling, 184: 125–139. [ Links ]
53. Vyncke, W., H. Hillewaert, M. Guns and P. van Hoeyweghen. 1999. Trace metals in cut trough shell (
Spisula subtruncata) from Belgian coastal waters. Food Additives and Contaminants, 16(1): 1- 8. [ Links ]54. Wells, M., N. Price and K. Bruland. 1995. Iron chemistry in seawater and its relationship to phytoplankton: a workshop report. Marine Chemistry, 48: 157-182. [ Links ]
55. World Health Organization/ United Nation Environment Programme (WHO/UNEP). 1997. Water Pollution Control - A Guide to the Use of Water Quality Management Principles. Edited by Richard Helmer and Ivanildo Hespanhol (Eds). United Nations Environment Programme, the Water Supply and Sanitation Collaborative Council and the World Health Organization by E. and F. Spon. [ Links ]
56. Widianarko, B., R. Verweij, C. Van Gestel and N. Van Straalen. 2000. Spatial distribution of trace metals in sediments from urban streams of Semarang, Central Java, Indonesia. Ecotoxicology and Environmental Safety, 46: 95-100. [ Links ]
57. Yap, C., A. Ismail and S. Tan. 2003. Concentration, distribution and geochemical speciation of copper in surface sediments of the Straits of Malacca. Pakistan Journal of Biological Sciences, 6 (12): 1021-1026. [ Links ]
58. Yap, C., Y. Hatta, F. Edward and S. Tan. 2008. Comparison of heavy metal concentrations (Cd, Cu, Fe, Ni and Zn) in the shells and different soft tissues of
Anadara granosa collected from Jeram, Kuala Juru and Kuala Kurau, Peninsular Malaysia. Pertanika Journal of Tropical Agricultural Science, 31(2): 205-215. [ Links ]59. Yusof, A., N. Yanta and A. Wood. 2004. The use of bivalves as bio-indicators in the assessment of marine pollution along a coastal area. Journal of Radioanalytical and Nuclear Chemistry, 259 (1):119.127. [ Links ]
60. Zar, H. 1998. Biostatistical analysis. Prentice Hall, NJ. 4th Ed.
[ Links ]