Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Zootecnia Tropical
versión impresa ISSN 0798-7269
Zootecnia Trop. vol.29 no.4 Maracay dic. 2011
Efecto de diferentes salinidades sobre el crecimiento y supervivencia de juveniles del langostino de río Macrobrachium tenellum (Smith, 1871)
Fernando Vega-Villasante 1, Juan D. Galavíz-Parada 2, Manuel Guzmán-Arroyo 3, Carlos A. Flores Zepeda 1 y Luis D. Espinosa-Chaurand *
1 Universidad de Guadalajara. Centro de Investigaciones Costeras. Laboratorio de Acuicultura Experimental. Centro Universitario de la Costa, Av. Universidad no. 203, Del. Ixtapa, C.P. 48280. Puerto Vallarta, Jalisco, México.
2 Universidad de Guadalajara. Centro Universitario de la Costa. Licenciatura en Biología, Jalisco, México.
3 Instituto de Limnología. Centro Universitario de Ciencias Biológicas y Agropecuarias. Universidad de Guadalajara. Chapala, Jalisco, México. *correo electónico: mcespinosachaurand@gmail.com.
RESUMEN
Se analizó el efecto de diferentes concentraciones salinas sobre el crecimiento y supervivencia de juveniles del langostino Macrobrachium tenellum (Smith, 1871). Los diferentes tratamientos consistieron en someter a los organismos a 0, 5, 10, 15, 20, 25, 30, 35 y 40 ups por triplicado en unidades experimentales (UE) (30 L) (10 org/UE) durante un periodo de 40 días. Se suministró alimento a los organismos con alimento balanceado para camarón marino 35% PC a una tasa de 10% de la biomasa total viva por UE. Los tratamientos con 0 y 10 ups presentaron el 100% de supervivencia. La mortalidad total (100%) de los langostinos fue registrada en los tratamientos de 35 y 40 ups. Los organismos del tratamiento a 10 ups tuvieron un aumento de peso total (0,229±0,001 g), TCE (tasa de crecimiento específi co) (1,54±0,01) e IP (incremento en peso) (84,98±0,36%) que resultaron ser signifi cativamente mayores que los otros tratamientos (P<0,05). Se observó una disminución de estos parámetros conforme se incrementó la salinidad. El punto isosmótico potencial para juveniles de M. tenellum, bajo las condiciones establecidas, se encuentra en torno a 10 ups.
Palabras clave: Macrobrachium, salinidad, punto isosmótico, eurihalino, tasa de crecimiento específica.
Effect of different salinities on growth and survival of the juvenile prawn Macrobrachium tenellum (Smith, 1871)
ABSTRACT
The effect of different salinities on growth and survival of juveniles of the prawn Macrobrachium tenellum was studied. The different treatments consisted in placing the organisms at 0, 5, 10, 15, 20, 25, 30, 35 and 40 ups by triplicate in glass tanks (10 org / tank) for a period of 40 days. Balanced feed for shrimp 35% PC was supplied daily at a rate of 10% of the total living biomas per tank. The treatments with 0 and 10 ups showed 100% survival. Total mortality of the prawns was observed from 35 ups and higher. The prawns in treatment at 10 ups had a total weight gain (0,229±0,001 g), TCE (1,54±0,01) and IP (84,98±0,36%) which were signifi cantly higher than the other treatments (P<0,05). A reduction of these parameters was observed as salinity increased. The potential isosmotic point for juvenile M. tenellum, under the conditions stated, is about 10 ups.
Keywords: Macrobrachium, salinity, isosmotic point, euryhaline, specifi c growth rate.
Recibido: 18/05/12 Aceptado: 19/06/12
INTRODUCCIÓN
De las cuatro especies de mayor importancia comercial del género Macrobrachium en América Latina (M. carcinus, M. acanthurus, M. tenellum, M. americanum), M. tenellum ha sido considerado un buen candidato para el cultivo, ya que, se encuentra en altas densidades en la naturaleza, no es agresivo y se ha sugerido que puede tolerar un amplio intervalo de temperaturas, salinidades y concentraciones de oxígeno (Ponce- Palafox et al., 2002).
Macrobrachium tenellum es un crustáceo decápodo cuyo ciclo de vida transita entre las aguas dulces y salobres (Signoret y Soto, 1997; Espino-Barr et al., 2006). Generalmente se reproduce en verano a fi nales de la época de lluvias, cuando baja con los caudales de los ríos a las zonas costeras donde la salinidad es de alrededor de 12 ups o mayores a esta, ya que, los adultos cumplen su ciclo reproductivo en aguas salobres (Boschi, 1974; FAO, 1974). Los adultos, una vez completado el proceso reproductivo, y los juveniles remontan río arriba hacia sus zonas habituales con agua dulce (Román, 1979; Guzmán, 1987; Gamba y Rodríguez, 1987; Ponce-Palafox et al., 2002). Por lo tanto, se les encuentra tanto en esteros, ríos y lagunas costeras (Guzmán, 1987; Román, 1991), demostrando una buena capacidad de osmorregulación (Alpuche et al., 2005), que les permite adaptarse a altas salinidades durante el periodo de sequía (Chung, 2001). Signoret y Soto (1997), reportan que la salinidad máxima tolerada por esta especie fue de 28 ups.
La osmorregulación se refi ere al proceso mediante el cual los organismos mantienen una concentración estable de solutos en relación al medio ambiente (Vega- Villasante y Chong-Carrillo, 2006), y es un importante mecanismo de adaptación de las especies acuáticas, especialmente en crustáceos (Pequeux, 1995). Todos los crustáceos de agua dulce y muchas especies de aguas salobres muestran regulación hiperosmótica, manteniendo altas concentraciones de sales en la hemolinfa iguales al medio donde se desarrollan (Orellana, 2000), requiriendo energía para mantener la homeostasis del organismo (Wilson, 1989). En M. tenellum la concentración osmótica de la hemolinfa permanece constante, lo que signifi ca que es un fuerte euriregulador (Aguilar, 1995; Aguilar et al., 1998).
La mayoría de la información existente, que relacionan a M. tenellum con las condiciones de salinidad del agua ha provenido de evaluaciones en ríos, lagunas costeras y esteros como parte de la medición de parámetros físicos-químicos de estos cuerpos de agua dentro de estudios de la ecología poblacional de la especie. Algunos autores han reportado datos relacionados con la capacidad de osmoregulación de adultos de esta especie bajo condiciones controladas de laboratorio, pero poco es lo que se sabe sobre el efecto de diferentes concentraciones salinas en su crecimiento y supervivencia, así como sobre el intervalo preferido y óptimo para el desarrollo de los juveniles de esta especie. Por todo lo anterior, el objetivo del presente trabajo es aportar información adicional sobre el crecimiento y supervivencia de juveniles de M. tenellum sometidos a diferentes salinidades.
MATERIALES Y MÉTODOS
El presente estudio se llevó a cabo en el Laboratorio de Acuicultura Experimental del Centro Universitario de la Costa de la Universidad de Guadalajara, localizado en Puerto Vallarta, Jalisco, México (20º42´19´´ N y 105º13´16´´ W O; 10 msnm).
Se utilizaron juveniles de M. tenellum (0,28±0,02 g) obtenidos del medio natural y distribuidos aleatoriamente en 27 unidades experimentales (UE) de 30 L (10 org/UE). Los organismos fueron seleccionados por su peso para homogenizar la población y se alimentaron con una dieta con 35% de proteína cruda (PC) durante el experimento. No se determinó el sexo de los organismos. Todas las UE se mantuvieron con aguas claras y bajo condiciones controladas de oxígeno (5,95±0,41 ppm), temperatura (28,0±1,5 ºC), pH (7,8±0,4) y fotoperiodo (12:12 luz: oscuridad). Se emplearon fi ltros de cascada que permitieron la recirculación del agua a razón de 160 L/h.
Los tratamientos correspondieron a nueve concentraciones de salinidad (0, 5, 10, 15, 20, 25, 30, 35 y 40 ups) por triplicado y se distribuyeron con un diseño completamente al azar. La salinidad del agua se ajustó con sales comerciales para producir agua de mar artifi cial. Durante los 40 días que duro el experimento, los langostinos fueron alimentados una vez al día (14:00 h) con el 10% de su peso vivo, para asegurar la saciedad. Los residuos de alimentos, heces y mudas fueron retirados diariamente por sifoneo.
Los parámetros de crecimiento se calcularon pesando, en una balanza digital con 0,01 g de precisión, todos los organismos al inicio y final del bioensayo. Para la determinación de la supervivencia se registraron diariamente los organismos muertos. Los parámetros biológicos fueron calculados de acuerdo a lo siguiente:
Supervivencia (%) (S) = 100 - (org. inicio - org. final / org. inicio) X 100.
Incremento Total de Peso (g) (ITP) = Peso final - Peso inicial.
Porcentaje de Incremento en Peso (%) (IP) = [(Peso final - Peso inicial) / Peso inicial] * 100.
Tasa de Crecimiento Específico (TCE) = [ (Ln Peso final - Ln Peso inicial) / días bioensayo] X 100.
A los datos generados de S, ITP, IP y TCE se les aplicó un análisis de varianza (ANOVA) de una vía para cada caso, previas pruebas de normalidad (Kolmogorov-Smirnov, a=0,05) y homocedasticidad (Bartlett, a=0,05). Los datos expresados en porcentaje (S e IP) se les aplicó una transformación arcoseno de su raíz cuadrada cuando se detectó en ellos falta de normalidad o heterocedasticidad de las varianzas (Zar, 1984). Las diferencias signifi cativas entre los tratamientos se determinaron por medio del método de comparaciones mútiples de Tukey (P<0,05). Todas las pruebas se realizaron mediante el software estadístico Sigmastat V3,1 (2004).
RESULTADOS Y DISCUSIÓN
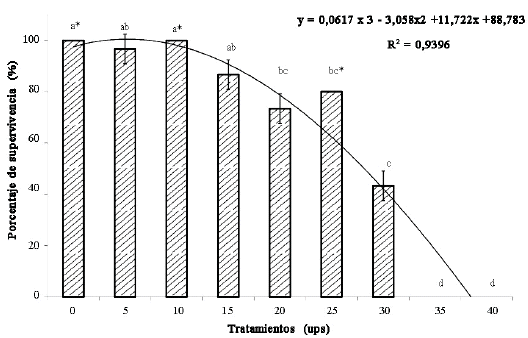
Se registraron diferencias significativas (P<0,05) en los porcentajes promedio de supervivencia de los juveniles de la especie bajo las diferentes salinidades a las que fueron expuestos (Cuadro). Los tratamientos con 0 y 10 ups presentaron el 100% de supervivencia, mientras que los langostinos que se encontraban en 0, 5, 10 y 15 ups tuvieron supervivencias mayores al 85% (Figura).
Cuadro. Valores promedio ± desviación estándar de variables de biomasa y supervivencia en juveniles de M. tenellum sometidos a diferentes salinidades durante 40 días.
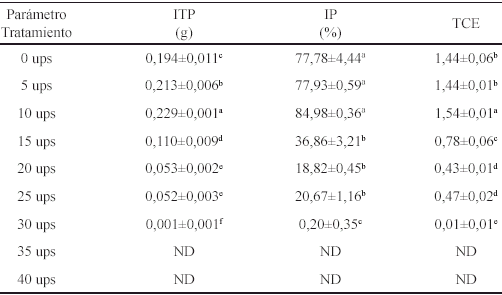
ITP= Incremento total de peso; IP= Incremento porcentual de peso; TCE= Tasa de crecimiento específi co. Los superíndices diferentes en las columnas muestran diferencias estadísticamente signifi cativas entre tratamientos (P<0,05). ND = No determinado.
Figura. Supervivencia de juveniles de Macrobrachium tenellum expuestos a salinidades de 0 a 40 ups durante 40 días.
Resultados similares han sido encontrados en M. idae y M. carcinus en los que se menciona que la mayor supervivencia se da en salinidades entre los 5 y 15 ups (Subramanian et al., 1980; Chung 2001). Por su parte Reyes et al., (2006), también mencionaron que en Cryphiops caementarius la máxima supervivencia fue observada en los organismos que se encontraban a 12 ups después de 49 días. Para M. carcinus se ha demostrado que en su estado larval los organismos prefi eren salinidades entre 5 y 15 ups y conforme avanzan hacia la etapa de juveniles migran a concentraciones entre 0 y 5 ups, sugiriendo este comportamiento fisiológico que las larvas prefi eren las aguas someras de bocas de ríos, donde existen fluctuaciones de la salinidad, mientras que las etapas de juvenil y preadulto realizan migraciones y remontan los ríos y arroyos hacía las aguas dulces (Chung, 2001). Este fenómeno también ocurre dentro del ciclo de vida de M. tenellum, el cual puede ubicarse en su etapa juvenil en esteros y bocas de ríos a punto de migrar a sus zonas habituales en los cuerpos dulceacuícolas costeros donde terminar su desarrollo y reclutamiento (Espinosa-Chaurand et al., 2011; Vega-Villasante et al., 2011).
La mortalidad del 50% de los organismos se encontró en el tratamiento de 30 ups y la mortalidad total a partir de 35 ups, esta última durante los primeros días del experimento. Subramanian et al., (1980), muestran resultados parecidos al mencionar en M. idae una mortalidad del 50% a 27 ups. Otros trabajos que mencionan resultados similares a los encontrados en la presente investigación en cuanto a la salinidad máxima tolerada, la reportan para M. tenellum a los 28 ups (Signoret y Soto, 1997), mientras que para M. acanthurus ocurre a los 25 ups y M. carcinus a los 30 ups (Signoret y Brailovsky, 2004).
Aunque la velocidad de cambio de salinidad (gradual o brusco) se considera un factor importante en la tolerancia a éste y al máximo salino crítico de acuerdo a Chung (2001), al presentarse una mortalidad aproximada al 50% a 30 ups después de 40 días, se podría suponer que este factor de cambio de ambiente no infl uyó en la tolerancia salina de los organismos de esta investigación. Signoret y Soto (1997) y Reyes et al., (2006), coinciden con este estudio al reportar que la mortalidad total de M. tenellum y C. caementarius se encuentra a partir de los 35 ups.
Las líneas verticales sobre las barras indican la desviación estándar. Los superíndices diferentes entre las columnas muestran diferencias, estadísticamente, signifi cativas entre tratamientos (P<0,05). *La desviación estándar es igual a 0,00%. (Ajuste polinomial de 3er orden).
El mayor valor promedio del incremento total de peso (ITP) y la correspondiente tasa más elevada de crecimiento específico de peso (TCE) se observaron en los organismos del tratamiento de 10 ups, que fueron, significativamente, mayores a los demás tratamientos (P<0,05; 0,229±0,001 g y 1,54±0,01, respectivamente). Los valores de estos parámetros disminuyeron conforme se incrementaba la salinidad. Los organismos alojados en los acuarios con 30 ups obtuvieron los menores valores promedio en las variables de biomasa (ITP, IP y TCE) durante los 40 días del experimento.
Aunque en las concentraciones de 0 y 5 ups se presentaron diferencias estadísticas significativas con respecto a la de 10 ups para el ITP y la TCE, los valores medios de estos fueron superiores a los encontrados desde 15 hasta 30 ups. El IP fue superior en los tratamientos de 0 a 10 ups y diferentes estadísticamente a los organismos encontrados entre 15 y 30 ups.
Yen y Bart (2008), mencionaron en hembras reproductoras de M. rosenbergii un comportamiento similar al encontrado en el presente estudio, en el cual observaron una disminución en el crecimiento y producción de larvas conforme se aumenta la salinidad del medio. Estas observaciones coinciden con lo establecido para M. tenellum por Román (1979), quien indica que el tamaño de los organismos está relacionado con el gradiente de salinidad. Por su parte Reyes et al., (2006), presentan resultados muy parecidos cuando reportan que en poslarvas de C. caementarius la tasa de crecimiento en peso fue mayor a los 12 ups. Un intervalo de salinidad más amplio para el crecimiento óptimo ha sido reportado para larvas M. idea (5-20 ups; Subramanian et al., 1980) y reproductoras de M. rosenbergii (5-15 ups) (Hangsapreukel et al., 2010).
El mejor crecimiento se debería observar en el intervalo óptimo de salinidad, ya que en condiciones de salinidad extrema se origina un gasto energético elevado para la osmoregulación a expensas de otros procesos, como el crecimiento (Vijayan y Diwan, 1995). Se ha mencionado que el trabajo osmótico de un organismo es mínimo cuando el medio externo y los fluidos corporales están en equilibrio, operando en su óptimo fisiológico y acumulando el máximo de energía que se canalizará en crecimiento (Valdez et al., 2008).
Según los resultados obtenidos en el presente trabajo se puede sugerir que el punto isosmótico para juveniles de M. tenellum, en donde se presenta la mayor supervivencia y el mayor crecimiento, es cuando éstos se encuentran a 10 ups. Signoret y Soto (1997), difieren de estos resultados al reportar que M. tenellum tiene su punto isosmótico alrededor de 21 ups (640 mmol/kg), aunque esto puede estar dado porque los organismos con los que ellos trabajaron se encontraban en su etapa adulta. Existe evidencia en la que se menciona que M. tenellum presenta un comportamiento hiperregulador en bajas salinidades (0-20 ups) (Signoret y Soto, 1997) e hipo conformador a mayores valores de esta (Aguilar, 1995; Signoret y Soto, 1997), lo cual corresponde al comportamiento de un organismo eurihalino (Aguilar, 1995) que recientemente invadió el ambiente dulceacuícola (Aguilar, 1995; Aguilar et al., 1998). Existen varias especies de Macrobrachium que cumplen con esta premisa de ser consideradas como hiperosmóticas en bajas salinidades (de 0 a 20 ups) e hiposmóticas a altas salinidades como en M. tenellum. Un ejemplo de estas son M. acanthurus, M. carcinus (Signoret y Brailovsky, 2004), M. olfersii, M. potiuna y M. brasiliense (Freire et al., 2003).
El conocer el intervalo preferido y óptimo de los organismos para algún factor físico-químico que afecte directamente su crecimiento y supervivencia, es dar un paso importante para su conservación y aprovechamiento sostenible, así como para elevar el éxito de su cultivo. Los resultados de la presente investigación aportan datos relevantes de la tolerancia a la salinidad del camarón continental M. tenellum, los cuales son necesarios para comprender mejor su ciclo de vida y mejorar las técnicas de aprovechamiento de la especie.
CONCLUSIONES
Los juveniles de M. tenellum tuvieron mayor supervivencia y crecimiento en concentraciones de 0 a 10 ups. Bajo las condiciones establecidas en el presente trabajo se sugiere que el punto isosmótico, para esta etapa de desarrollo en dicha especie, se encuentra en 10 ups. La supervivencia y crecimiento de los organismos disminuye al aumentar la salinidad del medio, encontrándose la mortalidad del 50% a 30 ups y siendo letal (100% de mortalidad) a partir de 35 ups.
LITERATURA CITADA
1. Aguilar, J. M. 1995. Efecto de la salinidad sobre el metabolismo respiratorio, excreción nitrogenada y osmoregulación en Macrobrachium tenellum de Mulegé, Baja California Sur, México. Tesis de M. Sc. Centro de Investigaciones Científi cas y Educación Superior de Ensenada. Departamento de Acuicultura, División de Oceanología, Ensenada, México. 46 p. [ Links ]
2. Aguilar, M., F. Díaz and F.L. Bückle. 1998. The effect of salinity on oxygen consumption and osmoregulation of Macrobrachium tenellum. Mar Freshw Behav Physiol. 31: 105-113. [ Links ]
3. Alpuche, J., A. Pereyra y C. Agundis. 2005. Respuestas bioquímicas de camarones marinos a factores ambientales. REDVET, 6(5): 1-10. Disponible en línea: http://www.veterinaria.org/revistas/redvet/n050505.html [Nov. 19, 2011]. [ Links ]
4. Boschi, E. E. 1974. Biología de los crustáceos cultivables en América Latina. In: FAO. Actas del Simposio sobre Acuicultura en América Latina. Volumen 2, documentos de reseña. Informe de Pesca, 159(2): 1-24. [ Links ]
5. Chung, K.S. 2001. Adaptabilidad ecofi siológica de organismos acuáticos tropicales a cambios de salinidad. Rev. Biol. Trop., 49: 9-13. [ Links ]
6. Espino-Barr, E., B. A. García, G. M. Puente, A. C. Zamorano, A. O. Ahumada y E. Cabral- Solís. 2006. Análisis preliminar de los aspectos biológicos del langostino mazacate Macrobrachium tenellum, en el estado de Colima. Memorias del III Foro científico de pesca ribereña. Centro Regional de Investigaciones Pesqueras de Manzanillo, Instituto Nacional de la Pesca, SAGARPA, Jalisco, México. pp. 93- 94. [ Links ]
7. Espinosa-Chaurand, L.D., M. Vargas-Ceballos, M. Guzmán-Arroyo, H. Nolasco-Soria, O. Carrillo- Farnés, O.Chong-Carrillo y F. Vega-Villasante. 2011. Biología y cultivo de Macrobrachium tenellum: Estado del arte. Hidrobiológica. 21: 99-117. [ Links ]
8. FAO. 1974. Actas del Simposio sobre Acuicultura en América Latina. Volumen 2. Documentos de reseña. Informe de Pesca ,159(2): 130 p. [ Links ]
9. Freire, C. A., F. Cavassin, E. N. Rodrigues, A. H. Torres and J. C. McNamara. 2003. Adaptive patterns of osmotic and ionic regulation, and the invasion of fresh water by the palaemonid shrimps. Comp. Biochem. Physiol., Part A Mol. Integr. Physiol., 136: 771-778. [ Links ]
10. Gamba, A. L. and G. Rodríguez. 1987. Migratory behavior of postlarval white, Penaeus schmitti, and river shrimps, Macrobrachium olfersi and Macrobrachium acanthurus, in their zone of overlap in a tropical lagoon. Bull. Mar. Sci., 40(3): 454-463. [ Links ]
11. Guzmán, A. M. 1987. Biología, ecología y pesca del langostino Macrobrachium tenellum (Smith, 1871), en lagunas costeras del estado de Guerrero. Tesis de Ph. D. Universidad Autónoma de México. Instituto de Ciencias del Mar y Limnología, D.F., México. 319 p. [ Links ]
12. Hangsapreurke, K., T. Thamrongnawasawat, S. Powtongsook, P. Tabthipwon, P. Lumubol y B. Pratoomchat. 2010. Effect of salinity on embryonic development of Macrobrachium rosenbergii (De Man). J. Fish. Technol. 2: 1-11. [ Links ]
13. Orellana, T. A. P. 2000. Efecto de diferentes niveles de salinidad y balances proteína/energía en el crecimiento del Penaeus vannamei. Tesis de Lic. Universidad Técnica de Machala. Facultad de Agronomia, Veterinaria y Acuacultura, Machala, Ecuador. 105 p. [ Links ]
14. Péqueux, A. 1995. Osmotic regulation in crustaceans. J. Crust. Biol., 15: 1-60. [ Links ]
15. Ponce-Palafox, J. T., M.F. Arana, B.H. Cabanillas y L.H. Esparza. 2002. Bases biológicas y técnicas para el cultivo de los camarones de agua dulce nativos del Pacífi co Americano Macrobrachium tenellum (Smith, 1871) y M. americanum (Bate, 1968). CIVA, 2002: 534-546. Disponible en línea: http://www.revistaaquatic.com/civa2002/coms/pdf/67.pdf [Noviembre 19, 2011]. [ Links ]
16. Reyes, W. E., S. Bacilio, M. Villavicencio y R. Mendoza. 2006. Efecto de la salinidad en el crecimiento y supervivencia de postlarvas del Camarón de Río Cryphiops caementarius Molina, 1872 (Crustacea, Palaemonidae), en laboratorio. CIVA, 2006: 341-346. Disponible en línea: http://www.revistaaquatic.com/civa2006/coms/pdf/208.pdf. [Noviembre 20, 2011]. [ Links ]
17. Román, C. R. 1979. Contribución al conocimiento de la biología y ecología de Macrobrachium tenellum (Smith) (Crustacea, Decapoda, Palaemonidae). Ann. Inst. Cienc. Mar. Limnol., 6: 137-160. [ Links ]
18. Román, C. R. 1991. Ecología de Macrobrachium tenellum (Decapoda: Palaemonidae) en la laguna de Coyuca, Pacífico de México. Ann. Inst. Cienc. Mar. Limnol., 18: 109-160. [ Links ]
19. Sigmastat. 2004. SigmaStat, Advisory Statistics for Scientists (programa de computadora). Version 3.1. Chicago (IL): SYSTAT software inc. [ Links ]
20. Signoret, P. B. G. y G. E. Soto. 1997. Comportamiento osmoregulador de Macrobrachium tenellum y Macrobrachium acanthurus (Decapoda:Palaemonidae) en diferentes salinidades. Rev.Biol. Trop., 45: 1085-1091. [ Links ]
21. Signoret P. B. G. and S. D. Brailovsky. 2004. Adaptive osmotic responses of Macrobrachium acanthurus (Wiegmann) and Macrobrachium carcinus (Linnaeus) (Decapoda, Palaemonidae) from the Southern Gulf of México. Crustaceana, 77: 455-465. [ Links ]
22. Subramanian, P., S. Sambasivam and K. Krishnamurty. 1980. Experimental study on the salinity tolerance of Macrobrachium idae larvae. Mar. Ecol. Prog. Ser., 3: 71-73. [ Links ]
23. Valdez, G., F. Díaz, A. D. Re y E. Sierra. 2008. Efecto de la salinidad sobre la fisiología energética del camarón blanco Litopenaeus vannamei (Bone). Hidrobiológica, 18: 105-115. [ Links ]
24. Vega-Villasante, F. y O. Chong. 2006. El Dicamarón, Diccionario de camaronicultura. Ed. Universidad de Guadalajara y Universidad de La Habana, México. 2da Ed. [ Links ]
25. Vega-Villasante, F., L. D. Espinosa-Chaurand, S. Yamasaki-Granados, E. Cortés-Jacinto, M. García-Guerrero, A.L. Cupul-Magaña, H. Nolasco-Soria y M. Guzmán-Arroyo. 2011. Acuicultura del langostino Macrobrachium tenellum: engorda en estanques semirrústicos. Ed. Universidad de Guadalajara y COECYTJAL. México. [ Links ]
26. Vijayan, K. K. and A. D. Diwan. 1995. Infl uence of temperature, salinity, pH and light on molting and growth in the Indian white prawn Penaeus indicus (Crustacea: Decapoda: Penaeidae) under laboratory conditions. Asian Fish Sci, 8: 63-72. [ Links ]
27. Wilson, J. A. 1989. Fundamentos de fi siología animal. Ed. Limusa S.A. México. 2da Ed. [ Links ]
28. Yen, P. T. and A. N. Bart. 2008. Salinity effects on reproduction of giant freshwater prawn Macrobrachium rosenbergii (de Man). Aquaculture, 280: 124-128. [ Links ]
29. Zar, J. H. 1984. Biostatistical analysis. Ed. Prentice- Hall. USA. 2da Ed. [ Links ]