Saber
versión impresa ISSN 1315-0162
Saber vol.26 no.1 Cumaná mar. 2014
Análisis por cg/em y actividad antimicrobiana de algunas fracciones del extracto en acetato de etilo de Pseudopterogorgia acerosa
Analysis by GC/MS and antimicrobial activity of some chromatograp hic fractions of the Pseudopterogorgia acerosa ethyl acetate extract
Gabriel Ordaz1, Haydelba DArmas1, Juan Hernández2, Shailili Moreno1, Ángel Camacho3, Dayanis Yañez3
1 Universidad de Oriente, Núcleo de Sucre, Escuela de Ciencias, Departamento de Química, Laboratorio de Productos Naturales y Lípidos, Cumaná, Venezuela.
2 Laboratorio de Control de Calidad, Coca-Cola FEMSA, Valencia, Venezuela.
3 Universidad de Oriente, Núcleo de Monagas, Unidad de Estudios Básicos, Departamento de Ciencias, Sección de Química, Maturín, Venezuela E-mail: gabrieljordazgonz@yahoo.com
RESUMEN
Algunas fracciones obtenidas mediante cromatografía en columna del extracto en acetato de etilo del octocoral Pseudopterogorgia acerosa, mostraron actividad antimicrobiana frente a las bacterias Salmonella enteritidis, Bacillus subtlis, Staphylococcus aureus y Citrobacter freundii y frente al hongo Candida albicans, lo que indica la presencia de constituyentes bioactivos en dichas fracciones. Por su parte, el análisis por CG/EM de fracciones obtenidas mediante separación cromatográfica continua, permitió identificar los constituyentes: pristano, éter bis(3,5,5-trimetilhexílico), 4-octadecanólido, tricloroeicosilsilano, (2-endo,7-exo)-7-etil-2,4- dimetil-6,8-dioxabiciclo[3,2,1]oct-3-eno, 1-metoxi-12-octoherberteno, butilftalilbutilglicolato, N-metil-N-(4-(4- metoxi-1-hexahidropiridil)-2-butinil)acetamida, diisobutilftalato, 3-(4-(difenilmetil)fenil)-1-fenil-4,4-dimetil-1- pentanona, por comparación con las bases de datos WILEY y el estudio de los patrones de fragmentación de sus espectros de masa.
Palabras clave: Corales, metabolitos secundarios.
ABSTRACT
Psudopterogorgia acerosa, showed antimicrobial activity against Salmonella enteritidis, Bacillus subtlis, Staphylococcus aureus and Citrobacter freundii bacteria and the fungus Candida albicans, indicating the presence of bioactive constituents in these fractions. Moreover, the GC/MS analysis of some subfractions obtained through continuous chromatographic separation., allowed the identification of the constituents: pristane, bis(3,5,5-trimethylhexyl) ether, 4-octadecanolide, tricloroeicosylsilane, (2-endo,7-exo)-7-ethyl-2,4-dimethyl- 6,8-dioxabycicle[3,2,1]oct-3-ene,1-methoxy-12-octoherbertene, butylphtalylbutylglycolate, N-methyl-N-(4-(4- methoxy-1-hexahydropyridil)-2-butynyl)acetamide, diisobutylphtalate, 3-(4-(diphenylmethyl)phenyl)-1-phenyl- 4,4-dimethyl-1-pentanone, by comparison with WILEY databases and the study of the patterns of fragmentation of their mass spectra.
Key words: Soft corals, antibacterial activity, secondary metabolites.
Recibido: octubre 2013. Aprobado: diciembre 2013. Versión final: febrero 2014.
INTRODUCCIÓN
El interés en los metabolitos secundarios marinos ha crecido en las últimas décadas debido al descubrimiento de compuestos biológicamente activos potencialmente aptos para aplicaciones clínicas (Montaser y Luesch 2011, Houssen y Jaspars 2012, Leal et al. 2012, Gao et al. 2013).
El estudio quimiotaxonómico de los octocorales, en especial los del género Pseudopterogorgia (orden Gorgonacea, familia Plexauridae), han mostrado que este componente de la fauna invertebrada de las aguas poco profundas es una fuente importante de metabolitos secundarios con características estructurales únicas y con propiedades farmacodinámicas (Kate et al. 2010, Marrero et al. 2010, Correa et al. 2011, Correa et al. 2012).
Por otro lado, la técnica acoplada de cromatografía de gases/espectrometría de masas (CG/EM), se ha convertido en una herramienta importante para identificar metabolitos secundarios (Marcano y Hasegawa 2002) tanto de origen marino (Abou-Elela et al. 2009, Ordaz et al. 2009, Hernández et al. 2010, Camacho et al. 2011) como terrestres (Flores et al. 2007, Castillo et al. 2010, Ordaz et al. 2011). En este sentido, el presente trabajo informa sobre algunos metabolitos secundarios identificados mediante CG/EM presentes en el extracto en acetato de etilo del coral Pseudopterogorgia acerosa, así como las propiedades antimicrobianas de algunas fracciones, como un aporte a la quimiotaxonomía de esta especie en latitudes venezolanas.
MATERIALES Y MÉTODOS
Recolección
Las muestras de P. acerosa, fueron obtenidas del Golfo de Cariaco, estado Sucre, Venezuela (10°30-10°32 N y 64°12-64°13 W). La identificación taxonómica fue realizada en la Fundación Pro-desarrollo de las Ciencias del Mar (FUNDEMAR) del Instituto Oceanográfico de Venezuela de la Universidad de Oriente.
Extracción
El material obtenido del octocoral, fue lavado con abundante agua destilada, troceado y macerado en metanol puro (99,9%) en extracciones sucesivas por espacio de 96 y 120 h, respectivamente. El extracto en metanol fue concentrado a presión reducida (aprox. 11 mbar) en un rotaevaporador marca Hidolph, para la obtención del extracto crudo. Una suspensión del mismo en una solución acuosa de metanol al 90% fue desgrasada con éter de petróleo puro (grado analítico) y luego se sometió a extracción con acetato de etilo. La fase en acetato de etilo fue secada con sulfato de sodio anhidro, filtrada y evaporada a presión reducida para obtener la fracción soluble en este solvente (FA).
Fraccionamiento cromatográfico
La FA (8,99 g), fue particionada mediante cromatografía en columna (CC), en una columna de vidrio de 4 x 65 cm empaquetada con sílica (Si) gel 35-70 mesh y hexano a una proporción en masa 1:30 (extracto:sílica). La fase móvil estuvo constituida por sistemas de solventes de polaridad creciente, iniciándose con hexano y luego, mezclas de éste con acetona y metanol en distintas proporciones en volumen. Se recolectaron 117 eluatos de aproximadamente 50 mL cada uno, los cuales fueron analizados por cromatografía de capa fina (CCF), empleándose placas de vidrio (20 x 20 cm) recubiertas con Si gel 60 mesh, con un espesor de 0,5 mm y, como agente revelador, una solución de molibdato de amonio al 5% en H2SO4 al 5%, agrupándose en 15 fracciones identificadas con las letras A hasta la O (6,78 g; 75,40%). Con base en el análisis por CCF y los rendimientos obtenidos de las fracciones, se seleccionaron C (0,1163 g; 1,72%) y E (0,9840 g; 14,51%) para ser particionadas sucesivamente mediante CC (Si gel 35-70 mesh).
Actividad antibacteriana
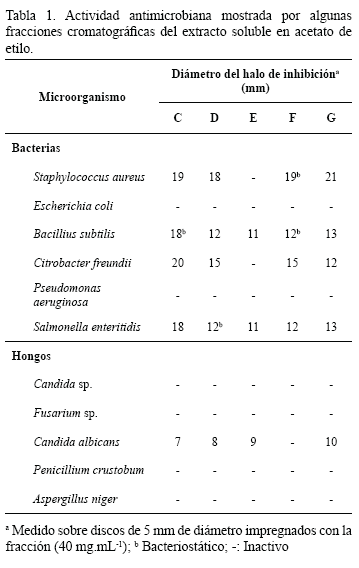
Los principios antibacterianos se detectaron utilizando cepas pertenecientes al Centro Venezolano de Colección de Microorganismos de Bacillus subtilis (CVCM438), Citrobacter freundii (CVCM924), Staphylococcus aureus (CVCM48), Escherichia coli (CVCM39), Salmonella enteritidis (CVCM497) y Pseudomonas aeruginosa (CVCM625) inoculadas en agar Müller-Hinton a 37°C. La acción antibacteriana se evidenció midiendo el diámetro (mm) del halo de inhibición del crecimiento bacteriano alrededor de los discos impregnados con la fracción a probar (40 mg·mL-1) (Bauer et al. 1966).
Actividad antifúngica
La actividad antifúngica fue evaluada mediante la utilización de cepas de los hongos Candida albicans (oportunista), Candida sp. (oportunista), Fusarium sp. (fitopatógeno), Aspergillus niger (fitopatógeno) y Penicillium crustobum (fitopatógeno), incubados en agar papa dextrosa a temperatura ambiente. La actividad fue detectada al medir el diámetro (mm) de los halos de inhibición que se observaron alrededor de los discos impregnados con la fracción a probar (40 mg·mL-1) (Madubunyi 1995).
Caracterización
Las fracciones obtenidas de P. acerosa fueron disueltas en cloroformo e inyectadas en un cromatógrafo de gases marca Hewlett-Packard modelo 5890, serie II, con inyector de tipo Split-Splitless, el cual estaba acoplado con un espectrómetro de masas de la misma marca modelo 5971 A, con fuente de ionización por impacto electrónico de 70 eV. La temperatura del inyector fue 280°C. Se utilizó una columna de metil-silicona de 25 x 0,18 D.I x 0,17 mm de espesor y helio como gas de arrastre. La temperatura inicial del horno fue de 70°C con una rampa de 10°C/min hasta llegar a 300°C. La identificación de los metabolitos secundarios se realizó por comparación computarizada con las librerías WILEY 138 L y WILEY 275 L.
RESULTADOS
En la partición inicial del extracto crudo en metanol (17,0 g), se lograron solubilizar 8,99 g (52,88%) en acetato de etilo (FA). Los resultados de algunos ensayos químicos y de bioactividad realizados a estos extractos ha sido informado previamente (Ordaz et al. 2010).
Actividad antimicrobiana de las fracciones
Las fracciones C, D, E, F y G, mostraron inhibición del crecimiento de las bacterias S. aureus, B. subtilis, C. freundii y S. enteritidis y del hongo C. albicans (Tabla 1). La fracción E, sólo mostró actividad frente B. subtilis y S. enteritidis, con halos de inhibición bactericida de 11 mm de diámetro en cada caso. La inhibición bacteriostática se observó para B. subtilis con las fracciones C (18 mm) y F (12 mm), para S. aureus con la fracción F (19 mm) y para S. enteritidis con la fracción D (12 mm). El resto de las fracciones mostraron halos de inhibición bactericida entre 12 y 21 mm de diámetro frente a las cuatro bacterias que resultaron sensibles (Tabla 1). En cuanto a los hongos, C. albicans fue la única especie (de las cinco utilizadas) que resultó sensible a las fracciones evaluadas (excepto a la fracción F), con halos de inhibición fungicida que variaron entre 7 y 10 mm de diámetro (Tabla 1).
Análisis de la fracción C
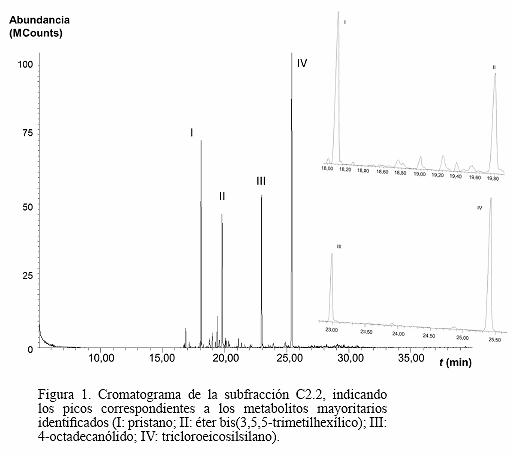
La fracción C (0,1163 g) fue particionada mediante CC con mezclas de hexano-acetato de etilo, obteniéndose 6 fracciones (C1 a C6; 66,38%), de las cuales C2 (0,0204 g) fue fraccionada por CC con mezclas de hexanodiclorometano en 5 nuevas fracciones (C2.1 a C2.5; 95,10%). De acuerdo a la separación observada en el análisis por CCF, se seleccionó C2.2 (0,0038 g) para el análisis por CG/EM. El cromatograma obtenido para esta fracción (Fig. 1), muestra cuatro picos significativos identificados como: pristano (Tr = 18,087 min; m/z = 268 [M]+, 183 [M-C6H13]+, 155 [M-C8H17]+, 141 [M-C9H19]+, 127 [M-C10H21]+, 113 [M-C11H23]+, 99 [M-C12H25]+, 97 [M-C12H27]+, 85 [M-C13H27]+, 71 [M-C14H29]+, 67 [M-C14H33]+, 57 [M-C15H31]+ (PB), 43 [M-C16H33]+, 41 [M-C16H35]+), éter bis(3,5,5-trimetilhexílico) (Tr = 19,797 min; m/z = 270 [M]+, 97 [M-C11H25O]+, 83 [M-C12H27O]+, 82 [M-C12H28O]+, 69 [M-C13H29O]+, 57 [M-C14H29O]+, 55 [M-C14H31O]+, 44 [M-C16H34]+, 43 [M-C15H31O]+ (PB)), 4-octadecanólido (Tr = 22,970 min; m/z = 282 [M]+, 85 [M-C12H21O2]+/ [M-C14H29]+, 83 [M-C12H23O2]+, 71 [M-C13H23O2]+, 69 [M-C13H25O2]+, 57 [M-C14H25O2]+/ [M-C15H29O]+/ [M-C16H33]+ (PB), 55 [M-C14H27O2]+, 44 [M-C17H34]+, 43 [M-C15H27O2]+, 41 [M-C15H29O2]+) y tricloroeicosilsilano (Tr = 25,405 min; m/z = 414 [M]+, 111 [M-C12H26Cl3Si]+, 98 [M-C15H31Cl3]+, 97 [M-C13H28Cl3Si]+, 84 [M-C16H33Cl3]+, 83 [M-C14H30Cl3Si]+, 69 [M-C15H32Cl3Si]+, 55 [M-C16H34Cl3Si]+ (PB), 43 [M-C17H34Cl3Si]+, 41 [M-C17H36Cl3Si]+).
Análisis de la fracción E
La fracción E (0,9840 g) fue particionada mediante CC con mezclas de hexano-acetato de etilo y acetato de etiloacetona, obteniéndose 9 fracciones (E1 a E9; 96,32%), de las cuales E8 (0,4652 g) se fraccionó mediante CC con mezclas de hexano-acetona en 5 nuevas fracciones (E8.1 a E8.5; 81,41%).
La fracción E8.2 (0,1056 g) se particionó mediante CC con mezclas de hexano-acetato de etilo en 4 fracciones (E8.2.1 a E8.2.4; 91,67%), de las cuales E8.2.3 (0,0846 g), se fraccionó por CC con mezclas de éter de petróleo-acetato de etilo en 4 nuevas fracciones (E8.2.3.1 a E.8.2.3.4; 32,65%). De éstas, la fracción E8.2.3.3 fue purificada mediante CC con hexano-acetato de etilo en proporciones 7:3 y 1:4, observándose un posible compuesto puro en el análisis por CCF, por lo que decidió analizarse por CG/EM. Por su parte, la fracción E8.3 (0,2086 g) fue particionada mediante CC con mezclas de hexano-acetato de etilo y acetato de etilo-acetona en 4 fracciones (E8.3.1 a E8.3.4; 23,49%), de la cuales E8.3.3 (0,0107g) se fraccionó mediante CC con hexanoacetato de etilo en proporciones 1:4 y 1:9, obteniéndose 3 fracciones (E8.3.3.1 a E8.3.3.3; 84,11%). De éstas, se seleccionó E8.3.3.1 para el análisis por CG/EM.
El cromatograma de la fracción E8.2.3.3 (Fig. 2) muestra un constituyente mayoritario a un tiempo de retención de 19,787 min, correspondiente al compuesto 1-metoxi-12-octoherberteno (m/z = 246 [M]+, 176 [M-C5H10]+, 175 [M-C5H11]+, 162 [M-C6H12]+, 161 [M-C5H9O]+, 133 [M-C8H17]+, 119 [M-C8H15O]+, 117 [M-C8H17O]+, 105 [M-C9H17O]+, 103 [M-C9H19O]+, 91 [M-C10H19O]+ (PB), 77 [M-C10H17O2]+, 71 [M-C11H11O2]+, 65 [M-C11H17O2]+, 55 [M-C12H15O2]+, 41 [M-C13H17O2]+). Asimismo, a tiempos de retención de 18,765 y 21,001 min, se observan dos constituyente minoritarios que se correlacionan respectivamente con los constituyentes (2-endo, 7-exo)-7-etil-2,4-dimetil- 6,8-dioxabiciclo(3,2,1)-oct-3-eno (m/z = 167 [M-1]+, 149 [M-H3O]+ (PB), 132 [M-H4O2]+, 113 [M-C4H7]+, 104 [M-C2H8O2]+, 97 [M-C4H7O]+, 83 [M-C4H5O2]+, 71 [M-C6H9O]+, 57 [M-C7H11O]+, 55 [M-C6H9O2]+, 43 [M-C8H13O]+) y butilftalilbutilglicolato (m/z = 336 [M]+, 278 [M-C4H10]+, 223 [M-C8H17]+, 205 [M-C8H19O]+, 192 [M-C8H16O2]+, 179 [M-C9H17O2]+, 160 [M-C11H12O2]+, 155 [M-C11H17O2]+, 149 [M-C10H20O3]+ (PB), 141 [M-C12H19O2]+, 133 [M-C10H19O4]+, 123 [M-C12H21O3]+, 121 [M-C11H19O4]+, 111 [M-C13H21O3]+, 104 [M-C11H20O5]+, 97 [M-C13H19O5]+, 93 [M-C12H19O5]+, 85 [M-C14H19O4]+, 76 [M-C12H20O6]+, 71 [M-C15H21O4]+, 65 [M-C13H19O6]+, 57 [M-C14H15O6]+, 55 [M-C15H21O5]+, 41 [M-C16H23O5]+).
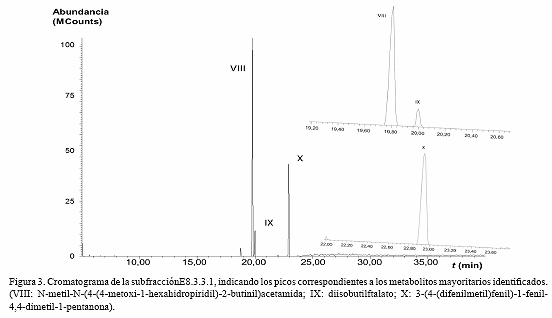
Por otro lado, el cromatograma de la fracción E8.3.3.1 (Fig. 3) muestra tres constituyentes mayoritarios identificados como N-metil-N-(4-(4- metoxi-1-hexahidropiridil)-2-butinil)acetamida (Tr = 19,797 min; m/z = 238 [M]+, 165 [M-C3H5O2]+, 141 [M-C5H7NO]+, 125 [M-C6H11NO]+, 119 [M-C5H13NO2]+, 111 [M-C7H13NO]+, 109 [M-C6H11NO2]+, 97 [M-C7H11NO2]+, 95 [M-C8H17NO]+, 83 [M-C8H13NO2]+, 81 [M-C8H15NO2]+, 71 [M-C10H16NO]+, 69 [M-C8H13N2O2]+, 67 [M-C9H17NO2]+, 57 [M-C11H19NO]+ (PB), 43 [M-C11H19N2O]+), diisobutilftalato (Tr = 19,999 min; m/z = 278 [M]+, 223 [M-C4H7]+, 149 [M-C8H17O]+ (PB), 104 [M-C9H18O3]+, 76 [M-C10H18O4]+, 57 [M-C12H13O4]+, 44 [M-C15H22O2]+.) y 3-(4-(difenilmetil)fenil)-1-fenil-4,4- dimetil-1-pentanona (Tr = 22,938 min; m/z = 432 [M]+, 279 [M-C12H10]+, 243 [M-C13H17O]+, 167 [M-C19H21O]+, 149 [M-C22H19]+ (PB), 83 [M-C27H25]+, 70 [M-C27H22O]+, 57 [M-C28H23O]+, 55 [M-C29H29]+, 41 [M-C30H31]+).
DISCUSIÓN
La inhibición bacteriana y fúngica mostrada por las fracciones obtenidas del extracto en acetato de etilo de P. acerosa (Tabla 1), indican la presencia de constituyentes con potencial antimicrobiano significativo, de moderado a fuerte, que pudieron actuar frente a esos microorganismos de manera independiente o por efecto sinérgico. Sin embargo, estos resultados no pueden asociarse a una bioactividad selectiva debido al número reducido de microorganismos utilizados y a que no se trataban de constituyentes puros, puede ser que los constituyentes fisiológicamente activos de estas fracciones, no se encontraban en una concentración adecuada (suficiente) para actuar frente a algunos de los microorganismos, en el que se observó inocuidad o un efecto antagónico de la bioactividad en esos casos por la presencia de más de un constituyente. De esta especie gorgónea se ha informado previamente la actividad antimicrobiana de algunas fracciones cromatográfi cas obtenidas del extracto lipídico (Hernández et al. 2010).
En cuanto a la identificación mediante CG/EM, de los compuestos identificados en el cromatograma de la fracción C2.2 (Fig. 1), el compuesto I (18,09 min) desplegó en su espectro de masas un ion molecular a m/z 268, el cual se correlaciona con la fórmula molecular C19H40 (calculado 268,31 g·mol-1) del pristano o norfitano (2,6,10,14-tetrametilpentadecano), un derivado diterpeno saturado. De igual forma, el compuesto II (19,80 min), mostró en su espectro de masas, un ion molecular a m/z 270, correspondiente a la fórmula molecular C18H38O (calculado 270,29 g·mol-1) y señales signifi cativas que se corresponden con el éter bis(3,5,5-trimetilhexílico). Asimismo, en el espectro de masas del compuesto III (22,97 min), se observó un ion molecular a m/z 282, correspondiente a la fórmula molecular C18H34O2 (calculado 282,26 g·mol-1) que se correlaciona con la estructura del 4-octadecanólido o γ-estearolactona (dihidro-5-tetradecil-2(3H)-furanona). Mientras, el compuesto IV (25,40 min), desplegó un ion molecular en su espectro de masas a m/z 414, el cual se correlaciona con la fórmula molecular C20H41Cl3Si (calculado 414,20 g·mol-1) del tricloroeicosilsilano. El ion padre o pico base (ion más abundante) en estos casos (m/z de 57, 43, 57 y 55, respectivamente) se corresponde con fracciones propílicas-butílicas de las cadenas carbonadas propias de los compuestos identificados.
Por otro lado, de los compuestos identificados en el cromatograma de la fracción E8.2.3.3 (Fig. 2), el espectro de masas del compuesto V (18,76 min) mostró un ion molecular a m/z 168, en correlación con la fórmula molecular C10H16O2 (calculado 168,12 g·mol-1) del (2-endo, 7-exo)-7-etil-2,4-dimetil-6,8-dioxabiciclo(3,2,1)-oct-3- eno, un derivado oxigenado de monoterpeno. Además, el compuesto VI (19,79 min) mostró en su espectro de masas un ion molecular a m/z 246, que se corresponde con la fórmula molecular C16H22O2 (calculado 246,16 g·mol-1) del 1-metoxi-12-octoherberteno o (S)-4-metoxi-3-(1,2,2- trimetilciclopentil)benzaldehído. Mientras, en el espectro de masas del compuesto VII (21,00 min) se observó un ion molecular a m/z 336, correspondiente a la fórmula molecular C18H24O6 (calculado 336,16 g·mol-1) y picos significativos del butilftalilbutilglicolato.
En cuanto a los constituyentes identificados en el cromatograma de la fracción E8.3.3.1 (Fig. 3), el espectro de masas del compuesto VIII (19,80 min), mostró un ion molecular a m/z 238, el cual corresponde a la fórmula molecular C13H22N2O2 (calculado 238,17 g·mol-1) del N-metil-N-(4-(4-metoxi-1-hexahidropiridil)- 2-butinil)acetamida. Asimismo, el compuesto IX (20,00 min), desplegó un ion molecular a m/z 278, el cual se corresponde con la fórmula molecular C16H22O4 (calculado 278,15 g·mol-1) y picos significativos para el diisobutilftalato. Mientras, en el espectro de masas del compuesto X (22,94 min) se observó un ion molecular a m/z 432 correspondiente a la fórmula molecular C32H32O (calculado 432,25 g·mol-1) del 3-(4-(difenilmetil)fenil)-1-fenil-4,4-dimetil-1-pentanona. La presencia de alquilftalatos como el butilftalilbutilglicolato identificado en la fracción E8.2.3.3 y el diisobutilftalato identificado en E8.3.3.1, se presume generalmente como un producto artificial (no propio de la especie) debido al proceso de aislamiento o análisis (Bhakuni y Rawat 2005), sin embargo, algunos estudios señalan que pueden ser biosintetizados por las propias especies (Namikoshi et al. 2006) y se ha informado dentro de los constituyentes identificados mediante CG/EM de la miel (Bahaffi y Al-Lihaibi 2005), los aceites esenciales de algunas plantas (Ordaz et al. 2011) y en fracciones del octocoral Eunicea sp. (Ordaz et al. 2009).
CONCLUSIONES
La inhibición del crecimiento de las bacterias S. aureus, B. subtilis, C. freundii y S. enteritidis y del hongo C. albicans por las fracciones C, D, E, F y G, evidencia la presencia de sustancias bioactivas con potencial antibacteriano en las mismas. Los constituyentes identificados mediante CG/EM en la fracción C2.2 fueron derivados lipídicos de cadenas largas, mientras que en las fracciones E8.2.3.3 y E8.3.3.1, se encontraron principalmente derivados bencenoides.
AGRADECIMIENTOS
Los autores desean agradecer a Iván López y José Lanza, así como al Departamento de Química y Rectorado de la Universidad de Oriente.
REFERENCIAS BIBLIOGRÁFICAS
1. Abou-Elela G, Abd-Elnaby H, Ibrahim H, Okbah M. 2009. Marine natural products and their potential applications as anti-infective agents. World Appl. Sci. J. 7(7):872-880. [ Links ]
2. Bahaffi S, Al-Lihaibi S. 2005. Determination of volatile organic compounds in local honey by gas chromatography-mass spectrometer. Commun. Fac. Sci. Univ. Ank. Series B. 51(2):1-12. [ Links ]
3. Bauer A, Kirby A, Sherris J, Turk M. 1966. Antibiotic susceptibility testing by standardized single disk method. Am. J. Clin. Pathol. 45(4):493-496. [ Links ]
4. Bhakuni D, Rawat D. 2006. Bioactive marine natural products. Anamaya/Springer. India. pp. 396 (p.215).
5. Camacho A, DArmas H, Ordaz G, Hernandez J. 2011. Constituyentes químicos de algunas fracciones bioactivas del extracto apolar del octocoral caribeño Muricea sp. identificados mediante CG/ EM. Ciencia. 19(4):285-292.
6. Castillo D, Lanza J, Crescente O. 2010. Identificación preliminar de algunos constituyentes del tallo de Paulliniafuscescens (Sapindaceae) y actividad biológica. Avances en Química. 5(1):57-61.
7. Correa H, Aristizabal F, Duque C, Kerr R. 2011. Cytotoxic and antimicrobial activity of pseudopterosins and seco-pseudopterosins isolated from the octocoral Pseudopterogorgia elisabethae of San Andrés and Providencia Islands (Southwest Caribbean Sea). Mar. Drugs. 9(3):334-344.
8. Correa H, Zorro P, Arevalo-Ferro C, Puyana M, Duque C. 2012. Possible ecological role of pseudopterosins G and PU and seco-pseudopterosins J and K from the Gorgonian Pseudopterogorgia elisabethae from Providencia Island (SW Caribbean) in regulating microbial surface communities. J. Chem. Ecol. 38(9):1190-1202.
9. Flores M, Darmas H, Herrera H. 2007. Identificación de algunos constituyentes químicos de las hojas de Chromolaena laevigata mediante cromatografía de gas-espectrometría de masas. Parte II. Ciencia. 15(3):1-12.
10. Gao C, Yi X, Huang R, Yan F, He B, Chen B. 2013. Alkaloids from Corals. Chem. Biodivers. 10(8):1435-1447.
11. Hernández J, DArmas H, Ordaz G, Camacho A. 2010. Identificación de algunos constituyentes químicos del extracto soluble en éter de petróleo del octocoral Pseudopterogorgia acerosa mediante CG/EM y su posible actividad biológica. Ciencia. 18(1):26-33.
12. Houssen W, Jaspars M. 2012. Isolation of Marine Natural Products. In: Naturals Products Isolation. Humana Press, pp. 367-392.
13. Kate A, Rich ard K, Ramanath an B, Kerr R. 2010. A halogenated pseudopterane diterpene from the Bahamian octocoral Pseudopterogorgia acerosa. Can. J. Chem. 88(4):318-322.
14. Leal M, Puga J, Serôdio J, Gomes N, Calado R. 2012. Trends in the discovery of new marine natural products from invertebrates over the last two decades – Where and what are we bioprospecting? PloS ONE. 7(1):e30580. doi:10.1371/journal. pone.0030580
15. Marcano D, Hasegawa M. 2002. Fitoquimica organica. UCV, Litopar, Venezuela.
16. Madubunyi I. 1995. Antimicrobial activities of the constituents of Garcinia kola seeds. Int. J. Pharmacog. 33(3):232-237.
17. Marrero J, Rodriguez I, Rodriguez A. 2010. The natural products chemistry of the gorgonian genus Pseudopterogorgia (Octocorallia: Gorgoniidae). Comprehensive natural products II: chemistry and biology. 1st edition.Edited by Mander L, Liu HW.Oxford: Elsevier. pp. 363-428.
18. Montaser R, Luesch H. 2011. Marine natural products: a new wave of drugs? Future Med. Chem. 3(12):1475-1489.
19. Namikoshi M, Fujiwara T, Nishikawa T, Ukai K. 2006. Natural abundance 14C content of dibutyl phthalate (DBP) from three marine algae. Mar. Drugs. 4(1):290-297.
20. Ordaz G, DArmas H, Hernández J, Camacho A. 2009. Identificación mediante CG/EM de algunos constituyentes con actividad biológica del extracto apolar del celenterado Eunicea sp. Ciencia. 17(3):245-254.
21. Ordaz G, DArmas H, Yañez D, Hernández J, Camacho A. 2010. Metabolitos secundarios, letalidad y actividad antimicrobiana de los extractos de tres corales y tres moluscos marinos de Sucre, Venezuela. Rev. Biol. Trop. 58(2):677-688.
22. Ordaz G, DArmas H, Yañez D, Moreno S. 2011. Composición química de los aceites esenciales de las hojas de Helicteres guazumifolia (Sterculiaceae), Piper tuberculatum (Piperaceae), Scoparia dulcis (Arecaceae) y Solanum subinerme (Solanaceae), recolectadas en Sucre, Venezuela. Rev. Biol. Trop. 59(2):585-595.












 uBio
uBio