Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.22 n.2 Caracas jul. 2002
Staphylococcus aureus: Revisión de los mecanismos de patogenicidad y la fisiopatología de la infección estafilocócica.
Staphylococcus aureus: Revision of the mechanisms of pathogenicity and physiopathology of staphylococcal infections.
Hurtado, M. P.*; de la Parte, M. A.* y Brito, A.**
* Cátedra de Microbiología, Escuela de Enfermería, U.C.V.
** Cátedra de Microbiología, Escuela de Medicina "José María Vargas", U.C.V.
Resumen
Staphylococcus aureus es un patógeno humano importante que coloniza e infecta a pacientes hospitalizados y a personas inmunocompetentes en la comunidad. Produce patologías diversas, desde un absceso de piel hasta septicemias mortales y choque tóxico estafilocócico (SSTS). Puede ser causante de intoxicación por alimentos, debido a la ingestión de la enterotoxina B termoestable preformada, producida por una cepa toxigénica. La mayoría de los niños y adultos están colonizados por S. aureus en forma intermitente, que son habitantes normales de las vías respiratorias superiores, piel, intestino y vagina. S. aureus posee un arsenal de elementos que justifican su capacidad patogénica y de protección ante las defensas del huésped.
Revisamos su genoma, la pared de esta bacteria, su cápsula, las proteínas en la superficie de la pared, componentes de la superficie bacteriana que reconocen las moléculas de adhesión de la matriz extracelular y han sido denominadas como MSCRAMM, toxinas que elabora, enzimas y otros componentes, así como sus factores y determinantes de virulencia. La pared celular del estafilococo está formada por un 50% de mureína de su peso seco, y este péptidoglucano puede tener actividad endotóxica y estimular la liberación de citoquinas por los macrófagos, activación de la vía del complemento y agregación plaquetaria. Los eventos celulares que conducen al shock séptico son similares en la infección estafilocócica y la infección por bacterias gramnegativas.
De nuestra revisión se desprende que, con los nuevos hallazgos fisiopatológicos, se hace difícil diferenciar clínicamente las septicemias por bacterias grampositivas y gramnegativas.
Abstract
Staphylococcus aureus, is an important pathogen both, in hospitalized subjects and in the community. It can be responsible for localized, invasive and toxin mediated diseases, mainly of skin, soft tissue, respiratory, bone, joint and endovascular localization. It can be also involved in food intoxication episodes when the latter contains the preformed thermostable enterotoxin B. A great number of children and adults are intermittent carriers of S. aureus and are usually present in the upper respiratory tract, skin, bowel and vagina. S. aureus has many components that account for its pathogenicity and avoidal of the mechanisms of defense of the human host.
We revised its genome, wall composition, capsule, surface proteins such as protein A with its antiphagocytic properties and other related that bind extracellular matrix molecules which have been named microbial surface components recognizing adhesive matrix molecules (MSCRAMM); also toxins, enzymes and other components and virulence factors. Its cell wall contains up to 50% of the dry weight in murein; this peptidoglucan has endotoxic activity and can stimulate the liberation of cytokines by macrophages, activate the complement pathway and produce platelet aggregation. The cellular events that lead to septic shock in the staphylococcal infection are similar to those produced by gramnegative bacteria.
From this revision we conclude that with the newer physiopathological events described there is no clinical difference between sepsis produced by bacteria grampositive such S. aureus and those produced by gramnegative species.
Palabras-clave: Staphylococcus aureus, mecanismos de patogenicidad, fisiopatología, infección estafilocócica.
Introducción
S. aureus es un patógeno humano importante que coloniza e infecta a pacientes hospitalizados con defensas disminuidas y a personas inmunocompetentes en la comunidad (1). Produce patologías diversas, desde un absceso de piel hasta septicemias mortales y choque tóxico estafilocócico (SSTS). Además, puede ser causante de intoxicación por alimentos, la cual ocurre en epidemias y es debida a la ingestión de la enterotoxina B termoestable preformada, producida por una cepa toxigénica de S. aureus que crece en el alimento(1).
El género Staphylococcus está compuesto por cocos grampositivos de 0,5 a 1,5 µm de diámetro, que se agrupan en parejas y en tétradas, y que en forma característica se dividen en más de un plano para formar racimos irregulares. La pared celular contiene peptidoglucano y ácido teicoico (2). (Figura 1).
Figura 1. Esquema de pared de bacteria grampositiva.
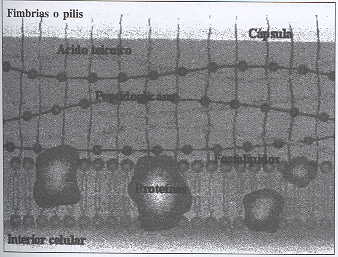
S. aureus es anaerobio facultativo y habitualmente catalasa y coagulasa positivos; no esporulados, resistentes, ya que pueden sobrevivir a muchas condiciones ambientales adversas; es productor de gran variedad de enzimas y toxinas, así como la fermentación del manitol y la prueba positiva para la desoxirribonucleasa (2).
Loeb (1903) realiza el descubrimiento de la coagulasa y Elek (1959) hace un estudio sobre "Staphylococcus pyogenes", abarcando una revisión sobre todas las interrogantes existentes para la época (3).
En 1945, Spink Ferris, poco después de que la penicilina G estuviera disponible, comunicó el aislamiento de una cepa resistente de S. aureus que producía una ß-lactamasa (penicilinasa) que inactivaba el antibiótico. Si bien al principio aparecía en forma esporádica, este tipo de resistencia se difundió rápidamente a muchos aislamientos de S. aureus (1).
La mayoría de los niños y adultos están colonizados por S. aureus en forma intermitente, y éstos son habitantes normales de las vías respiratorias superiores, piel, intestino y vagina (2).
Los estafilococos figuran entre las bacterias patógenas más importantes para el ser humano (2).
Mecanismos de Patogenicidad de Staphylococcus Aureus:
S. aureus posee un arsenal de elementos que justifican su capacidad patogénica y de defensa ante los mecanismos de defensa del huésped y los antimicrobianos utilizados para su combate.
Revisamos su genoma, la pared de esta bacteria, su cápsula, las proteínas en la superficie de la pared, toxinas que elabora, enzimas y otros componentes, así como sus factores y determinantes de virulencia.
El genoma del estafilococo está representado por un cromosoma circular (de aproximadamente 2.800 pares de bases), además de profagos, plásmidos y transposones. Los genes responsables de la virulencia y de la resistencia a los antimicrobianos se hallan en el cromosoma y en los elementos extracromosomales(4). Estos genes pueden ser transferidos entre las diferentes cepas de estafilococos, diferentes especies y también entre otras bacterias grampositivas mediante elementos extracromosómicos (5).
La pared celular del estafilococo está formada por un 50% de mureína de su peso seco. La mureína es un péptidoglucano compuesto de subunidades alternas de los polisacáridos ácido N-acetilglucosamina y ácido N-acetilmurámico con enlaces ß1,4. Estas cadenas de polisacáridos tienen, a su vez, enlaces cruzados por cadenas de tetrapéptidos unidas al ácido N-acetilmurámico y por un puente de pentaglicina específico para S. aureus. El péptidoglucano puede tener actividad endotóxica y estimular la liberación de citoquinas por los macrófagos, activación de la vía del complemento y agregación plaquetaria. Existen diferencias en la estructura del péptidoglucano en las diferentes cepas de estafilococos que podrían explicar su variación en relación con la capacidad de producir el síndrome de coagulación intravascular diseminada. Otros componentes importantes de la pared celular del estafilococo son los ácidos teicoicos con ribitol, unidos covalentemente al péptidoglucano. El ácido lipoteicoico es un polímero de glicerol y fosfato unido al glicolípido terminal anclado a la membrana citoplasmática (6).
La mayoría de los estafilococos producen microcápsulas, y a partir del polisacárido capsular se han identificado 11 tipos diferentes, siendo los tipos 5 y 8 los responsables del 75% de las infecciones humanas. La mayoría de las cepas de S. aureus aisladas meticilino-resistentes son del tipo 5. Ya ha sido determinada la composición química de 4 de los 11 polisacáridos antifagocíticos, incluidos los tipos 5 y 8; todos ellos están químicamente relacionados(7).
Además, la pared del estafilococo posee muchas proteínas de superficie, las cuales tienen algunas características comunes. Éstas incluyen una secuencia de señal secretoria en el extremo amino terminal, con aminoácidos de carga positiva, los cuales se extienden hasta el citoplasma; un extremo hidrofóbico que se extiende hasta la membrana; y una región de anclaje a la pared celular, todos ubicados en el extremo carboxílico. Un dominio de adherencia en el amino-terminal, que está expuesto en la superficie de la célula bacteriana, permite que alguna de estas proteínas actúen como adhesinas (8). La proteína A, es el prototipo de estas proteínas, y tiene propiedades antifagocíticas que están basadas en su capacidad de unión a la porción Fc de las inmunoglobulinas
Cuadro 1. Factores de patogenicidad de S. aureus.

Varias de estas proteínas de superficie relacionadas se unen a moléculas de la matriz extracelular, y han sido denominadas como MSCRAMM (componentes de la superficie bacteriana que reconocen las moléculas de adhesión de la matriz celular). Estudios recientes sugieren que estas proteínas juegan un papel importante en la colonización de los tejidos del hospedador por el estafilococo (9,10).
El estafilococo produce muchas toxinas, las cuales se clasifican según su mecanismo de acción en citotoxinas como la proteína alfa-toxina de 33 kd que produce formación de poros e induce cambios proinflamatorios en las células de mamíferos. Estos daños celulares podrían explicar las manifestaciones del síndrome séptico (11,12). Los superantígenos de la toxina pirogénica están estructuralmente relacionados y comparten varios grados de homología de su secuencia de aminoácidos. Funcionan como superantígenos, uniéndose a las proteínas clase II del complejo mayor de histocompatibilidad, produciendo gran proliferación de células T y liberación de citoquinas (13). Diferentes dominios de la molécula de enterotoxina son responsables de dos enfermedades causadas por estas proteínas: el síndrome del shock tóxico estafilocócico (SSTS) y la intoxicación alimentaria (14). A pesar de una homología pequeña de sus secuencias aminoácidas, la toxina 1 del síndrome del shock tóxico es estructuralmente similar a las enterotoxinas B y C. El gen para la toxina 1 de SSTS está presente en el 20% de todos los aislamientos de S. aureus (13). Las toxinas exfoliativas, que incluyen las toxinas epidermolíticas A y B, causan eritema de piel y desprendimiento, tal como se observa en los casos del síndrome de piel escaldada. El mecanismo de acción de estas toxinas es controversial. La leucocidina es una toxina leucocitolítica epidemiológicamente asociada con infecciones cutáneas severas (15).
Los estafilococos producen varias enzimas, proteasas, lipasas e hialuronidasas que destruyen tejidos. Estos productos bacterianos pueden facilitar la diseminación de la infección a los tejidos adyacentes, a pesar de que su papel en la patogenicidad no está bien definido.
La ß-lactamasa es una enzima que inactiva la penicilina. Las proteínas fijadoras de penicilina son enzimas localizadas en la membrana citoplasmática implicadas en el ensamblaje de la pared bacteriana (4,16). Una proteína fijadora de penicilina nueva es responsable de la resistencia del estafilococo a las penicilinas penicilinasa-resistentes y a las cefalosporinas.
La coagulasa es un activador de la protrombina que convierte el fibrinógeno en fibrina. S. aureus tiene componentes diversos y productos que contribuyen con la patogénesis de la infección. Estos componentes y productos tienen funciones que se sobreponen y que pueden actuar solos o en sinergia.
La virulencia del estafilococo está determinada y regulada genéticamente. Se han identificado genes universales que coordinan la expresión de varios grupos de genes del estafilococo(17,18,19). El gen estudiado más extensamente, agr, induce la expresión de una exoproteína (proteína extracelular), mientras que suprime la expresión de una proteína de superficie a través de un octapéptido sensible a la densidad bacteriana (20). Las proteínas de superficie son predominantemente sintetizadas durante la fase de crecimiento exponencial y las proteínas secretorias se sintetizan durante la fase estacionaria. Esta expresión secuencial de los genes pudiera tener importancia clínica.
Diferentes fases de la infección estafilocócica parecen requerir diferentes grupos de determinantes de virulencia. Durante las primeras fases de la infección, la expresión de las proteínas de superficie que unen las moléculas de la matriz extracelular, favorecen la colonización exitosa de los tejidos del huésped, mientras que la síntesis de exoproteínas favorece la diseminación a tejidos adyacentes. Esta hipótesis es avalada por estudios en animales donde la inactivación de genes reguladores reduce la virulencia bacteriana(20).
Los seres humanos son un reservorio natural de S. aureus. Entre el 30 y el 50% de los adultos sanos están colonizados, y entre el 10 y el 20% se mantienen colonizados persistentemente(22,23). Ambos aislados, cepas meticilino-sensibles y meticilino-resistentes, son colonizadores persistentes (24). Las personas colonizadas con S. aureus tienen riesgo aumentado de infecciones. Las tasas de colonización por estafilococos son altas entre los pacientes con diabetes tipo 1(25), usuarios de drogas intravenosas (26), pacientes en hemodiálisis(27), pacientes quirúrgicos(28,29) y aquellos con SIDA(30). Pacientes con defectos cualitativos o cuantitativos de la función leucocitaria también tienen mayor riesgo de infección estafilocócica.
Figura 2 . Esquema de la estructura antigenica de S. Aureus.

Las personas colonizadas con cepas de S. aureus tienen mayor riesgo de infección por estas cepas. La mayor parte de los casos de infecciones hospitalarias se adquieren por la exposición a las manos de los trabajadores del equipo de salud, una vez que éstas han sido colonizadas transitoriamente con estafilococos de sus propios reservorios o por el contacto con otro paciente infectado. Pueden ocurrir brotes a través del contacto con un portador persistente o de fuentes ambientales, pero estas formas de transmisión son menos comunes(23).
Se sabe mucho sobre la contribución de los factores bacterianos de patogenicidad y virulencia en la producción de la infección(13, 31, 32). Se sabe menos sobre su interacción con los factores del hospedador y la importancia relativa en la infección.
La virulencia de la infección por S. aureus es notable, en el sentido de que se trata de un comensal de fosas nasales, axilas, vagina, faringe o de las superficies dañadas de la piel (22,23). Las infecciones se inician con una solución de continuidad de la barrera cutánea o mucosa que permite al estafilococo acceder a los tejidos cercanos o a la circulación sanguínea.
No se comprende totalmente la biología de la colonización de las fosas nasales por el estafilococo. La mucina parece ser un factor determinante del hospedador colonizado en el proceso que implica interacciones entre la proteína del estafilococo y el carbohidrato de la mucina (33,34). Se desconoce el papel de otros comensales, Ig A secretoria o adhesinas específicas del estafilococo.
El riesgo de infección aumenta con la presencia de cuerpos extraños. Elek y Conen (35) demostraron la capacidad de las suturas para disminuir el nivel de resistencia a la infección. Varios factores contribuyen a aumentar la susceptibilidad a la infección. La función fagocitaria en la presencia de cuerpos extraños está considerablemente disminuida (36). Elementos como catéteres intravenosos se cubren rápidamente con sustancias séricas como el fibrinógeno y la fibronectina, los cuales facilitan la adherencia del estafilococo a través de mecanismos mediados por los componentes de la superficie bacteriana que reconocen las moléculas de adhesión de la matriz extracelular (MSCRAMM) y elaboran glicocálices que facilitan aún más la colonización (37,38).
Los leucocitos son la primera línea de defensa del hospedador en respuesta a la infección estafilocócica (39). La migración de los leucocitos al sitio de la infección resulta de la expresión dirigida por las moléculas de adhesión a la célula endotelial. El proceso mediado por citoquinas es desencadenado por las bacterias y los macrófagos fijos tisulares. Posterior a la infección, las citokinas son los primeros productos demostrables en el intravascular, extendiéndose a los tejidos a medida que las células inflamatorias migran al lugar de la infección (40). Las células endoteliales infectadas por S. aureus también expresan la molécula 1 de adhesión intercelular (CD54), la molécula 1 de adhesión a la célula vascular (CD106) y las moléculas del CMH clase I, las cuales probablemente contribuyan en el proceso (41). Ratones genéticamente manipulados, los cuales carecen de la molécula 1 de adhesión intercelular, presentan un defecto de la migración de los leucocitos, que produce un aumento de la mortalidad, pero también presentan infecciones estafilocócicas menos graves que los ratones normales, quizás como resultado de un menor daño mediado por leucocitos (42).
La presencia de anticuerpos opsonizantes dirigidos contra la cápsula, el peptidoglucano o el complemento, facilita la fagocitosis in vitro(7,43,44). El papel del anticuerpo in vivo es menos conocido, debido a que los títulos de anticuerpos anti-estafilocócicos no se correlacionan con protección para la infección, excepto para el caso del síndrome del shock tóxico, en el cual la presencia de la toxina 1 anti-síndrome del shock tóxico es protectora (45, 46).
Fisiopatología de la Infección Estafilocócica
En el hospedador, el hallazgo patológico típico es la formación de abscesos. El hecho de que la lesión sea limitada o generalizada depende de una interrelación compleja entre los determinantes de virulencia del S. aureus y los mecanismos de defensa del hospedador.
La patología estafilocócica podemos dividirla en localizada y generalizada (1); las localizadas están favorecidas por una higiene personal deficiente, por traumatismos menores y procesos dermatológicos. Las infecciones de piel por S. aureus se pueden clasificar también en: aquéllas con exantema y las que carecen de éste.
Las enfermedades infecciosas estafilocócicas generalizadas incluyen la bacteriemia estafilocócica, la cual puede complicarse con endocarditis, infección metastásica o el síndrome séptico. La célula endotelial es básica en estos procesos patogénicos. No solamente es un blanco potencial para el daño, sino que también su activación contribuye con la progresión de la enfermedad endovascular. Los estafilococos se adhieren ávidamente a las células endoteliales y se unen a través de un mecanismo de interacción adhesina-receptor (47,48). Los estudios in vitro demuestran que después de la adherencia, los estafilococos son fagocitados por la célula endotelial (49,50).
El medio intracelular protege al estafilococo de los mecanismos de defensa del hospedador así como de los efectos bactericidas de los antibióticos. Vesga y cols.(51) demostraron que el medio intracelular endotelial favorece la formación de variantes productoras de colonias pequeñas. Estos factores pueden favorecer la supervivencia bacteriana y contribuir con el desarrollo de infecciones persistentes o recurrentes(52).
Las cepas de estafilococos que causan endocarditis son resistentes al suero, se adhieren a superficies valvulares sanas o dañadas, son resistentes a las proteínas microbicidas de las plaquetas (53) y elaboran enzimas proteolíticas que facilitan la diseminación a tejidos adyacentes (16). La adherencia de los estafilococos a los trombos de fibrina y plaquetas que se forman en las superficies valvulares dañadas puede involucrar la adherencia de las proteínas componentes de la superficie bacteriana que reconocen las moléculas de adhesión de la matriz extracelular (MSCRAMM) expuestas.
La endocarditis por estafilococo ocurre también en válvulas sanas. La invasión de las células endoteliales por el estafilococo puede iniciar las alteraciones celulares, incluyendo la expresión de factor tisular que promueve la formación de vegetaciones(48,49,50,54,55).
La capacidad para invadir el tejido endovascular también favorece la diseminación a otros tejidos. Alternativamente, el estafilococo pudiera unirse directamente al endotelio. El rol potencial de las MSCRAMM se ilustra de la mejor manera mediante una proteína de unión al colágeno. Su presencia facilita la infección de huesos y articulaciones en animales (56).
Los eventos celulares que conducen al shock séptico son similares en la infección estafilocócica y la infección por bacterias gramnegativas. En ambos casos, los monocitos y los macrófagos tienen un rol central, a pesar de que los poilimorfonucleares, células endoteliales y plaquetas también juegan su papel. Los monocitos liberan el factor de necrosis tumoral a e interleukina-1(IL-1), interleukina-6 (IL-6) e interleukina-8 (IL-8) después del contacto con estafilococos intactos, peptidoglicano o ácido lipoteicoico(57,58). En contraste, la expresión de IL-1 e IL-6 por las células endoteliales requiere de la fagocitosis de las bacterias.
Como resultado de la citoquinas y activación celular, las vías del complemento y coagulación se activan, se metaboliza el ácido araquidónico y se libera el factor plaquetario. Estos eventos, a su vez, causan fiebre, hipotensión, extravasación capilar, coagulopatía intravascular diseminada, depresión de la función miocárdica y disfunción multiorgánica. Varios de los componentes estafilocócicos parecen ser capaces de iniciar el síndrome séptico (59). Los peptidoglicanos, especialmente cuando se combinan con ácido lipoteicoico, reproducen muchas de las respuestas de endotoxina en el modelo animal de sepsis (60,61).
La alfatoxina, por sí sola, reproduce muchos de los hallazgos de la sepsis, incluyendo hipotensión, trombocitopenia e hipoxia en el modelo animal (11).
La tasa global de mortalidad por bacteremia estafilocócica, la cual ha permanecido inalterada durante los últimos 15 años, está entre el 11 y el 43%(62). Los factores asociados a la mortalidad incluyen edad mayor de 50 años, foco infeccioso no removible, patología cardíaca grave subyacente y enfermedad neurológica o respiratoria. La bacteremia causada por cepas resistentes a la meticilina no está asociada con mayor mortalidad. Recientemente se observó que el cambio en el puntaje que evalúa la Fisiología Aguda y la Enfermedad Crónica (APACHE II) el día anterior a la bacteremia por S. aureus, podía predecir el curso clínico y la evolución (63). La frecuencia de complicaciones por la bacteremia estafilocócica es alta, con un rango de entre el 11 y el 53%. Tantos como el 31% de los pacientes con bacteremia que no tienen evidencia de endocarditis si demuestran infección metastásica (55,62,64).
Bibliografía
1. Mandell GL, Bennett JE, Dolin R, eds. Enfermedades Infecciosas Principios y Prácticas. 4a ed. New York, Churchill Livingstone 1997; 1754-77 y 1961-87. [ Links ]
2. Prescott ML, Harley JP y Klein DA. Microbiología, 4a. Ed. McGraw-Hill Interamericana 1999; 713 y 812. [ Links ]
3. Landaeta JM. Estafilococos coagulasa-negativos: una aproximación microbiológica. Bol Soc Ven Micr 1998; 18 (2): 71-8 [ Links ]
4. Novick RP. The staphylococcus as a molecular genetic system, In: Novick RP, ed. Molecular biology of the staphylococci. New York: VCH, 1990: 1-37 [ Links ]
5. Schaberg DR, Zervos MJ. Intergeneric and interspecies gene exchange in gram positive cocci. Antimicrob Agents Chemother 1986; 30: 817-22. [ Links ]
6. Kessler C.M, Nussbaum E, Tuazon CU. Disseminated intravascular coagulation associated with Staphylococcus aureus septicemia is mediated by peptidoglycan-induced platelet aggregation. J Infect Dis 1991; 164:101-7. [ Links ]
7. Lee JC. The prospects for developing a vaccine against Staphylococcus aureus, Trends Microbiol 1996;4:162-6. [ Links ]
8. Foster TJ, McDevitt D. Surface-associated proteins of Staphylococcus aureus: their possible roles in virulence. FEMS Microbiol Lett 1994; 118: 199-205. [ Links ]
9. Lowy FD. Staphylococcus aureus Infections. J Engl J Med 1998; 339(8): 520-532. [ Links ]
10. Patti JM, Allen BL, McGavin MJ, Höök M. MSCRAM Mediated adherence of microorganisms to host tissues. Ann Rev Microbiol 1994; 48: 585-617. [ Links ]
11. Bhakdi S, Tranum-Jensen J. Alpha-toxin of Staphylococcus aureus. Microbiol Rev 1991; 55:733-51. [ Links ]
12. Walev I, Reske K, Palmer M, Valeva A, Bhakdi S. Potassium-inhibited processing of II, IB in human monocytes. EMBO J 1995;14:1607. [ Links ]
13. Marrack P, Kappler J. The staphylococcal enterotoxins and their relatives. Science 1990; 248:705-11. (Erratum, Science 1990; 248:1066). [ Links ]
14. Harris TO, Grossman D, Kappler JW, Marrack P, Rich RR, Betley MJ. Lack of complete correlation between T-cell-stimulatory activities of staphylococcal enterotoxins. Infect Immun 1993; 61: 3175-83. [ Links ]
15. Cribier B, Prevost G, Gouppie P, Finck-Barbancon V, Grosshans E, Piemont Y. Staphylococcus aureus leukocidin: anew virulence factor in cutancous infections? An epidemiological and experimental study. Dermatology 1992; 185:175-80. [ Links ]
16. Wilkinson BJ. Biology, In: Crossley KB, Archer GL., eds. The staphylococci in human disease. New York: Churchill Livingstone, 1997:1-38. [ Links ]
17. Peng HL, Novick RP, Kreiswirth B, Kornblum J, Schlievert P. Cloning, characterization, and sequencing of an accessory gene regulator (agr) in Staphylococcus aureus. J Bacteriol 1988; 170:4365-72. [ Links ]
18. Cheung AL., Koomey JM, Butler CA, Projan SJ, Fischetti VA. Regulation of exoprotein expression in Staphylococcus aureus by a locus (sar) distinct from agr. Proc Natl Acad Sci USA 1991;89:6462-6. [ Links ]
19. Ji G, Beavis RC, Novick RP. Cell density control of staphylococcal virulence mediated by an octapeptide pheromone. Proc Natl Acad Sci USA 1995; 92:12055-9. [ Links ]
20. Cheung AL, Eberhardt KJ, Chung E, et al. Diminished virulence of a sar-agr mutant of Staphylococcus aureus in the rabbit model of endocarditis. J Clin Invest 1994; 94:1815-22. [ Links ]
21. Noble WC, Valkenburg HA, Wolters CHI. Carriage of Staphylococcus aureus in random samples of a normal population. J Hyg (Lond) 1967; 65: 567-73. [ Links ]
22. Casewell MW, Hill RI.R. The carrier state: methicillin-resistant Staphylococcus aureus. J Antimicrob Chemother 1986; 18:Suppl A:1 12. [ Links ]
23. Sanford MD, Widmer AF, Bale MJ, Jones RN, Wenzel RP. Efficient detection and long-term persistence of the carriage of methicillin resistant Staphylococcus aureus. Clin Infect Dis 1994; 19:1123-8. [ Links ]
24. Wenzel RP, Perl TM. The significance of nasal carriage of Staphylococcus aureus and the incidence of postoperative wound infection. J Hosp Infect 1995; 31:13-24. [ Links ]
25. Tuazon CU, Perez A, Kishaba T, Sheagren JN. Staphylococcus aureus among insulin-injecting diabetic patients: an increased carrier rate. JAMA 1975; 231:1272. [ Links ]
26. Tuazon CU, Sheagren JN. Increased rate of carriage of Staphylococcus aureus among narcotic addicts. J Infect Dis 1974; 129:725-7. [ Links ]
27. Yu VL, Goetz A, Wagener M, et al. Staphylococcus aureus nasal carriage and infection in patients on hemodialysis: efficacy of antibiotic prophylaxis. N Engl J Med 1986; 315:91-6 [ Links ]
28. Weinstein HJ. The relation between the nasal staphylococcal carrier state and the incidence of postoperative complications. N Engl J Med 1959; 260:1303-8. [ Links ]
29. Kluytmans JAJW, Mouton JW, Ijzerman EPF, et al. Nasal carriage of Staphylococcus aureus as a major risk factor for wound infections after cardiac surgery. J Infect Dis 1995; 171:216-9. [ Links ]
30. Weinke T, Schiller R, Fehrenbach FJ, Pohle HD. Association between Staphylococcus aureus nasopharyngeal colonization and septicemia in patients infected with the human immunodeficiency virus. Eur J Clin Microbiol Infect Dis 1992; 11:985-9. [ Links ]
31. Banerjee SN, Emori TG, Culver DH, et al. Secular trends in nosocomial primary bloodstream infections in the United States, 1980 1989. Am J Med 1991; 91:Suppl 3B-86S-3B-89S. [ Links ]
32. Emori TG, Gaynes RP. An overview of nosocomial infections, including the role of the microbiology laboratory. Clin Microbiol Rev 1993; 6:428-42. [ Links ]
33. Sanford BA, Ramsay MA. In vivo localization of Staphylococcus aureus in nasal tissues of healthy and influenza A virus-infected ferrets. Proc Soc Exp Biol Med 1989; 191:163-9. [ Links ]
34. Shuter J, Hatcher VB, Lowy FD. Staphylococcus aureus binding to human nasal mucin. Infect Immun 1996; 64: 310-8. [ Links ]
35. Elck SD, Conen PF. The virulence of Staphylococus pyogenes for man a study of the problems of wound infection. Br J Exp Pathol 1957;38:573-86. [ Links ]
36. Zimmerli W, Lew PD, Waldvogel FA. Pathogenesis of foreign body infection: evidence for a local granulocyte defect. J Clin Invest 1984; 73:1191-200. [ Links ]
37. Cheung AL, Fischetti VA. The role of fibrinogen in staphylococcal adherence to catheters in vitro. J Infect Dis 1990;161:1177-86. [ Links ]
38. Vaudaux P, Pittet D, Haeberli A, et al. Fibronectin is more active than fibrin or fibrinogen in promoting Staphylococcus aureus adherence to inserted intravascular catheters. J. Infect Dis 1993; 167:633-41. [ Links ]
39. Verdrengh M, Tarkowski A. Role of neutrophils in experimental septicemia and septic arthritis induced by Staphylococcus aureus. Infect Immun 1997; 65:2517-21. [ Links ]
40. Yao L, Berman JW, Factor SM, Lowy FD. Correlation of histopathologic and bacteriologic changes with cytokine expression in an experimental murine model of bacteremic Staphylococcus aureus infection. Infect Immun 1997; 65:3889-95. [ Links ]
41. Beckhuizen H, van de Gevel JS, Olsson B, van Benten IJ, van Furth R. Infection of human vascular endothelial cells with Staphylococcus aureus induces hyperadhesiveness for human monocytes and granulocytes. J Immunol 1997; 158:774-82. [ Links ]
42. Verdrengh M, Springer TA, Gutiérrez Ramos J.C, Tarkowski A. Role of intercellular adhesion molecule I in pathogenesis of staphylococcal arthritis and in host defense against staphylococcal bacteremia. Infect Immun 1996; 64:2804-7. [ Links ]
43. Peterson PK, Wilkinson BJ, Kim Y, et al. The key role of peptidoglycan in the opsonization of Staphylococcus aureus. J Clin Invest 1978;61:597-609. [ Links ]
44. Karakawa WW, Sutton A, Schneerson R, Karpas A,Vann WF. Capsular antibodies induce type specific phagocytosis of capsulated Staphylococcus aureus by human polymorphonuclear leukocytes. Infect Immun 1988; 56: 1090-5. [ Links ]
45. Wergeland HI, Haaheim I.R, Natas OB, Wesenberg F, Oeding P. Antibodies to staphylococcal peptidoglycan and its peptide epitopes, teichoic acid, and lipoteichoic acid in sera from blood donors and patients with staphylococcal infections. J Clin Microbiol 1989; 27:1286-91. [ Links ]
46. Fredman JD, Beer DJ. Expanding perspectives on the toxic shock syndrome. Adv Intern Med 1991; 36:363-97. [ Links ]
47. Vercellotti GM, Lussenhop D, Peterson PK, et al. Bacterial adherence to fibronectin and endothelial cells: a possible mechanism for bacterial tissue tropism. J I ab Clin Med 1984; 103:34-43 [ Links ]
48. Tomkins DC, Hatcher VB, Patel D, OrrGA, Higgins LL, Lowy FD. A human endothelial cell membrane protein that binds Staphylococcus aureus in vitro. J Clin Invest 1990; 85:1248-54. [ Links ]
49. Ogawa SK, Yurberg ER, Hatcher VB, Levitt MA, Lowy FD. Bacterial adherence to human endothelial cells in vitro. Infect Immun 1985; 50:218-24. [ Links ]
50. Hamill RJ. Vann JM, Proctor RA. Phagocytosis of Staphylococcus aureus by cultured bovine aortic endothelial cells: model for postadherence events in endovascular infections. Infect Immun 1986; 54:833-6 [ Links ]
51. Vesga O, Groesehel MC, Otten MF, Brar DW Vann JM, Proctor RA. Staphylococcus aureus small colony variants are induced by the endothelial cell infracellular milieu. J Infect Dis 1996; 173:739-42. [ Links ]
52. Proctor RA, van Langevelde P, Kristjansson M, Maslow JN, Arbeit RD. Persistent and relapsing infections associated with small colony variants of Staphylococcus aureus. Clin Infect Dis 1995; 20:95-102. [ Links ]
53. Wu T, Yeaman MR, Bayer AS. In vitro resistance to platelet microbicidal protein correlates with endocarditis source among bacteremic staphylococcal and streptococcal isolates. Antimicrob Agents Chemother 1994; 38:729-32. [ Links ]
54. Drake TA. Pang M. Staphylococcus aureus induces tissue factor expression in cultured human cardiac valve endothelium. J Infect Dis 1988; 157:749-56. [ Links ]
55. Ing. MB, Baddour IM, Bayer AS. Bacteremia and infective endocarditis: pathogenesis, diagnosis, and complications. In: Crossley KB, Archer GI, eds. The staphylococci in human discase. New York: Churchill Living stone, 1997: 331-54. [ Links ]
56. Patti JM, Bremell T, Krajewska Pietrasik D, et al. The Staphylococcus aureus collagen adhesin is a virulence determinant in experimental septic arthritis. Infect Immun 1994; 62: 152-61. [ Links ]
57. Timmerman CP, Mattsson E, Martínez Martínez I, et al. Induction of release of tumor necrosis factor from human monocytes by staphylococci and staphylococcal peptidoglycans. Infect Immun 1993; 61:4167-72. [ Links ]
58. Heumann D, Barras C, Severin A, Glauser MP, Tomasz A. Grampositive cell walls stimulate synthesis of tumor necrosis factor alpha and interleukin-6 by human monocytes. Infect Immun 1994; 62:2715-21. [ Links ]
59. Bone RC. Gram positive organisms and sepsis. Arch Intern Med 1994; 154: 26-34. [ Links ]
60. Spika JS, Peterson PK, Wilkinson BJ, et al. Role of peptidoglycan from Staphylococcus aureus in leukopenia, thrombocytopenia, and complement activation associated with bacteremia. J Infect Dis 1982; 146:227-34. [ Links ]
61. De Kimpe SJ, Kengatharan M, Thiemermann C, Vane JR. The cell wall components peptidoglycan and lipoteichoic acid from Staphylococcus aureus act in synergy to cause shock and multiple organ failure. Proc Natl Acad Sci USA 1995; 92:10359-63. [ Links ]
62. Mylotte JM, McDermott C, Spooner JA. Prospective study of 114 consecutive episodes of Staphylococcus aureus infection in a terriary care hospital. Medicine (baltimore) 1994; 73:186-208. [ Links ]
63. Yzerman EPF, Boelens HAM, Tjhie JHT, Kluytmans JAJW, Mounton JW, Verbrugh HA. APACHE II for predicting course and outcome of nosocomial Staphylococcus aureus bacteremia and its relation tohost defense. J Infec Dis 1996; 173:914-9. [ Links ]
64. Sanabria TJ, Alpert JS, Goldberg R, Pape LA, Cheeseman SH. Increasing frequency of staphylococcal infective endocarditis: experienece at a university hospital, 1981 trough 1988. Arch Intern Med 1990; 150:1305-9. [ Links ]












 uBio
uBio 
