Revista de la Sociedad Venezolana de Microbiología
versión impresa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. vol.33 no.2 Caracas dic. 2013
Disponibilidad de fósforo soluble en ensilado experimental fermentado con una cepa de Lactococcus lactis subsp. lactis con alta actividad de fitasa
Emilio Rogelio Margueta,*, Pablo Ledesmab, Marisol Vallejoa
a Cátedra de Biología Celular y Molecular, Facultad de Ciencias Naturales (FCN), Sede Trelew, Universidad Nacional de la Patagonia San Juan Bosco (UNPSJB). Argentina.
b Cátedra de Química Orgánica, FCN, Sede Trelew, UNPSJB. Argentina.
* Correspondencia: E-mail: emarguet@yahoo.com.ar
Resumen:
El fitato es la forma principal de almacenamiento de fósforo en semillas y granos, pero el fósforo unido a fitato resulta inaccesible para los peces. El objetivo del presente trabajo fue estudiar la eficacia de Lactococcus lactis subsp. lactis Tw34 para liberar fósforo de fitato en un alimento experimental que contenía harina de cereal. La bacteria inoculante del ensilado biológico se seleccionó por su alta actividad de fitasa y las mezclas se prepararon con productos de descarte de merluza (Merluccius hubbsi). Las harinas de girasol, maíz, trigo y cebada se mezclaron con desechos picados de merluza hasta alcanzar el 25% y se inocularon con la bacteria citada. Después de 7 días de fermentación a 18 ºC los mejores resultados se obtuvieron cuando se utilizó harina de cebada. La cepa fue capaz de reducir el valor del pH a 4,4 y aumentar cuatro veces la concentración inicial de fósforo libre. Los resultados sugieren que la fitasa de Lactococcus lactis subsp. lactis Tw34 puede aumentar la accesibilidad del fósforo en dietas basadas en harina de cereales, evitando los efectos negativos del ácido fítico en la biodisponibilidad de minerales y proteínas, y disminuyendo la liberación de residuos de fósforo.
Palabras clave: ensilado, fósforo, fitasa, fitato, Lactococcus lactis subsp. lactis.
Soluble phosphorous availability in experimental silage fermented with a Lactococcus lactis subsp. lactis strain with high phytase activity
Abstract:
Phytate is the main phosphorous storage form in grains and seeds, but phytate linked phosphorous is inaccessible for fishes. The purpose of this wok was to study the efficacy of Lactococcus lactis subsp. lactis Tw34 for liberating phosphorous in an experimental feed which contained cereal flour. The inoculating bacterium of the biological silage was selected due to its high phytase activity, and the mixtures were prepared with waste hake products (Merluccius hubbsi). Sunflower, corn, wheat and barley flours were mixed with waste ground hake products up to 25% and inoculated with the bacterium mentioned. After 7 days fermentation at 18 oC, the best results were obtained when barley flour was used. The strain was able to reduce the pH value to 4.4 and increase four times the initial concentration of free phosphorous. The results suggest that Lactococcus lactis subsp. lactis Tw34 can increase phosphorous accessibility in cereal flour based diets, avoiding the negative effects of phytic acid on the bioavailability of minerals and proteins, and decreasing the liberation of phosphorous residues.
Keywords: silage, phosphorous, phytase, phytate, Lactococcus lactis subsp. lactis.
Recibido 3 de julio de 2012; aceptado 28 de noviembre de 2012
Introducción
La industria de alimentos destinados a la acuicultura desarrolla productos basados en proteínas de origen animal, principalmente harina de pescado pero, su alto costo y oferta limitada, han inducido la búsqueda de fuentes alternativas de origen vegetal. Varias proteínas de origen vegetal son consideradas promisorias como sustitutas de la harina de pescado [1-5]. Sin embargo uno de los mayores problemas asociados con el uso de extractos proteicos vegetales es la presencia de factores antinutricionales, donde se destaca el ácido fítico [6-9].
Aproximadamente el 80% del total del fósforo contenido en las células vegetales está presente como fitato y su biodisponibilidad resulta prácticamente inaccesible tanto para peces monogástricos como para los agástricos. En consecuencia, la mayoría del fósforo de origen vegetal es excretado al medio acuático sin ser digerido, impactando en forma negativa porque este fenómeno induce la proliferación excesiva de algas [6,7,10,11].
El ácido fítico es definido desde el punto de vista químico como ácido mioinositol hexafosfórico [1-6]. Su estructura le permite formar quelatos estables e insolubles con cationes divalentes como Ca++, Mg++, Zn++, Cu++ y Fe++, fenómeno que trae como consecuencia una disminución en la absorción y digestión de estos minerales en el tracto intestinal de animales. También se ha reportado que los fitatos tienen la capacidad de formar complejos con las proteínas disminuyendo su solubilidad e interfiriendo en la capacidad enzimática de las proteinasas afectando de esta manera su digestibilidad [5-7,12,13].
La industria especializada en alimentos para animales ha dedicado esfuerzos para evitar los efectos negativos de la presencia de fitatos; la germinación previa, el malteado y los tratamientos térmicos se han mostrado ineficaces en lograr este objetivo [13-16]. En la actualidad la degradación enzimática del ácido fítico constituye la mejor alternativa para disminuir y evitar sus efectos negativos, sin embargo, hay que tener en cuenta algunos detalles técnicos para evaluar en el futuro el impacto en el costo final de los alimentos y la accesibilidad de enzimas de calidad certificada [6,7].
Las fitasas comerciales se han popularizado como suplemento en la alimentación de animales terrestres mientras que en la acuicultura aún no son utilizadas en forma habitual [6,17]. Uno de los motivos radica en que las enzimas que se encuentran en el mercado actual han sido seleccionadas de acuerdo a la actividad que desarrollan bajo las condiciones impuestas en el tracto digestivo de animales monogástricos terrestres. Las enzimas industriales se obtienen a partir de microorganismos y presentan su máxima actividad a pH ácido (4,0-5,0) y altas temperaturas (55-80 ºC), características que responden a la necesidad de tolerar en forma estable la acidez del estómago y la temperatura que se alcanza en el proceso de extrusado durante la elaboración del alimento [6,7,12,15,16,18,19].
En los últimos años se han diseñado ensayos in vivo e in vitro con el propósito de evaluar la accesibilidad de fósforo en alimentos suplementados con productos de origen vegetal para su aplicación en acuicultura. Los resultados obtenidos indican una gran variación de respuesta que depende de la especie estudiada y del tipo de fitasas utilizadas [2- 4,8,9,11,12,20,21]. El tratamiento enzimático previo de dietas para peces se presenta como una alternativa viable debido a que mejora la aceptabilidad del alimento, aumenta la utilización de nutrientes y evita la pérdida de actividad enzimática producida por los tratamientos térmicos inherentes a la elaboración del producto [6,12].
El objetivo del presente trabajo fue estudiar la eficacia de una cepa de Lactococcus lactis subsp. lactis Tw34, seleccionada sobre la base de la actividad de fitasa, para liberar fósforo de fitato en un ensilado experimental que contenía harina de cereal. Se estudiaron también, la influencia del pH y la temperatura sobre la actividad de la fitasa de la cepa citada, con el propósito de determinar su capacidad enzimática en las condiciones experimentales impuestas durante la fermentación.
Materiales y métodos
Microorganismo: La cepa Lactococcus lactis subsp. lactis Tw34 se obtuvo de la colección perteneciente al Laboratorio de Biología Celular y Molecular (Facultad de Ciencias Naturales, Universidad Nacional de la Patagonia, Argentina). Se reactivó con sucesivos cultivos en caldo y agar de Man, Rogosa y Sharp (MRS, Biokar, Francia) y se conservó en leche descremada suplementada con glicerol al 10% a -30 ºC. La identificación fenotípica y genotípica se realizó en un trabajo previo [22], utilizando el patrón de fermentaciones API 50 CHL (Bio-Mérieux, Francia) y determinando la secuencia del gen 16S rARN (número de acceso del GenBank GQ845022).
Determinación de la actividad enzimática: La cepa de Lc. lactis subsp. lactis Tw34 se cultivó durante 18 h a 30 ºC en caldo MRS. Luego del período de incubación el cultivo se centrifugó a 5.000 g durante 5 min. Las células se resuspendieron en agua destilada y se sometieron a un tratamiento con cuentas de vidrio y vortex durante 10 min con el objeto de liberar su contenido citoplasmático. Luego de este tratamiento se centrifugaron los extractos celulares a 5.000 g durante 5 min y se determinó la actividad enzimática del sobrenadante. La reacción se llevó a cabo con 100 μL de sobrenadante y 900 μL de una mezcla de reacción que contenía 10 mg/mL de fitato de sodio (Sigma) en buffer acetato 0,1 M, pH 5,5 [23]. La reacción se realizó a 35 ºC durante 30 min y se detuvo agregando 1 mL de ácido tricloroacético al 10%. Luego de la reacción, el fosfato liberado se determinó utilizando 100 μL de muestra y 900 μL de una solución que contenía 0,6 M de H2SO4, 2% de ácido ascórbico y 0,5% de molibdato de amonio. La reacción se llevó a cabo a 50 ºC durante 30 min y luego se realizó la lectura de la densidad óptica a 820 nm [24]. Para la curva de calibración se utilizó una solución patrón de K2HPO4.
La unidad enzimática de fitasa se definió como la cantidad de enzima requerida para liberar 1 μmol de fosfato por min a partir de fitato de sodio bajo condiciones de pH y temperatura establecidas.
Determinación del pH óptimo: La actividad enzimática se ensayó a 35 ºC a valores de pH comprendidos entre 4,0 y 8,0 y se utilizó buffer acetato 0,1 M en el rango 4,0-5,5; buffer imidazol 0,1 M en el rango 6,0-7,0 y buffer Tris 0,1 M en el rango 7,5-8,0.
Determinación de la temperatura óptima: La actividad enzimática se determinó a pH 5,5 a valores comprendidos entre 18 y 65 ºC.
Elaboración del ensilado experimental: Se realizó a partir de residuos de merluza (Merluccius hubbsi), triturados hasta obtener una masa uniforme, utilizando un molinillo ad hoc (12.000 rpm). Se utilizaron granos de cebada, girasol, maíz y trigo tratados como el procedimiento descrito para los residuos de merluza, hasta obtener una harina de aspecto uniforme. La composición final del ensilado experimental contenía una mezcla homogenea de 65% de merluza, 25% de harina de cereal, 8% de aceite de girasol, 1% de mezcla de vitaminas y 1% de sorbato de sodio.
Proceso de fermentación: Los ensilados experimentales se sometieron a un proceso de fermentación durante 7 días a una temperatura constante de 18 ºC. La inoculación se realizó con 1 mL de un cultivo en caldo MRS de Lc. lactis subsp. lactis Tw34 por cada 100 g de la mezcla. Como control se realizó la incubación del ensilado experimental, previamente tratado con ácido láctico hasta alcanzar un pH de 4,5 y bajo las condiciones descritas. La toma de muestras se llevó a cabo cada 24 h hasta completar la experiencia de 7 días. Las muestras se conservaron a -30 ºC hasta el momento de su procesamiento.
Determinación del pH: El pH de las muestras de los ensilados experimentales se determinaron con un pHmetro Orion modelo 410A con electrodo Orion 8135BN para sólidos.
Determinación de fosfato libre: Para la determinación de fosfato libre se seleccionó el ensilado experimental suplementado con harina de cebada debido a que con este cereal se obtuvieron, luego de 7 días de incubación, los más bajos valores de pH entre los cereales ensayados. El fosfato liberado en las muestras se determinó según la técnica descrita para la determinación de actividad enzimática de fitasa [24].
Análisis estadístico: Todos los ensayos se realizaron por triplicado; los promedios, desvíos estándar y análisis de la varianza (ANOVA) se calcularon mediante el uso del programa estadístico HyperStat. El ANOVA se aplicó para establecer diferencias significativas (p<0,05).
Resultados
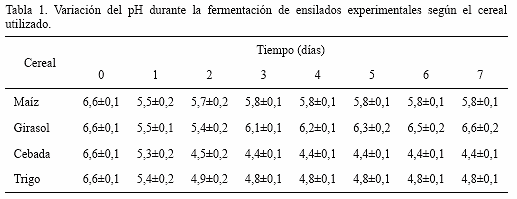
Variación del pH en el ensilado experimental en función del cereal utilizado: En la tabla 1 se pueden observar las variaciones de pH en los ensilados experimentales según el cereal utilizado durante la fermentación. Luego de 24 h el pH en las 4 experiencias descendió hasta aproximadamente 5,5. Sin embargo, luego de 2 días de incubación, el pH del alimento suplementado con harina de maíz aumentó hasta llegar a valores estables de 5,8 hasta los 7 días de incubación. En el caso del girasol se observó un fenómeno comparable, pero el pH continuó en ascenso hasta el final de la experiencia alcanzando valores de 6,6. El pH del alimento suplementado con harina de trigo descendió hasta estabilizarse luego de 2 días de incubación en un valor de 4,8; mientras que en el caso de la cebada los valores se estabilizaron en igual período en 4,4.
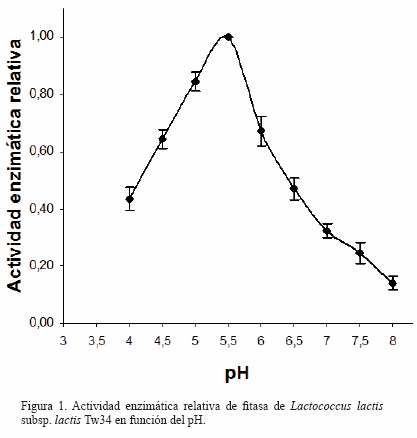
Actividad enzimática de fitasa en función de la temperatura y el pH: En la figura 1 se puede observar la variación de la actividad enzimática en función del pH. La enzima se mantuvo activa en el rango ensayado (4,0-8,0) y se observó la máxima actividad a pH 5,5.
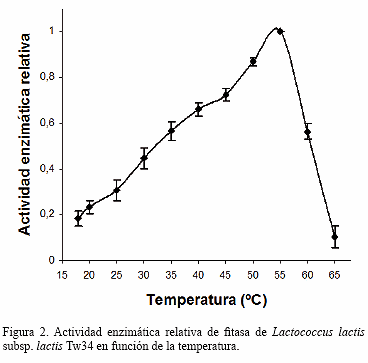
La fitasa mostró actividad en todo el espectro de temperatura estudiado (18-65 ºC). A 55 ºC se obtuvo la máxima actividad enzimática (Figura 2), por encima de la cual se observó una disminución drástica.
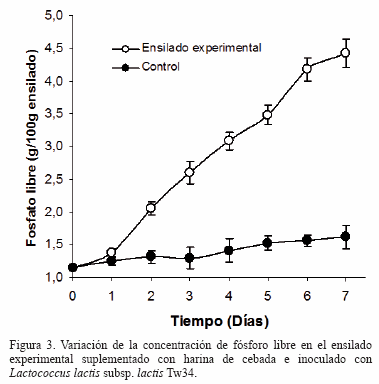
Variación de la concentración de fósforo libre durante el proceso de fermentación: La mezcla control y la mezcla experimental exhibieron al comienzo del ensayo una concentración de 1,14 g/100 g de fósforo libre (Figura 3). Luego de 24 h de incubación a 18 ºC no se observó una diferencia significativa en ambas muestras. A partir del 2º día la mezcla experimental inoculada con Lc. lactis subsp. lactis Tw34 aumentó en forma continua el fósforo libre hasta alcanzar, luego de 7 días, una concentración media de 4,41 g/100 g, mientras que la muestra control exhibió un leve aumento hasta alcanzar al final de la experiencia una concentración de 1,61 g/100 g.
Discusión
En las décadas pasadas los investigadores dedicados a la nutrición humana y de animales terrestres han enfocado su atención en el efecto producido por las fitasas en los alimentos que incluyen suplementos de origen vegetal sobre la biodisponibilidad de fósforo, proteínas y minerales [5,7,14]. En el caso particular de la acuicultura el alto costo de la harina de pescado ha inducido su reemplazo por proteínas de origen vegetal. La harina de soja es universalmente aceptada como un suplemento capaz de ofrecer altos niveles de proteínas [1,3,4,20], sin embargo el aumento sostenido de su precio internacional ha provocado la búsqueda de otras alternativas.
En este trabajo se realizaron ensayos con 4 cereales que, no obstante exhibir menores niveles proteicos que la soja, contienen altas concentraciones de azúcares fermentables. La adición de harina de cereal al hidrolizado de pescado tuvo el propósito de facilitar a la cepa de Lc. lactis subsp. lactis Tw34 una fuente de carbono accesible que permitiera el descenso de pH del alimento en forma rápida. Las bacterias ácido lácticas pueden, bajo estas condiciones, producir ácidos orgánicos, especialmente ácido láctico, que permiten inhibir el desarrollo de microorganismos contaminantes y en el caso particular de esta experiencia, lograr mejores condiciones para la actividad fitásica [19,20].
En los casos de los ensilados suplementados con harina de girasol o maíz, no se logró un pronunciado descenso del pH, posiblemente por una baja oferta de carbohidratos metabolizables (Tabla 1). Este fenómeno permite la proliferación de bacterias contaminantes que originan metabolitos alcalinos y como consecuencia una mala calidad organoléptica del producto. En el caso particular de Lc. lactis subsp. lactis Tw34, tanto la harina de girasol como la de maíz no resultan recomendables como suplementos vegetales en la elaboración de alimentos fermentados para peces.
Las harinas de trigo y cebada lograron en la mezcla ensayada descensos significativos y estables hasta el final de las respectivas experiencias inhibiendo el desarrollo de microorganismos que por su metabolismo producen inestabilidad del alimento (Tabla 1). Bajo estas condiciones de acidez es posible mantener su calidad durante un tiempo prolongado y optimizar la acción enzimática de la fitasa bacteriana con el consecuente aumento de la disponibilidad de fósforo soluble.
Las curvas de actividad enzimática en función del pH y la temperatura fueron comparables con las descritas para otras bacterias ácido lácticas [23]. En este caso la máxima actividad se logró a pH 5,5 y se mantuvo activa a valores de 4,0; característica que le permite a la enzima superar en forma estable el tránsito digestivo de peces gástricos. En el caso del ensilado experimental que contenía cebada, el pH varió desde un valor inicial de 6,6 hasta 4,4 (Tabla 1); rango en el cual la fitasa de la cepa utilizada se mantiene siempre activa. En el mínimo valor de pH, alcanzado luego de 7 días de incubación, la enzima logra más del 60% de la actividad determinada a pH óptimo.
A 55 ºC se logró la máxima actividad pero a temperaturas superiores se produjo un descenso brusco de la misma. Este fenómeno se observó en la mayoría de los estudios realizados en otras bacterias, posiblemente por la inestabilidad de la molécula enzimática a temperaturas por encima de la óptima [6,13,15,23]. Desde el punto de vista industrial esta característica es importante para los casos donde el alimento se somete al proceso de extrusado donde las temperaturas alcanzan aproximadamente los 70 ºC. En el mercado se comercializan enzimas semipurificadas, generalmente obtenidas de hongos, que soportan las temperaturas del procesamiento [4,6,17-19].
La experiencia de la evolución de la concentración de fósforo libre se realizó a 18 ºC, valor seleccionado como una temperatura media aceptable para realizar ensayos a mayor escala en el medio ambiente y sin la necesidad de recurrir a fuentes de calor. A la temperatura citada la actividad enzimática alcanzo el 18% de la máxima.
Bajo las condiciones experimentales logradas durante la fermentación con la cepa Lc. lactis subsp. lactis Tw34 del ensilado suplementado con harina de cebada (18 ºC, pH 4,4) se logró un aumento constante de la concentración de fosfatos libres a partir del segundo día de incubación, alcanzando al final de la experiencia un valor aproximadamente 4 veces mayor al inicial. En cambio, este parámetro no varió en forma significativa en la muestra control; el pequeño aumento observado se debe a la liberación espontánea de fosfatos a partir de acido fítico [25] y a la acción de la fitasa del cereal que bajo las condiciones de la experiencia no exhibe una actividad apreciable [6,17].
Los resultados obtenidos indican que bajo las condiciones de pH y temperatura impuestos durante el proceso de fermentación, la actividad enzimática de la fitasa de la cepa en estudio logra hidrolizar el ácido fítico en forma efectiva hasta lograr altos niveles de fosfatos libres. Esta acción metabólica no sólo logra facilitar la disponibilidad del elemento liberado y de otros cationes como Ca++, Mg++, Zn++, Cu++ y Fe++, sino que evita el efecto negativo producido por altos niveles de ácido fítico en la absorción de proteínas [3,5]. En el caso particular de la acuicultura también se debe tener en cuenta que este tipo de tratamientos logra mitigar los impactos negativos que produce la dispersión del ácido fítico en ambientes acuáticos [7,17].
Conclusiones
Los resultados obtenidos en este trabajo demuestran, como en experiencias anteriores, que el proceso de previa fermentación con microorganismos, seleccionados de acuerdo a la actividad enzimática de fitasa, logra aumentar la disponibilidad de fósforo soluble en los ensilados cuya composición incluye productos de origen vegetal y en consecuencia, mejoran su calidad en función de un aumento potencial de la digestibilidad de oligoelementos y proteínas.
Referencias
1. Huy PV, Huynh P, Dayanthi N. Effects of dietary supplements on growth performance and phosphorus waste production of australian catfish, tandanus tandanus, fed with diets containing soybean meal as fishmeal replacement. J World Aquacult Soc. 2011; 42:645-56. [ Links ]
2. Morales GA, Moyano FJ. Application of an in vitro gastrointestinal model to evaluate nitrogen and phosphorus bioaccessibility and bioaccessibility in fish feed ingredients. Aquaculture. 2010; 306:244-51. [ Links ]
3. Morales GA, Moyano FJ, Marquez L. In vitro assessment of the effects of phytate and phytase on nitrogen and phosphorus bioaccessibility within fish digestive tract. Anim Feed Sci Technol. 2011; 170:209-21. [ Links ]
4. Cheng ZJ, Hardy RW. Effects of extrusion and expelling processing, and microbial phytase supplementation on apparent digestibility coefficients of nutrients in fullfat soybeans for rainbow trout Oncorhynchus mykiss. Aquaculture. 2003; 218:501-14. [ Links ]
5. Dalsgaard J, Verlhac V, Hjermitslev NH, Ekmann KS, Fischer M, Klausen M, Pedersen PB. Effects of exogenous enzymes on apparent nutrient digestibility in rainbow trout (Oncorhynchus mykiss) fed diets with high inclusion of plantbased protein. Anim Feed Sci Technol. 2012; 171:181-91. [ Links ]
6. Kumar V, Sinha AK, Makkar HP, De Boeck G, Beck K. Phytate and phytase in fish nutrition. J Anim Physiol Anim Nutr. 2012; 96:335-64. [ Links ]
7. Kumar V, Sinha AK, Makkar HP, De Boeck G, Beck K. Dietary roles of phytate and phytase in human nutrition: a review. Food Chem. 2010; 120:945-59. [ Links ]
8. Liebert F, Portz L. Nutrient utilization of Nile tilapia Oreochromis niloticus fed plant based low phosphorus diets supplemented with graded levels of different sources of microbial phytase. Aquaculture. 2005; 248:111-9. [ Links ]
9. Fortes-Silva R, Sánchez-Vázquez FJ, Martínez FJ. Effects of pretreating a plant-based diet with phytase on diet selection and nutrient utilization in European sea bass. Aquaculture. 2011; 319:417-22. [ Links ]
10. Nwanna LC, Schwarz F. Effect of supplementation phytase on growth, phosphorus digestibility and bone mineralization of common carp (Cyprinus carpio). Aquac Res. 2007; 38:1037-44. [ Links ]
11. Nwanna LC, Schwarz FJ. Effect of different levels of phytase on growth and mineral deposition in common carp (Cyprinus carpio). J Appl Ichthyol. 2008; 24:574-80. [ Links ]
12. Cao L, Yang Y, Wang WM, Yakupitiyage A, Yuan DR, James D. Effects of pretreatment with microbial phytase on phosphorous utilization and growth performance of Nile tilapia (Oreochromis niloticus). Aquac Nutr. 2008; 14:99- 109. [ Links ]
13. Kumar V, Sinha AK, Makkar PS, Becker K. Dietary roles of phytate and phytase in human nutrition: a review. Food Chem. 2010; 120:945-59. [ Links ]
14. Masud T, Mahmood T, Latif A, Sammi S, Hameed, T. Influence of processing and cooking methodologies for reduction of phytic acid content in wheat (Triticum aestivum) varieties. J Food Process Preserv. 2007; 31:583–94. [ Links ]
15. Greiner R, Konietzny U. Phytase for food application. Food Technol Biotechnol. 2006; 44:125-40. [ Links ]
16. Garrett JB, Kretz, KA, Donoghue, E, Kerovuo J, Kim W, Barton NR, Hazlewood GP, Short JM, Robertson DE, Gray KA. Enhancing the thermal tolerance and gastric performance of a microbial phytase for use as a phosphate-mobilizing monogastric-feed supplement. Appl Environ Microbiol. 2004; 70:3041-6. [ Links ]
17. Cao L, Wang W, Yang, C, Yang Y, James D, Yakupitiyage A, Luo S, Li D. Application of microbial phytase in fish feed. Enzyme Microb Technol. 2007; 40:497-507. [ Links ]
18. Nuobariene L, Hansen AS, Arneborg, N. Isolation and identification of phytase-active yeasts from sourdoughs. LWT-Food Sci Technol. 2012; 48:190-6. [ Links ]
19. Greiner R, Konietzny U. Phytase for food application. Food Technol Biotechnol. 2006; 44:125-40. [ Links ]
20. Yoo GY, Wang XJ, Choi SM, Han KM. Dietary microbial phytase increased the phosphorus digestibility in juvenile Korean rockfish Sebastes schlegeli fed diets containing soybean meal. Aquaculture. 2005; 243:315-22. [ Links ]
21. Sajjadi M, Carter CG. Effect of phytic acid and phytase on feed intake, growth, digestibility and trypsin activity in Atlantic salmon (Salmo salar). Aquacult Nutr. 2004;10:135- 42. [ Links ]
22. Sequeiros C, Vallejo M, Marguet E, Olivera N. Inhibitory activity against the fish pathogen Lactococcus garvieae produced by Lactococcus lactis TW34, a lactic acid bacterium isolated from the intestinal tract of a Patagonian fish. Arch Microbiology. 2010; 192:237-45. [ Links ]
23. De Angelisa M, Gallo G, Corbo M, McSweeney P, Faccia M, Giovine M, Gobbetti M. Phytase activity in sourdough lactic acid bacteria: purification and characterization of a phytase from Lactobacillus sanfranciscensis CB1. Int J Food Microbiol. 2003; 87:259-70. [ Links ]
24. Fiske CH, Subarrow Y. The colorimetric determination of phosphorus. J Biol Chem. 1925; 66:375-400. [ Links ]
25. Sugiura SH, Roy PK, Ferraris RP. Dietary acidification enhances phosphorus digestibility but decreases H+/K+- ATPase expression in rainbow trout. J Exp Biol. 2006; 209:3719-28. [ Links ]












 uBio
uBio